Similar presentations:
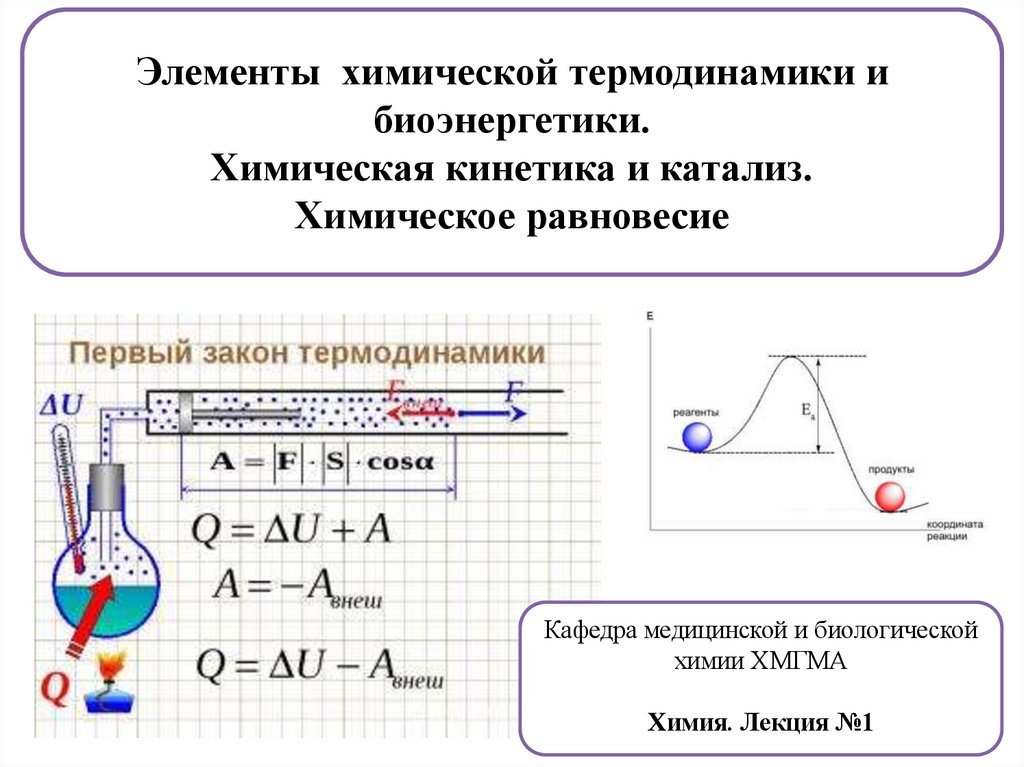
Элементы химической термодинамики и биоэнергетики. Химическая кинетика и катализ. Химическое равновесие
1.
Элементы химической термодинамики ибиоэнергетики.
Химическая кинетика и катализ.
Химическое равновесие
Кафедра медицинской и биологической
химии ХМГМА
Химия. Лекция №1
2.
План лекцииОсновные понятия и задачи термодинамики. Энтальпия, энтропия,
энергия Гиббса. Основные задачи биоэнергетики.
Понятие о скорости химической реакции. Влияние различных
факторов на скорость химической реакции.
Понятие о фармакокинетике. Кинетика ферментативного катализа.
Условия
возникновения
химического
равновесия.
Факторы,
влияющие на смещение химического равновесия.
Понятие о стационарном состоянии живого организма, гомеостаз и
адаптация организма.
3.
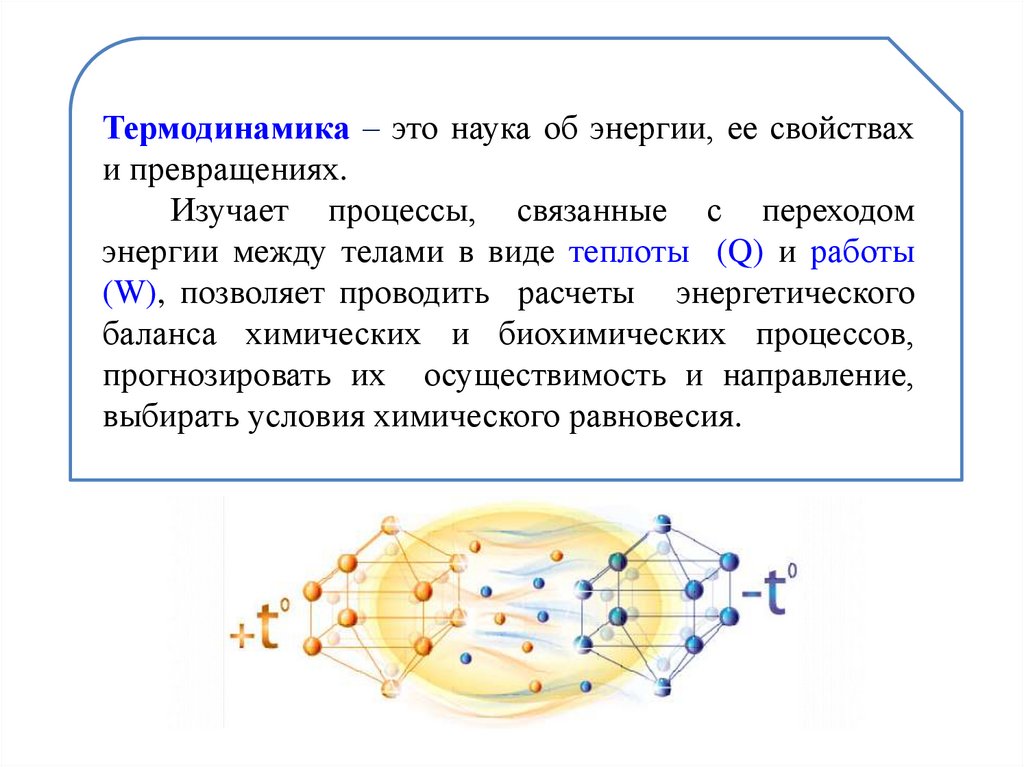
Термодинамика – это наука об энергии, ее свойствахи превращениях.
Изучает процессы, связанные с переходом
энергии между телами в виде теплоты (Q) и работы
(W), позволяет проводить расчеты энергетического
баланса химических и биохимических процессов,
прогнозировать их осуществимость и направление,
выбирать условия химического равновесия.
4.
Основные понятия:Термодинамическая
система – любой объект
природы, состоящий из
достаточно
большого
числа
структурных
единиц, находящихся во
взаимодействии
и
отделенных от других
объектов
природы
реальной
или
воображаемой границей
раздела.
Объекты природы, не
входящие в систему,
называются средой.
5.
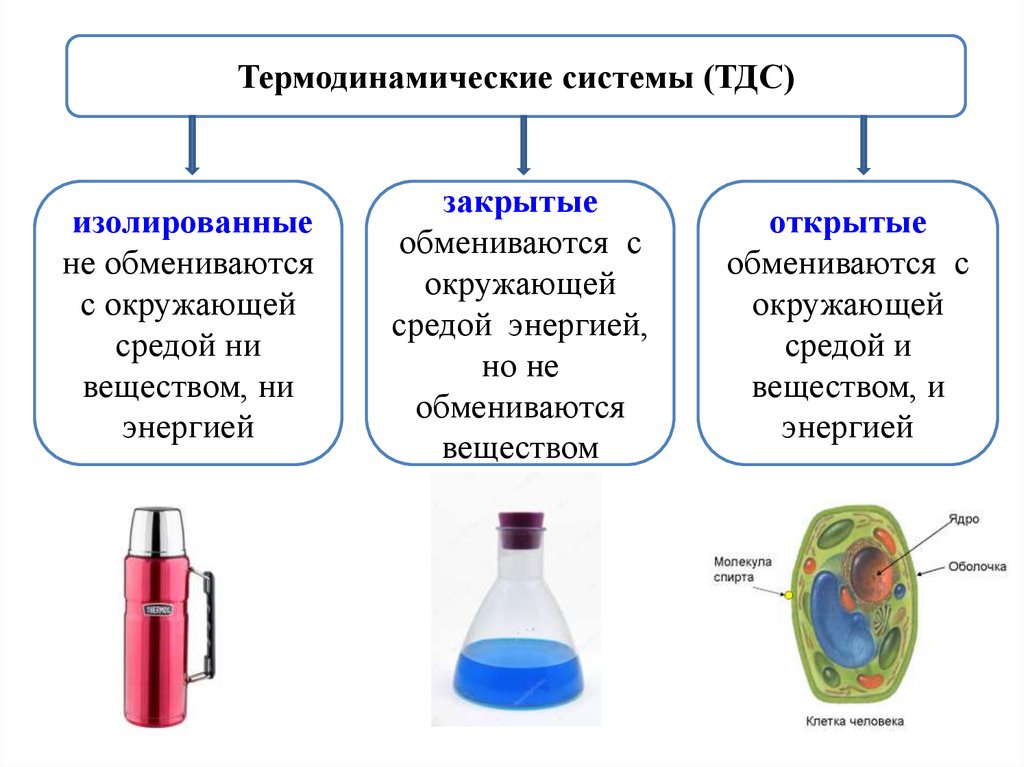
Термодинамические системы (ТДС)изолированные
не обмениваются
с окружающей
средой ни
веществом, ни
энергией
закрытые
обмениваются с
окружающей
средой энергией,
но не
обмениваются
веществом
открытые
обмениваются с
окружающей
средой и
веществом, и
энергией
6.
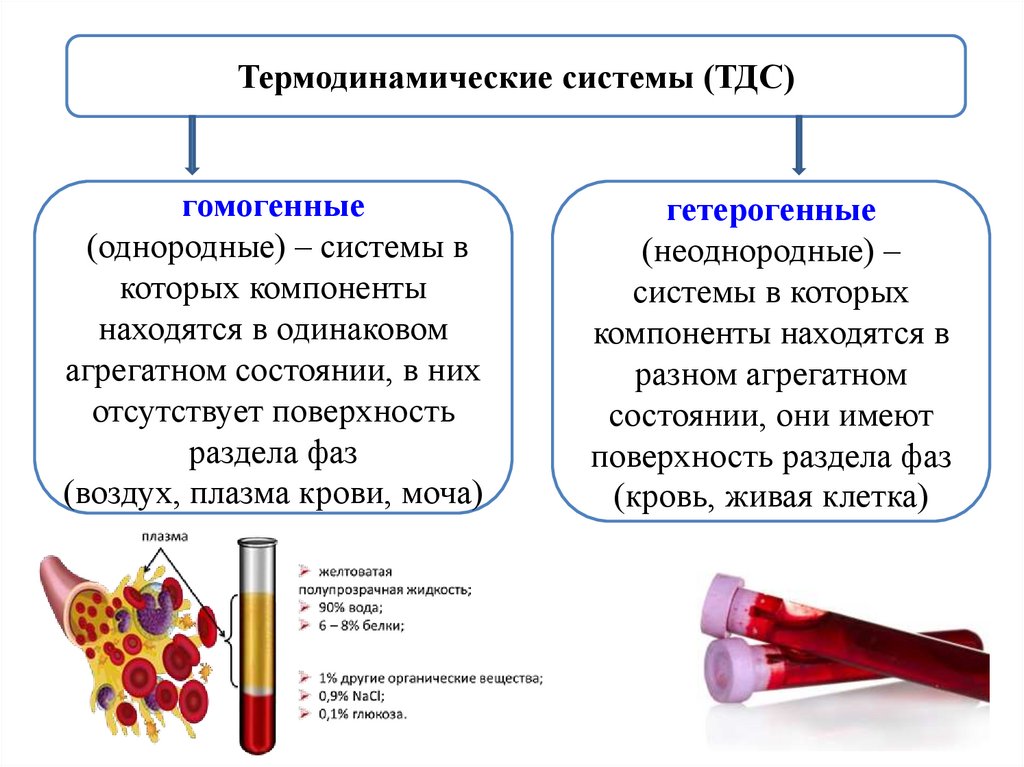
Термодинамические системы (ТДС)гомогенные
(однородные) – системы в
которых компоненты
находятся в одинаковом
агрегатном состоянии, в них
отсутствует поверхность
раздела фаз
(воздух, плазма крови, моча)
гетерогенные
(неоднородные) –
системы в которых
компоненты находятся в
разном агрегатном
состоянии, они имеют
поверхность раздела фаз
(кровь, живая клетка)
7.
Состояние системы (совокупность свойств)Равновесное - свойства остаются постоянными в течение
большого промежутка времени и отсутствуют потоки
вещества и энергии.
Стационарное свойства остаются постоянными во
времени, но происходят потоки вещества и энергии.
Переходное - свойства системы меняются со временем.
8.
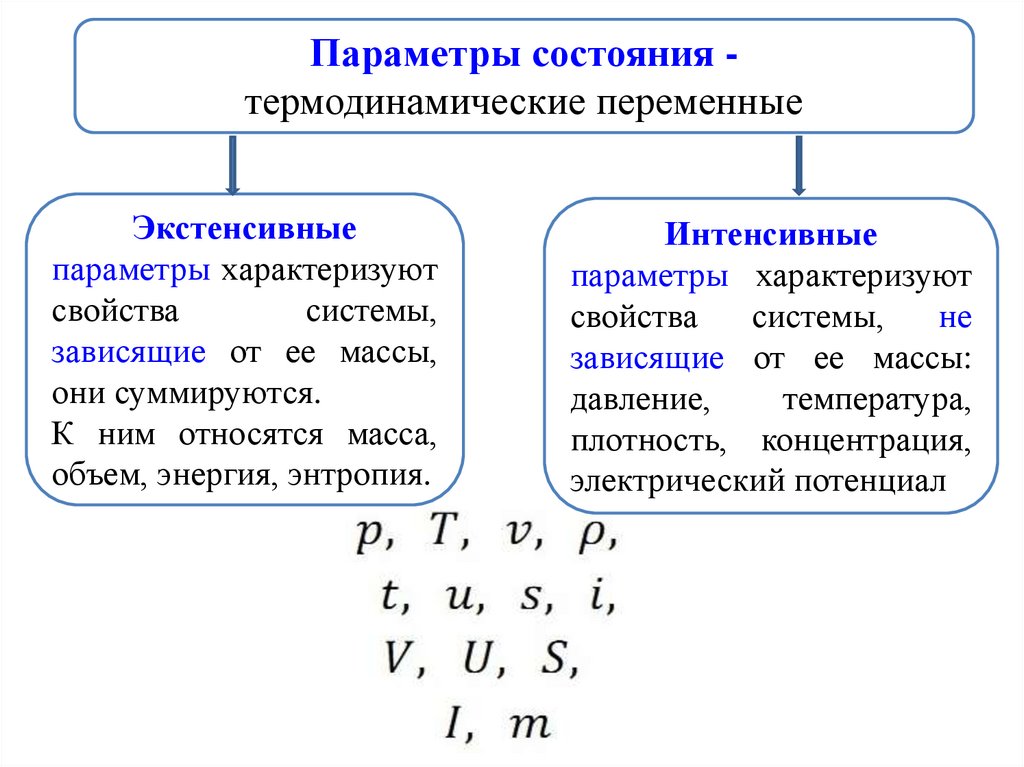
Параметры состояния термодинамические переменныеЭкстенсивные
параметры характеризуют
свойства
системы,
зависящие от ее массы,
они суммируются.
К ним относятся масса,
объем, энергия, энтропия.
Интенсивные
параметры характеризуют
свойства
системы,
не
зависящие от ее массы:
давление,
температура,
плотность, концентрация,
электрический потенциал
9.
Система может переходить из одного состояния в другое,что называется процессом.
Процесс может быть обратимым и не обратимым.
Процесс обратим, если можно провести обратный процесс
через промежуточные состояния так, чтобы после
возвращения системы в исходное состояние, в
окружающих телах не произошло каких либо изменений.
При переходе системы из одного состояния в другое
происходит изменение параметров состояния системы.
10.
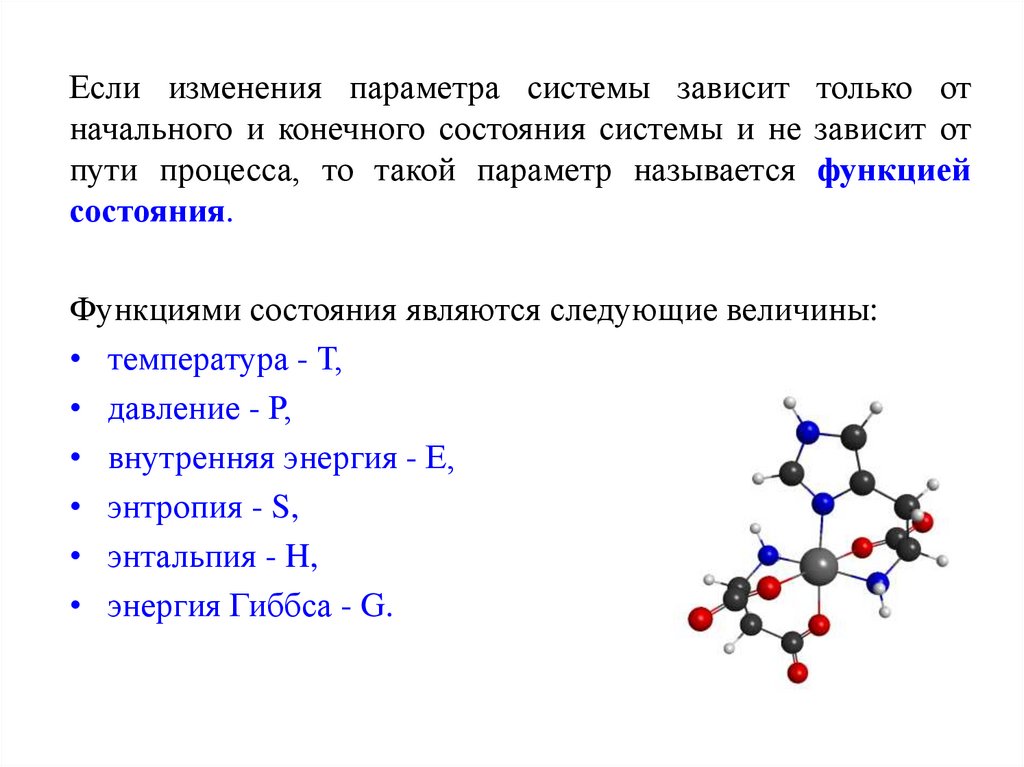
Если изменения параметра системы зависит только отначального и конечного состояния системы и не зависит от
пути процесса, то такой параметр называется функцией
состояния.
Функциями состояния являются следующие величины:
• температура - Т,
• давление - Р,
• внутренняя энергия - Е,
• энтропия - S,
• энтальпия - H,
• энергия Гиббса - G.
11.
Внутренняя энергия (Е)Внутренняя энергия определяет общий запас энергии
всех форм движения (поступательного, вращательного,
колебательного) молекул, атомов, атомных групп,
электронов в атомах и так далее за исключением
кинетической энергии в целом и потенциальной энергии
положения.
Абсолютное значение внутренней
определить невозможно.
энергии
системы
12.
Информативным является изменение данного параметрапри переходе системы из одного состояния в другое.
Е = Е2 – Е1,
где Е - изменение внутренней энергии.
Внутренняя энергия зависит от природы вещества и массы.
Изменение внутренней энергии определяется работой,
которая совершается системой и теплотой, как способом
передачи энергии между средой и системой.
13.
I начало термодинамикиЭто есть обобщенный результат работы многих ученых:
Ломоносов, Лаплас, Лавуазье, Майер, Гесс, Джоуль.
Всего
существует
несколько
общепризнанных
формулировок I начала термодинамики.
1.В любой изолированной системе запас энергии остается
постоянным.
2.Разные формы энергии переходят друг в друга в строго
эквивалентных количествах.
3.Вечный двигатель первого рода не возможен, то есть не
возможно построить машину, которая давала бы
механическую работу, не затрачивая на это энергию.
14.
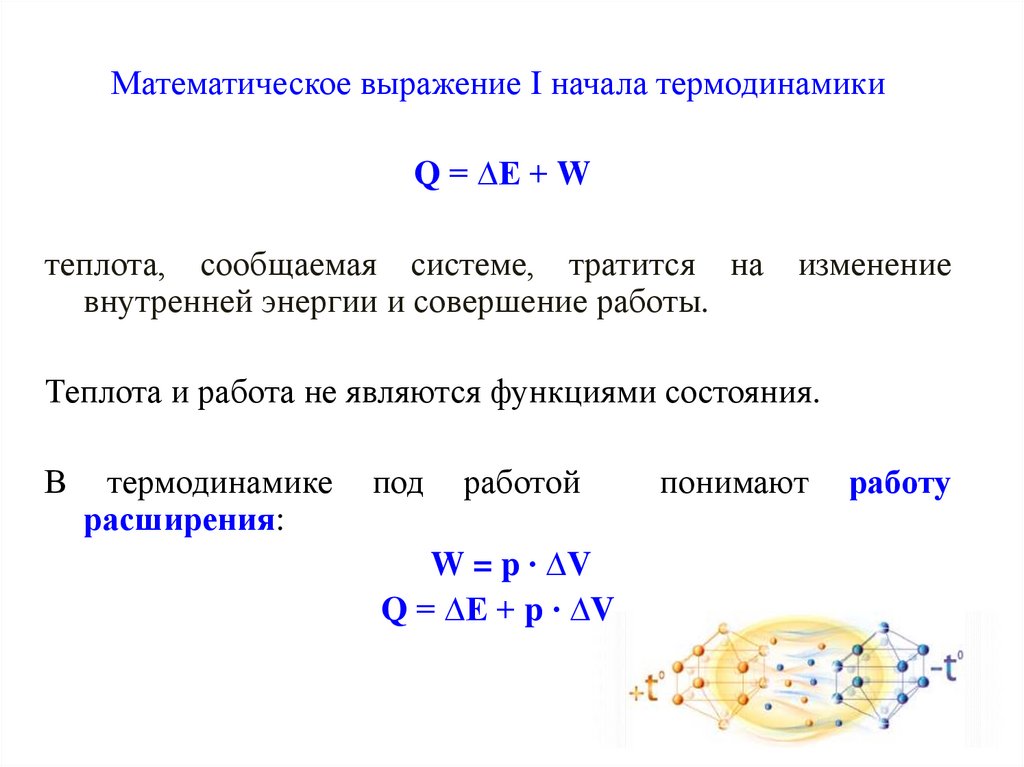
Математическое выражение I начала термодинамикиQ = ∆Е + W
теплота, сообщаемая системе, тратится на изменение
внутренней энергии и совершение работы.
Теплота и работа не являются функциями состояния.
В
термодинамике
расширения:
под
работой
W = p ∙ ∆V
Q = ∆Е + p ∙ ∆V
понимают
работу
15. Применение I начала термодинамики
Изохорный процесс – характеризуется постоянством объемасистемы, V – const.
Qv = ∆Е + p ∙ ∆V
∆V = 0
Qv = ∆Е
Таким образом, теплота изохорного процесса становится
функцией состояния и называется тепловым эффектом.
Тепловой эффект изохорного процесса равен изменению
внутренней энергии.
16.
Изобарный процесс – характеризуетсядавления системы, р – const.
Qр = ∆Е + p∙(V2 – V1)
Qр = Е2 – Е1 + pV2 – pV1
Qр = (Е2 + pV2) – (Е1 + pV1)
Е + pV ≡ Н (энтальпия)
(от греч. “энтальпо” – нагреваю)
Qр = H2 – H1
Qр = ∆H
∆H = ∆Е + W
постоянством
17.
Энтальпия – функция состояния, которая показываетэнергию расширенной системы или теплосодержание
системы.
Теплота изобарного процесса становится функцией
состояния и называется тепловым эффектом. Тепловой
эффект изобарного процесса равен изменению энтальпии.
По значению энтальпии судят о характере процесса:
• Экзотермический – процесс, идущий с выделением
энергии, ∆H < 0.
• Эндотермический - процесс, идущий с поглощением
энергии, ∆H > 0.
Таким образом, теплота приобретает свойство функции
состояния системы только для изобарных и изохорных
процессов. Это было установлено Гессом в 1840 г.
18. Закон Гесса
Тепловой эффект реакции при постоянном объеме идавлении не зависит от пути процесса, а зависит от
начального и конечного состояния системы.
Гесс ввел понятие термохимическое уравнение – уравнение
химической реакции, в котором указывается агрегатное
состояние реагирующих веществ и тепловой эффект
реакции.
Например: 2Н2(г) + О2(г) = 2Н2О(г), ∆H = -572кДж/моль.
Тепловой эффект реакции определяют двумя путями:
экспериментальный, проводится в калориметрах;
теоретический, расчетный, основан на двух следствиях из
закона Гесса, которые связаны с понятием стандартных
теплот образования и сгорания.
19.
Первое следствие закона Гесса – тепловой эффектхимической реакции равен разности между суммой теплот
образования продуктов реакции и суммой теплот
образования исходных веществ, взятых со своими
стехиометрическими коэффициентами.
∆Hр = ∑i ni ∆Hо298 обр. прод. р-ии – ∑i ni ∆Hо298 обр. исх. в-в р-ии
Теплоты образования простых веществ равны нулю.
Второе следствие закона Гесса – тепловой эффект
химической реакции равен разности между суммой теплот
сгорания исходных веществ реакции и суммой теплот
сгорания продуктов реакции, взятых со своими
стехиометрическими коэффициентами.
∆Hр = ∑i ni ∆Hо298 сгор. исх. в-в р-ии – ∑i ni ∆Hо298 сгор. прод. р-ии
20.
Стандартная теплота образования (∆Hо298 обр) – тепловойэффект преобразования из простых веществ 1моля
соединения при стандартных условиях.
Стандартная теплота сгорания (∆Hо 298 сгор ) – тепловой
эффект окисления 1 моля соединения при условии, что
начальные и конечные вещества находятся в стандартных
условиях .
Стандартные условия:
Давление
1атм = 760 мм. рт. ст. = 1,013·105 Па(Н/м2) = 101,3 кПа;
Температура
25оС; 298оК.
21.
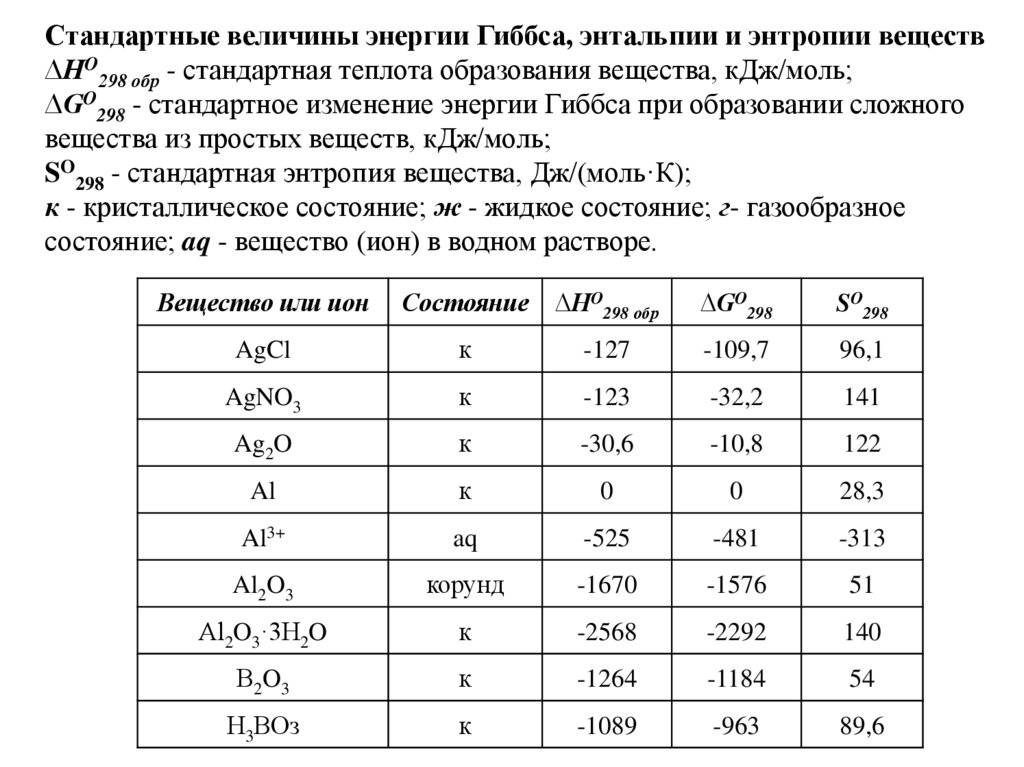
Стандартные величины энергии Гиббса, энтальпии и энтропии веществ∆HO298 обр - стандартная теплота образования вещества, кДж/моль;
∆GO298 - стандартное изменение энергии Гиббса при образовании сложного
вещества из простых веществ, кДж/моль;
SO298 - стандартная энтропия вещества, Дж/(моль·К);
к - кристаллическое состояние; ж - жидкое состояние; г- газообразное
состояние; aq - вещество (ион) в водном растворе.
Вещество или ион
Состояние
∆HO298 обр
∆GO298
SO298
AgCl
к
-127
-109,7
96,1
AgNO3
к
-123
-32,2
141
Ag2O
к
-30,6
-10,8
122
Al
к
0
0
28,3
Al3+
aq
-525
-481
-313
Al2O3
корунд
-1670
-1576
51
Аl2O3·3Н2O
к
-2568
-2292
140
В2O3
к
-1264
-1184
54
Н3ВОз
к
-1089
-963
89,6
22. Биоэнергетика
задача биоэнергетики - изучение законов и механизмовнакопления, хранения и использования энергии живыми
системами.
Позволяет
составить
правильное
представление
об
энергетической ценности продуктов питания и организации
режима питания.
23.
Энергия. Нормируемые показателиСуточные энерготраты определяются энерготратами на
конкретные виды деятельности, возраста, массы тела и
пола.
Все взрослое население в зависимости от величины
энерготрат делится на 5 групп для мужчин и 4 - для женщин.
Расход энергии на адаптацию к холодному климату в районах
Крайнего Севера – увеличивается в среднем на 15%.
У женщин: ВОО на 15% ниже, чем у мужчин.
При беременности и грудном вскармливании потребности в
энергии увеличиваются в среднем на 15 и 25%
соответственно.
24.
Физиологические потребности в энергии для взрослыхсоставляют:
от 2100 до 4200 ккал/сутки для мужчин и
от 1800 до 3050 ккал/сутки для женщин.
Физиологические потребности в энергии для детей:
110-115 ккал/кг массы тела для детей до 1 года и
от 1200 до 2900 ккал/сутки для детей старше 1 года.
25.
Источники энергииОсновными источниками энергии являются углеводы, жиры и
белки пищи.
Углеводы
1 г углеводов при окислении в организме дает 4,1 ккал.
Физиологическая потребность в усвояемых углеводах для
взрослого человека составляет 50-60% от энергетической
суточной потребности (от 257 до 586 г/сутки).
Физиологическая потребность в углеводах для детей до года
13 г/кг массы тела, для детей старше года от 170 до 420
г/сутки.
26.
Жиры1 г жира при окислении в организме дает 9,3 ккал.
Физиологическая потребность в жирах –
от 70 до 154 г/сутки для мужчин и
от 60 до 102 г/сутки для женщин.
Физиологическая потребность в жирах
для детей до года – 5,5-6,5 г/кг массы тела,
для детей старше года – от 40 до 97 г/сутки.
27.
Белки1 г белка при окислении в организме дает 4,1 ккал.
Физиологическая потребность в белке для взрослого населения
- от 65 до 117 г/сутки для мужчин, и от 58 до 87 г/сутки для
женщин.
Физиологические потребности в белке детей до 1 года – 2,2-2,9
г/кг массы тела, детей старше 1 года от 36 до 87 г/ сутки.
28. Первое начало термодинамики для живых организмов -
Первое начало термодинамики для живых организмов все виды работ в организме совершаются за счетэквивалентного количества энергии, выделяющейся при
окислении питательных веществ
Q=ΔЕ+W
Если в живом организме t°=37°С=const, то ΔЕ=0, тогда первое
начало термодинамики для живых организмов:
Q =W
В организмах совершается не только работа расширения, но и
другие виды работ:
химическая (синтез белка),
механическая (сокращения мышц),
электрическая (проведение возбуждения по клеткам),
осмотическая (перенос вещества через мембрану).
29.
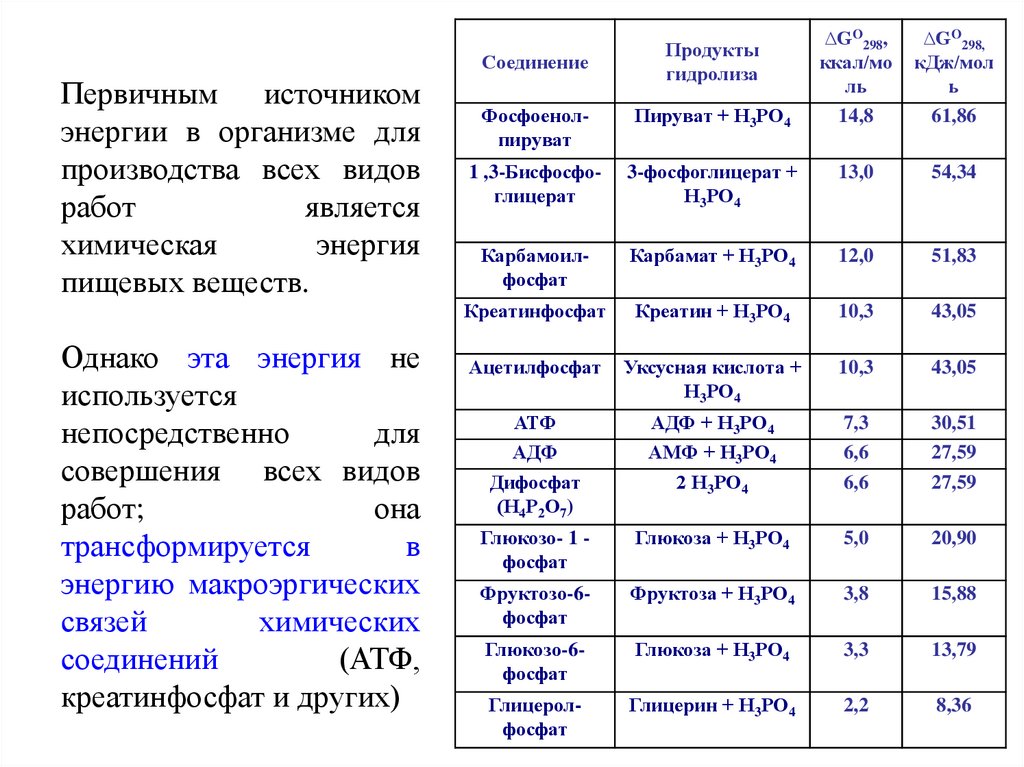
СоединениеПервичным источником
энергии в организме для
производства всех видов
работ
является
химическая
энергия
пищевых веществ.
Однако эта энергия не
используется
непосредственно
для
совершения всех видов
работ;
она
трансформируется
в
энергию макроэргических
связей
химических
соединений
(АТФ,
креатинфосфат и других)
Продукты
гидролиза
∆GO298,
ккал/мо
ль
14,8
∆GO298,
кДж/мол
ь
61,86
Фосфоенолпируват
Пируват + Н3РО4
1 ,3-Бисфосфоглицерат
3-фосфоглицерат +
Н3РО4
13,0
54,34
Карбамоилфосфат
Карбамат + Н3РО4
12,0
51,83
Креатинфосфат
Креатин + Н3РО4
10,3
43,05
Ацетилфосфат
Уксусная кислота +
Н3РО4
10,3
43,05
АТФ
АДФ
Дифосфат
(Н4Р2О7)
АДФ + Н3РО4
АМФ + Н3РО4
2 Н3РО4
7,3
6,6
6,6
30,51
27,59
27,59
Глюкозо- 1 фосфат
Глюкоза + Н3РО4
5,0
20,90
Фруктозо-6фосфат
Фруктоза + Н3РО4
3,8
15,88
Глюкозо-6фосфат
Глюкоза + Н3РО4
3,3
13,79
Глицеролфосфат
Глицерин + Н3РО4
2,2
8,36
30. Второе начало термодинамики. Свободная энергия Гиббса
Формулировки второго начала термодинамики:Клаузиус (1850): Теплота не может самопроизвольно
переходить от более холодного тела к более нагретому телу.
Томсон (1851): Вечный двигатель 2 рода, в котором вся
теплота, сообщаемая системе, превращается в работу,
невозможен.
Вывод: Протекание самопроизвольных процессов в
изолированной системе сопровождается рассеиванием тепловой
энергии.
Чтобы процесс рассеивания энергии охарактеризовать
количественно потребовалась еще одна термодинамическая
функция. Ее ввел Роберт Клаузиус в 1865 году – энтропия –
это функция состояния.
31.
Величинаизменения энтропии для обратимых и не
обратимых
процессов
в
изолированных
системах
определяется по уравнению:
∆S ≥ Q / T, Дж/моль К, где
Q – теплота, сообщаемая системе;
Т – температура системы после окончания процесса.
Только часть теплоты идет на совершение работы, а другая
часть является обесцененной или связанной. Связанная
энергия не может быть превращена в работу, так как она
рассеивается.
Величина обесцененной энергии есть энтропия.
32.
Статистический смысл энтропии определил австриец ЛюдвигБольцман в 1872 году. Одно и то же состояние системы
может быть реализовано большим числом микросостояний.
Это число – термодинамическая вероятность ω
S = К · lnω, где
К – постоянная Больцмана = 1,8 · 10-23 Дж/К;
Людвиг Больцман
Австрийский физик-теоретик, основатель
статистической механики и молекулярнокинетической теории.
Дата и место рождения:
20 февраля 1844 г., Вена, Австрийская
империя
Дата и место смерти:
5 сентября 1906 г. (62 года), Дуино, Италия
33.
Энтропия увеличивается с увеличением температуры,при переходе из кристаллического состояния в жидкое и
газообразное. Чем больше энтропия, тем больше скорость
реакции в этой системе.
Энтропия - есть мера обесцененной энергии, она же
есть движущая сила процессов.
Физический смысл можно определить так: энтропия –
мера неупорядоченности расположения частиц в
системе или мера беспорядка.
34.
Изменение энтропии в реакции можно рассчитать, используя1 следствие закона Гесса:
∆Sр = ∑i ni Sо298 прод. р-ии – ∑i ni Sо298 исх. в-в р-ии
В уравнении даны не изменения энтропии, а абсолютные
значения энтропии, которые получены при равновесном
переходе из кристаллического состояния при абсолютном
нуле, где энтропия равна нулю (III начало термодинамики),
в стандартное состояние при температуре 298К.
Абсолютные значения энтропии – справочные величины.
35.
Применение II начала термодинамики к живыморганизмам
Теорема Пригожина: в открытой системе в
стационарном состоянии прирост энтропии в единицу
времени для необратимых процессов принимает
минимальное положительное значение для данных
условий
∆S / ∆t = ∆Si / ∆t + ∆Se / ∆t, где
∆Si / ∆t > 0 - протекание химических процессов внутри
организма;
∆Se / ∆t > 0 и ∆Se / ∆t < 0 - изменения энтропии за счет
воздействия окружающей среды.
∆S / ∆t ≥0 – непременное условие жизни
36.
Истинным критерием направленности процессов являетсятермодинамическая величина – свободная энергия Гиббса
- ∆G (изобарно-изотермический потенциал).
∆G = ∆Н - Т∆S, Дж/моль
∆G < 0 – реакция самопроизвольная, идет в прямом
направлении:
∆G > 0 – реакция идет в обратном направлении.
∆G = 0 – момент равновесия.
Свободную энергию Гиббса можно рассчитать, используя I
следствие закона Гесса:
∆Gр = ∑i ni ∆Gо298 обр. прод. р-ии – ∑i ni ∆Gо298 обр. исх. в-в р-ии
37.
Процессы, идущие в живых организмах называются:∆G < 0 – экзергонические – самопроизвольные
∆G > 0 – эндергонические – не самопроизвольные, эти
реакции могут протекать в прямом направлении, если они
сопряжены с экзергоническими реакциями.
Примером сопряженных процессов являются реакции
окисления и восстановления.
Процесс окисления глюкозы проходит в несколько стадий:
АТФ + Н2О → АДФ + Н3РО4, ∆G = -30,6 кДж/моль.
глюкоза → глюкоза-6-фосфат, ∆G = +13,4 кДж/моль.
АТФ + Н2О + глюкоза → АДФ + глюкоза-6-фосфат,
∆G = -17,2 кДж/моль.
38.
КПД – коэффициент полезного действияКПД машин ≈ 20%,
КПД биохимических процессов > 40 – 45%.
Например: полное окисление 1 моля глюкозы проходит с
выделением энергии 2879 кДж/моль.
Часть этой энергии идет на синтез АТФ:
1 моль глюкозы – 38 моль АТФ,
для образования 1 моль АТФ требуется 31,4 кДж,
отсюда
31,4 · 38 = 1193,2 кДж/моль – полезная работа
КПД = 1193,2 · 100 / 2879 = 41,4%.
39.
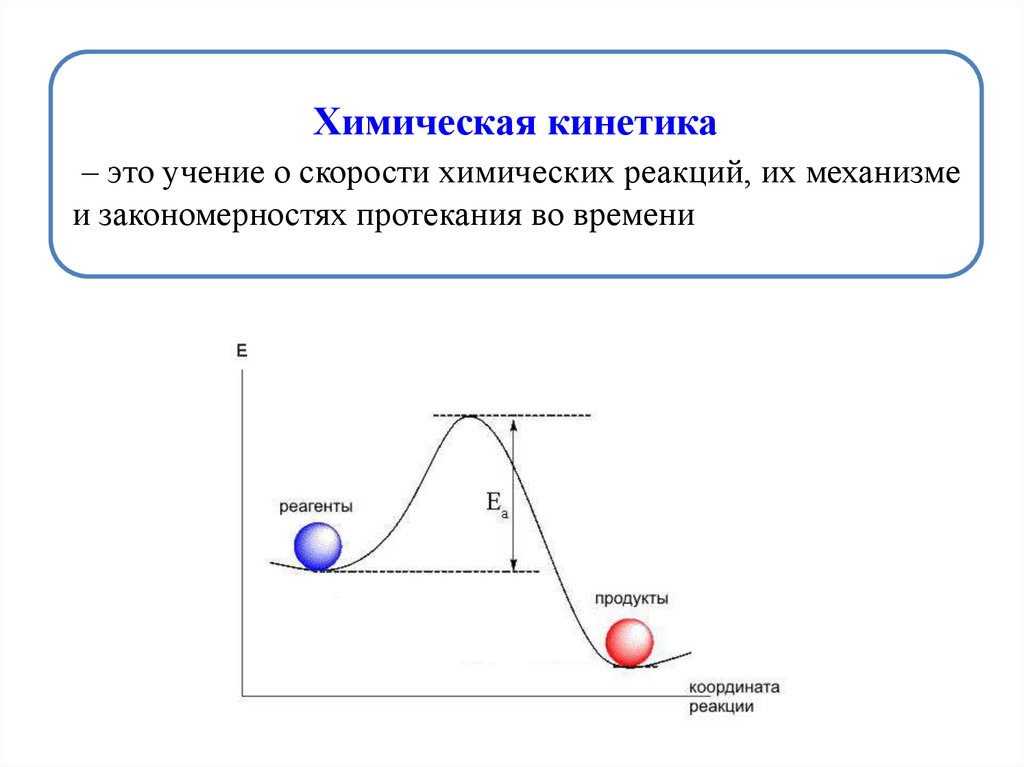
Химическая кинетика– это учение о скорости химических реакций, их механизме
и закономерностях протекания во времени
40.
Скорость химической реакциипоказывает изменение концентрации веществ во времени
Средняя
-характеризует изменение
концентрации веществ за
некоторый промежуток
времени.
Для гомогенных систем
υср. = ± n/ V t, или
υср. = ± С/ t,
моль/л с (мин., час)
Для гетерогенных систем
υср. = ± n/ S t
моль/м2 с (мин., час)
Истинная
-характеризует
изменение
концентрации веществ к
бесконечно
малому
промежутку времени
υист. = ± dC/dt, моль/л с ,
υ=k C
Дифференциальное
(кинетическое уравнение):
dC/dt = k C,
где k – константа скорости
реакции, она зависит от
природы
реагирующих
веществ, температуры.
41.
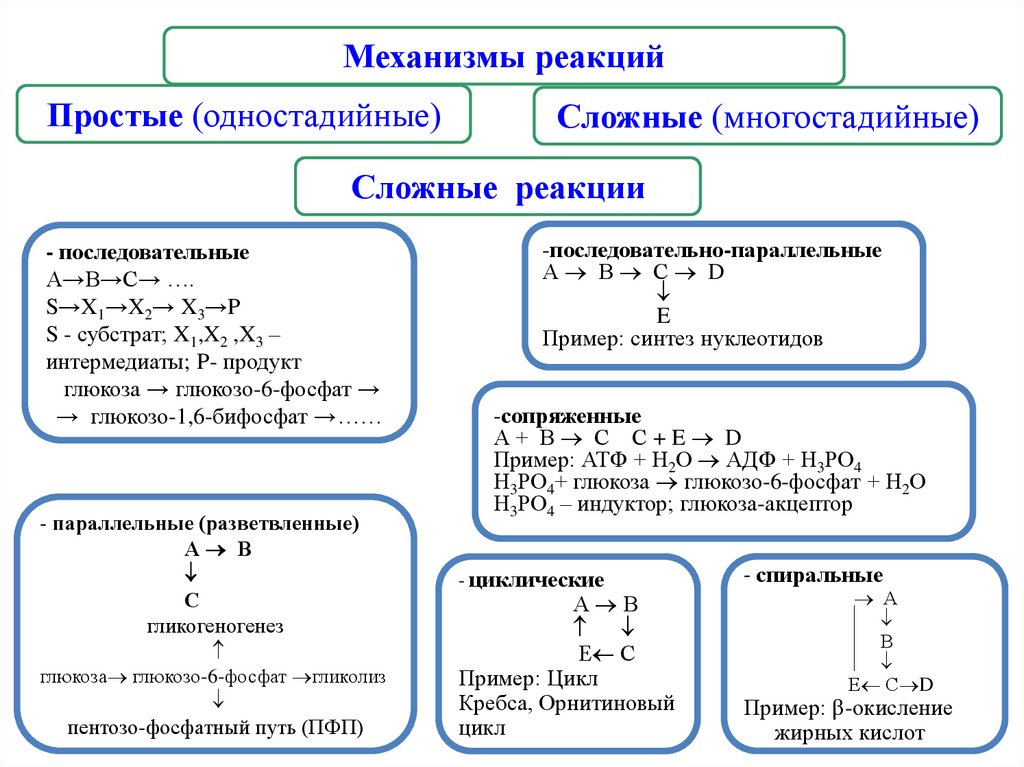
Механизмы реакцийПростые (одностадийные)
Сложные (многостадийные)
Сложные реакции
- последовательные
А→В→С→ ….
S→X1→X2→ X3→P
S - субстрат; X1,X2 ,X3 –
интермедиаты; P- продукт
глюкоза → глюкозо-6-фосфат →
→ глюкозо-1,6-бифосфат →……
- параллельные (разветвленные)
А В
С
гликогеногенез
глюкоза глюкозо-6-фосфат гликолиз
пентозо-фосфатный путь (ПФП)
-последовательно-параллельные
А В С D
E
Пример: синтез нуклеотидов
-сопряженные
А+ В С С+E D
Пример: АТФ + Н2О АДФ + Н3РО4
Н3РО4+ глюкоза глюкозо-6-фосфат + Н2О
Н3РО4 – индуктор; глюкоза-акцептор
- циклические
А В
Е С
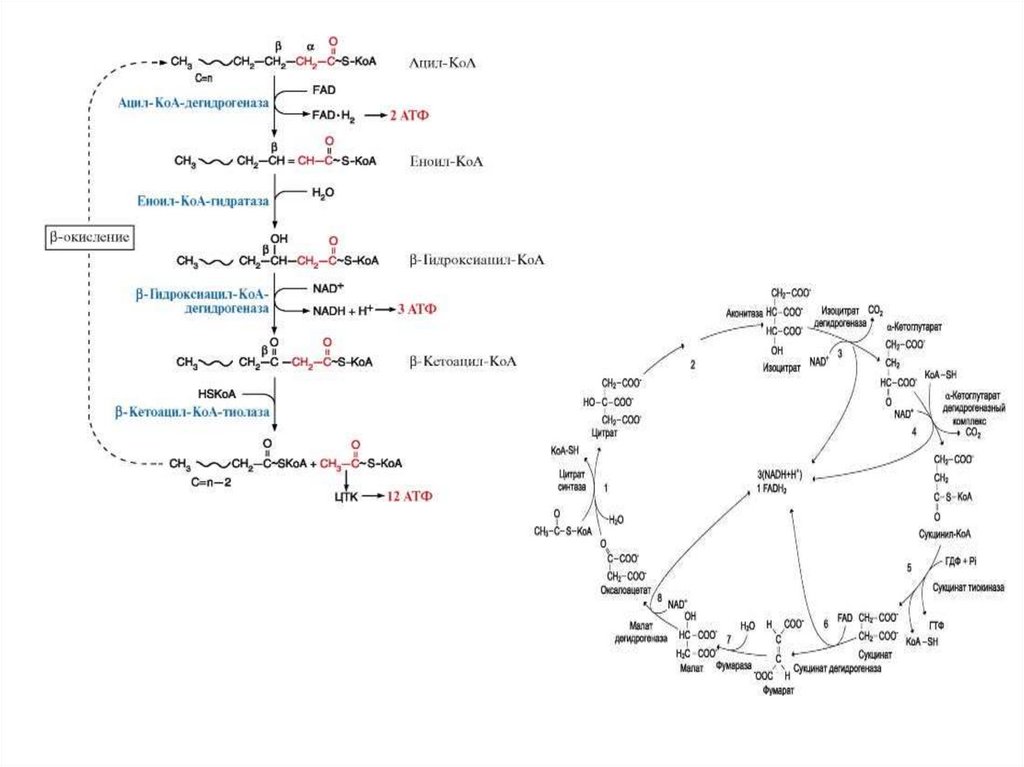
Пример: Цикл
Кребса, Орнитиновый
цикл
- спиральные
А
В
Е С D
Пример: -окисление
жирных кислот
42.
43.
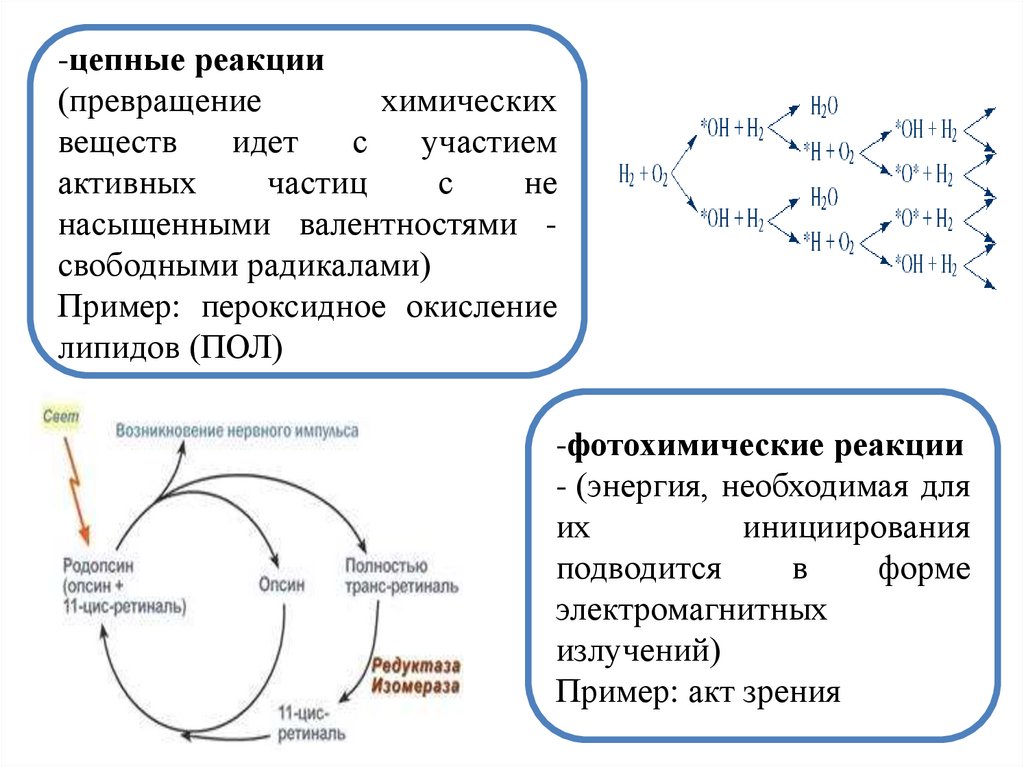
-цепные реакции(превращение
химических
веществ
идет
с
участием
активных
частиц
с
не
насыщенными валентностями свободными радикалами)
Пример: пероксидное окисление
липидов (ПОЛ)
-фотохимические реакции
- (энергия, необходимая для
их
инициирования
подводится
в
форме
электромагнитных
излучений)
Пример: акт зрения
44. Факторы, влияющие на скорость реакции
1) КонцентрацияЗакон Гульдберга и Вааге: «При постоянной
температуре скорость реакции пропорциональна
произведению концентраций реагирующих веществ,
взятых в степенях, равных их стехиометрическим
коэффициентам», для реакции: aA + bB↔cC + dD
υ = k1 C(A)a C(B)b
Закон справедлив для простых реакций, для сложных
реакций определяют порядок реакции, являющийся
суммой стехиометрических коэффициентов a + b
Для сложных реакций:
υ = k1 C(A)νA C(B) νB, где
νA ,νB – порядки реакций для веществ А и В
45. Кинетические уравнения
С0 - исходная концентрация вещества;С - оставшаяся концентрация вещества после реакции
для реакций :
0-порядка υ = k; С0-С=k0 t;
k0=С0-С/t (моль/л с)
I-порядка υ = kI С; С = С0 e kI t;
lgС = lg С0 - kI t/2,3;
kI= 1/t lnС0/С (с-1);
kI= 2,3/t lg С0/С (с-1)
II-порядка υ = kII С2; С = С0/1+ kII С0 t;
kII= 1/t (С0-С/ С0 С)
46.
Период полупревращения (полураспада)t½ - промежуток времени в течение которого реагирует
половина взятого количества вещества
для реакций :
0-порядка t½ = С0 /2 k0
I-порядка t½ = 0,693/ kI
II-порядка t½ = 1/ kII С0
47. Факторы, влияющие на скорость реакции
2) ТемператураЗакон Вант-Гоффа: «При повышении температуры на 100С
скорость гомогенной реакции возрастает в 2-4 раза».
υТ2/ υТ1 = γ Т2 -Т1/10
γ - температурный коэффициент реакции, показывающий во
сколько раз возрастает скорость реакции при увеличении
температуры на 100С.
Уравнение Аррениуса:
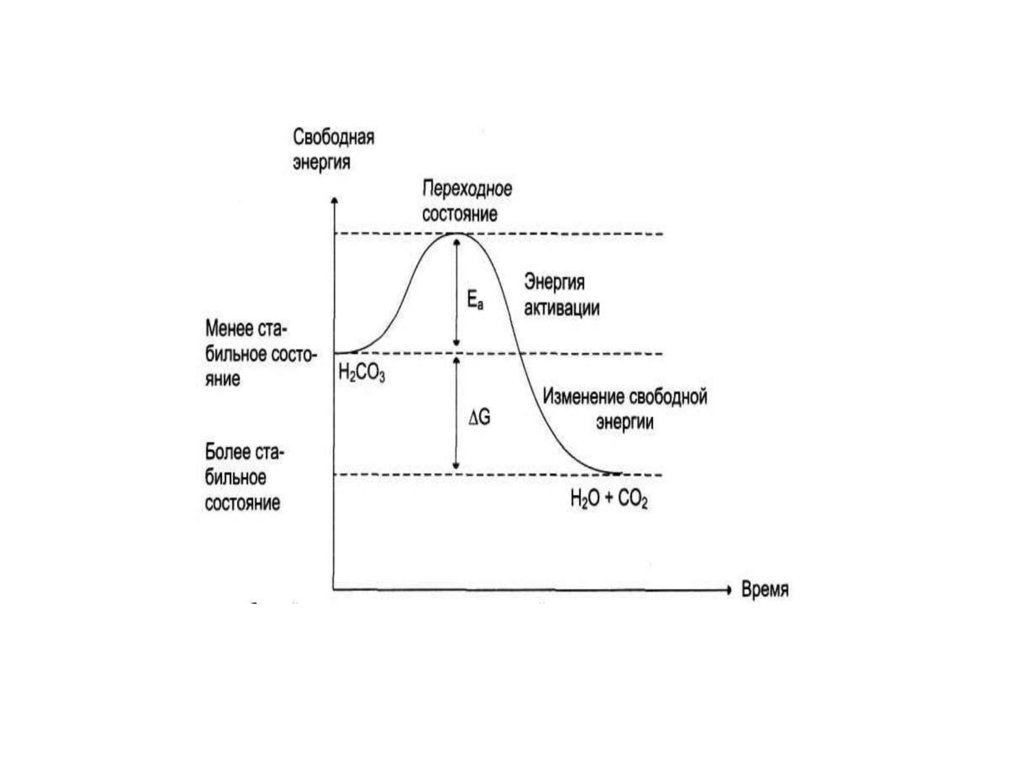
k = А е –Еа/RT, где
А – предэкспоненциальный множитель, учитывающий
вероятность и число активных столкновений;
Еа – энергия активации, показывающая тот необходимый
избыток энергии, которым должны обладать молекулы в
момент столкновения, чтобы реакция была возможной
48.
49.
Ферменты (энзимы) – биологические катализаторыСвойства ферментов
Высокая специфичность в отношении субстратов;
Высокая биологическая активность;
Лабильность(способность к небольшим изменениям
нативной конформации при разрывеслабых связей, что
может приводить к уменьшению каталитической активности
;
Зависимость активности от физико-химических
параметров среды;
Регулируемость интенсивности ферментативных реакций.
50.
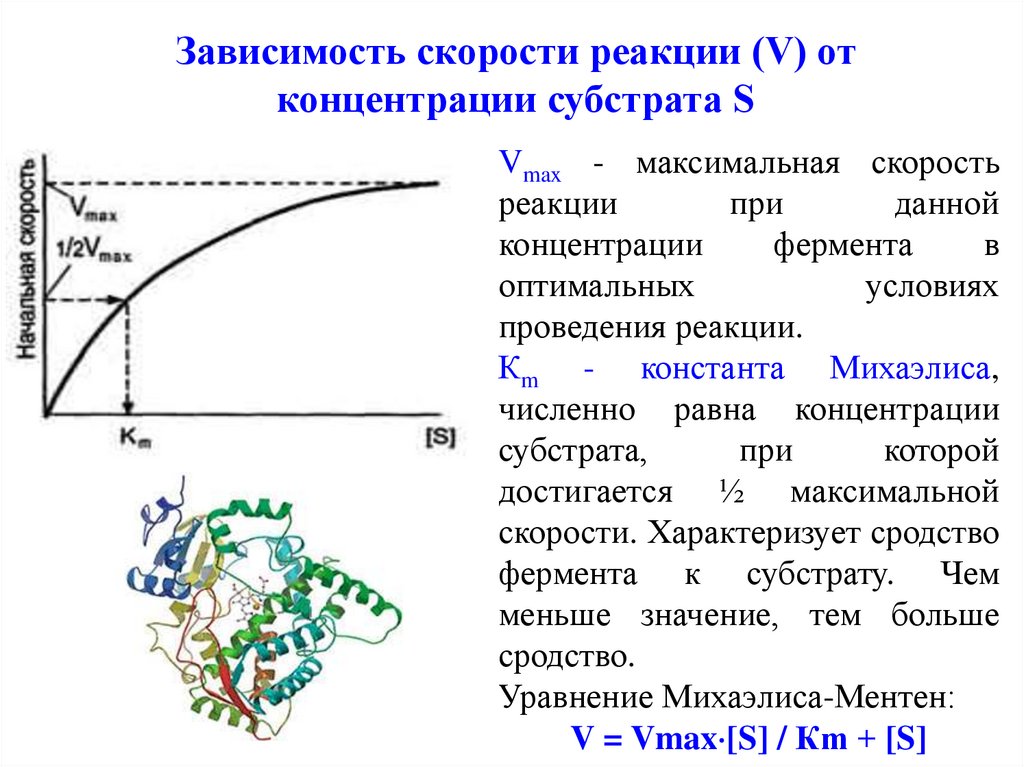
Зависимость скорости реакции (V) отконцентрации субстрата S
Vmax - максимальная скорость
реакции
при
данной
концентрации
фермента
в
оптимальных
условиях
проведения реакции.
Кm - константа Михаэлиса,
численно равна концентрации
субстрата,
при
которой
достигается ½ максимальной
скорости. Характеризует сродство
фермента к субстрату. Чем
меньше значение, тем больше
сродство.
Уравнение Михаэлиса-Ментен:
V = Vmax [S] / Кm + [S]
51.
Классификация химических реакций пообратимости
Необратимые реакции протекают в одном направлении
практически до конца. Практически необратимыми являются
реакции значения G0298 которых больше 30 кДж/моль или
меньше -30 кДж/моль.
Признаками
таких
реакций
является
образование
газообразных продуктов, трудно растворимого соединения,
слабого электролита.
Пример:
2KMnO4 K2MnO4 + MnO2 + O2
BaCl2 + H2SO4 BaSO4 + 2HCl
NaOH + HCl NaCl + H2O
52.
Обратимые реакции одновременно протекают как впрямом, так и в обратном направлении. Значения G0298
находятся в пределах от -30 кДж/моль до 30 кДж/моль.
Пример:
I2 + H2 ↔ 2HI
CH3COOH + C2H5OH ↔ CH3COOC2H5 + H2O
53.
Условия химического равновесияДля уравнения в общем виде:
aA + bB ↔ cC + dD
исходные в-ва
продукты реакции
Пс =С(С)c С(D)d/ С(A)a С(B)b
Kc = [C]c [D]d/[A]a [B]b
Пс – стехиометрическое соотношение концентраций веществ
Kс – константа равновесия реакции
[C];[D];[A]; [B] – равновесные концентрации веществ.
Закон действующих масс К. Гульдберга и Вааге:
«Частное от деления произведения концентраций продуктов
реакции на произведение концентраций исходных веществ
взятых в степенях, равных их стехиометрическим
коэффициентам при постоянных внешних условиях, есть
величина постоянная»
54.
Термодинамика химического равновесияХимическое равновесие наступает, когда G = 0
∆G = ∆G0 + R T Пс
∆G0 = - R T lnКс
Для газообразных веществ:
Кр = рc(C) рd(D) / рa(A) рb(B)
[C] = С(исх.) – С(прореаг.)
∆G = - R T lnКс + R T lnПс
Уравнение изотермы химической реакции –
∆G = R T ln(Пс/Кс)
Кс > Пс, ∆G < 0 – прямая реакция.
Кс < Пс, ∆G > 0 – обратная реакция.
Кс = Пс, ∆G = 0 – химическое равновесие.
55.
Смещение химического равновесияПринцип Ле-Шателье:
«Если на систему, находящуюся в состоянии химического
равновесия, оказывать внешнее воздействие, то
равновесие смещается в направлении той реакции,
протекание которой ослабляет это воздействие».
Факторы, смещающие равновесие:
- Изменение
концентрации
веществ.
Увеличение
концентрации исходных веществ вызывает смещение
равновесия в сторону образования продуктов реакции.
- Изменение температуры. Повышение температуры
вызывает
смещение
равновесия
в
сторону
эндотермической реакции.
- Изменение давления (для газообразных систем).
Повышение
давления
смещает
равновесие
в
направлении реакции, идущей с уменьшением объема.
N2 + 3H2 ↔ 2NH3
Hb + O2 HbO2
56.
Понятие о гомеостазе и стационарном состоянииживого организма
Для живых организмов характерно постоянство параметров
стационарного состояния во времени, которое называется
гомеостаз.
Сходство химического равновесия со стационарным
состоянием заключается в неизменности во времени
(сохраняет свои параметры).
Отличие заключается в двух признаках:
- для стационарного состояния ∆G ≠ 0,
∆G / ∆t = ∆Gi / ∆t + ∆Ge / ∆t ≥ 0
- для химического равновесия ∆G = 0.
Изменение энтропии при стационарных состояниях
минимальна, а при химическом равновесии – максимальна.
Аутостабилизация – восстановление и поддержание
стационарного
состояния
(свойство
стационарности
открытых систем).






































 chemistry
chemistry








