Similar presentations:
9_Угольная кислота и её соли (1)
1.
Тема урока:«Угольная кислота и её соли»
2.
Сегодня на уроке вы…Познакомитесь
со строением и
свойствами
угольной
кислоты и её
солей
Узнаете
Научитесь
о значении
составлять
угольной
уравнения
кислоты и её
реакций,
описывающих солей в природе
и жизни
свойства данной
человека
кислоты
3.
Вспомним:1. Какие оксиды образует углерод? Какие группы оксидов
они представляют?
2. Охарактеризуйте получение и свойства оксида углерода
(II). Запишите уравнения соответствующих реакций.
3. Охарактеризуйте получение и свойства оксида углерода
(IV). Запишите уравнения соответствующих реакций.
4. Где используют оксиды углерода?
4.
Угольная кислота H₂CO₃История открытия и особенность молекулы:
В начале XVIII века угольную кислоту впервые
получил английский химик Джозеф Пристли,
растворяя углекислый газ в воде. Полученный
раствор долгое время называли «содовым»
раствором.
Джозеф Пристли
Это слабая неустойчивая, существующая только в
растворе, двухосновная растворимая кислота. Молекула
линейная, все связи в ней – ковалентные полярные.
27.01.2026
5.
Угольная кислота H₂CO₃Способы получения:
1. Растворение углекислого газа в воде:
CO₂ + H₂O
H₂CO₃
Охлаждение раствора и повышение давления сместит равновесие в сторону
образования угольной кислоты.
2. Взаимодействие солей угольной кислоты с сильными кислотами:
Na₂CO₃ + 2HCl = 2NaCl + H₂O + CO₂
H₂CO₃
Большая часть молекул кислоты распадется на углекислый газ и воду
27.01.2026
6.
Угольная кислота H₂CO₃Специфические химические свойства:
1. Диссоциирует (ступенчато):
H₂CO₃
H⁺ + HCO₃¯
Гидрокарбонат-анион
HCO₃¯
H⁺ + CO₃²¯
Карбонат-анион
Лакмус в растворе окрасится не в красный цвет, а в розовый.
2. Разлагается (даже при очень слабом нагревании):
H₂CO₃
27.01.2026
H₂O + CO₂
7.
Угольная кислота H₂CO₃Общие химические свойства для всех кислот:
1. Реагирует с активными металлами:
H₂CO₃ + 2Na = Na₂CO₃ + H₂
Карбонат натрия
2. Реагирует с основными оксидами:
H₂CO₃ + CaO = CaCO₃ + H₂O
3. Реагирует с основаниями:
Карбонат кальция
H₂CO₃ + 2KOH = K₂CO₃ + 2H₂O
Карбонат калия
H₂CO₃(избыток) + KOH = KHCO₃ + H₂O
27.01.2026
Гидрокарбонат калия
8.
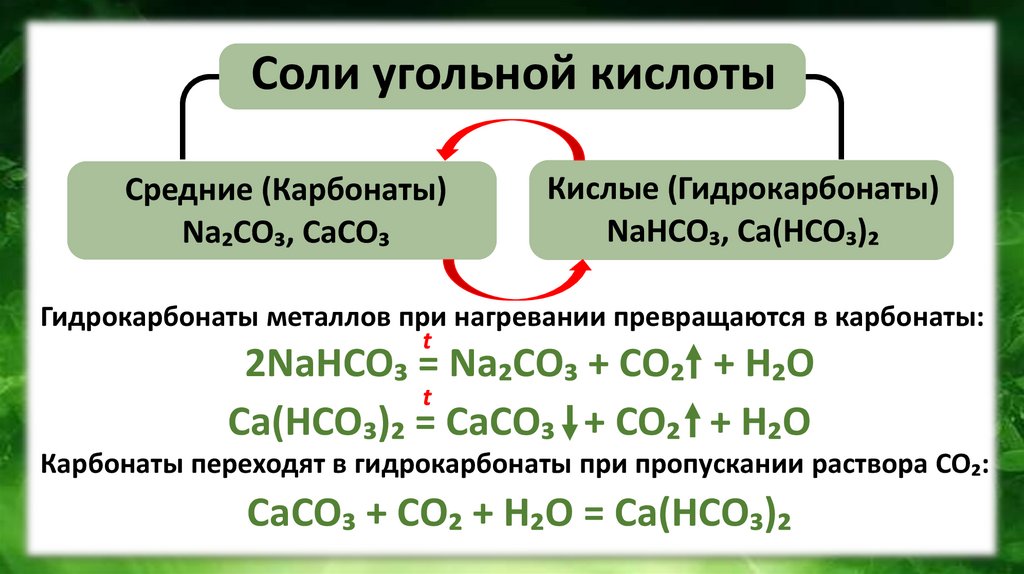
Соли угольной кислотыСредние (Карбонаты)
Na₂CO₃, CaCO₃
Кислые (Гидрокарбонаты)
NaHCO₃, Ca(HCO₃)₂
Гидрокарбонаты металлов при нагревании превращаются в карбонаты:
t
2NaHCO₃ = Na₂CO₃ + CO₂ + H₂O
t
Ca(HCO₃)₂ = CaCO₃ + CO₂ + H₂O
Карбонаты переходят в гидрокарбонаты при пропускании раствора CO₂:
CaCO₃ + CO₂ + H₂O = Ca(HCO₃)₂
27.01.2026
9.
Соли угольной кислоты в природеВ природе в результате обратного
превращения растворимого гидрокарбоната кальция Ca(HCO₃)₂ в
нерастворимый карбонат CaCO₃ в
пещерах формируются сталактиты
и сталагмиты.
27.01.2026
10.
Свойства солей угольной кислотыКарбонаты – твёрдые
кристаллические вещества, в
воде растворяются только:
(NH₄)₂CO₃, Na₂CO₃ и K₂CO₃.
Гидрокарбонаты в воде
растворяются лучше: NaHCO₃,
KHCO₃, Mg(HCO₃)₂, Ca(HCO₃)₂,
Ba(HCO₃)₂, Sr(HCO₃)₂.
1. При нагревании разлагаются:
t
CaCO₃ = CaO + CO₂
t
2NaHCO₃ = Na₂CO₃ + H₂O + CO₂
Не разлагаются карбонаты щелочных металлов.
27.01.2026
11.
Свойства солей угольной кислоты2. Взаимодействуют с другими солями (если образуется осадок):
Na₂CO₃ + CaCl₂ = 2NaCl + CaCO₃
2NaHCO₃ + CaCl₂ = 2NaCl + H₂O + CO₂ + CaCO₃
3. Взаимодействуют с кислотами:
Na₂CO₃ + 2HCl = 2NaCl + H₂O + CO₂
NaHCO₃ + HCl = NaCl + H₂O + CO₂
Качественная реакция на карбонат-анион CO₃²¯
Бурное выделение углекислого газа
27.01.2026
12.
Применение угольной кислоты и ее солейNaHCO₃
H₂CO₃
В пищевой промышленности
Производство
и фармацевтике
газированных напитков
K₂CO₃
Производство хрусталя и
в качестве удобрения
27.01.2026
CaCO₃
В скульптуре и
строительстве
Na₂CO₃
Уход за
контактными линзами
Производство стекла,
бумаги и жидкого мыла
13.
Вывод:1. Угольная кислота H₂CO₃ - слабая и неустойчивая,
но играет глобальную роль в окружающей среде.
2. Соли угольной кислоты – важные минералы,
участвующие в круговороте углерода на Земле.
3. Соли угольной кислоты – нашли широкое
применение
от
кухни
до
тяжёлой
промышленности.
27.01.2026
14.
Домашнее задание:1. Изучить параграф 36.
2. Уметь записывать уравнения химических реакций,
описывающие получение и химические свойства
угольной кислоты и её солей.
3. Творческое задание (на выбор): подготовить
сообщение на тему «Пещеры как результат работы
угольной кислоты».













 chemistry
chemistry








