Similar presentations:
фосфор
1. ФОСФОР- ЭЛЕМЕНТ V ГРУППЫ
2.
Относительная атомная масса 30,9738Порядковый номер 15
Число протонов в ядре 15
Число нейтронов 16
Наиболее характерная степень окисления
+3, +5, реже встречается -3
3. ФОСФОР
Электронная формула:+15
Р 1s 2s 2
2
2
P6
3S2 3P3
4. Фосфор в природе
Из-за большой химической активности фосфор вприроде встречается только в соединениях.
Фосфор входит в состав:
минералов фосфоритов и апатитов, в виде соединения
фосфата кальция Ca3(PO4)2;
Крупнейшее месторождение апатитов находится на
Кольском полуострове, в районе Хибинских гор.
Залежи фосфоритов находятся в районе гор Каратау, в
Московской, Калужской, Брянской областях и в
других местах.
белковых веществ, содержащихся в генеративных
органах растений;
нервной и костной тканей организмов животных и
человека;
мозговых клеток.
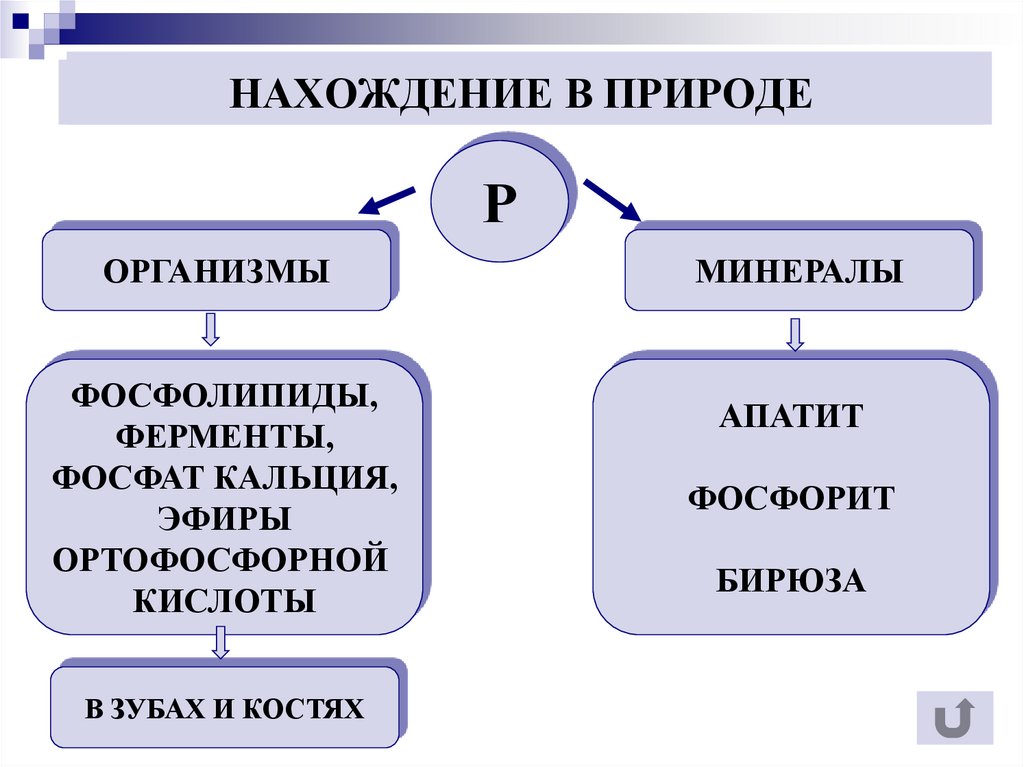
5. НАХОЖДЕНИЕ В ПРИРОДЕ
РОРГАНИЗМЫ
ФОСФОЛИПИДЫ,
ФЕРМЕНТЫ,
ФОСФАТ КАЛЬЦИЯ,
ЭФИРЫ
ОРТОФОСФОРНОЙ
КИСЛОТЫ
В ЗУБАХ И КОСТЯХ
МИНЕРАЛЫ
АПАТИТ
ФОСФОРИТ
БИРЮЗА
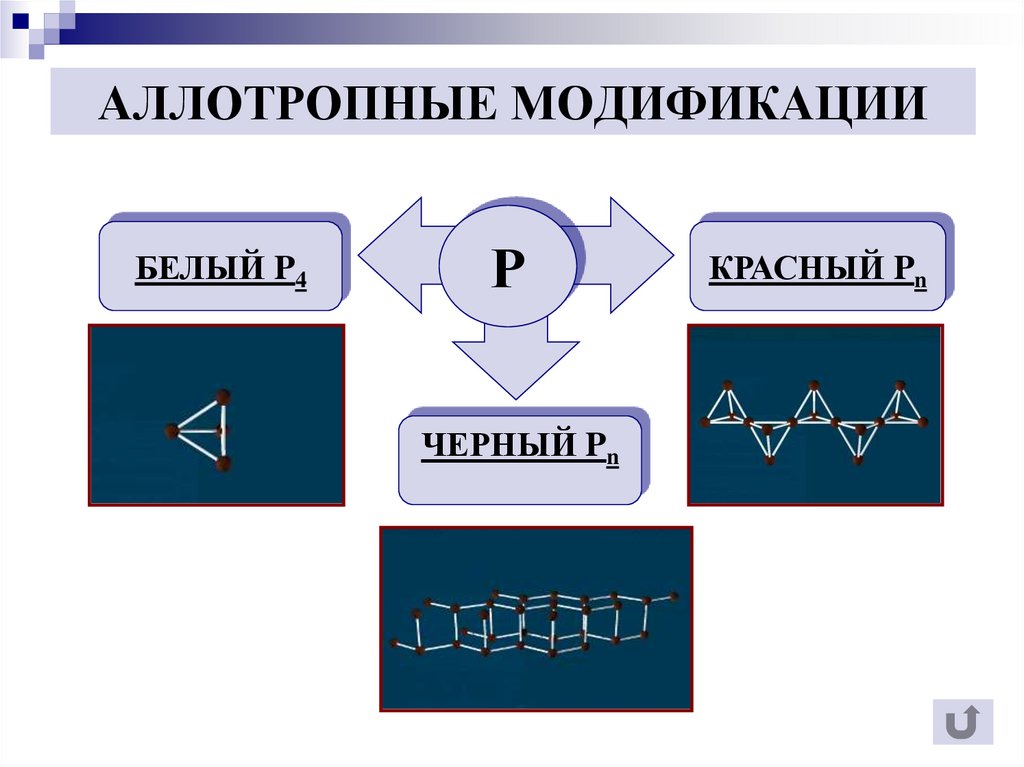
6. Аллотропные модификации фосфора
7. АЛЛОТРОПНЫЕ МОДИФИКАЦИИ
БЕЛЫЙ P4Р
ЧЕРНЫЙ Pn
КРАСНЫЙ Pn
8. БЕЛЫЙ ФОСФОР
Молекулы P4 имеют форму тетраэдра. Этолегкоплавкое t(пл)=44,1оС, t(кип)=275оС, мягкое,
бесцветное
воскообразное
вещество.
Хорошо
растворяется в сероуглероде и ряде других
органических
растворителей.
Ядовит,
воспламеняется на воздухе, светится в темноте.
Хранят его под слоем воды.
9. КРАСНЫЙ ФОСФОР
Существует несколько форм красного фосфора Ихструктуры окончательно не установлены. Известно, что
они являются атомными веществами с полимерной
кристаллической решеткой. Их температура плавления
585-600оС, цвет от темно-корчневого до красного и
фиолетового. Не ядовит.
10. ЧЕРНЫЙ ФОСФОР
Черный фосфор имеет слоистую атомнуюкристаллическую решетку. По внешнему виду
похож на графит, но является полупроводником.
Не ядовит.
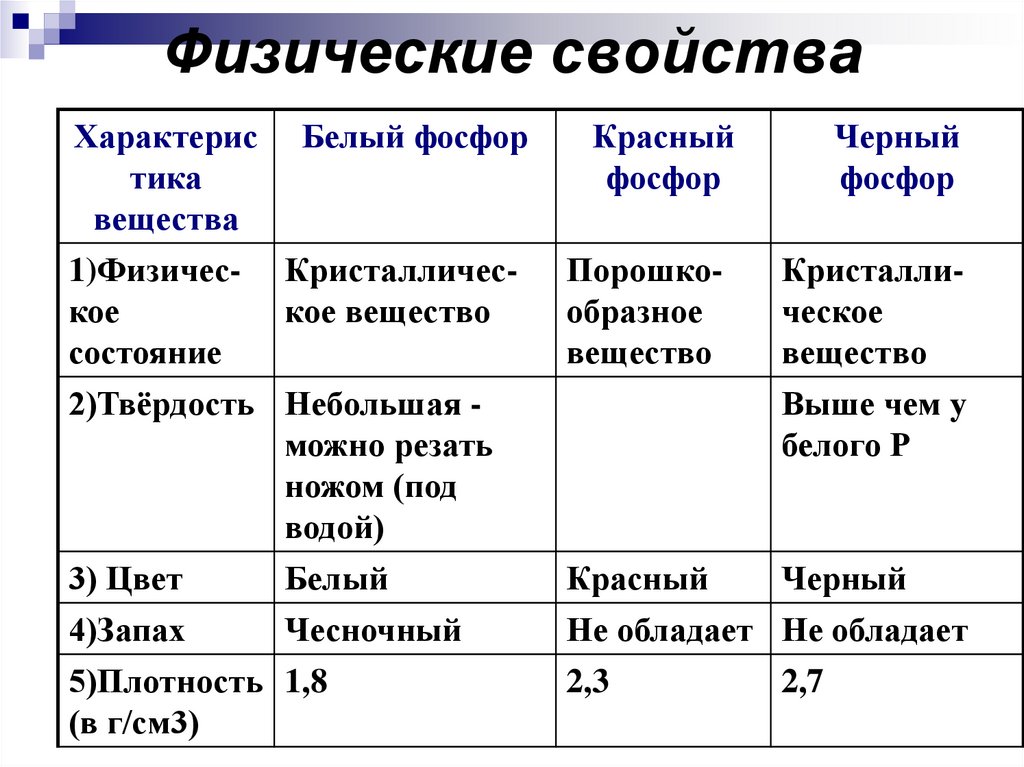
11. Физические свойства
Характерис Белый фосфортика
вещества
1)Физичес- Кристаллическое
кое вещество
состояние
2)Твёрдость Небольшая можно резать
ножом (под
водой)
3) Цвет
Белый
4)Запах
Чесночный
5)Плотность 1,8
(в г/см3)
Красный
фосфор
Черный
фосфор
Порошкообразное
вещество
Кристаллическое
вещество
Выше чем у
белого Р
Красный
Черный
Не обладает Не обладает
2,3
2,7
12.
6)Растворимость в водеНе
Не
Не
растворяется растворяется растворяется
7)Температура 44
плавления (0С)
260
280
8)Свечение
Не светится
Не светится
Не ядовит
Не ядовит
9)Действие на
организм
В темноте
светится
Сильный яд
13. Химические свойства
При длительном нагревании белого фосфора бездоступа воздуха он желтеет и постепенно
превращается в красный фосфор. При
нагревании красного фосфора в тех же
условиях он превращается в пар, при
конденсации которого образуется белый
фосфор.
Фосфор проявляет окислительные и
восстановительные свойства.
14.
Фосфор – восстановитель:5О2 (изб.) + 4Р → 2Р2О5
3О2 (недост.) + 4Р → 2Р2О3
3Сl2 + 2P → 2PCl3
PСl3 + Cl2 → PCl5
3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO
4P + 16H2O → 4H3PO4 + 10H2
Фосфор – окислитель:
2Р + 3Mg → Mg3P2
15. Получение
Фосфор получают из фосфоритов иапатитов, нагревая их в электрической
печи без доступа воздуха в присутствии
оксида кремния (IV) и угля
Са3(РО4)2+5С+3SiO2 t
3CaSiO3+2P+5CO
пары фосфора конденсируются под водой,
и при этом образуется белый фосфор, в
узлах кристаллической решётки
которого находятся молекулы Р4.
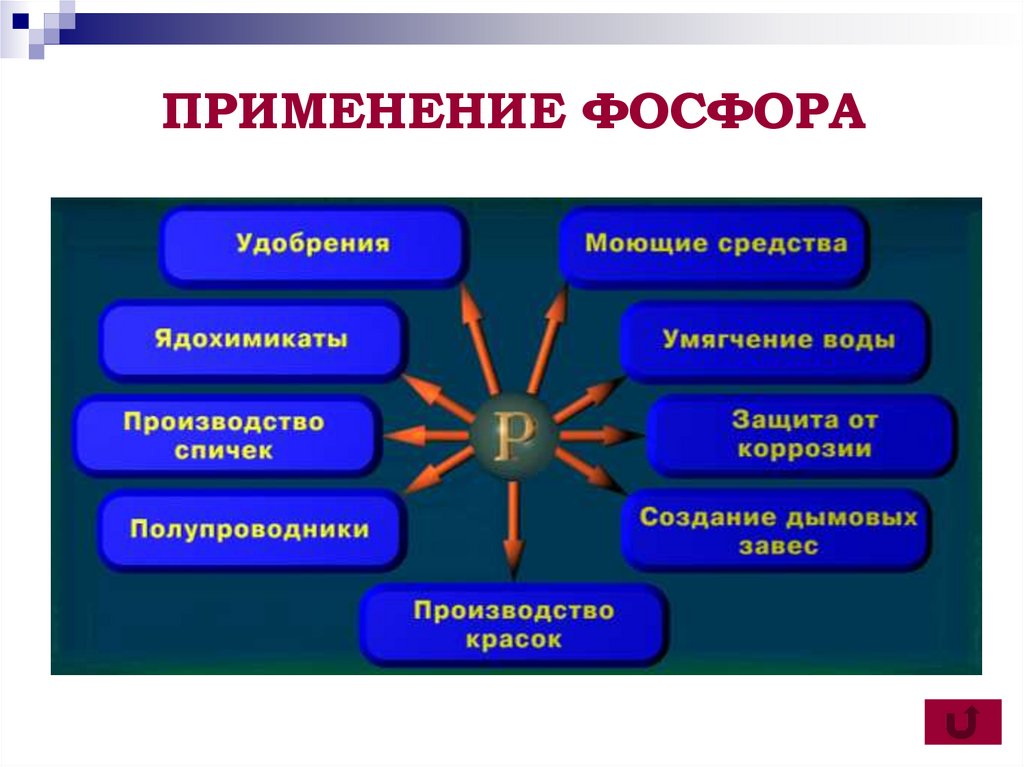
16. Применение
Красный фосфор применяют в производствеспичек. Его вместе с тонко измельченным
стеклом и клеем наносят на боковую сторону
коробка. При трении спичечной головки, в
состав которой входят хлорат калия KClО3 и
сера, происходит воспламенение:
6Р+5KClO3 5KCl+3P2O5
Белый фосфор в военное время использовали в
зажигательных бомбах и для создания
дымовых завес.
17. ПРИМЕНЕНИЕ ФОСФОРА
18. Фосфор. Соединения фосфора
19. План
Оксид фосфора - Р2О52) Фосфорная кислота - Н3РО4
3) Соли фосфорной кислоты –
Са3(РО4)3 Са(Н2РО4)2 СаНРО4
1)
20. Фосфор в природе
В природе фосфор в свободном виде невстречается – только в виде соединений.
Важнейшими природными
соединениями фосфора являются
минералы фосфориты и апатиты.
Основную их массу составляет фосфат
кальция Са3 (РО4)3, из которого и
получают в промышленности фосфор.
21. Кислотный оксид Р2О5 Физические свойства
Белое гигроскопичное порошкообразноевещество.
Хорошо растворимое в воде, образует
несколько кислот.
Используется как осушитель газов и
жидкостей, отнимает воду у химических
соединений.
22. Кислотный оксид Р2О5 Химические свойства
1) с водойР2О5 + 3 Н2О → 2Н3РО4
(ортофосфорная кислота)
Р2О5 + Н2О → 2НРО3
(метафосфорная кислота)
Р2О5 + 2 Н2О → Н4Р2О7
(пирофосфорная кислота)
23. Кислотный оксид Р2О5 Химические свойства
2) с основными оксидамиР2О5 + 3 СаО = Са3 (РО4)3
3) со щелочами
Р2О5 + 6 Nа ОН = 2 Nа3РО4 + 3 Н2О
24. Ортофосфорная кислота Н3РО4 Физические свойства
Белые прозрачные кристаллы,не ядовита
Кислота средней силы
С водой смешивается в любых соотношениях.
Тплав. = 42 0С, плавиться без разложения, при
умеренном нагревании разлагается.
Окислительные свойства не проявляет
(отличие от Н2SO4 (конц.), НNO3)
25. Ортофосфорная кислота Н3РО4
Является трехосновной кислотой иобразует три ряда солей:
1) средние соли, или фосфаты - Са3(РО4)3
Которые нерастворимы в воде, кроме
фосфатов щелочных металлов
2) Кислые-дигидрофосфаты- Са(Н2РО4)2
Большинство из которых хорошо
растворимы в воде
26. Ортофосфорная кислота Н3РО4
3) Кислые-гидрофосфаты- СаНРО4Которые малорастворимы в воде (кроме
фосфатов натрия, калия и аммония), т.е.
занимают промежуточное положение между
фосфатами и дигидрофосфатами по
растворимости.
Вывод: с увеличением содержания атомов
водорода в молекуле соли, ее растворимость
повышается.
27. Ортофосфорная кислота Н3РО4 Химические свойства
Н3РО4 проявляет все свойства кислотРеагирует:
1) со щелочами: NaOH, КОН
2) с основными оксидами: Li2O, Na2O
3) c солями: К2СО3
4) с металлами не реагирует !!!
(см.Таблицу растворимости)
?
28. Ортофосфорная кислота Н3РО4 Химические свойства
Фосфаты всех металлов (КромеЩМе)нерастворимы, поэтому на поверхности
этих металлов образуется
нерастворимая пленка, препятствующая
их дальнейшему растворению в кислоте.
ЩМе при растворении в кислоте,
начинают взаимодействовать с водой.
29. Ортофосфорная кислота Н3РО4 Химические свойства
Некоторые реакции с металламипротекают в очень разбавленных
растворах:
2 Н3РО4 (разб) + 3 Мg = Мg3(РО4 )2↓ + 3Н2↑
30. Качественная реакция на фосфат-ион РО43-
Качественная реакцияна фосфат-ион РО43 РО43-
+ 3Ag+ → Ag3РО4 ↓ (желтый
фосфат серебра)
Полученный осадок растворяется в
сильных кислотах.
По этому признаку его можно отличить
от других нерастворимых солей серебра
желтого цвета – AgI, AgBr
AgCl – белого цвета
31. Задание
Напишите уравнение диссоциации солейФосфата натрия
Гидрофосфата натрия
Дигидрофосфата натрия
Обратите внимание: средние соли
диссоциируют в 1 ступень (сильные
электролиты), у кислых солей –
несколько ступеней диссоциации.
32. Диссоциация солей фосфора
Вывод: Каждаяпоследующая
ступень
диссоциации
протекает в
меньшей
степени, чем
предыдущая.
33. Применение
Фосфорную кислотуиспользуют при
производстве, лекарств,
синтетических моющих
средств, стекла.
Фосфаты используют при
производстве удобрений.
Фосфорная кислота
используется при
производстве
газированных напитков
(кока-кола)
Соединения фосфора
используют для получения
антикоррозионных добавок
Соединения фосфора
используют для
получения добавок
к маслам и горючему для
автомобилей.
Фосфаты добавляют в
корм скоту как пищевую
добавку
34.
Домашнее задание:§19, прочитать, упр 4;
сделать конспект по
презентации;
Подготовить сообщение о
применении фосфора и его
соединений






























 chemistry
chemistry








