Similar presentations:
Фосфор и его соединения
1.
Найдите химическую ошибку:Артур Конан Дойль
«СОБАКА БАСКЕРВИЛЕЙ»
2.
“...Да! Это была собака, огромная,черная, как смоль. Но такой собаки еще
никто из нас, смертных, не видывал. Из ее
отверстой пасти вырывалось пламя, глаза
метали искры, по морде и загривку
переливался мерцающий огонь. Ни в
чьем воспаленном мозгу не могло
возникнуть видение более страшное,
более омерзительное, чем это адское
существо, выскочившее на нас из
тумана... Страшный пес, величиной с
молодую львицу. Его огромная пасть все
еще светилась голубоватым пламенем,
глубоко сидящие дикие глаза были
обведены огненными кругами. Я
дотронулся до этой светящейся головы и,
отняв руку, увидел, что мои пальцы тоже
засветились в темноте. Фосфор! Странная
смесь … Совершенно без запаха. Состав
преступления теперь налицо…”.
Вот в какой неприятной истории оказался
замешан элемент №15. Но могло ли быть
такое в действительности, имеет ли
фосфор такие свойства, прав ли был
А.Конан-Дойл? Выясним сегодня на
уроке.
3.
химия 9 классФосфор и его соединения
4.
Положение в ПСХЭ Д.И.Менделеева5.
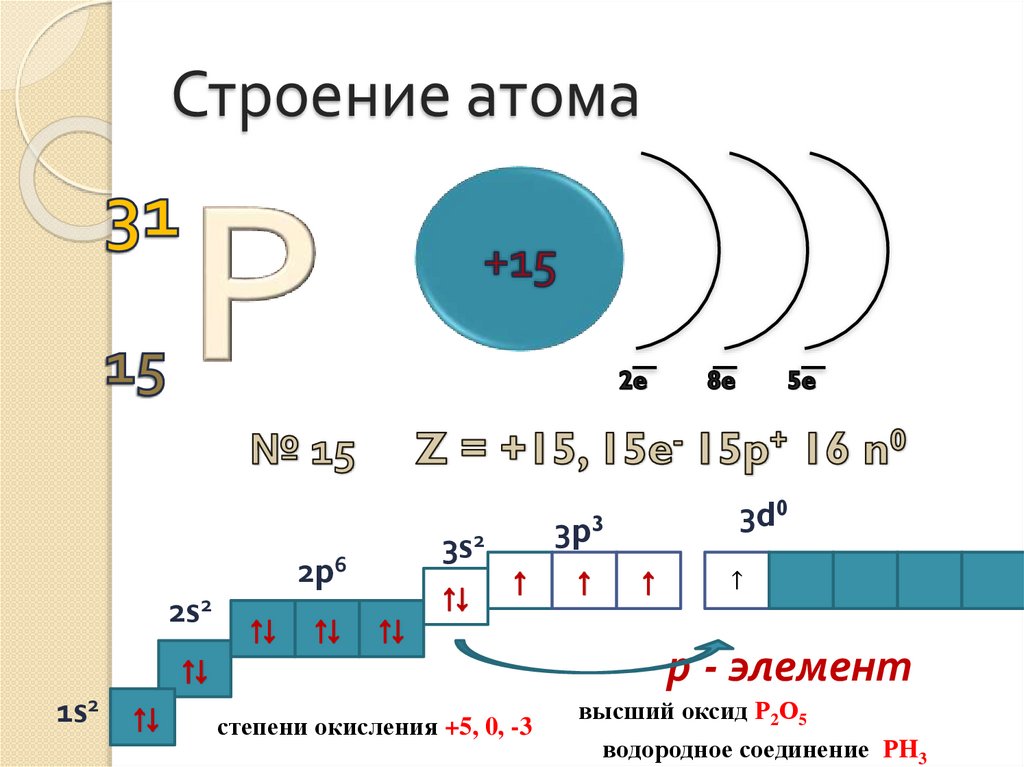
Строение атома2p6
3s2
2s2
3p3
3d0
↑
р - элемент
1s2
степени окисления +5, 0, -3
высший оксид Р2О5
водородное соединение РH3
6.
Открытие фосфорабыл открыт в
1669г. немецким алхимиком
- в 1847г.
при нагревании
белого до 2500 С в инертном
газе.
открыл в
1797г. русский учёный
В 1934г. проф.
,
подвергая белый фосфор
давлению до 1100 атм.
превратил его в
7.
Как называется явлениесуществования нескольких простых
веществ, образованных одним и тем
же химическим элементом?
Аллотропия
8.
Физические свойства9.
Белый фосфор –10.
Горение белого фосфора11.
16 июля, в 16:55 в Львовской области Украины на перегоне КрасноеОжидив сошли с рельсов и перевернулись 15 цистерн с желтымфосфором товарного поезда №2005. Всего в составе было 58
вагонов. Цистерны следовали с казахской станции Аса (Джамбул,
Казахстан) на станцию Оклеса (Республика Польша). Утечка фосфора
из одной цистерны спровоцировала самовозгорание шести других
цистерн.
Однако неприятности на этом не закончились. Во время тушения
пожара образовалось облако из продуктов горения с зоной
поражения около 90 квадратных километров. В этой зоне оказались
14 населенных пунктов , где проживает 11 тысяч человек.
На следующее утро, пострадавших насчитывалось 20 человек , из них
13 в тяжелом и средне-тяжелом состоянии были госпитализированы .
Желтый фосфор, с которым пришлось столкнуться спасателям и
жителям Львовской области, это тот же самый белый фосфор, только
с добавлением технических примесей. Это сильноядовитое,
огнеопасное кристаллическое вещество . В воде он не растворяется,
на воздухе легко окисляется и самовоспламеняется. Горит с
выделением густого белого дыма. Загоревшийся фосфор легко
гасится водой, однако опять-таки выделяет ядовитый газ.
Смертельная доза желтого фосфора составляет всего десятую долю
грамма. Ядовитое вещество вызывает поражение костей, костного
мозга, некроз челюсти.
12.
Красный фосфор13.
черный фосфор14.
Химические свойства1. C неметаллами:
ВЗАИМОДЕЙСТВИЕ С КИСЛОРОДОМ.
белый при t = 40°С
красный при t = 260°С
черный при t = 400°С
15.
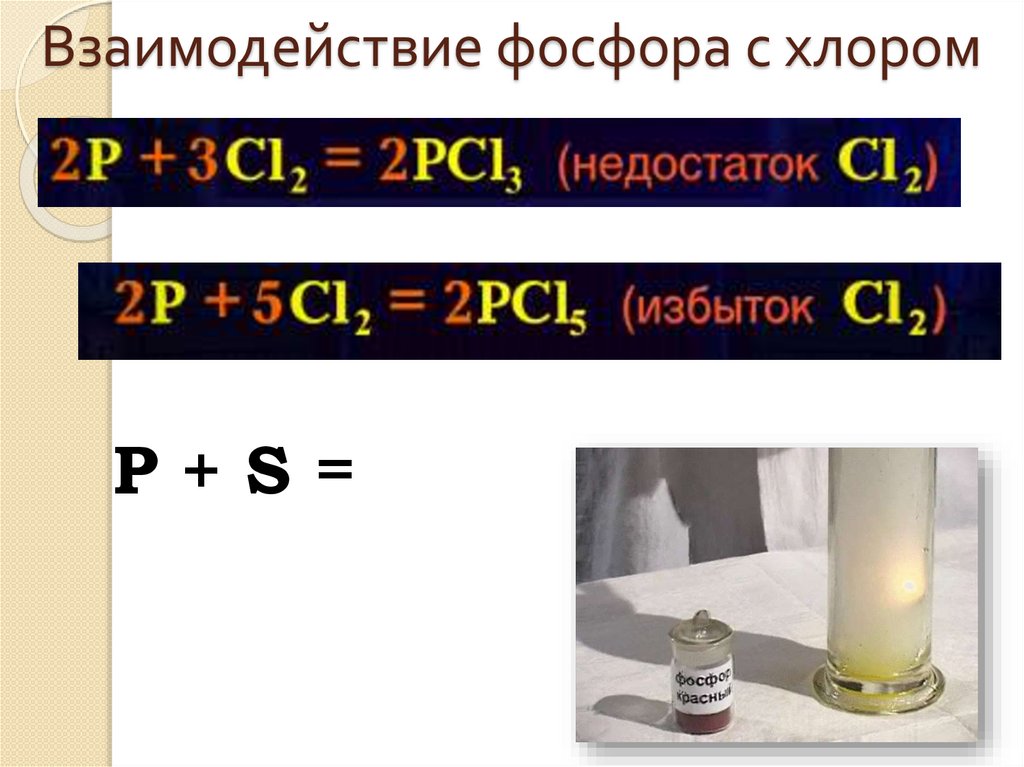
Взаимодействие фосфора с хлоромP+S=
16.
Химические свойства1. C металлами:
Фосфор как окислитель
2P+3Ca=Ca₃P₂
17.
Фосфор непосредственно сводородом не взаимодействует.
18.
19.
Блуждающие огни, также болотные огни, «бесовские огни»(лат. ignis fatum, от ignis — «огонь» и fatum — «судьба») — редкие
природные явления, наблюдаемые по ночам
на болотах, полях и кладбищах.
20.
фосфоритыапатиты
Важнейшие Природные
соединения
21.
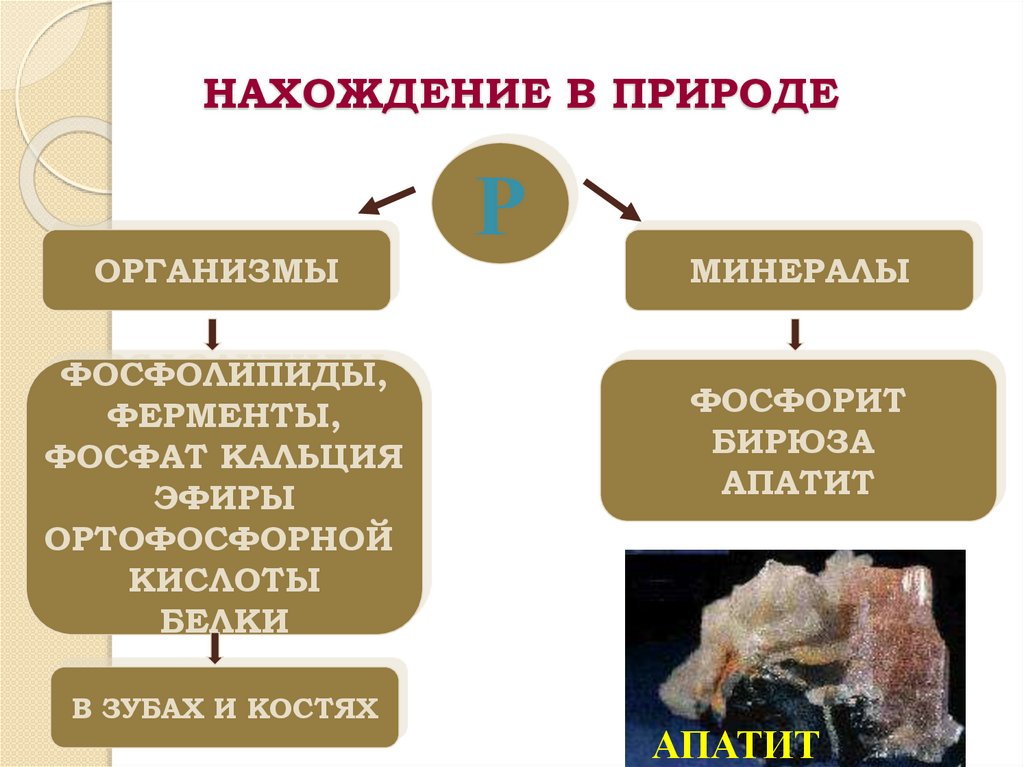
НАХОЖДЕНИЕ В ПРИРОДЕОРГАНИЗМЫ
ФОСФОЛИПИДЫ,
ФЕРМЕНТЫ,
ФОСФАТ КАЛЬЦИЯ
ЭФИРЫ
ОРТОФОСФОРНОЙ
КИСЛОТЫ
БЕЛКИ
В ЗУБАХ И КОСТЯХ
Р
МИНЕРАЛЫ
ФОСФОРИТ
БИРЮЗА
АПАТИТ
АПАТИТ
22.
Получение фосфоранагреванием смеси фосфорита, угля и
песка в электропечи:
Ca3(PO4)2 + C + SiO2 → P4 + CaSiO3 + CO
23.
Продукты питания богатыефосфором (P)Указано ориентировочное наличие в 100г продукта:
Сыр плавленый
600 мг
Камбала
400 мг
Брынза
375 мг
Сардина
280 мг
Тунец
280 мг
Скумбрия
280 мг
Осетр
270 мг
Краб
260 мг
Ставрида
250 мг
Кальмар
250 мг
Минтай
240 мг
Корюшка
240 мг
Мойва
240 мг
Креветка
225 мг
Творог
220 мг
24.
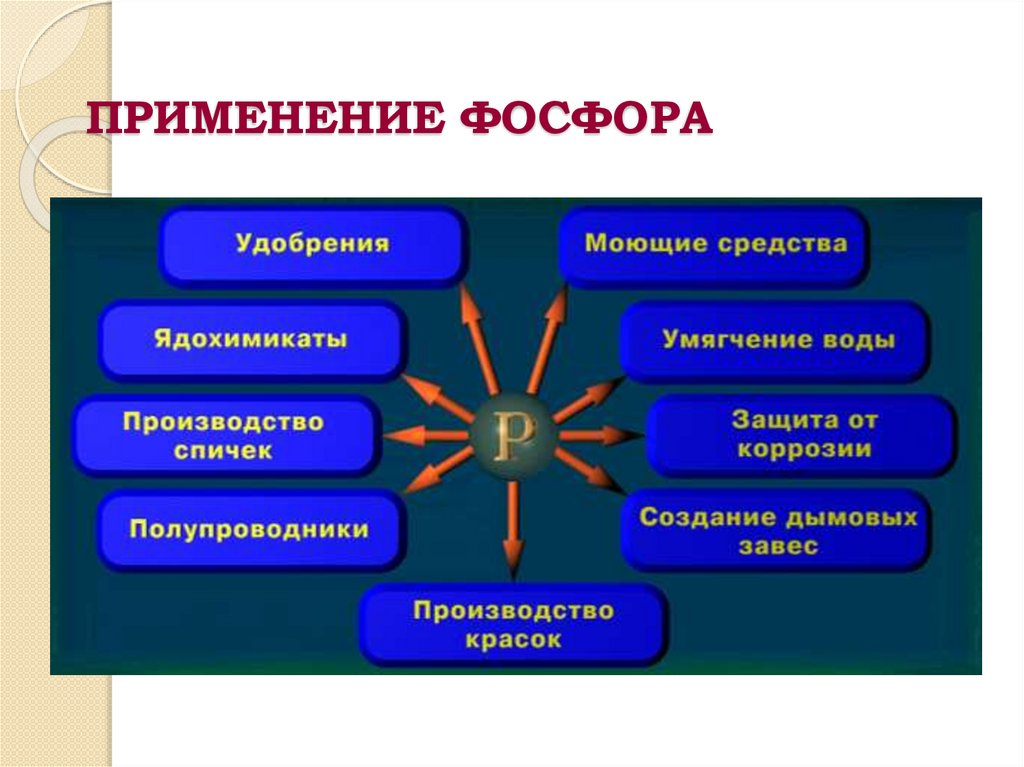
ПРИМЕНЕНИЕ ФОСФОРА25.
Кроме того красный фосфор идёт на получение ядохимикатов(дихлофос, хлорофос), дымовых снарядов. Фосфаты входят в
состав синтетических моющих средств, огнеупорных красок. Из
фосфатов получают специальные цементы, например
цинкофосфатный цемент применяют для пломбирования зубов.
26.
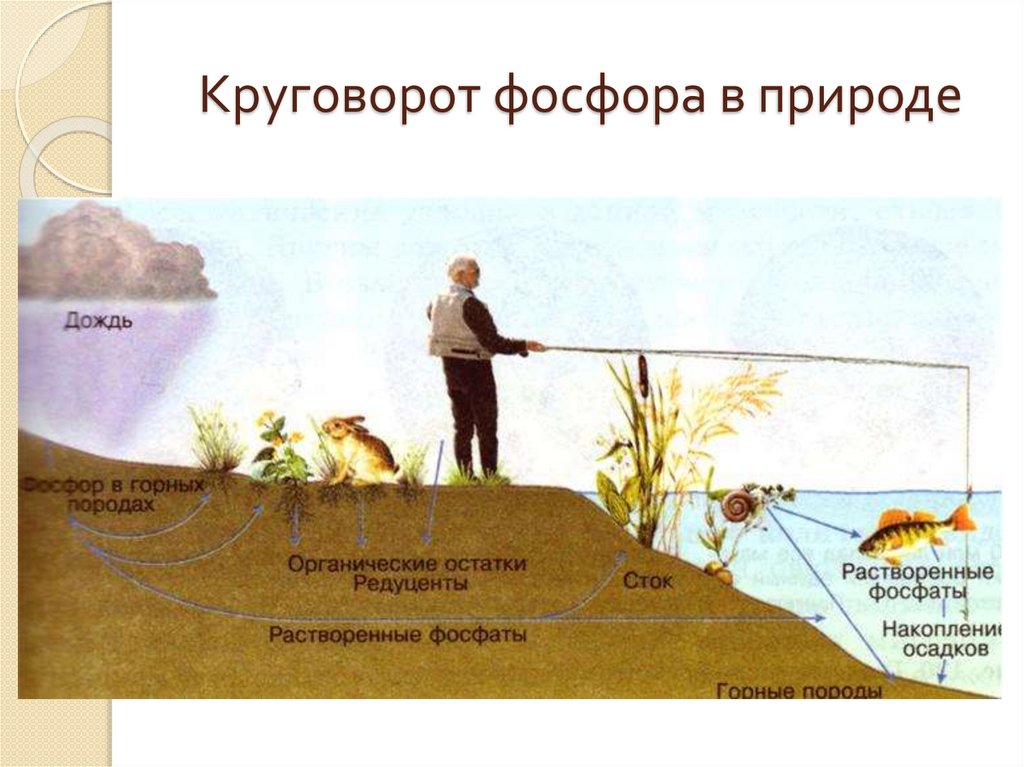
Круговорот фосфора в природе27.
Круговорот фосфораВ растениях фосфор сосредоточен главным
образом в семенах и плодах , в организме
человека и животных- в скелете, мышечной и
нервной тканях. Растения извлекают фосфор из
почвы, а животные получают его с растительной
пищей. После отмирания растений и животных
органические соединения, содержащие фосфор,
под действием фосфоробактерий превращаются
в неорганические –фосфаты. Так осуществляется
круговорот фосфора в природе. Этот круговорот
нарушается при удалении соединений фосфора с
урожаем сельскохозяйственных культур, поэтому
необходимо в почву вносить фосфорные
удобрения.
28.
Тест1.Тип кристаллической решетки у белого фосфора….
а) молекулярный б) атомный в) ионный
а) молекулярный Р4
2. У фосфора….. аллотропных модификаций
а) две
б) три
в) четыре г) пять
в) четыре – белый, черный, красный, фиолетовый
3. В атоме фосфора неспаренных электронов -…
а) три
б) четыре
в) пять
а) три
4. В реакции…. Фосфор проявляет восстановительные свойства
а)4Р+5О2=2Р2О5
б)2Р+3Mg=Mg3P2
в)2Р+3Н2=2РН3
а)4Р+5О2=2Р2О5
29.
Тест5. Причина свечения белого фосфора….
а)изменение агрегатного состояния вещества
б) химическое явление в) физическое явление
б) химическое явление
6.Как называются соединения фосфора с металлами
а) сульфаты
б)фосфаты
в) фосфиды
в) фосфиды
7.Какой тип связи в молекуле фосфина РН3
а) ковалентная неполярная б) ковалентная полярная в) ионная
а) ковалентная неполярная
8) Красный или белый фосфор ядовит?
а) красный б) белый
б) белый
9) Очень ядовит, с неприятным запахом, легко воспламеняется на воздухе,
образует болотные блуждающие огни. О каком газе идет речь?
О фосфине РН3
30.
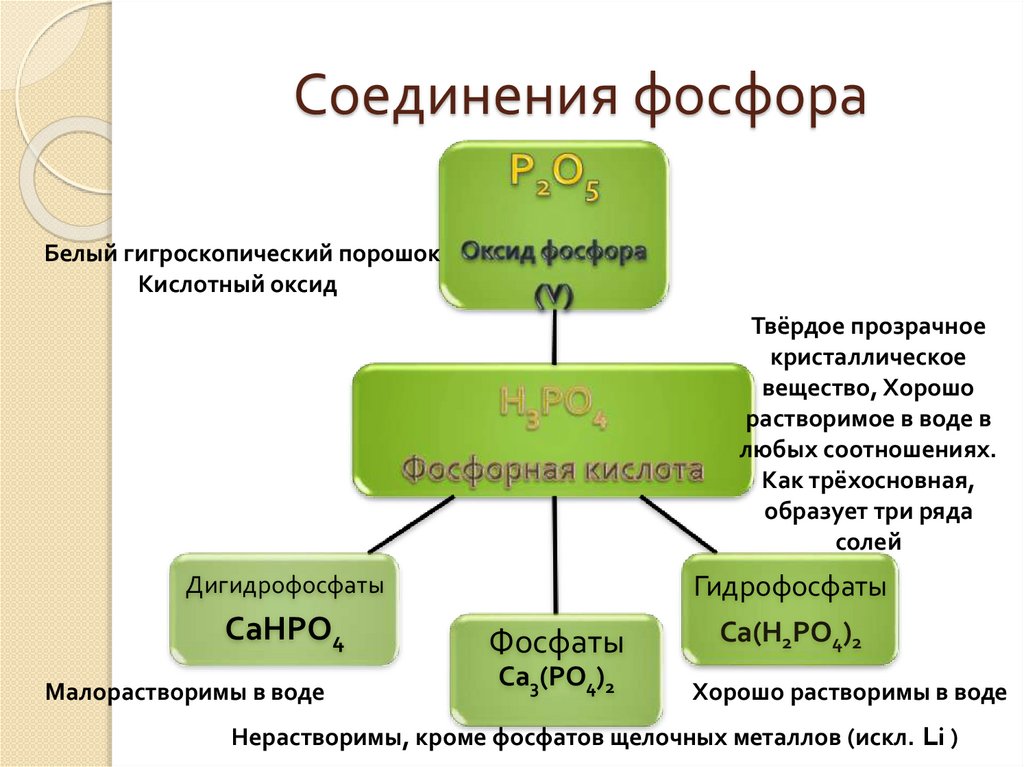
Соединения фосфораБелый гигроскопический порошок
Кислотный оксид
Твёрдое прозрачное
кристаллическое
вещество, Хорошо
растворимое в воде в
любых соотношениях.
Как трёхосновная,
образует три ряда
солей
Гидрофосфаты
Дигидрофосфаты
СаНРО4
Малорастворимы в воде
Фосфаты
Са3(РО4)2
Са(Н2РО4)2
Хорошо растворимы в воде
Нерастворимы, кроме фосфатов щелочных металлов (искл. Li )
31.
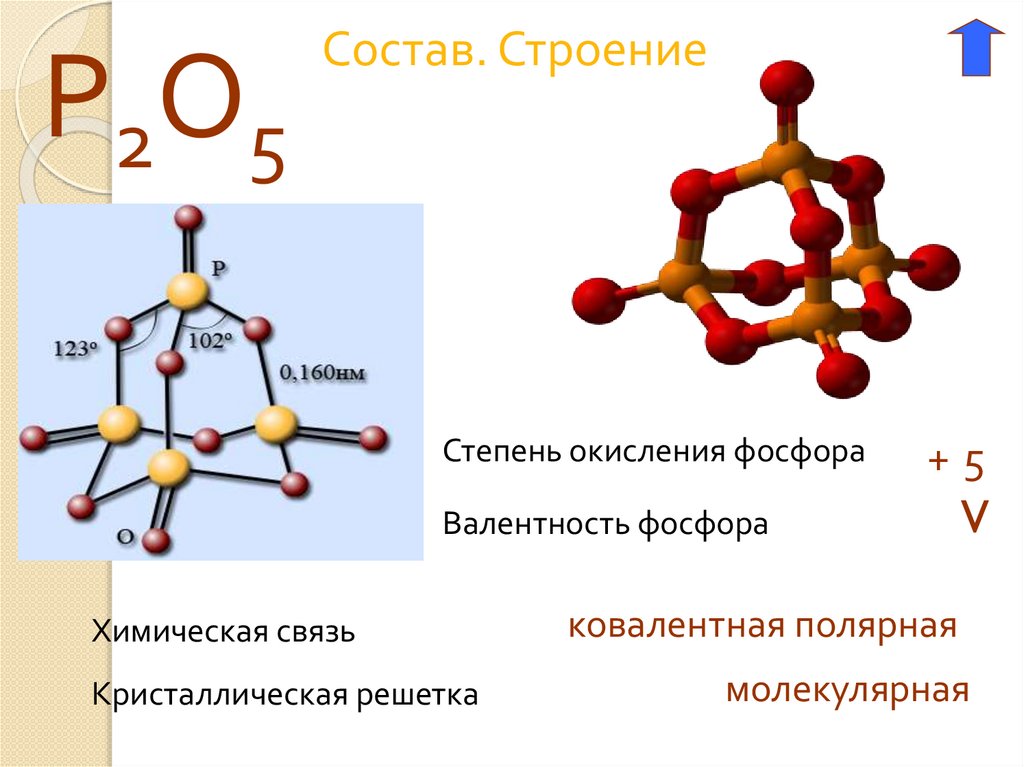
Р2О5Состав. Строение
Степень окисления фосфора
Валентность фосфора
Химическая связь
Кристаллическая решетка
+5
V
ковалентная полярная
молекулярная
32.
Оксид фосфораР2О5 (типичный кислотный
оксид - способен
взаимодействовать с водой,
оксидами металлов,
щелочами ) - это белый
гигроскопичный
(притягивающий к себе
воду в любом виде)
порошок без вкуса и запаха
с хорошей растворимостью
в воде.
33.
Оксид фосфора (V) - Р2О5Белые кристаллы, t пл.= 5700оС, t кип.= 6000оC,
ρ= 2,7 г/см3.
Получение:
4P + 5O2 = 2P2O5
Благодаря исключительной гигроскопичности
оксид
фосфора
(V)
используется
в
лабораторной и промышленной технике в
качестве осушающего и дегидратирующего
средства. По своему осушающему действию
он превосходит все остальные вещества.
34.
Кислотный оксид Р2О5Химические свойства
1) с водой
Р2О5 + 3 Н2О = 2Н3РО4
(ортофосфорная кислота)
Р2О5 + Н2О = 2НРО3
(метафосфорная кислота)
Р2О5 + 2 Н2О = Н4Р2О7
(пирофосфорная кислота)
35.
Кислотный оксид Р2О5Химические свойства
2) с основными оксидами
Р2О5 + 3 СаО = Са3 (РО4)3
3) со щелочами
Р2О5 + 6 Nа ОН = 2 Nа3РО4 + 3 Н2О
36.
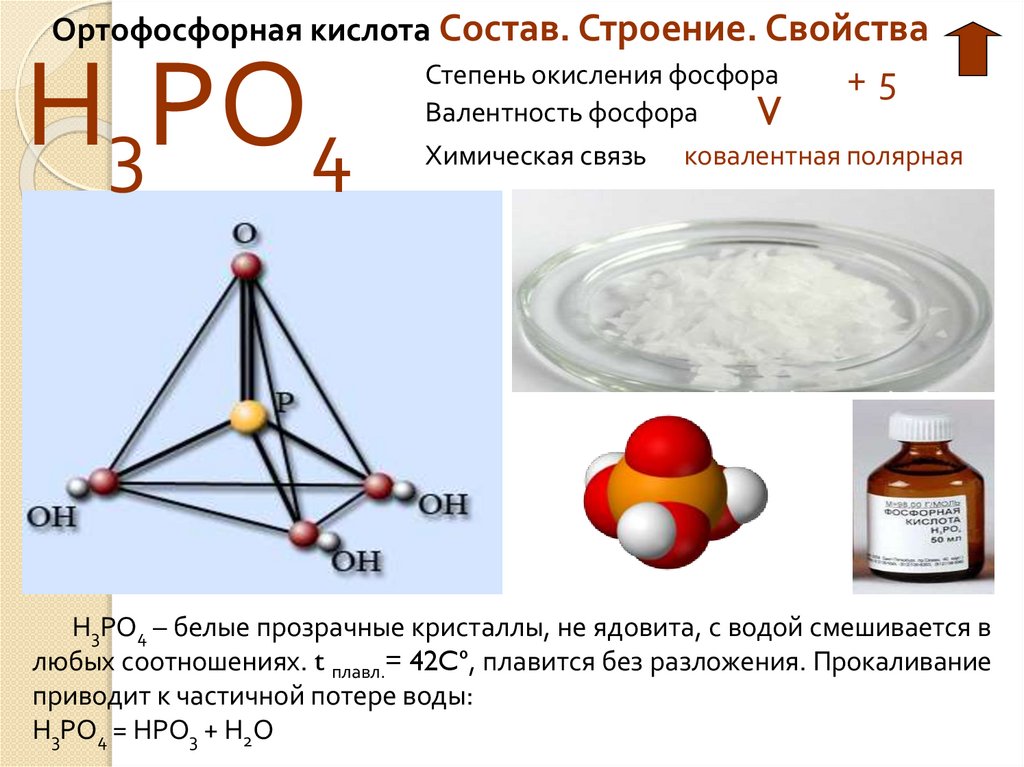
Ортофосфорная кислота Состав. Строение. СвойстваН3РО4
Степень окисления фосфора
Валентность фосфора
V
Химическая связь
+5
ковалентная полярная
Н3РО4 – белые прозрачные кристаллы, не ядовита, с водой смешивается в
любых соотношениях. t плавл.= 42Cº, плавится без разложения. Прокаливание
приводит к частичной потере воды:
Н3РО4 = НРО3 + Н2О
37.
Фосфорная кислота (H3РO4). КлассификацияФосфорная кислота по:
наличию кислорода:
кислородсодержащая
основности:
трехосновная
растворимости в воде:
растворимая
летучести:
степени электролитической диссоциации:
стабильности:
нелетучая
средней силы
стабильная
38.
Ортофосфорная кислота Н3РО4Химические свойства
Н3РО4 проявляет все свойства кислот
Реагирует:
1) со щелочами: NaOH, КОН
2) с основными оксидами: Li2O, Na2O
3) c солями: К2СО3
4) со щелочными металлами реагирует
!
(см.Таблицу растворимости)
39.
Ортофосфорная кислота Н3РО4Химические свойства
Некоторые реакции с металлами
протекают в очень разбавленных
растворах:
2 Н3РО4 (разб) + 3 Мg = Мg3(РО4 )2↓ +
3Н2↑
40.
Химические свойства ортофосфорной кислотыобщие с другими кислотами
специфические
1. Водный раствор кислоты изменяет окраску
индикаторов. Диссоциация происходит
ступенчато:
Н3РО4———>Н++Н2РО4Н2РО-4———> Н++НРО42НРО42- ———> Н++РО43Легче всего идет диссоциация по первой ступени
и труднее всего — по третьей
2. Реагирует с металлами, расположенными в
вытеснительном ряду до водорода:
6Nа+2Н3РО4 ———>2Nа3РО4+ЗН2
3. Реагирует с основными оксидами:
ЗСаО+2Н3РО4 ———>Са3(РО4)2+ЗН2О
4. Реагирует с основаниями и аммиаком; если
кислота взята в избытке, то образуются кислые
соли:
Н3РО4+3NaОН ———>Nа3РО4+ЗН2О
Н3РО4+2NН3———>(NН4)2НРО4
Н3РО4+NаОН ———>NаН2РО4+Н2О
5. Реагирует с солями слабых кислот:
2Н3РО4+ЗNа2СО3 ——>2Nа3РО4+ЗСО2+ЗН2О
1.При нагревании постепенно превращается в
метафосфорную кислоту:
2Н3Р04 ———>Н4Р207+Н20 (двуфосфорная
кислота)
Н4Р2О7 ———>2НРО3+Н2О
2. При действии раствора нитрата серебра (I)
появляется желтый осадок:
Н3РО4+ЗАgNО3———> Ag3P04+3HN03
желтый осадок
3. Ортофосфорная кислота играет большую роль
в жизнедеятельности животных и растений. Ее
остатки входят в состав
аденозинтрифосфорной кислоты АТФ.
При разложении АТФ выделяется большое количество энергии.
С АТФ вы подробнее ознакомитесь в курсе общей
биологии и органической химии
41.
Качественная реакцияна фосфат-ион РО43 РО43-
+ 3 Ag+ = Ag3РО4 ↓ (желтый
фосфат серебра)
Полученный осадок растворяется в
сильных кислотах.
По этому признаку его можно
отличить от других нерастворимых
солей серебра желтого цвета – AgI,
AgBr
AgCl – белого цвета
42.
Ортофосфорная кислота.Получение ортофосфорной кислоты
В лаборатории
P + 5HNO3(к) → 5NO2↑ +
+ H3PO4 + H2O
3P + 5HNO3(разб) + 2H2O
→ 5NO↑ + 3H3PO4
В промышленности
Экстракционный
метод
Термический
метод
обработка измельченных
природных фосфатов
серной кислотой:
2P + 5H2SO4 = 2H3PO4 +
5SO2 + 2H2O
Термический метод
состоит в
восстановлении
природных фосфатов
до Р4О10 и
растворением
последнего в воде.
43.
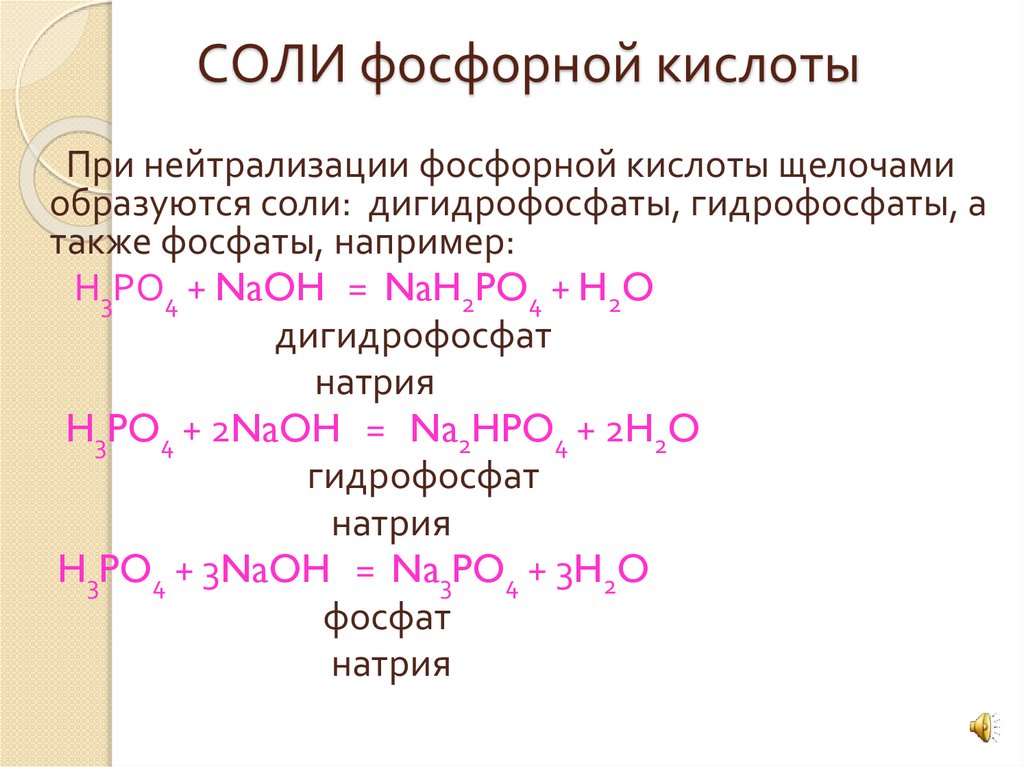
СОЛИ фосфорной кислотыПри нейтрализации фосфорной кислоты щелочами
образуются соли: дигидрофосфаты, гидрофосфаты, а
также фосфаты, например:
Н3РО4 + NaOH = NaH2PO4 + H2O
дигидрофосфат
натрия
H3PO4 + 2NaOH = Na2HPO4 + 2H2O
гидрофосфат
натрия
H3PO4 + 3NaOH = Na3PO4 + 3H2O
фосфат
натрия
44.
ДОМАШНЕЕ ЗАДАНИЕ:§21., ЗАПИСИ В ТЕТРАДИ


































 chemistry
chemistry








