Similar presentations:
оксид_фосфора_5_ортофосфорная_кислота
1.
Оксид фосфора (V)Фосфорная кислота
2. Оксид фосфора (V) - Р2О5
Фосфор образует несколько оксидов.Важнейшим из них является оксид фосфора (V) P4O10.
Часто его формулу пишут в упрощенном виде – P2O5.
Физические свойства: Оксид фосфора (V) Р2О5 —
белый гигроскопичный порошок (поглощает воду),
следует хранить в плотно закрытых сосудах.
Получение: Получается при горении фосфора в избытке
воздуха или кислорода
4P + 5O2 = 2P2O5
Применение: Оксид фосфора (V) очень энергично
соединяется с водой, а также отнимает воду от других
соединений. Применяется как осушитель газов и
жидкостей.
3. Химические свойства:
Оксид фосфора (V) – это кислотный оксид, взаимодействует, подобнодругим кислотным оксидам с водой, основными оксидами и
основаниями.
Фосфорный ангидрид особым образом взаимодействует с водой,
взаимодействуя с водой при обычных условиях (без нагревания),
образует в первую очередь метафосфорную кислоту НРО3:
P2O5 + H2O = HPO3
при нагревании образуется ортофосфорная кислота H3PO4:
t˚C
P2O5 + 3H2O = 2H3PO4
При нагревании H3PO4 можно получить пирофосфорную кислоту H4P2O7:
t˚C
2H3PO4 = H2O + H4P2O7
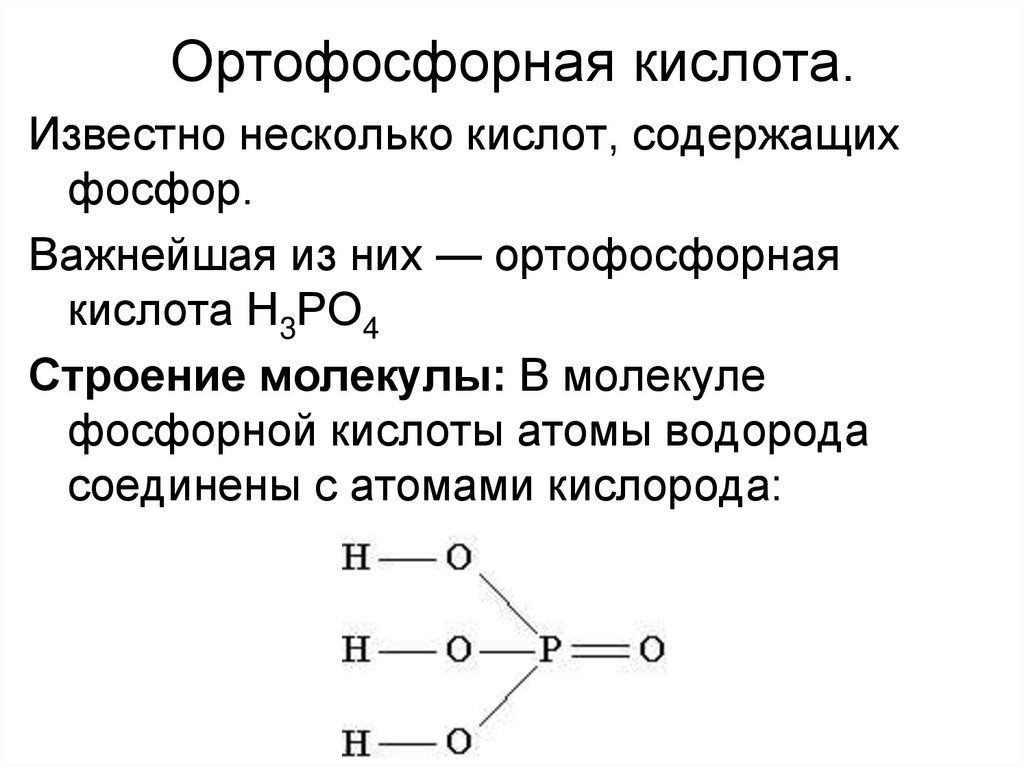
4. Ортофосфорная кислота.
Известно несколько кислот, содержащихфосфор.
Важнейшая из них — ортофосфорная
кислота Н3РО4
Строение молекулы: В молекуле
фосфорной кислоты атомы водорода
соединены с атомами кислорода:
5.
Физические свойства: Фосфорная кислота представляетсобой бесцветное, гигроскопичное твердое вещество,
хорошо растворимое в воде.
Получение:
1) Взаимодействие оксида фосфора (V) с водой при
нагревании:
t˚C
P2O5 + 3H2O = 2H3PO4
2) Взаимодействие природной соли – ортофосфата кальция
с серной кислотой при нагревании:
t˚C
Сa3(PO4)2 + 3H2SO4 = 3CaSO4 + 2H3PO4
3) При взаимодействии фосфора с концентрированной
азотной кислотой
3P + 5HNO3+ 2H2O = 3H3PO4+ 5NO
6.
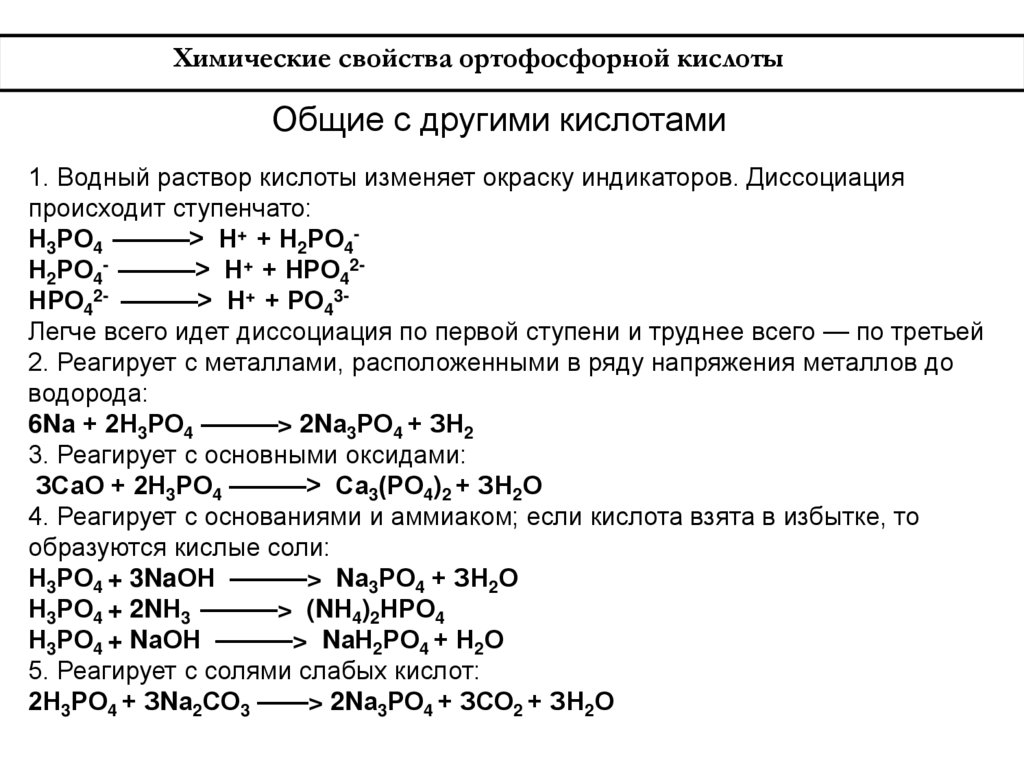
Химические свойства ортофосфорной кислотыОбщие с другими кислотами
1. Водный раствор кислоты изменяет окраску индикаторов. Диссоциация
происходит ступенчато:
Н3РО4 ———> Н+ + Н2РО4Н2РО4- ———> Н+ + НРО42НРО42- ———> Н+ + РО43Легче всего идет диссоциация по первой ступени и труднее всего — по третьей
2. Реагирует с металлами, расположенными в ряду напряжения металлов до
водорода:
6Nа + 2Н3РО4 ———> 2Nа3РО4 + ЗН2
3. Реагирует с основными оксидами:
ЗСаО + 2Н3РО4 ———> Са3(РО4)2 + ЗН2О
4. Реагирует с основаниями и аммиаком; если кислота взята в избытке, то
образуются кислые соли:
Н3РО4 + 3NaОН ———> Nа3РО4 + ЗН2О
Н3РО4 + 2NН3 ———> (NН4)2НРО4
Н3РО4 + NаОН ———> NаН2РО4 + Н2О
5. Реагирует с солями слабых кислот:
2Н3РО4 + ЗNа2СО3 ——> 2Nа3РО4 + ЗСО2 + ЗН2О
7. Специфические свойства
1.При нагревании постепенно превращается в метафосфорнуюкислоту:
2Н3Р04 ———>Н4Р207+Н20 (двуфосфорная кислота)
Н4Р2О7 ———>2НРО3+Н2О
2. При действии раствора нитрата серебра (I) появляется желтый
осадок:
Н3РО4+ЗАgNО3———> Ag3P04+3HN03
желтый осадок
3. Ортофосфорная кислота играет большую роль в
жизнедеятельности животных и растений. Ее остатки входят в
состав аденозинтрифосфорной кислоты АТФ.
При разложении АТФ выделяется большое количество энергии.
С АТФ вы подробнее ознакомитесь в курсе общей биологии и
органической химии
8.
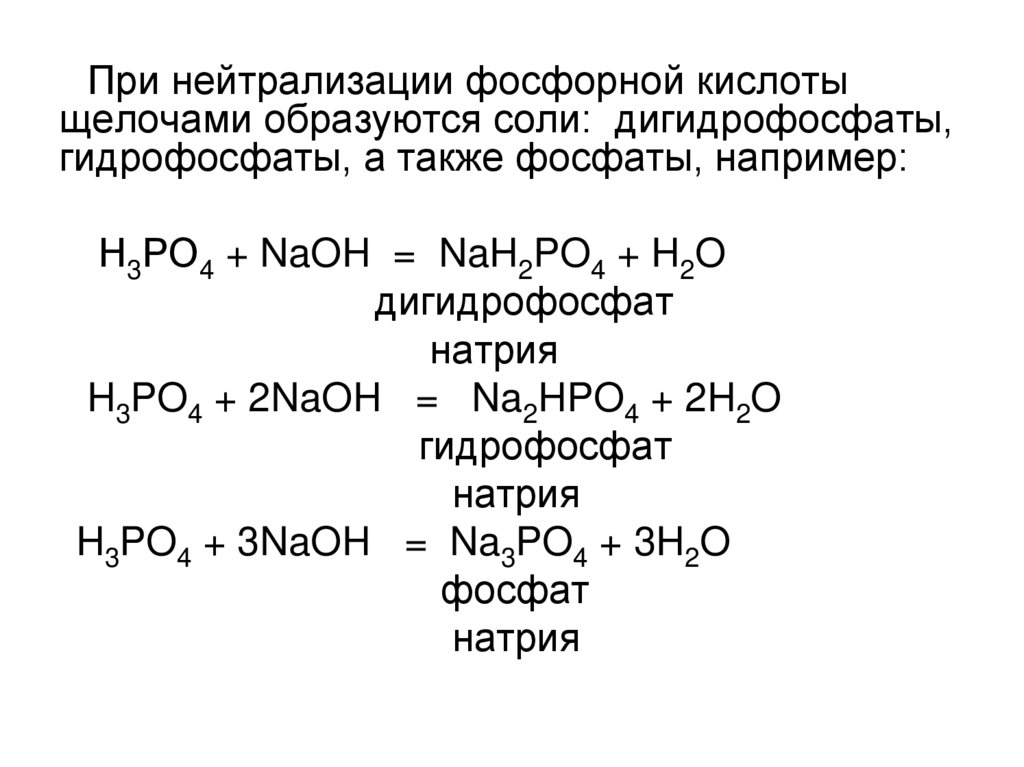
При нейтрализации фосфорной кислотыщелочами образуются соли: дигидрофосфаты,
гидрофосфаты, а также фосфаты, например:
Н3РО4 + NaOH = NaH2PO4 + H2O
дигидрофосфат
натрия
H3PO4 + 2NaOH = Na2HPO4 + 2H2O
гидрофосфат
натрия
H3PO4 + 3NaOH = Na3PO4 + 3H2O
фосфат
натрия
9. Выполнить задание по теме:
1. Напишите уравнения реакций между ортофосфорной кислотойи следующими веществами:
а) оксидом магния; б) карбонатом калия; в) нитратом серебра;
г) сульфатом железа (II).
2. Составьте уравнения реакций между ортофосфорной
кислотой и гидроксидом калия, в результате которых
образуются
3 типа солей: средняя и две кислых.
3. Напишите уравнения реакций, с помощью которых можно
осуществить следующие превращения:
а) Р → Р205 → Н3Р04 → Nа3Р04 → Са3(Р04)2
б) Р → Са3Р2 → РН3 → Р2О5 → К3Р04 → Са3(Р04)2→ Са(Н2Р04)2
4. Методом электронного баланса подберите коэффициенты в
схемах следующих окислительно-восстановительных
реакций:
а) РНз + О2 → Р2О5 + Н2О
б) Са3(РО4)2 + С + SiO2 → СаSiO3 + Р + СО






 chemistry
chemistry








