Similar presentations:
Лекция 1 КХ_26cef4c64c3d01312a2e7abcad644bb9
1.
Общая характеристика коллоидных(дисперсных систем).
2. Коллоидная химия ‒ …
… наука о поверхностных явленияхи дисперсных системах.
… наука о коллоидном состоянии
вещества.
… физика и химия реальных тел.
2
3.
4.
Термин«коллоид»
(от
греч.
kolla+eidos («клей» + «вид») слово,
означающее «имеющие вид клея».)
ввел английский ученый Т.Грэм в
1861 г, которого принято считать
основоположником
коллоидной
химии. Грэм считал, что все
вещества
в
природе
следует
разделить
на
две
группы
кристаллоиды,
образующие
обычные растворы и коллоиды,
дающие коллоидные растворы, по
многим свойствам отличающиеся от
обычных
растворов.
Грэм
предпринял
систематические
исследования
коллоидных
растворов.
5.
Впоследствии было выяснено, что Грэмошибался, следовало бы говорить не об
особых веществах коллоидах, а об особом
гетерогенно-дисперсном состоянии
вещества.
6.
Коллоидная химия- наука о дисперсных системах иповерхностных явлениях, взаимосвязи физико-химических и
механических свойств дисперсных систем.
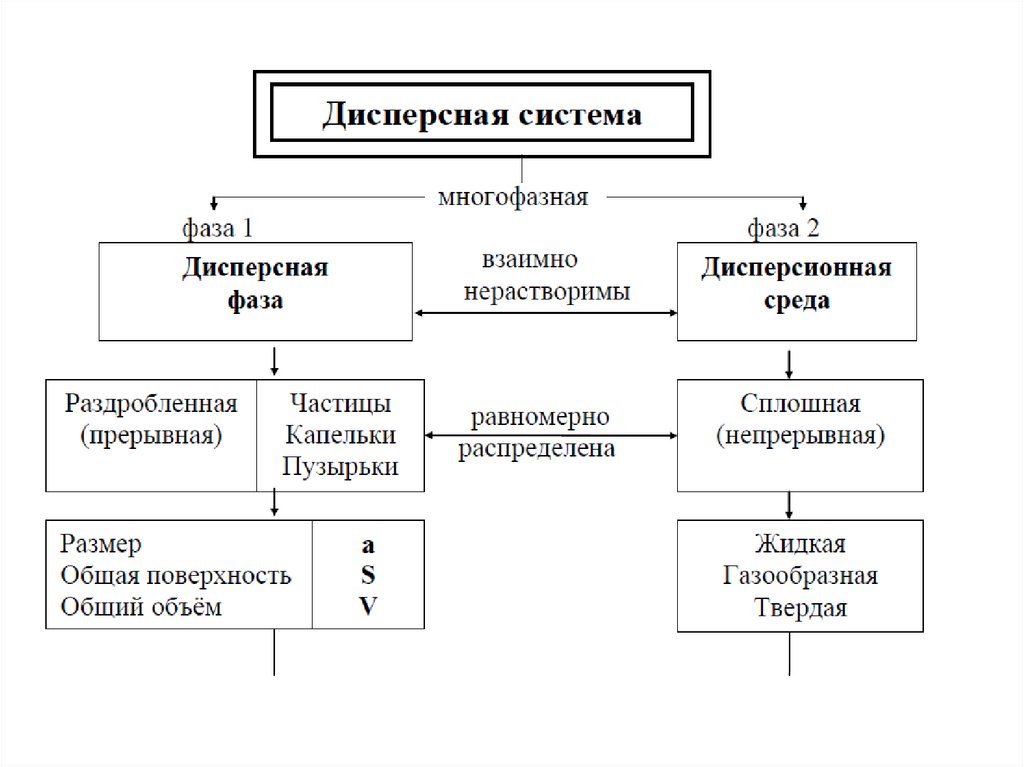
Дисперсные системы – гетерогенные системы, которые состоят, по
крайней мере, их двух фаз, и одна из них прерывная – дисперсная
фаза, а вторая непрерывная – дисперсионная среда.
Фаза – (термодинамическая) – гомогенная часть гетерогенной
системы с постоянными или непрерывно меняющимися от точки к
точке интенсивными переменными.
Коллоидные
растворы золота
полученные
Майклом
Фарадеем
7.
8.
9.
10. Основные понятия:
1. Дисперсность ‒ мерой её служит удельнаяповерхность (Sуд). Sуд ‒ площадь раздела фаз,
приходящаяся на единицу массы или объёма
дисперсной фазы.
Sуд = 6 · а-1
2. Гетерогенность ‒ мерой её служит
поверхностное натяжение (σ ‒ величина энергии
единицы поверхности).
10
11.
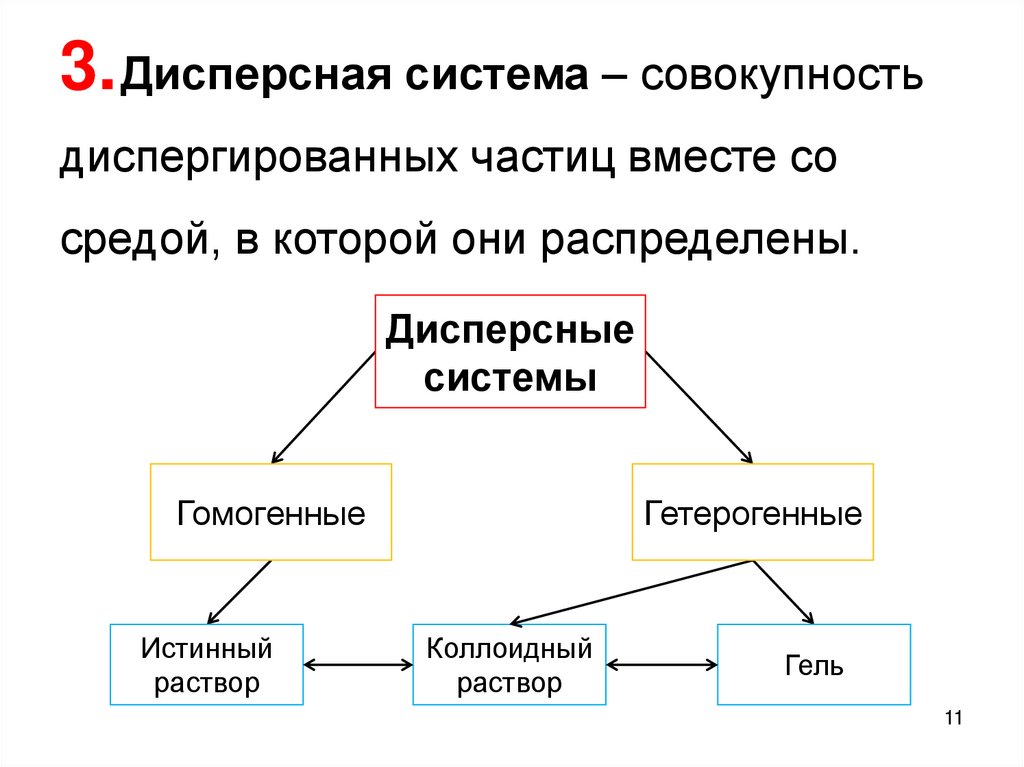
3. Дисперсная система ‒ совокупностьдиспергированных частиц вместе со
средой, в которой они распределены.
Дисперсные
системы
Гомогенные
Истинный
раствор
Гетерогенные
Коллоидный
раствор
Гель
11
12.
4. Дисперсная фаза (ДФ) ‒ совокупностьдиспергированных частиц, размеры которых
больше молекулярных.
5. Дисперсионная среда (ДС) ‒
однородная непрерывная фаза, в которой
возможен переход из одной точки в другую
без выхода за пределы этой фазы.
Дисперсность и гетерогенность
связаны друг с другом GS = σ · S. Для объекта
коллоидной химии, дисперсной системы, GS
велика, что делает его термодинамически
неустойчивым.
12
13.
14.
Признаки объектов коллоидной химии1. Гетерогенность (многофазность).
2. Дисперсность (раздробленность).
14
15.
16.
17.
Меры дисперсностиПоперечный размер частицы (а) – диаметр для
сферических частиц (d) и длина ребра для кубических частиц (l).
Дисперсность (D) – величина, обратная поперечному
размеру частицы: D=1/a.
Удельная поверхность (Sуд) – межфазная поверхность,
приходящаяся на единицу объема или массы дисперсной
фазы:
S д .ф
S д .ф
S уд
S уд
m д .ф
Vд .ф
Частицы сферической формы
S уд 6 / d 6 D
Частицы цилиндрической формы
S уд 4 / d 4 D
Частицы кубической формы
S уд 6 / l 6 D
17
18.
Характерным признаком высокодисперсных системявляется очень большая поверхность раздела на
границе между дисперсной фазой и дисперсионной
средой. Её характеризуют удельной поверхностью,
под которой понимают отношение общей площади
поверхности дисперсной фазы Sд.ф. к её общему
объёму или к её массе
S уд ,V
S д .ф .
Vд . ф .
S уд.,m
S д .ф .
m д .ф .
19.
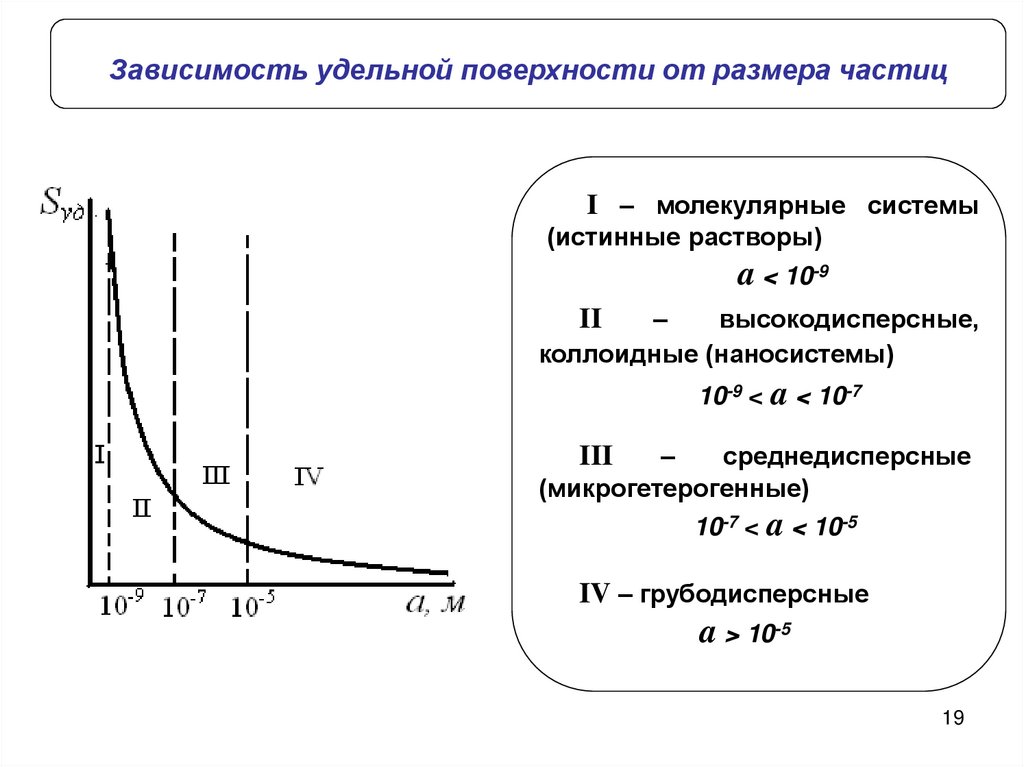
Зависимость удельной поверхности от размера частицI – молекулярные системы
(истинные растворы)
a < 10-9
–
высокодисперсные,
коллоидные (наносистемы)
II
10-9 < a < 10-7
–
среднедисперсные
(микрогетерогенные)
III
10-7 < a < 10-5
IV – грубодисперсные
a > 10-5
19
20.
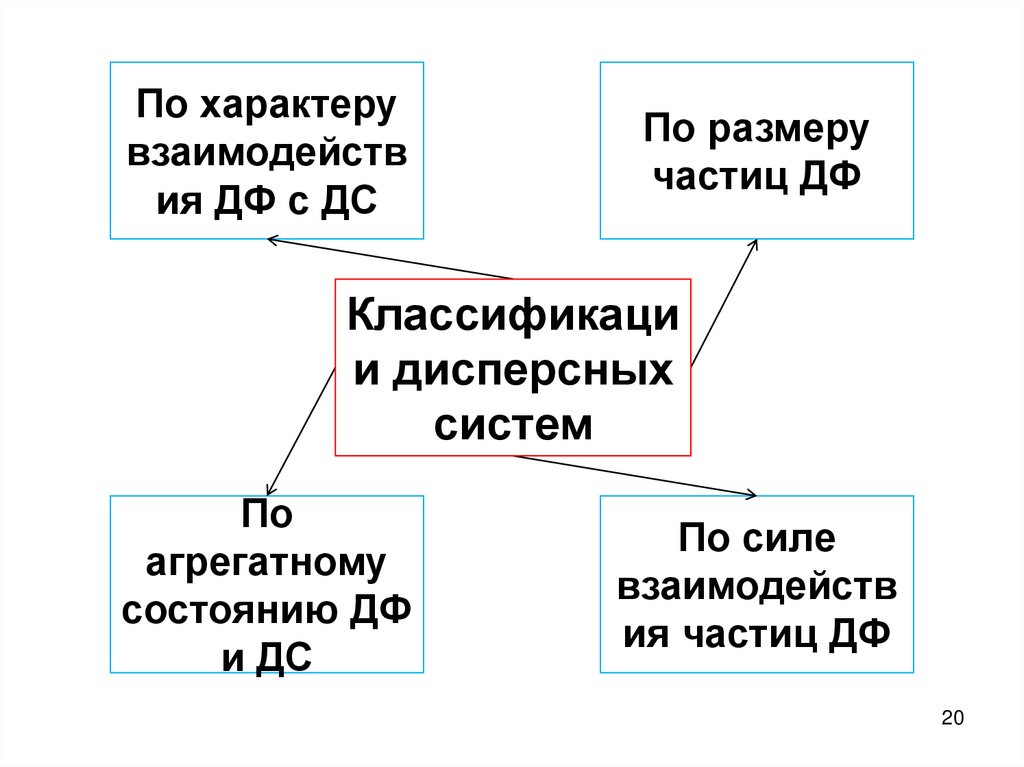
По характерувзаимодейств
ия ДФ с ДС
По размеру
частиц ДФ
Классификаци
и дисперсных
систем
По
агрегатному
состоянию ДФ
и ДС
По силе
взаимодейств
ия частиц ДФ
20
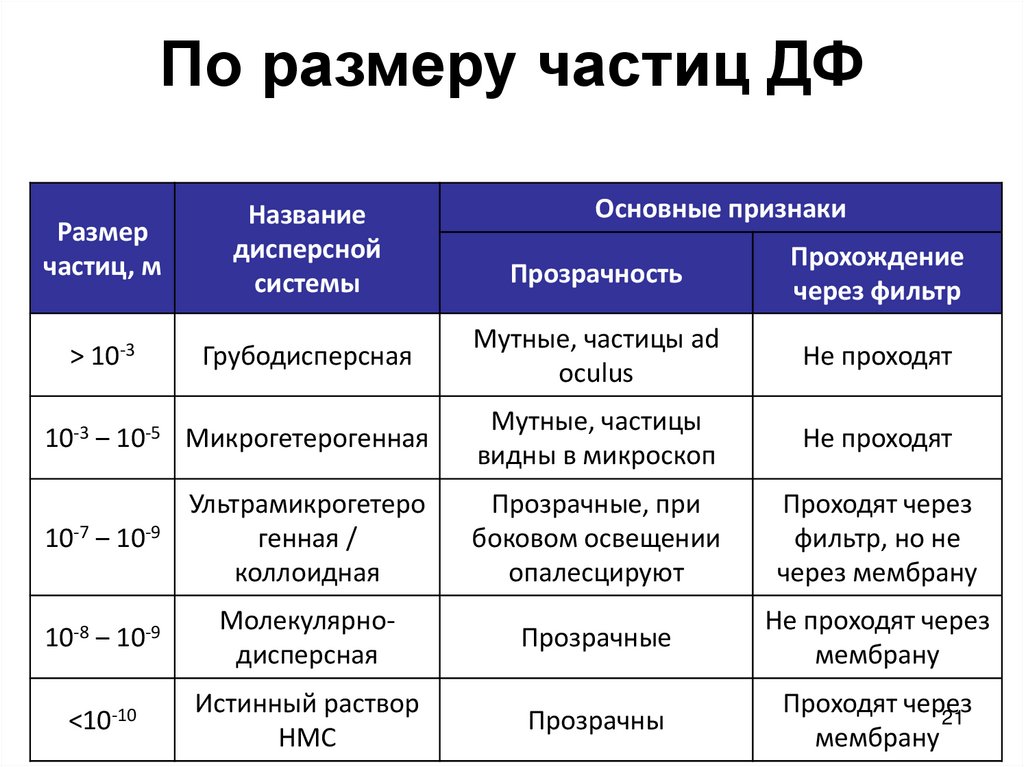
21. По размеру частиц ДФ
Размерчастиц, м
Название
дисперсной
системы
> 10-3
Основные признаки
Прозрачность
Прохождение
через фильтр
Грубодисперсная
Мутные, частицы ad
oculus
Не проходят
10-3 ‒ 10-5 Микрогетерогенная
Мутные, частицы
видны в микроскоп
Не проходят
10-7 ‒ 10-9
Ультрамикрогетеро
генная /
коллоидная
Прозрачные, при
боковом освещении
опалесцируют
Проходят через
фильтр, но не
через мембрану
10-8 ‒ 10-9
Молекулярнодисперсная
Прозрачные
Не проходят через
мембрану
<10-10
Истинный раствор
НМС
Прозрачны
Проходят через
21
мембрану
22.
23. По характеру взаимодействия ДФ с ДС
Лиофобные системы(золи, суспензии,
эмульсии, пены,
аэрозоли)
Лиофильные системы
(молекулярнодисперсные системы)
Слабое взаимодействие
между ДФ и ДС.
Эндэргонический процесс.
Термодинамически
неустойчивы и необратимы.
Необходим стабилизатор
при получении.
Сильное взаимодействие
между ДФ и ДС.
Экзэргонический процесс.
Термодинамически
устойчивы и обратимы.
Образуются
самопроизвольно. 23
24. По силе взаимодействия частиц ДФ
Свободнодисперсные системы
(золи, суспензии,
эмульсии, аэрозоли,
кровь)
Связнодисперсные
системы
(гели, студни,
костная ткань,
биомембраны)
Частицы ДФ обособлены и
свободно перемещаются
друг относительно друга.
Частицы ДФ связаны друг
с другом достаточно
сильно, образуя
пространственную сетку.
ДС заполняет
внутренность этой сетки.24
25.
26.
Связнодисперсные системыклассифицируют по размера пор.
микропористые размеры пор
менее
2 нм;
переходнопористые 2 – 200 нм;
макропористые более 200 нм
27.
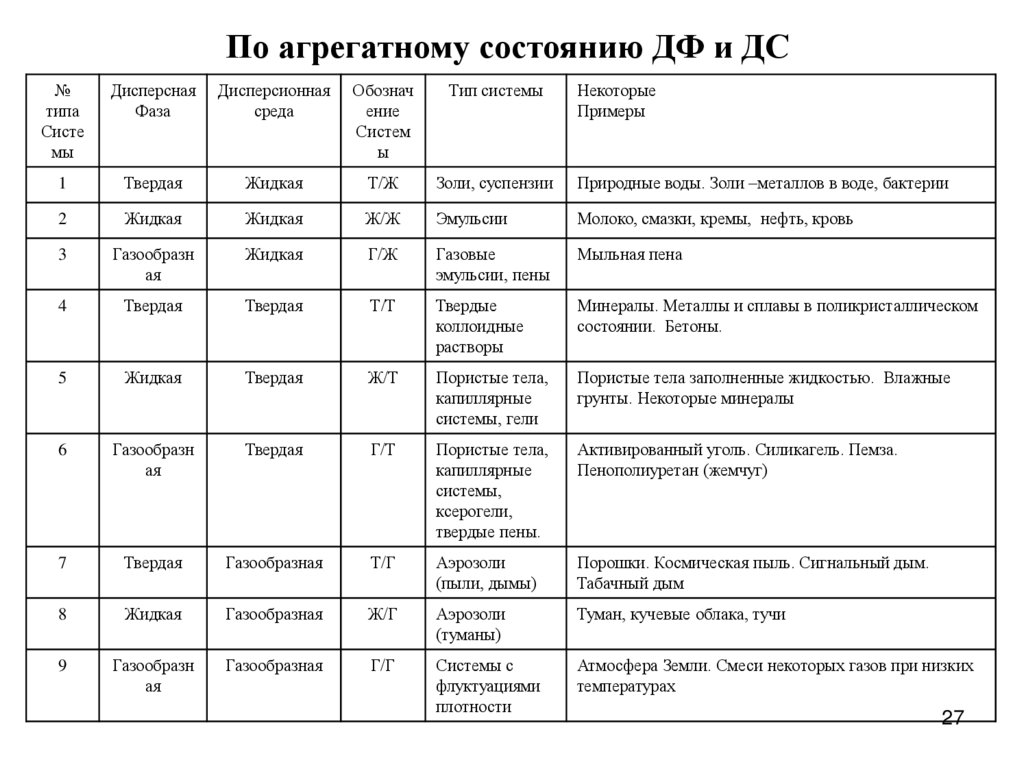
По агрегатному состоянию ДФ и ДС№
типа
Систе
мы
Дисперсная
Фаза
Дисперсионная
среда
Обознач
ение
Систем
ы
Тип системы
Некоторые
Примеры
1
Твердая
Жидкая
Т/Ж
Золи, суспензии
Природные воды. Золи –металлов в воде, бактерии
2
Жидкая
Жидкая
Ж/Ж
Эмульсии
Молоко, смазки, кремы, нефть, кровь
3
Газообразн
ая
Жидкая
Г/Ж
Газовые
эмульсии, пены
Мыльная пена
4
Твердая
Твердая
Т/Т
Твердые
коллоидные
растворы
Минералы. Металлы и сплавы в поликристаллическом
состоянии. Бетоны.
5
Жидкая
Твердая
Ж/Т
Пористые тела,
капиллярные
системы, гели
Пористые тела заполненные жидкостью. Влажные
грунты. Некоторые минералы
6
Газообразн
ая
Твердая
Г/Т
Пористые тела,
капиллярные
системы,
ксерогели,
твердые пены.
Активированный уголь. Силикагель. Пемза.
Пенополиуретан (жемчуг)
7
Твердая
Газообразная
Т/Г
Аэрозоли
(пыли, дымы)
Порошки. Космическая пыль. Сигнальный дым.
Табачный дым
8
Жидкая
Газообразная
Ж/Г
Аэрозоли
(туманы)
Туман, кучевые облака, тучи
9
Газообразн
ая
Газообразная
Г/Г
Системы с
флуктуациями
плотности
Атмосфера Земли. Смеси некоторых газов при низких
температурах
27
28.
Классификация дисперсных системПо топографическому признаку (по форме)
Дисперсная фаза
Размерность
Виды
Трехмерная
Твердые частицы,
(корпускулярные
капли, пузырьки
коллоиды)
Двухмерная
Нити, волокна,
(фибриллярные
капилляры, поры
коллоиды)
Одномерные
Пленки, мембраны
(ламинарные)
Примеры
Почва, порошки, молоко,
кремы, аэрозоли
Древесина, хлеб, пористые
вещества, цеолиты, ткани,
кожа
Жидкие пленки (нефть на
воде), мембраны,
биконтинуальные системы
Если минимальные размеры частиц каждой системы близки, то и удельная
поверхность одного порядка величины:
ламинарная 1 х 1 х 10-7
.
Sуд = 2 107м-1
фибриллярная 1 х10-7 х 10-7
Sуд = 4 107м-1
корпускулярная 10-7 х 10-7 х 10-7
Sуд = 6 107м-1
29.
Самоорганизующиеся коллоидные системы, растворы полимеров,биологические структуры, т.е. системы разного типа, для которых характерно
наличие упорядоченности, промежуточной между упорядоченностью твердых
кристаллов и обычных жидкостей, называют мягкой материей (soft matter).
Растворы поверхностно-активных веществ (ПАВ) являются одним из простейших
примеров самоорганизующихся мягких наносистем, размеры микроагрегатов –
мицелл которых составляют 1-500 нм
Поверхностно-активные вещества (ПАВ) - это амфифильные соединения,
которые адсорбируются на границе раздела фаз и уменьшают избыток
свободной энергии (поверхностное натяжение, ) на границе раздела.
Уравнение Лапласа: p = 2 /r
“Association colloids”
30.
31.
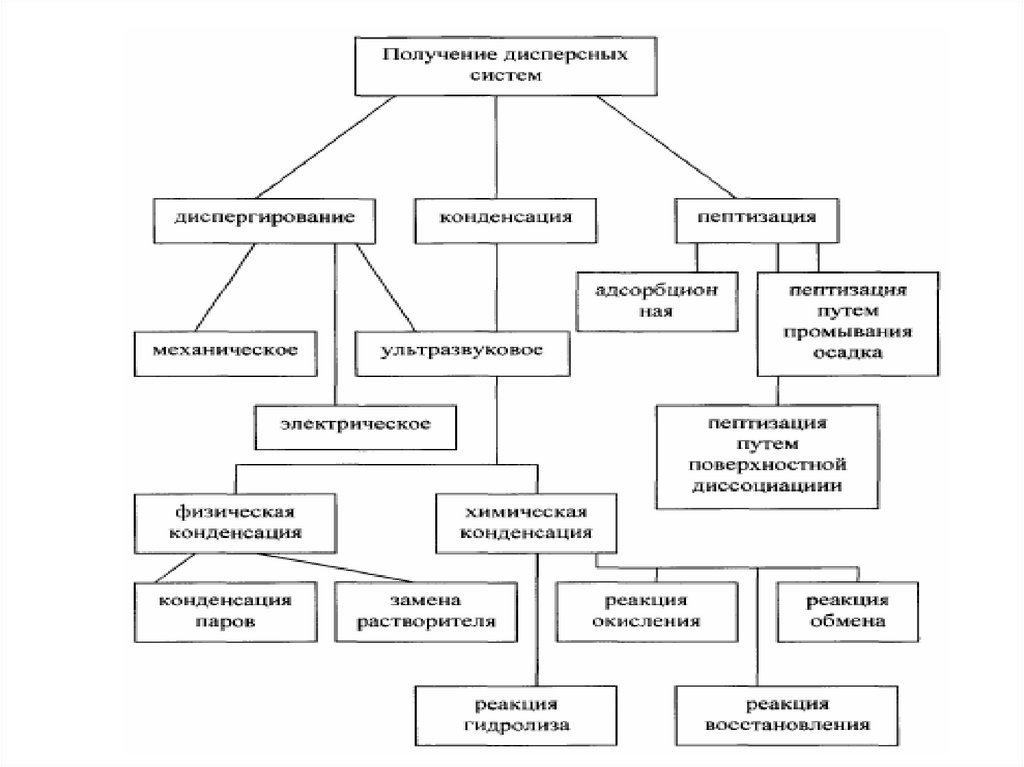
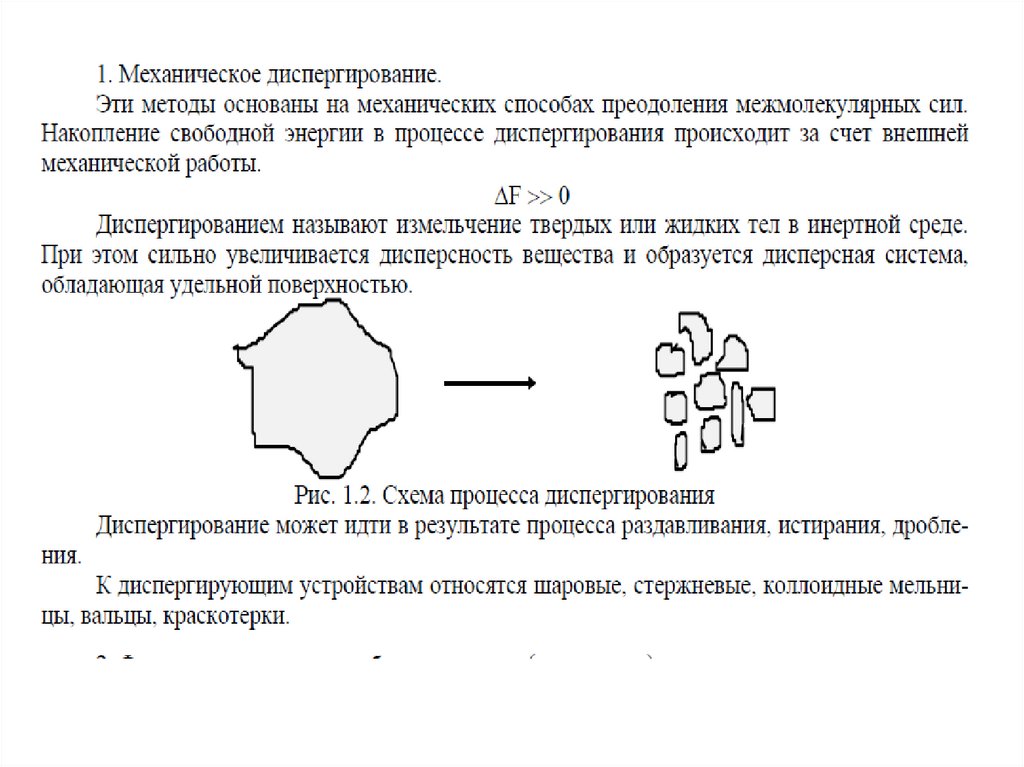
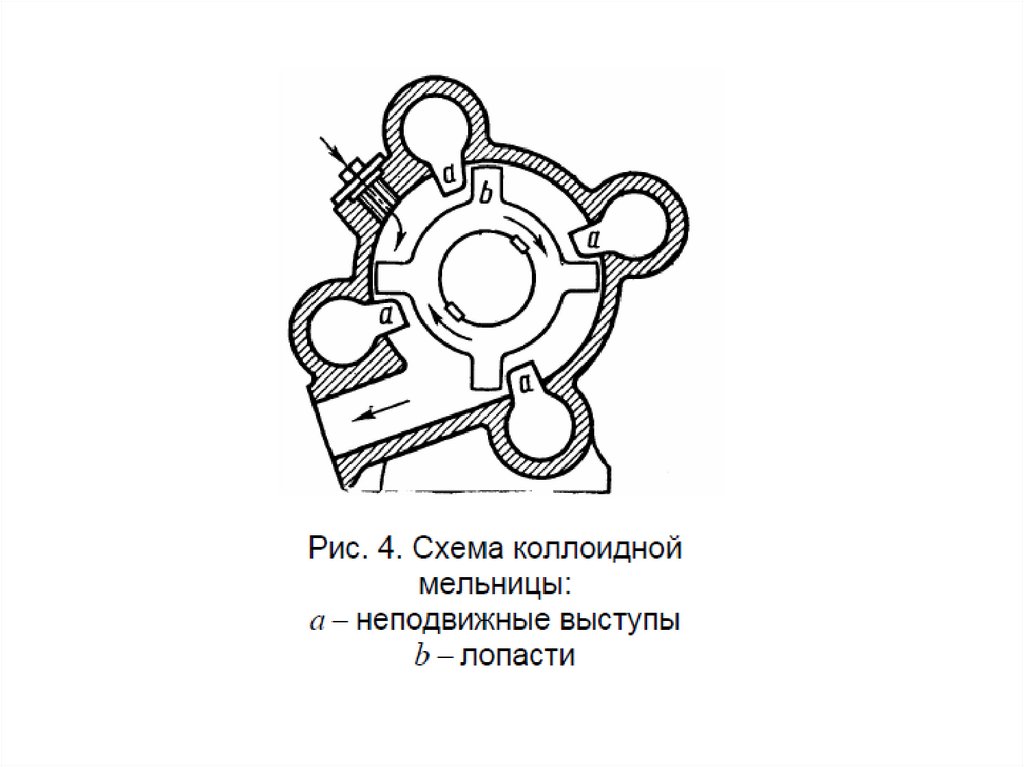
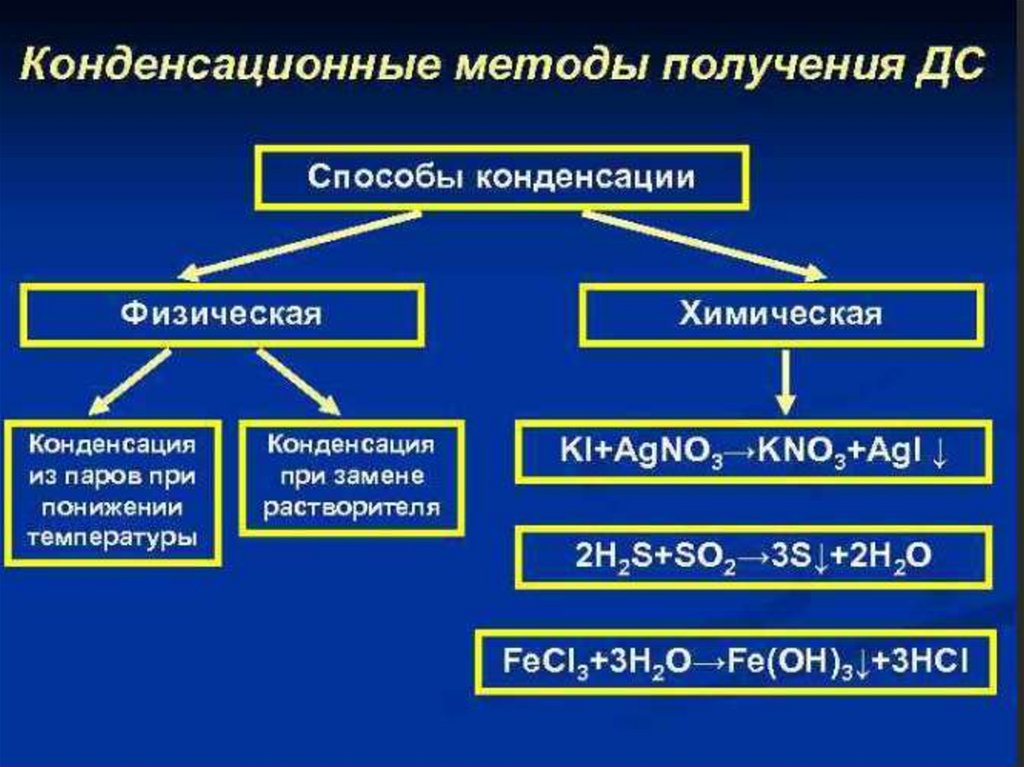
МЕТОДЫ ПОЛУЧЕНИЯ ДИСПЕРСНЫХ СИСТЕМА)
Диспергирование
измельчение, дробление, распыление;
механическое, ультразвуковое, электродуговое
В) Конденсация
агрегация, концентрирование, кристаллизация
физическая, химическая
32.
Получение дисперсных системДиспергационные методы
измельчение крупных образцов вещества до частиц
дисперсных размеров;
химический состав
вещества не меняется;
и
агрегатное
состояние
затрачивается внешняя работа;
используют для получения грубодисперсных систем
– производство цемента (1 млрд.т в год), измельчении руд
полезных ископаемых, помол муки и т.д.
32
33.
34.
35.
Конденсационные методыоснованы на ассоциации молекул в агрегаты из
истинных растворов;
используют
систем;
для
получения
высокодисперсных
не требуют затраты внешней работы;
появление новой фазы происходит при пересыщении
среды.
35
36.
37.
38.
Химические конденсационные методыМетоды основаны на образовании м.р.с. в результате
протекания химических реакций.
1. Реакции восстановления (получение золей Au, Ag, Pt).
Восстановление аурата натрия формальдегидом.
2NaAuO2 + 3HCOH + Na2CO3 = 2Au + 3HCOONa +NaHCO3 + H2O
Строение мицеллы :
m Au nAuO ( n x )Na xNa
2
x
38
39.
2. Реакции обмена.Получение золя иодида серебра.
AgNO3 + KJ(изб.) = AgJ↓ + KNO3
Строение мицеллы:
m AgJ nJ ( n x )K xK
x
39
40.
3. Реакции окисленияОбразование золя серы.
2H2Sр-р + O2 = 2S ↓+ 2H2O
Строение мицеллы:
m S nHS ( n x )H xH
x
40
41.
4. Реакции гидролизаПолучение золя гидроксида железа.
FeCl3 + 3H2O = Fe(OH)3 ↓ + 3HCl
Cтроение мицеллы:
m Fe( OH ) nFe 3( n x )Cl 3 xCl
3
3 x
3
41
42.
Метод пептизацииПептизация – метод, основанный на переводе
в коллоидный раствор осадков, первичные
размеры
которых
уже
имеют
размеры
высокодисперсных систем.
Суть метода: свежевыпавший рыхлый осадок
переводят в золь путем обработки пептизаторами
(растворами электролитов, ПАВ, растворителем).
42
43.
44.
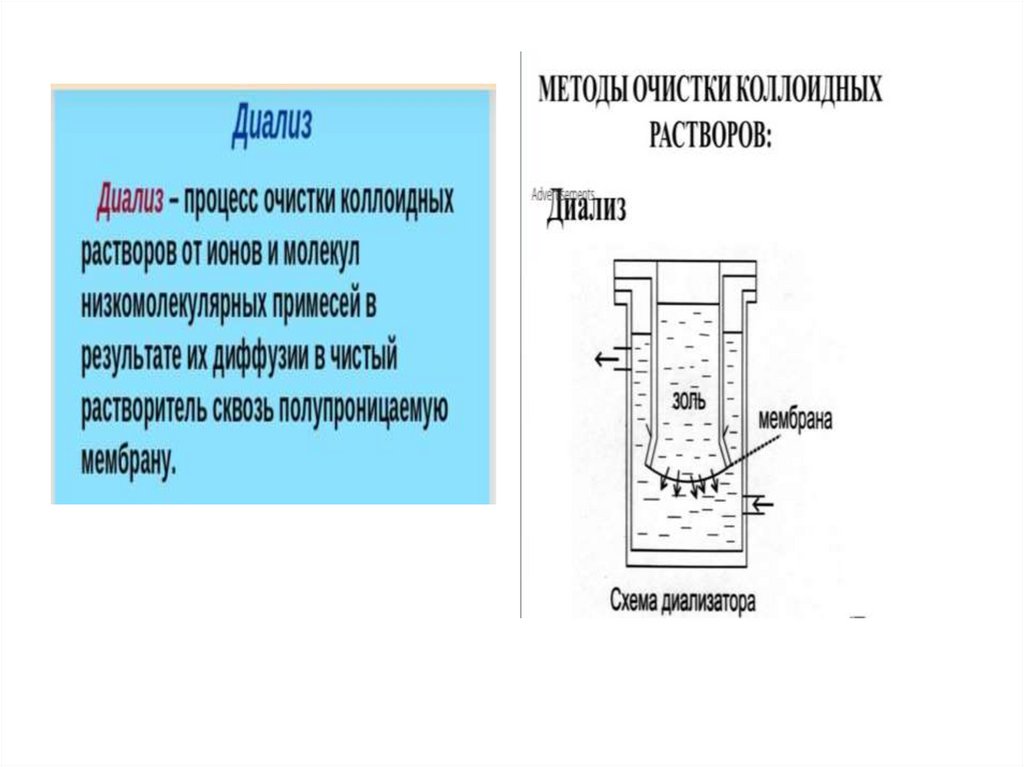
Методы очистки дисперсных системНизкомолекулярные примеси (чужеродные электролиты)
разрушают коллоидные системы.
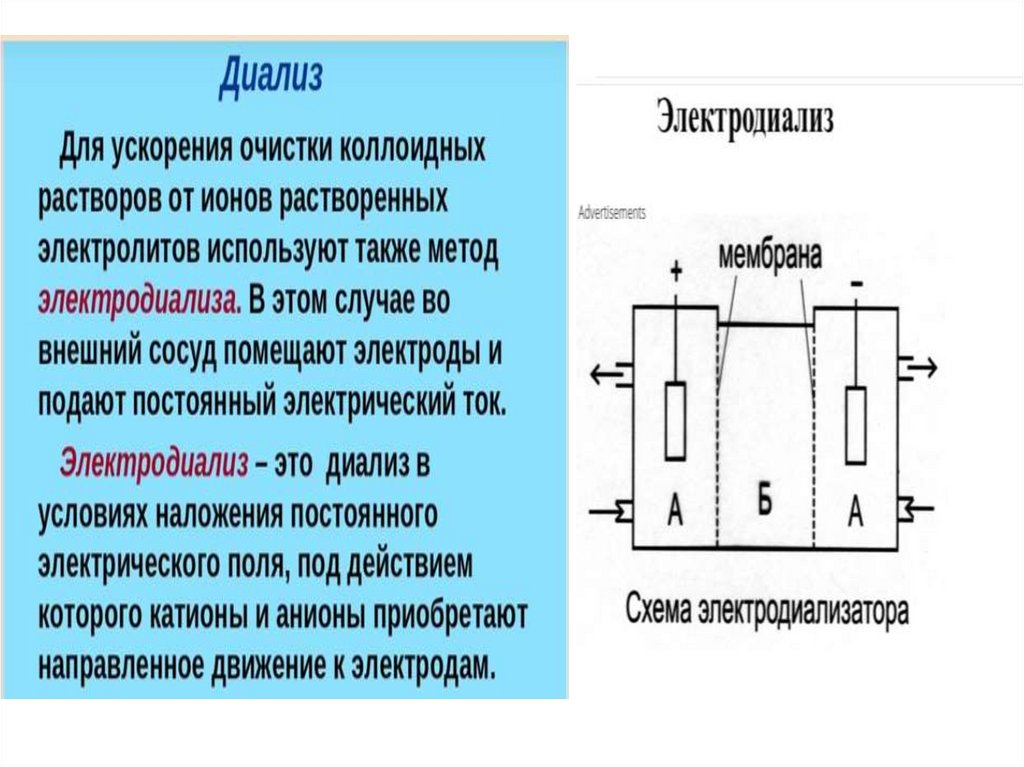
Диализ
–
отделение
золей
от
низкомолекулярных
примесей с помощью полупроницаемой мембраны.
Электродиализ
–
диализ,
ускоренный
внешним
электрическим полем.
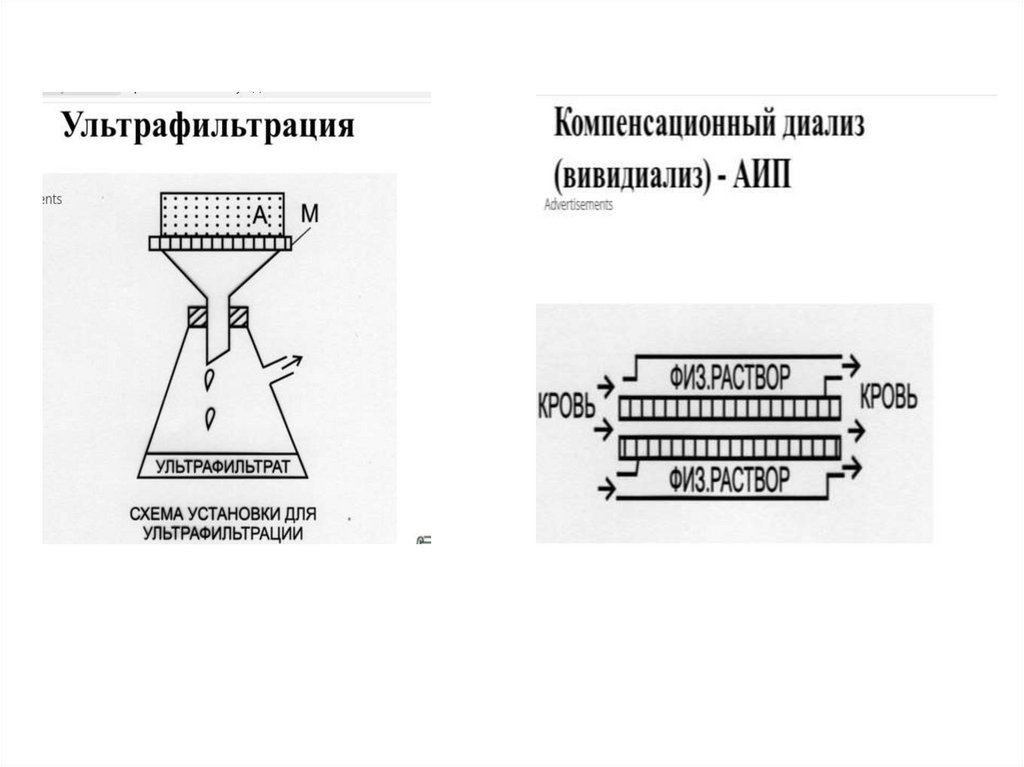
Ультрафильтрация – электродиализ под давлением
(гемодиализ).
44
45.
46.
47.
48.
49.
50.
Теоретические положенияМицелла – это структурная коллоидная частица дисперсной фазы.
Правила построения мицеллы:
1.Агрегатом является получающийся в ходе реакции осадок.
2.Потенциалобразующими ионами являются ионы, удовлетворяющие двум условиям:
а) данные ионы должны быть в строении вещества, которое находится в реакции в избытке или
является стабилизатором;
б) данные ионы должны быть подобны ионам, находящимся в агрегате (правило Панета-Фаянса: на
кристаллической поверхности агрегата адсорбируются те ионы, которые могут достроить её
кристаллическую структуру).
3.Противоионами и ионами, образующими диффузионный слой, являются оставшиеся ионы
вещества, которое находится в реакции в избытке или является стабилизатором.
4.Коэффициенты m, n, (n-x), x являются постоянными для любой мицеллы и численно не
определены.
При смешивании разбавленных растворов нитрата серебра и хлорида натрия взятого в избытке,
хлорид серебра не выпадает в осадок, а образуется коллоидный раствор.
Сначала составляем уравнение реакции в молекулярном и ионном виде:
AgNO3 + NaCl → NaNO3 + AgCl↓
Ag+ + NO3- + Na+ + Cl- → Na+ + NO3- + AgCl↓
Ag+ + Cl- → AgCl↓
Основу коллоидных частиц золя AgCl составляют микрокристаллы малорастворимого хлорида
серебра, которые называются агрегатами, обозначаются m (AgCl).
Эта реакция происходит при наличии избытка хлорида натрия, вследствие избирательной адсорбции
Сl-, на поверхности агрегата возникает отрицательно заряженный слой из хлорид-ионов.
Cl- называются потенциалопределяющими ионами.
Агрегат вместе с потенциалопределяющими ионами, которые адсорбировались и вошли в
кристаллическую решётку агрегата, являются частицами твердой фазы – ядра.
Обозначение: { m (AgCl) n ClОбратите внимание на то, что потенциалопределяющими ионами могут быть ионы, которые
достраивают кристаллическую решетку агрегата или содержатся в составе агрегата.
Под действием электростатических сил к поверхности ядра притягиваются ионы противоположного
знака – противоионы. В данном случае – это ионы Na+.
{ m (AgCl) n Cl- (n – x) Na+
51.
{m[AgCl]агрегат
n Cl–
∙(n – x) Na+} x–
ПотенциалПротивоионы
определяющие адсорбционного
ионы
слоя
ПОИ
ядро
коллоидная частица
x Na+
Противоионы
диффузного
слоя
мицелла
m – количество молекул, входящих в состав агрегата;
n – количество потенциалопределяющих ионов;
(n – х) – количество противоионов, входящих в адсорбционный слой;
х – количество противоионов, входящих в диффузный слой.
52.
• Агрегат и ядро образуют коллоидную частицу. Зарядколлоидной частицы определяется знаком заряда
потенциалопределяющих ионов (Cl–), обозначается в
правом верхнем углу.
• Так
как
концентрация
противоионов
около
поверхности больше, чем в растворе, то остальная часть
противоионов (Na+) слабее связана с ядром и под
влиянием теплового движения диффундирует в сторону с
меньшей концентрацией, образуя диффузный слой
противоионов.
• Коллоидная частица вместе с диффузным слоем
образует мицеллу. Мицеллы золей электронейтральны.






































 chemistry
chemistry








