Similar presentations:
Лекция Электрохимия 24 -2
1. Лекция 23-24
Электрохимическиепроцессы
2. Основные понятия
• Электрохимия – это раздел физической химии,в котором изучаются процессы превращения
химической и электрической энергии.
• Электрохимические процессы (э/х) протекают
на границе раздела фаз (например, металлраствор) с участием заряженных частиц.
• Различают две группы электрохимических
процессов:
• - равновесные электрохимические процессы;
• - неравновесные электрохимические
процессы.
3. Основные понятия
• Электродом называют э/х систему, состоящуюиз токопроводящего вещества и раствора
(расплава) электролита, в который погружается
это вещество.
• Твердые и жидкие проводники, электрический
ток в которых осуществляется потоком
электронов, называются проводниками I рода.
• Вещества, прохождение через которые эл.тока
вызывает передвижение ионов и
электрохимические реакции называются
проводниками II рода.
4.
• Между электродом и раствором электролитавозникает разность потенциалов, называемая
электродным потенциалом (Е). Возникновение
разности потенциалов на границе металл-раствор
обусловлено протеканием электродных процессов.
• Электродные (потенциалопределяющие)
процессы представляют собой окислительновосстановительные реакции.
• Различают обратимые и необратимые электроды.
При перемене направления электрического тока на
обратимых электродах протекают реакции,
противоположные по направлению, на
необратимых - протекают реакции не обратные
друг другу.
5.
• Гальваническими или химическимиэлементами, называются э/х системы, в
которых возникает разность потенциалов
в результате протекания химических
процессов на электродах.
• Основной характеристикой э/х системы
является разность потенциалов между
электродами, измеряемая при протекании
обратимых химических процессов,
которая называется электродвижущей
силой (ЭДС).
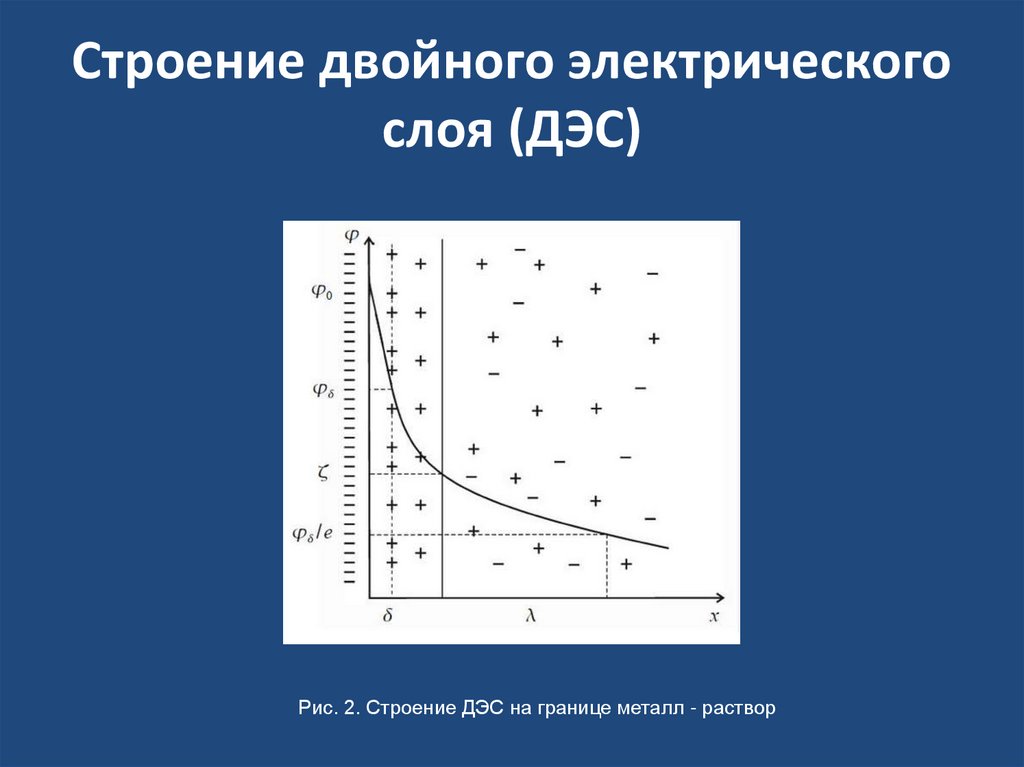
6. Возникновение скачка потенциала на границе раздела фаз.
• Переход заряженных частиц через границу раздела фазсопровождается нарушением баланса электрических
зарядов в каждой фазе и приводит к возникновению
двойного электрического слоя (ДЭС), которому
соответствует скачок потенциала.
• Потенциал, отвечающий работе переноса
элементарного положительного заряда из глубины
фазы в точку в вакууме, находящуюся вблизи
поверхности называется поверхностным. Разность
потенциалов между двумя точками, находящимися в
глубине разных фаз, называется гальванипотенциалом. Разность потенциалов между двумя
точками в вакууме или диэлектрике вблизи поверхности
двух фаз называется вольта-потенциалом.
7.
• Скачок потенциала между двумя контактирующиминесмешивающимися жидкостями называется
жидкостным потенциалом. Если растворы
различаются только природой или концентрацией
электролита, то разность потенциалов между ними
называется диффузионным потенциалом.
• Гальвани-потенциал между двумя металлами
называется контактным потенциалом.
• Проблема измерения абсолютного значения
возникающего скачка потенциала на границе
электрод – раствор экспериментально не разрешима.
Внутренние и поверхностные потенциалы, а также
гальвани-потенциалы не могут быть измерены. Вольтапотенциалы доступны экспериментальному
определению.
8. Возникновение скачка потенциала на границе раздела металл–раствор
• Причины возникновения• 1) ионизацией атомов металла на ионы и
электроны внутри металла (в узлах кристаллической
решетки находятся ионы металла, находящиеся в
равновесии с электронным газом)
• Ме <-> Меz+ + ze-;
• сольватацией поверхностных ионов металла при
соприкосновении с молекулами растворителя L
• Меz+ +nL <-> Меz+ ⸳nL
• Суммарно можно записать так:
• Ме +nL <-> Меz+ ⸳nL + ze
9. Строение двойного электрического слоя (ДЭС)
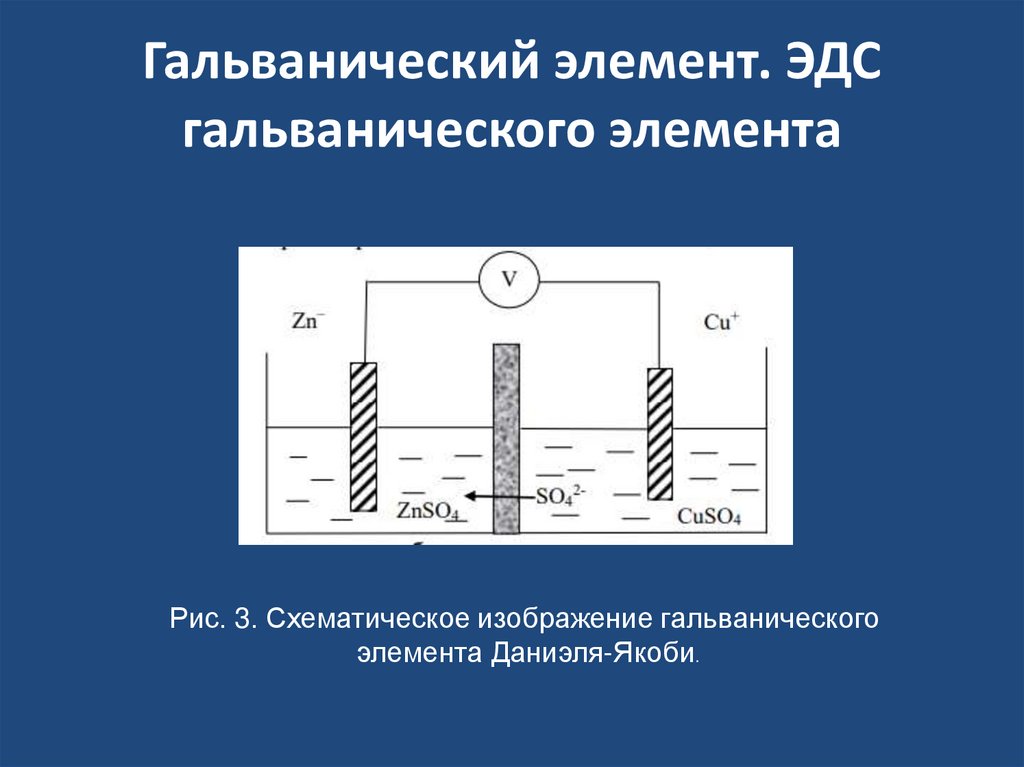
Рис. 2. Строение ДЭС на границе металл - раствор10. Гальванический элемент. ЭДС гальванического элемента
Рис. 3. Схематическое изображение гальваническогоэлемента Даниэля-Якоби.
11.
• На электродах протекают реакции:• Zn0 - 2e -> Zn2+(окисление)
• Cu2+ +2e -> Cu0(восстановление)
• Суммарный окислительновосстановительный процесс, происходящий
в гальваническом элементе, выражается
следующим уравнением:
• Сu2+ + Zn0 → Сu0 + Zn2+
12. Электродный потенциал. Уравнение Нернста
• Под относительным электроднымпотенциалом или просто электродным
потенциалом понимают ЭДС
электрохимической цепи, составленной из
данного электрода (в схеме справа) и
стандартного водородного электрода (в
схеме слева), т.е. ЭДС элемента. В этой
системе потенциал водородного электрода
условно принимается равным нулю.
13.
• Стандартный водородный электрод,следовательно, служит электродом, с
потенциалом которого сравниваются
потенциалы всех других электродов
(электродом сравнения). Потенциал
электрода, определенный таким образом,
также называют электродным
потенциалом в водородной шкале.
14.
• Величина электродного потенциаламеталлического электрода зависит от
температуры и активности (концентрации)
иона металла в растворе, в который опущен
электрод; математически эта зависимость
выражается уравнением Нернста:
аОх
RT
Е Е
ln
zF аRe d
0
0,059 аОх
Е Е
lg
z
аRe d
0
15. Международная конвенция об ЭДС и электродных потенциалах
Схема записи гальванического элемента следующая:
Материал одного из электродов;
Контактирующий с ним раствор;
Раствор, контактирующий со вторым электродом;
Материал второго электрода.
Правила записи:
Граница раздела электрода с раствором обозначается вертикальной
чертой.
Граница раздела разных электролитов обозначается двойной
вертикальной чертой в случае устранения диффузного потенциала и
пунктирной чертой при наличии диффузного потенциала.
Если раствор или электрод содержат в своем составе более одного
вещества, их разделяют запятыми.
В обозначении электрохимической системы слева записывают
отрицательный электрод, справа – положительный электрод.
Водородный электрод всегда записывается слева.
16.
Примеры:
медно-цинковый элемент:
(–) Zn|ZnSO4 ||CuSO4 |Cu (+)
система, состоящая из водородного и медного электрода
( -) Pt,H2| HСl ||CuCl2 |Cu (+)
• Электроды (полуэлементы) записывают так:
• вещества (ионы), которые находятся в растворе,
записываются слева, электродный материал справа:
• Примеры:
• Zn2+|Zn;
• Cl- |Cl2,Pt;
• Cl-|AgCl,Ag.
17.
• Электродные реакции записывают так, чтобыслева были вещества в окисленной форме и
электроны, справа – восстановленная форма.
• Примеры:
• Zn2+ + 2e- Zn;
• 1/2Cl2+e- Cl-;
• Fe3++e- Fe2+ .
• Величина ЭДС элемента всегда положительна.
Поэтому при вычислении ЭДС из величины
потенциала правого электрода вычитают величину
левого электрода:
• E = Епр- Елев
18. Электроды 1-го рода рода
• К электродам 1-го рода обычно относятэлектрохимические системы, состоящие из металла
(неметалла), помещенного в раствор, содержащий
ионы того же металла (неметалла).
• Виды электродов 1-го рода :
- обратимые по катиону (ионно-металллические);
- обратимые по аниону;
- амальгамные.
• .
19. Электроды 1-го рода, обратимые по катиону
- Условное обозначение электрода:Mz+|M
- Электродная полуреакция:
M z+ + ze- <-> M
- Уравнение Нернста:
Е M z Е
M
0
M z
0,059
z
lg aM
z
M
- Примеры: медный, серебряный электроды
20. Электроды 1-го рода, обратимые по аниону
- Условное обозначение электрода:Az-|A
- Электродная полуреакция:
• A + ze- <-> Az- Уравнение Нернста:
0,059
Е AZ Е AZ
lg a A Z
A
A
z
- Примеры: селеновый (Se 2-|Se ), теллуровый
(Te 2-| Te) электроды
21. Амальгамные электроды
- Условное обозначение электрода:Mz+|M(Hg)
- Электродная полуреакция:
• M z+ + ze- <-> M (Hg)
- Уравнение Нернста:
z
0,059 aM
Е M z
ЕM0 z
lg
M ( Hg )
z
aM ( Hg )
M ( Hg )
- Примеры: кадмиевый амальгамный электрод:
Сd 2+ |Cd(Hg).
22. Электроды 2-го рода
Электроды 2-го рода представляют собойметаллическую пластинку, покрытую слоем
малорастворимого соединения этого
металла (соли, оксида или гидроксида) и
помещенную в раствор электролита,
который содержит анионы, одноименные с
анионом малорастворимого соединения.
Теория работы основывается на двух
подходах.
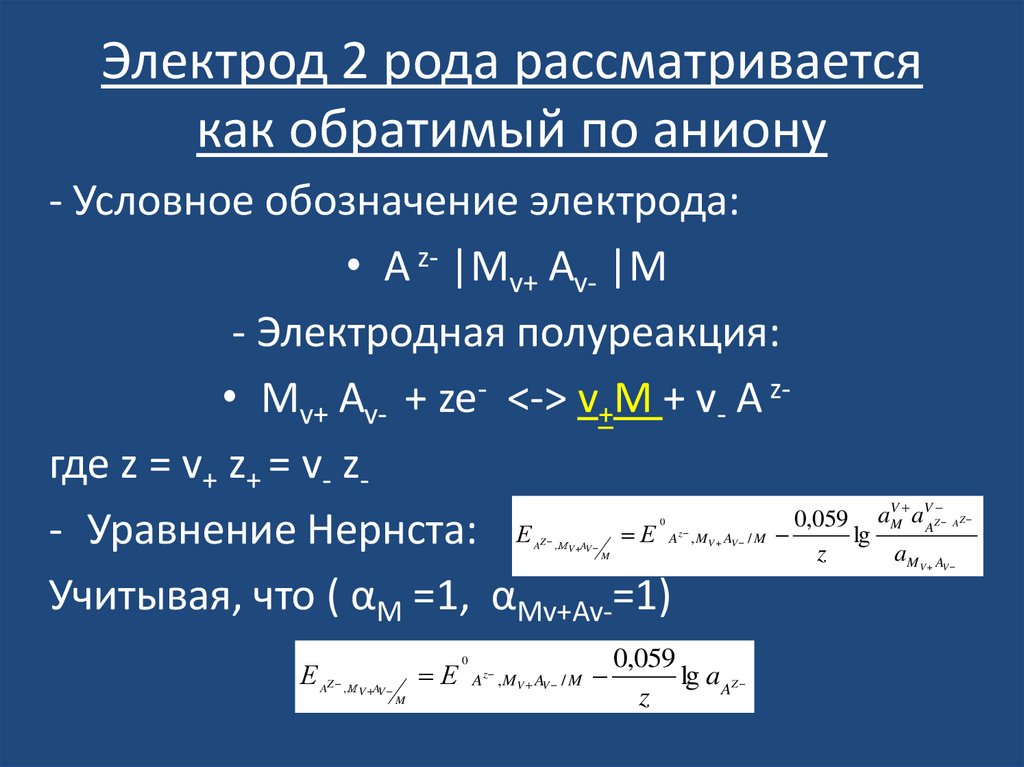
23. Электрод 2 рода рассматривается как обратимый по аниону
- Условное обозначение электрода:• A z- |Mv+ Av- |M
- Электродная полуреакция:
• Mv+ Av- + ze- <-> v+M + v- A zгде z = v+ z+ = v- z0,059 a a
Е
lg
- Уравнение Нернста: Е
z
a
Учитывая, что ( αM =1, αMv+Av-=1)
0
AZ , М V AV
M
Е AZ , МV AV Е Az ,MV AV / M
0
M
A z , M V AV / M
V
M
V
Z
AZ A
M V AV
0,059
lg a AZ
z
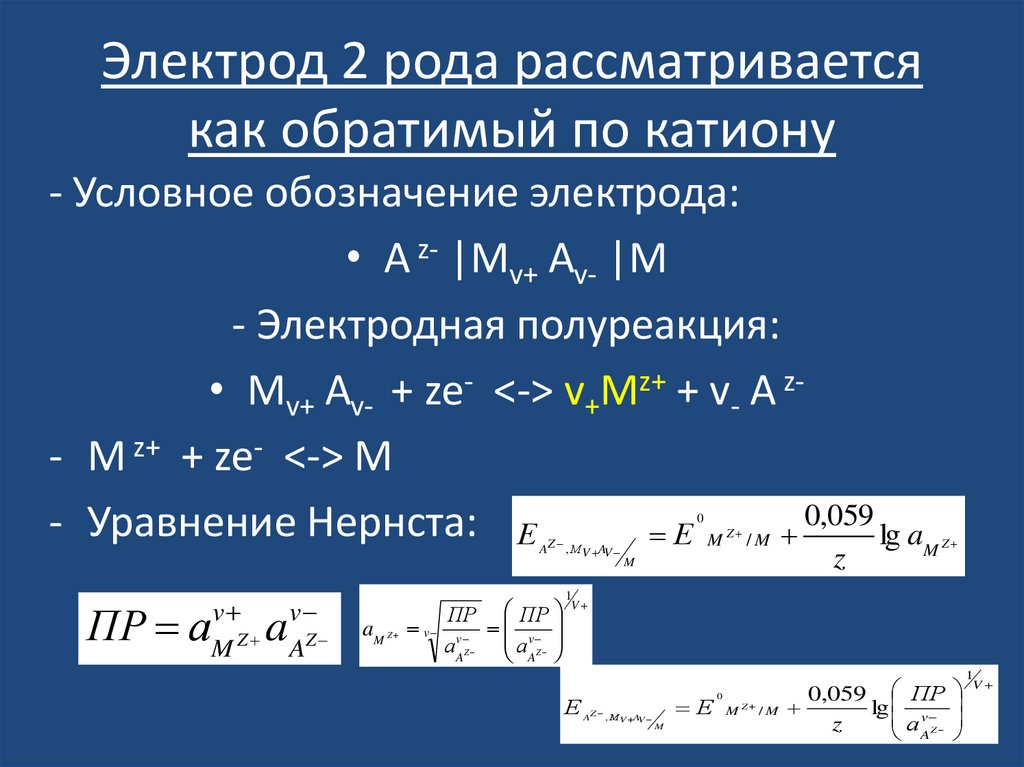
24. Электрод 2 рода рассматривается как обратимый по катиону
- Условное обозначение электрода:• A z- |Mv+ Av- |M
- Электродная полуреакция:
• Mv+ Av- + ze- <-> v+Mz+ + v- A z- M z+ + ze- <-> M
0,059
- Уравнение Нернста: Е
Е
lg a
0
AZ , М V AV
v
M Z
ПР а
a
v
AZ
M Z / M
M
z
M Z
1
V
ПР ПР
aM Z v v v
а AZ а AZ
1
ПР V
0
,
059
Е AZ , М V AV Е M Z / M
lg v
а Z
M
z
A
0
25. Каломельный электрод
26. Каломельный электрод
• Каломельный электрод существует в видетрех модификаций:
• - насыщенный каломельный электрод
(концентрация KCl отвечает концентрации
насыщенного раствора);
• - с концентрацией KCl , равной 1,0 л/моль;
• - с концентрацией KCl , равной 0,1 л/моль.
27. Хлоридсеребрянный электрод
28. Газовые электроды
- Газовые электроды состоят из платиновойпроволоки, покрытой осадком платиновой черни –
Pt/Pt-электрод, который контактирует
одновременно и с электрохимически активным
газом, пропускаемым через раствор электролита, и
с самим раствором, содержащим ионы, природа
которых соответствует продуктам окисления или
восстановления этого газа на электроде.
- Газовые электроды могут быть обратимы как
относительно катиона (водородный электрод), так и
аниона (хлорный, кислородный электроды).
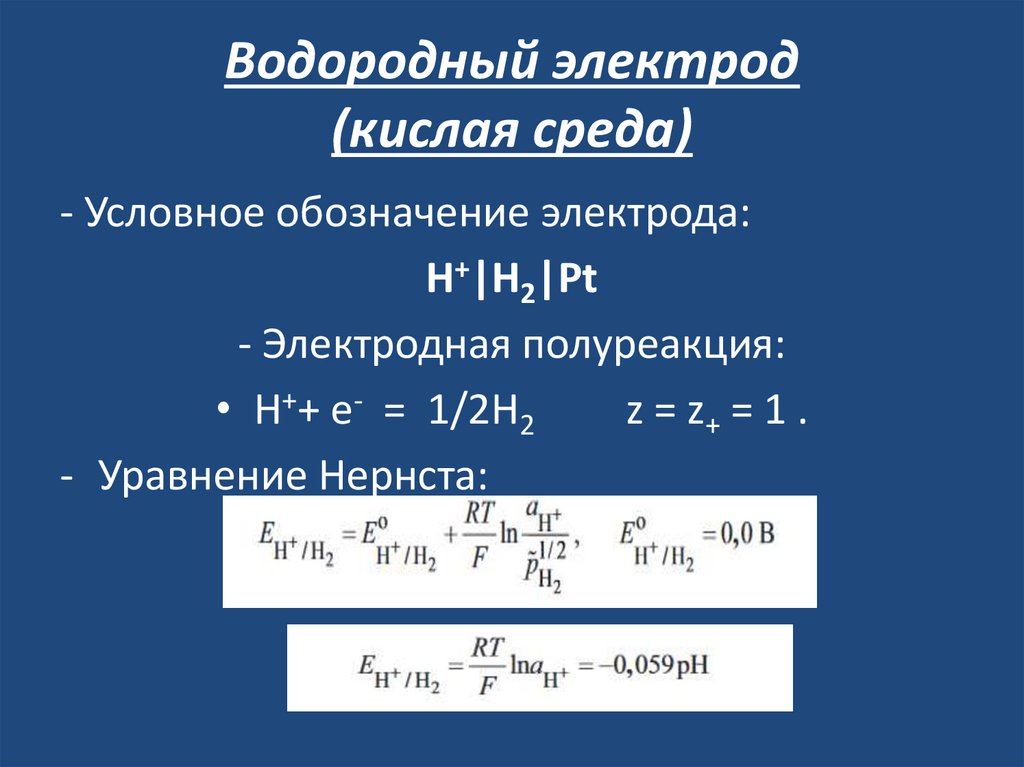
29. Водородный электрод (кислая среда)
- Условное обозначение электрода:Н+|Н2|Рt
- Электродная полуреакция:
• H++ e- = 1/2H2
z = z+ = 1 .
- Уравнение Нернста:
30. Водородный электрод (щелочная среда)
- Условное обозначение электрода:• OH-| H2| Pt
- Электродная полуреакция:
• 2 H2O + 2e- <=> H2 + 2OH- Уравнение Нернста:
31. Кислородный электрод (кислая среда)
- Условное обозначение электрода:• Н+|О2|Рt
- Электродная полуреакция:
- Уравнение Нернста:
0
,
059
2
Е Н ,О
Е Н ,О 2 / Н 2 О
lg a
2 / Н 2О
Н
2
0
32. Кислородный электрод (щелочная среда среда)
- Условное обозначение электрода:• OH- |О2|Рt
- Электродная полуреакция:
- О2 +2Н2О +4е- = 4ОН- Уравнение Нернста:
рО2
0
,
059
Е Н ,О
Е Н ,О 2 / Н 2 О
lg 4
2 / Н 2О
4
с
0
ОН
33. Окислительно-восстановительные электроды
- Окислительно-восстановительные электроды (илиредокс-электроды) -группа электродов, которые
представляют собой инертный проводящий
материал (Pt, Ti, C), погруженный в раствор,
содержащий окисленную и восстановленную форму
одного и того же элемента (Ox, Red | Pt )
- . Ox + ze- <=> Red
0,059 а
ЕOx/Red Е Ox/Red
0
z
lg
Ox
аRed
- Особенность этого типа электродов состоит в том,
что металл электрода не претерпевает
химических превращений в электрохимическом
процессе на электроде, а лишь является
передатчиком электронов между окислителем и
восстановителем.
34. Хингидронный электрод
- Условное обозначение электрода:C6H4O2, C6H4(OH)2 H+|Pt
Уравнение Нернста:
ЕQ ,H /
QH 2
0,699 0,059 lg аН 0,699 0,059 рН
35. Мембранные или ионообменные электроды
- Под мембранным электродом понимаютсистему, которая включает два раствора
электролита разной концентрации,
разделенных полупроницаемой
мембраной.
36. Стеклянный электрод
-37. Электрохимические цепи (гальванические элементы)
• Гальванические элементы(электрохимические цепи) классифицируют
по двум основным признакам:
• – по источнику электрической энергии
(физические, химические и
концентрационные),
• – по наличию или отсутствию в цепи
границы раздела жидких фаз (с переносом
или без переноса).
38. Химические гальванические элементы
• Химические гальванические элементы – этоэлектрохимические цепи, источником
электрической энергии в которых служит
химическая реакция, протекающая в элементе.
• Различают два вида химических цепей:
простые (без переноса) и сложные (с
переносом).
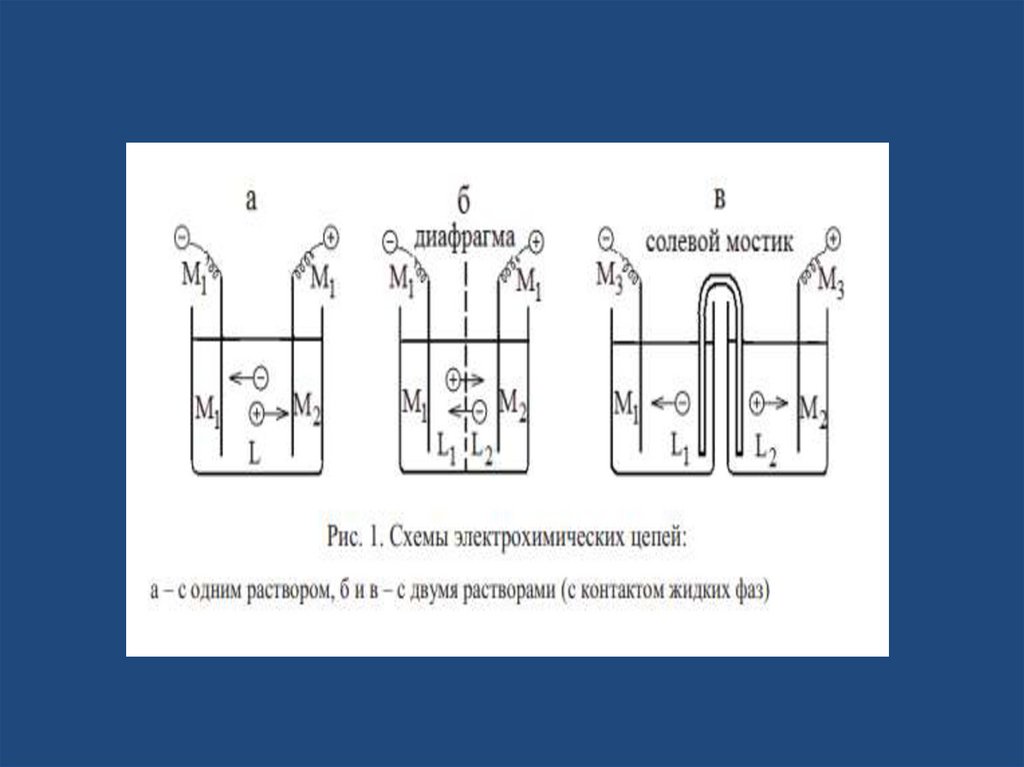
• К простым химическим элементам (без
переноса) относят электрохимические цепи с
одним общим раствором (рис. 1):
39.
40.
• Сложными химическими элементами(элементами с переносом) называют
электрохимические цепи, которые включают
электроды с различными по составу
растворами электролитов. Контакт между
двумя растворами осуществляется либо
непосредственно через полупроницаемую
пористую стеклянную или керамическую
перегородку (рис. 1б), либо с помощью
солевого мостика (рис. 1в). В таких цепях
происходит перенос ионов из одного раствора
в другой , это связано с различными
подвижностями ионов.
41.
• Концентрационные цепи состоят из двух электродоводного металла, которые находятся в растворах
своих солей с разной концентрацией. Источником
электрической энергии является различие в энергиях
Гиббса одних и тех же электрически активных
компонентов, обусловленное разными их
концентрациями в полуэлементах.
• Например, схема цинкового концентрационного
элемента:
• (-) Zn | ZnSO4(c1) ¦ ZnSO4(c2)| Zn (+)
• С1 ≠ С2
• С1 < С 2
0,059 a2
• (-) Zn -2е <=> Zn2+
Е Еправ Е лев
lg
z
a1
• (+) Zn2+<=> Zn
42. Нормальный элемент Вестона
• Условная запись элемента Вестона:• (-) Pt |Cd(Hg)|CdSO4(нас.)| Hg2SO4| Hg|Pt (+)
• Элемент Вестона характеризуется стабильным
(неизменным во времени) значением ЭДС: E 20
o =1,0183 B.
C




































 chemistry
chemistry








