Similar presentations:
Подгруппа азота (пниктогены) (1)
1.
Подгруппа азота(пниктогены)
11ендобавления текста
Для
щёлкните мышью
2.
Общая характеристикаР-элементы V группы главной подгруппы
На внешнем слое 5 электронов ns2np3
Высшая степень окисления +5, низшая -3
У азота валентность I, II, III, IV
У фосфора и др. валентность III, V (есть dподуровень)
Водородные соединения ЭН3
Оксиды (кислотные) Э2О3 и Э2О5
Кислоты НЭО2 и НЭО3
3.
ПолучениеИз жидкого воздуха (фракционная перегонка)
Разложение нитрита аммония NH4NO2 = N2 +
2H2O
NH4Cl + NaNO2 = N2 + NaCl + 2 H2O
Из апатитов или фосфоритов 2Сa3(PO4)2 +
10C + 6SiO2 = 6CaSiO3 + P4 + 10CO
4.
Cтроение молекулы азота2-х атомная молекула азота
Сигма и 2 пи-связи – тройная связь
Ковалентная, неполярная связь
Неполярная молекула
Молекулярная кристаллическая
решетка
5.
Строение фосфораБелый фосфор – молекулярная
кристаллическая решетка, молекулы Р4
Красный фосфор – полимерная
модификация (смесь аллотропных
модификаций разного цвета), атомная
кристаллическая решетка
Черный фосфор – полимерная
модификация со свободными электронами,
атомная кристаллическая решетка
6.
Физическиесвойства
Азот - газ без цвета и запаха, легче воздуха,
плохо растворим в воде, низкие температуры
плавления и кипения
Белый фосфор – бесцветное твердое вещество,
ядовит, не растворим в воде, растворим в
сероуглероде, светится в темноте
Красный фосфор – порошок красно-бурого
цвета, не ядовит, не светится в темноте, не
растворим в воде и СS2, высокие t плавления и
кипения
Черный фосфор – похож на графит, жирный на
ощупь, полупроводниковые свойства, не
растворим в воде и СS2, высокие t плавления и
кипения
7.
Химические свойства азотаС металлами (при нагревании)
3Сa + N2 = Ca3N2
С литием (при комнатной t)
6Li + N2 = 2Li3N
C водородом (kat, p, t)
3Н2 + N2 = 2NH3
С кислородом (при t 3000-4000ºC)
N2 + O2 = 2NO
8.
Химические свойства фосфораС кислородом 4Р + 5О2 = 2Р2О5
С галогенами 2Р + 5Сl2 = 2PCl5; 2P + 3Cl2 =
2PCl3
С серой 2P + 3S = P2S3
C металлами 2P + 3Ca = Ca3P2
Не реагирует с водородом
С кислотами-окислителями
2P + 5H2SO4 = 2H3PO4 + 5SO2 + 2H2O
P + 5HNO3 = H3PO4 + 5NO2 + H2O
P + HNO3 + 2H2O = 3H3PO4 + 5NO
C галогенидами фосфора (V)
3PCl5 + 2P = 5PCl3
C концентрированными растворами щелочей
4P + 3KOH + 3H2O = 3KH2PO2 + PH3
9.
Водородные соединенияМолекулярное строение
Связи в молекулах ковалентные полярные (в
разной степени)
Гибридизация центрального атома – SP3
(NH3, PH3)
Пространственное строение молекул:
треугольная пирамида (NH3, PH3)
10.
Физические свойстваГазы
Плохо растворяется в воде (РН3), т.к.
малополярен
Хорошо растворяется в воде (NH3) –
образование водородных связей между этими
молекулами и молекулами воды
Образование ассоциатов (NH3 )
11.
Кислотно-основные свойстваNH3, PH3 – основания (акцепторы протонов)
NH3 + H2O = NH4+ + OH NH3 +HCl = NH4Cl
Увеличение кислотных свойств с
увеличением атомного радиуса элемента (в
подгруппе – сверху вниз)
12.
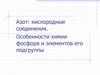
Восстановительные свойстваВосстановительные свойства увеличиваются
в подгруппах
За счет Э-1 и Э-2
8HI + H2SO4(конц)=4I2+H2S+4H2O
6HI + CH3COOH = C2H6 + 3I2 + 2H2O
6HCl + KClO3 = 3Cl2 + KCl + 3H2O
2H2S + 3O2 = 2SO2 + 2H2O
2H2S + O2 = 2S + 2H2O
H2S + Br2 = S + 2HBr
4NH3 + 3O2 = 4N2 + 6H2O
4NH3 + 5O2 (kat) = 4NO + 6H2O
3CuO + 2NH3 = 3Cu + N2 + 3H2O
13.
УстойчивостьNH3 устойчив
PH3 воспламеняется на воздухе
4PH3 + 8O2 = 4H3PO4
14.
Окислительные свойстваЗа счет Н+1
2Na
+
2NH
=
2NaNH
+
H
3
2
2
2Al + 2NH3 (t>600ºC) = 2AlN + 3H2
15.
ПолучениеИз простых веществ (PH3)
N2 + 3H2 = 2NH3
Гидролиз бинарных соединений
Ca3N2 + 6H2O = 3Ca(OH)2 + 2NH3
Специфические реакции
4P + 3KOH + 3H2O = PH3 + 3KH2PO2
Обменные реакции
Ca(OH)2 + NH4Cl = CaCl2 + NH3 + H2O
16.
Кислородосодержащиекислоты и соли
неметаллов
17.
Кислородные соединения N+3NO + NO2 + H2O = 2HNO2 (смесь газов
1:1)
NO + NO2 +2NaOH = 2NaNO2 + H2O
HNO2 – азотистая кислота, слабая,
сильный (и быстрый) окислитель
HNO2 + H+ + e- = NO + H2O E0 = +1,00 B
2HNO2 + 2HI = I2 + 2NO + 2H2O
Окисляется MnO4-, Cr2O72- до NO3
18.
Кислородные соединения N+5HNO3 – сильный окислитель
Нитраты – сильные окислители в расплавах
19.
Азотная кислотаПолучение в промышленности 4NH3 + 5O2 = 4NO +
6H2O, 2NO + O2 = 2NO2, 4NO2 + 2H2O + O2 = 4HNO3
Получение в лаборатории NaNO3 + H2SO4 = NaHSO4
+ HNO3
Сильная кислота HNO3 = H+ + NO3 C оксидами металлов СaO + 2HNO3 = Ca(NO3)2 +
H2O
C основаниями Ba(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O
C солями 2HNO3 + CaCO3 = Ca(NO3)2 + CO2 + H2O;
2HNO3 + Na2SiO3 = H2SiO3 + 2NaNO3
20.
Азотная кислота – сильныйокислитель
Чем меньше концентрация кислоты и чем сильнее
восстановитель, тем сильнее восстанавливается
азотная кислота
Концентрированная пассивирует железо,
алюминий, хром (без нагревания)
21.
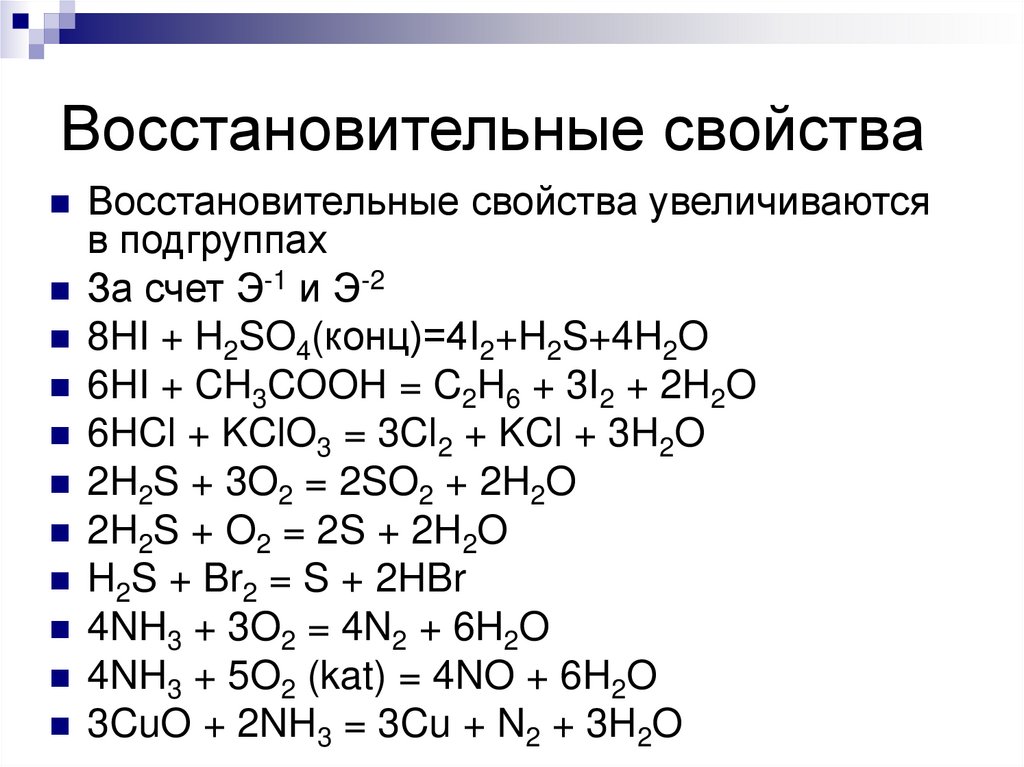
Металл Активн Средне Малоак Благороы
ые
й
тивные дные
Li - Mg активно Cu - Ag Au, Pt
сти
Be - Pb
HNO3
конц
N2O
NO
NO2
Не
реагирую
т
HNO3
разб
NH4NO3
N2, N2O
NO
Не
реагирую
т
22.
Окисление неметаллов и сложныхвеществ
С + 4HNO3 = CO2 + 4NO2 + 2H2O
P + 5HNO3 = H3PO4 + 5NO2 + H2O
S + 6HNO3 = H2SO4 + 6NO2 + 2H2O
3HCl + HNO3 = Cl2 + NOCl + 2H2O
6HNO3 + HI = HIO3 + 6NO2 + 3H2O
FeS + 12HNO3 = Fe(NO3)3 + H2SO4 + 9NO2 + 5H2O
1VHNO3 + 3VHCl – царская водка – окисляет золото
и платину
HNO3 + 4HCl + Au = H[AuCl4] + NO + 2H2O
23.
Взаимодействие с органическимивеществами
Радикальное замещение
С2H6 + HNO3 = C2H5NO2 + H2O
Электрофильное замещение
С6H6 + HNO3 (kat) = C6H5NO2 + H2O
C6H5CH3 + 3HNO3 (kat) = C6H2(NO2)3CH3 + 3H2O
Глицерин + 3HNO3 (H2SO4) = тринитрат глицерина
+ 3H2O
24.
НитратыОкислители 3FeCl2 + KNO3 + 4HCl = 3FeCl3 + KCl +
NO + 2H2O
Разложение при нагревании
От Li до Mg – нитрит + O2 2KNO3 = 2KNO2 + O2
Левее Mg до Cu – оксид Ме + NO2 + O2 2Zn(NO3)2
= 2ZnO + 4NO2 + O2
Правее Сu – Ме + NO2 + O2 2AgNO3 = 2Ag + 2NO2
+ O2
NH4NO3 = N2O + 2H2O
25.
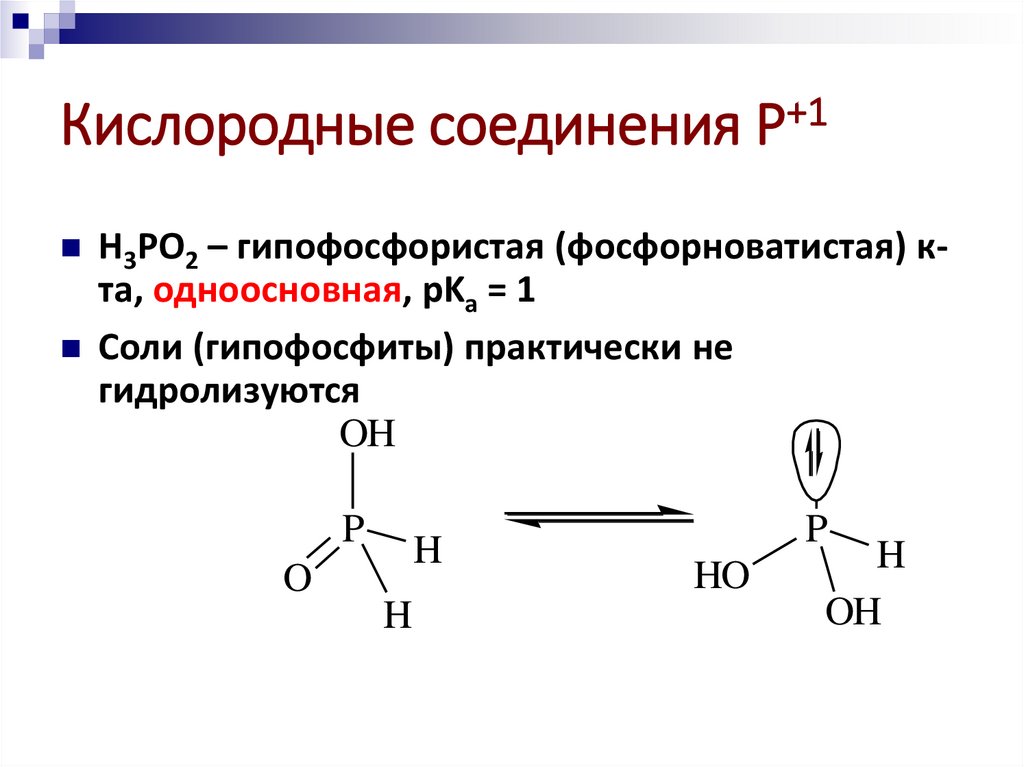
Кислородные соединения Р+1H3PO2 – гипофосфористая (фосфорноватистая) к-
та, одноосновная, pKa = 1
Соли (гипофосфиты) практически не
гидролизуются
OH
P
H
O
H
P
HO
H
OH
26.
Получение:8Pбелый +3Ba(OH)2 + 6H2O = 2PH3 + 3Ba(H2PO2)2
Ba(H2PO2)2 + H2SO4 = BaSO4↓ + 2H3PO2
H3PO2 - кислота средней силы
УДОБНЫЕ ВОССТАНОВИТЕЛИ
NaH2PO2 +4AgNO3 +2H2O = NaH2PO4+4Ag +4HNO3
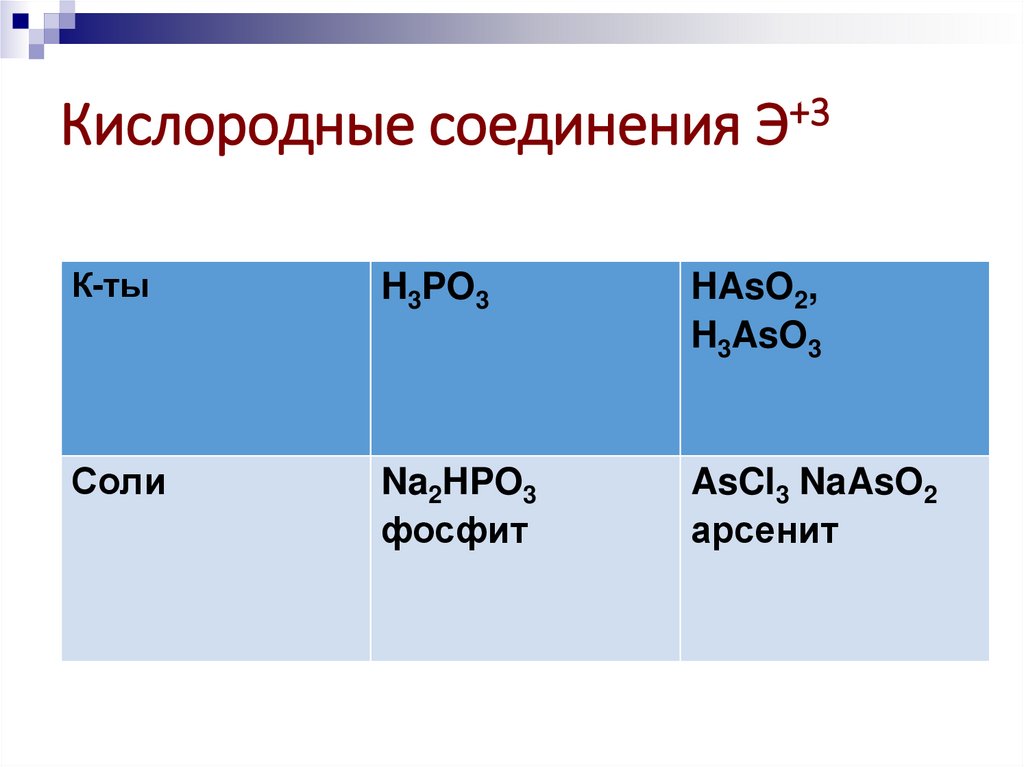
27.
Кислородные соединения Э+3К-ты
H3PO3
HAsO2,
H3AsO3
Соли
Na2HPO3
фосфит
AsCl3 NaAsO2
арсенит
28.
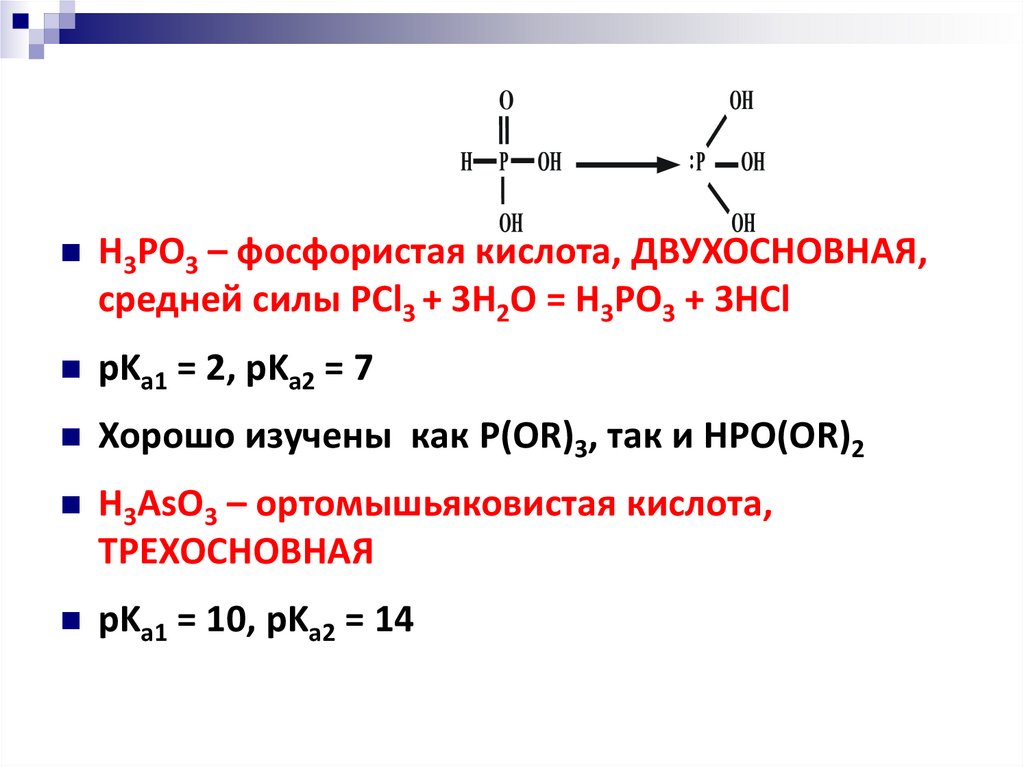
OH3PO3 – фосфористая кислота, ДВУХОСНОВНАЯ,
средней силы PCl3 + 3H2O = H3PO3 + 3HCl
pKa1 = 2, pKa2 = 7
Хорошо изучены как P(OR)3, так и HPO(OR)2
H3AsO3 – ортомышьяковистая кислота,
ТРЕХОСНОВНАЯ
pKa1 = 10, pKa2 = 14
29.
Ox/red св-ва кислородныхсоединений Э+3
Диспропорционирование H3PO3
4H3PO3 = 3H3PO4 + PH3 (при Т)
В кислой среде H3PO3 восстановитель
H3PO3 + 2AgNO3 + H2O = H2PO4 +2Ag +2HNO3
В щелочной среде Bi3+ может быть окислен или
восстановлен
Bi(OH)3 + Cl2 +3KOH = KBiO3 + 2KCl +3H2O
2Bi(OH)3 + 3[Sn(OH)4]2- = 2Bi + 3[Sn(OH)6]2 В кислой среде Bi3+ может быть восстановлен (но
не окислен!)
30.
Кислородные соединения Э+5К-ты
H3PO4
HPO3
HAsO3
H3AsO4
Соли
Na3PO4
NaPO3
Na3AsO4
NaAsO3
31.
Получение кислот Э+5P4O10 + 6H2O = 4H3PO4
ЭCl5 + 4H2O = H3ЭO4 + 5HCl (Э=P, As, Sb)
Э + 5HNO3 конц = H3ЭO4 + 5NO2 +H2O
Bi + 6HNO3 конц = Bi(NO3)3 + 3NO2 + 3H2O


























 chemistry
chemistry