Similar presentations:
Лекция 6_Общая химия_2025_ХимРав
1.
ОБЩАЯ ХИМИЯ(лекция 6)
2.
д.х.н.,профессор
кафедры
общей химии
Конюхов
Валерий
Юрьевич
VK
id2476227
3.
Химическое равновесие4. План лекций
1 неделя (13.02)Введение, строение атома
2 неделя (20.02)
Строение атома. Периодическая Система Элементов
3 неделя (27.02)
Химическая связь
4 неделя (6.03)
Химическая связь (продолжение).
Химическая термодинамика
5 неделя (13.03)
Химическая термодинамика (продолжение)
6 неделя (20.03)
Химическое равновесие. Равновесие в растворах
7 неделя (27.03)
Химическое равновесие в растворах (продолжение)
8 неделя (3.04)
Комплексные соединения
9 неделя (10.04)
Химическая кинетика
10 неделя (17.04)
Растворы
11 неделя (24.04)
Коллигативные свойства растворов
12 неделя (8.05)
Дисперсные системы
13 неделя (15.05)
Электрохимия. Системы. ХИТ
14 неделя (22.05)
Электролиз
15 неделя (29.05)
Коррозия
16 неделя
Заключительная лекция
5. Из программы курса: Основные закономерности химических процессов
6. Химическое равновесие
Основные закономерности химических процессовОбратимые и необратимые реакции. Химический потенциал и его свойства.
Химический потенциал компонентов идеальных и реальных систем.
Активность и коэффициент активности. Признаки истинного химического
равновесия. Термодинамическое условие химического равновесия. Закон
действия масс. Термодинамическая и концентрационная константы
равновесия. Расчет химического равновесия: равновесные концентрации,
степень превращения. Принцип Ле Шателье.
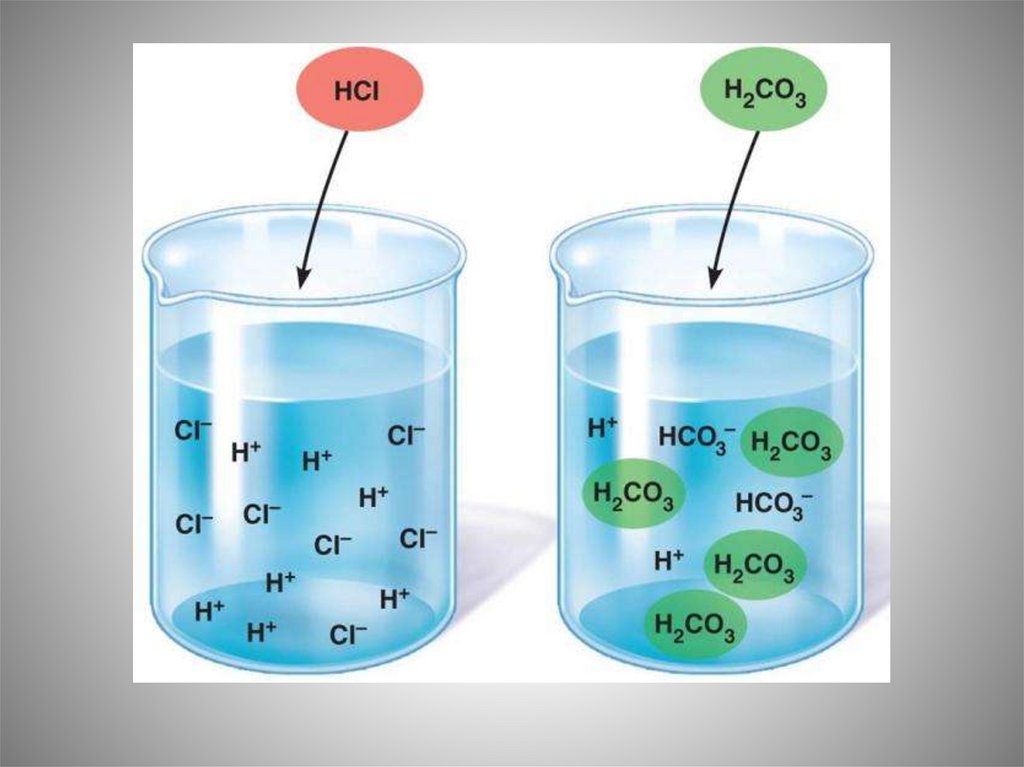
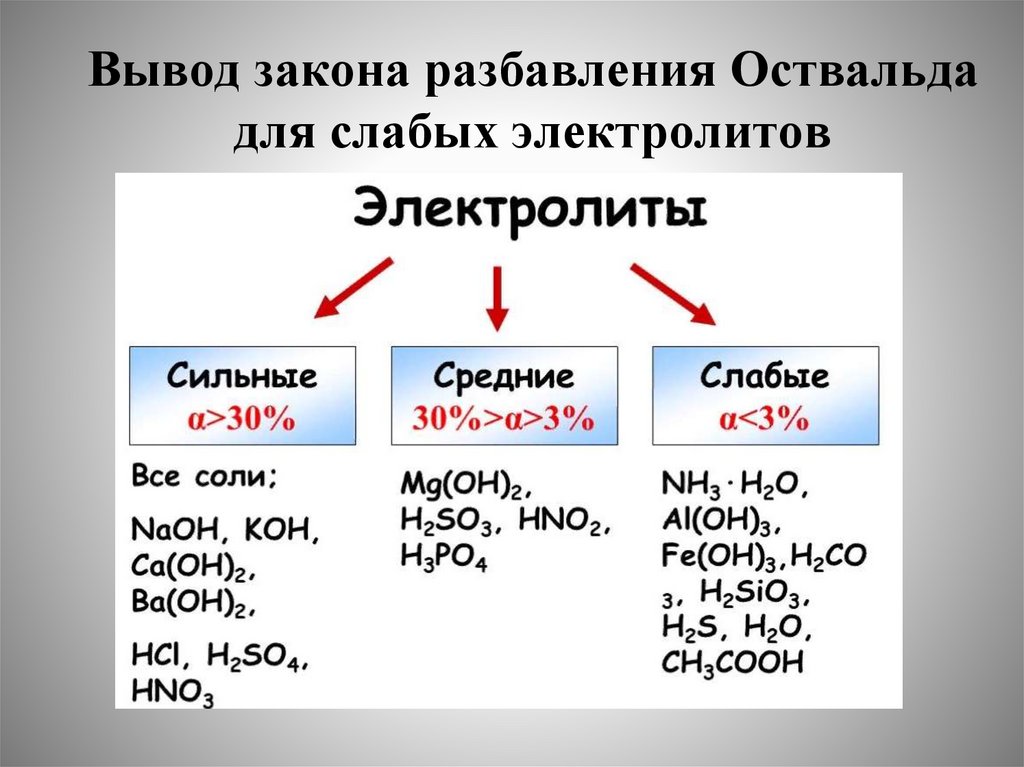
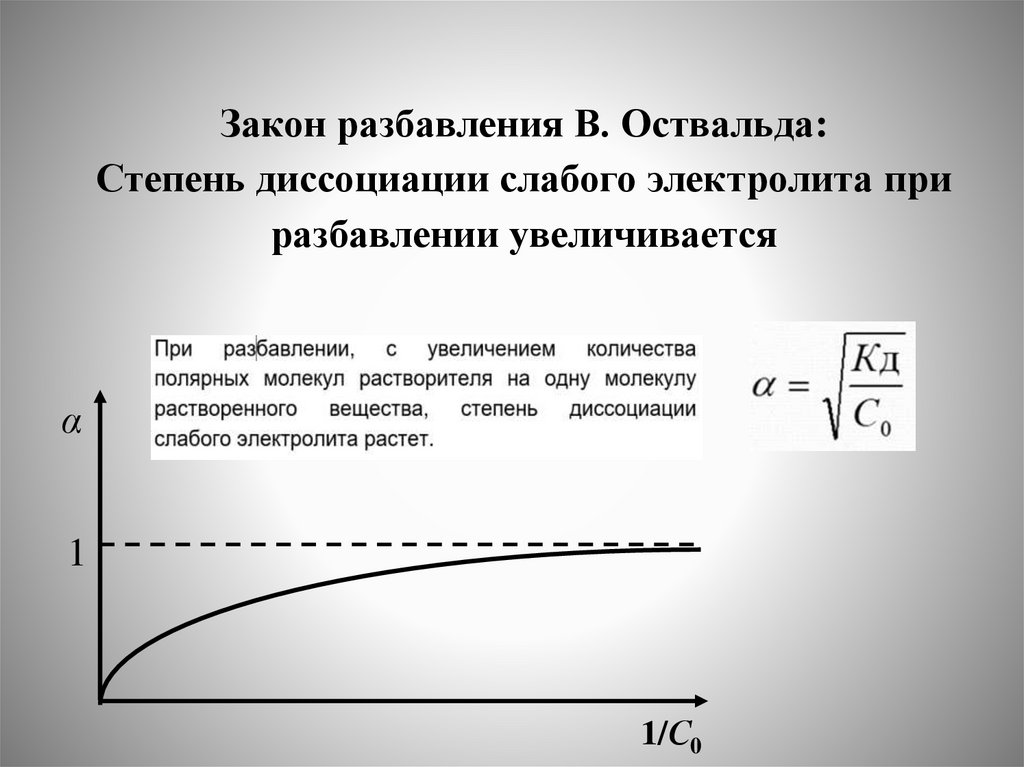
Химическое равновесие в растворах. Сильные и слабые электролиты.
Константа и степень диссоциации слабых электролитов. Закон разбавления
В.Оствальда.
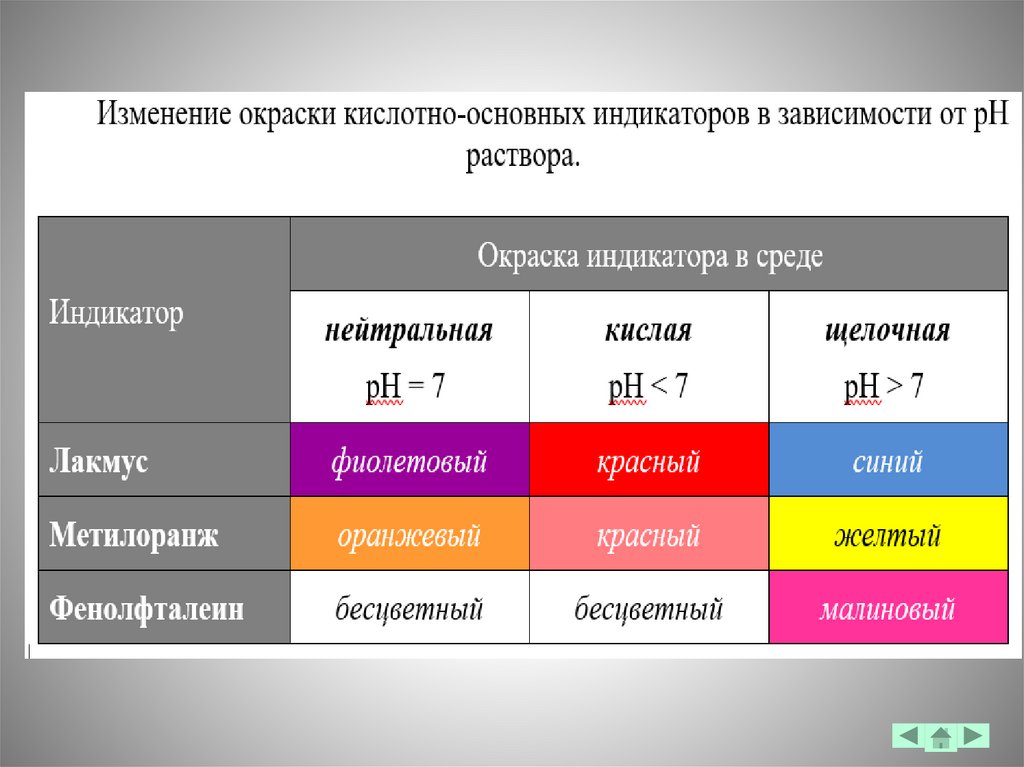
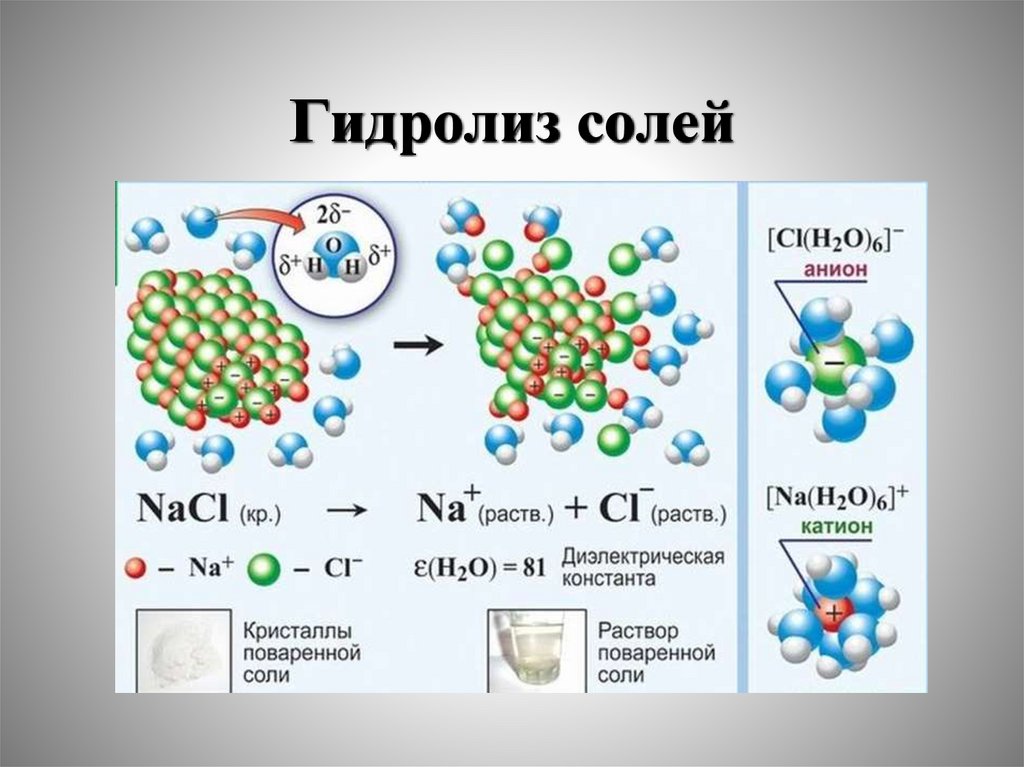
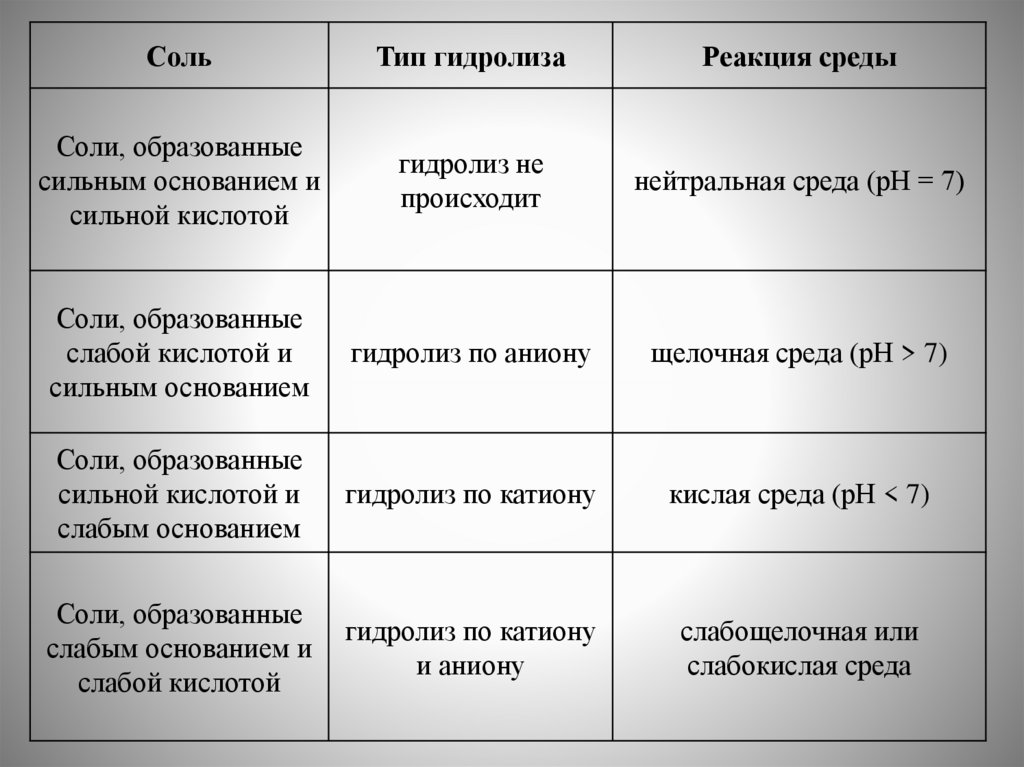
Гидролиз. Смещение равновесия диссоциации воды в растворах
электролитов. Гидролиз по катиону и аниону: изменение характера среды.
Константа и степень гидролиза.
Химическое равновесие в гетерогенных системах. Константа и коэффициент
распределения. Закон Бертло-Нернста. Произведение растворимости.
7. Тема 17. КОНТРОЛЬНЫЕ ВОПРОСЫ ПО КУРСУ ХИМИИ (для подготовки к экзамену и выполнения итогового домашнего задания)
Химическое равновесие. Химический потенциал и его свойства.Активность. Коэффициент активности неэлектролита и
электролита. Закон действующих масс для равновесия.
Термодинамическая и концентрационная константы равновесия.
2. Химическое равновесие в гетерогенных системах. Закон Бертло–
Нернста. Равновесие в растворах малорастворимых соединений.
Произведение растворимости.
3. Сильные и слабые электролиты. Равновесие диссоциации слабых
электролитов: воды, слабых кислот, слабых оснований.
константа и степень диссоциации слабых электролитов. Закон
разбавления В.Оствальда. Смещение равновесия диссоциации
слабых электролитов.
4. Гидролиз. Гидролиз по катиону и аниону (изменение рН среды).
Константа и степень гидролиза. Принцип Ле Шателье.
1.
8. ИТОГОВЫЙ КОНТРОЛЬ ПО ОСНОВАМ ТЕОРИИ ХИМИИ
1.2.
3.
4.
5.
6.
7.
Обратимые
реакции.
Химическое
равновесие.
Закон
действующих масс в химической термодинамике.
Смещение химического равновесия. Принцип Ле Шателье.
Диссоциация слабых электролитов. Константа и степень
электролитической диссоциации. Расчет рН раствора слабой
кислоты или слабого основания.
Произведение растворимости (ПР). Растворимость вещества и
её расчет по ПР.
Гидролиз. Гидролиз по катиону и аниону (изменение рН
среды). Константа и степень гидролиза.
Химический потенциал, активность, коэффициент активности.
Дайте определение химического потенциала и поясните его
физический смысл.
9. Список литературы
1. Н.В. Коровин. Общая химия. М.: Высшая школа.2014.
2. Н.С.Ахметов. Общая и неорганическая химия –
М.:ВШ, 2012.
3. Н.Л. Глинка «Общая химия» М.: Изд. «Химия»,
2002.
4. Жукова Т.В., Глаголева М.А., Липанова Н.В.,
Сергиевский В.В., Сорока И.В. Общая химия
(основные понятия, примеры, задачи). М.: МИФИ,
2008.
5. Сергиевский В.В., Ананьева Е.А., Жукова Т.В.,
Звончевская М.Ф., Кучук Ж.С., Котыхова О.А.
Неорганическая химия: учебное пособие для
внеаудиторной работы. М.: МИФИ, 2007.
10. Литература
Общая химия лабораторные работы(под редакцией Е.А. Ананьевой) М.:
МИФИ, 2010.
Сборник тестов и задач по курсу
химии. НИЯУ МИФИ. М.: 2014.
Общая и неорганическая химия (под
редакцией А.Ф. Воробьева).
Т. 1 и 2. М.: Академкнига. 2004.
11. Химическое равновесие
12. Химический потенциал
13.
1. Открытые системы, химическийпотенциал
Системы, в которых протекают химические
реакции (колбы, пробирки и т.п.) являются
открытыми системами. Действительно при
протекании химических реакций одни
вещества превращаются в другие. Количества
веществ в системе изменяются.
Открытые системы – системы, способные
обмениваться друг с другом и окружающей
средой веществом и энергией.
14. Функции: G, U, H, S и т.п. величины экстенсивные, т.е. их величины зависят от количества вещества в системе, и поэтому они
Функции: G, U, H, S и т.п. величиныэкстенсивные, т.е. их величины
зависят от количества вещества в
системе, и поэтому они должны
изменятся при протекании химических
или физико-химических процессов
даже при постоянстве Р, Т (для G).
15.
Следовательно, выведенное намивыражение для dG должно быть
дополнено слагаемыми,
учитывающими изменение
количества вещества в системе.
16.
Для однокомпонентной системы:dG SdT VdР μ dn
химический потенциал,
dn – изменение количества вещества
17. Для многокомпонентной системы:
dG SdT VdP 1dn12 dn2 ... n dnn
SdT VdP i dni
i
18. Из свойств полного дифференциала dG вытекает, что химический потенциал i-го компонента системы i при данном её составе и
Для обратимых (квазистатических)процессов:
dG SdT VdP μ i dni
i
Из свойств полного дифференциала dG
вытекает, что химический потенциал i-го
компонента системы i при данном её
составе и постоянстве Р и Т:
G
i
ni P ,T ,n j
19. Таким образом:
химический потенциал компонента– это частная производная энергии
Гиббса по количеству (числу моль)
этого компонента ni при постоянстве
Р, Т и количеств других
компонентов nj (т.е. при данном
составе системы).
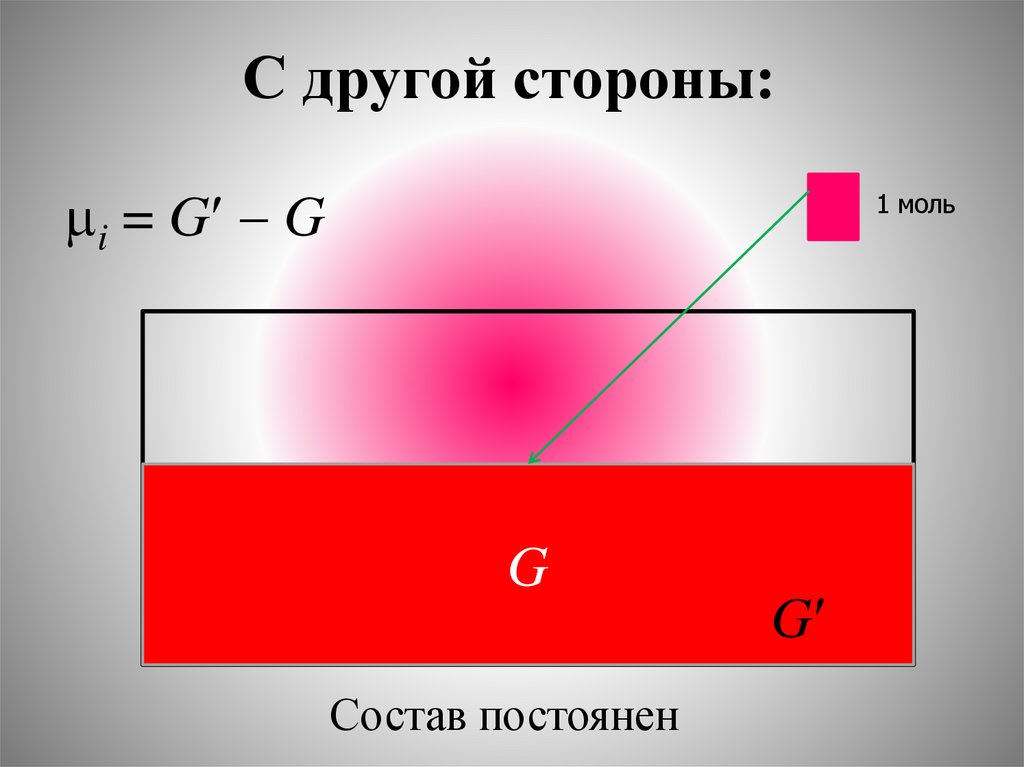
20. С другой стороны:
i = G G1 моль
G
G
Состав постоянен
21. С другой стороны
химический потенциал компонентачисленно равен увеличению энергии
Гиббса при добавлении в бесконечно
большую систему (настолько большую,
что прибавление 1 моль вещества не
изменяет её состав) одного моль
компонента при постоянных Р и Т.
22.
Для чистого веществахимический потенциал равен
его мольной энергии Гиббса
= Gm
23. Для идеального газа можно записать:
Gm RT ln P0
Для каждого i –го газа смеси идеальных
газов:
0
i
i
i
RT ln P
Pi – парциальное давление i-го газа
24. Для чего нам нужен химический потенциал?
25. Все процессы текут в сторону выравнивания соответствующего потенциала: так, электрический ток – от большего потенциала к
меньшему, тепловая (внутренняя)энергия от тела с большей
температурой к телу с меньшей Т
и т.д..
26.
Все химические и физико-химическиепроцессы протекают в сторону
уменьшения химического потенциала
до тех пор, пока химический
потенциал каждого компонента, в
каждой точке системы не станет
одинаковым.
27.
Так, если жидкость(однокомпонентная система)
находится в равновесии со своим
паром, то химический потенциал
один и тот же во всех точках
жидкости и по всему объёму
пара.
28.
Если же химический потенциалпара больше химического
потенциала контактирующей с ним
жидкости, то будет идти процесс
конденсации пара до тех пор, пока
химические потенциалы фаз не
сравняются: п = ж
29. Для многокомпонентной системы, состоящей из Ф фаз и содержащей К компонентов в состоянии равновесия:
12
3
Ф
1 1 1 .... 1
....
1
2
2
2
3
2
Ф
2
................................
1
K
2
K
3
K
....
Ф
K
30.
Т.е. при фазовомравновесии
химический
потенциал
каждого
компонента в
каждой фазе
одинаков.
31. Условия химического равновесия
32.
Попробуем понять, как, используяхимические потенциалы
компонентов, сформулировать
условие равновесия для химической
реакции:
1A1+ 2A2+…= 1 A 1+ 2 A 2 …
33. Для любознательных (вывод)
34. Введём понятие химической переменной
Введём понятие химическойпеременной
35.
Для химической реакции:1A1 2A2+…= 1 A 1 2 A 2 …
dn1 dn2
dn1 dn2
...
... d
1 2
1 2
химическая переменная
(пробег реакции)
36.
Новая запись для dG с учётомхимической переменной:
dG SdT VdP ( i i )d
При такой записи энергия Гиббса –
функция трех переменных Р,Т и
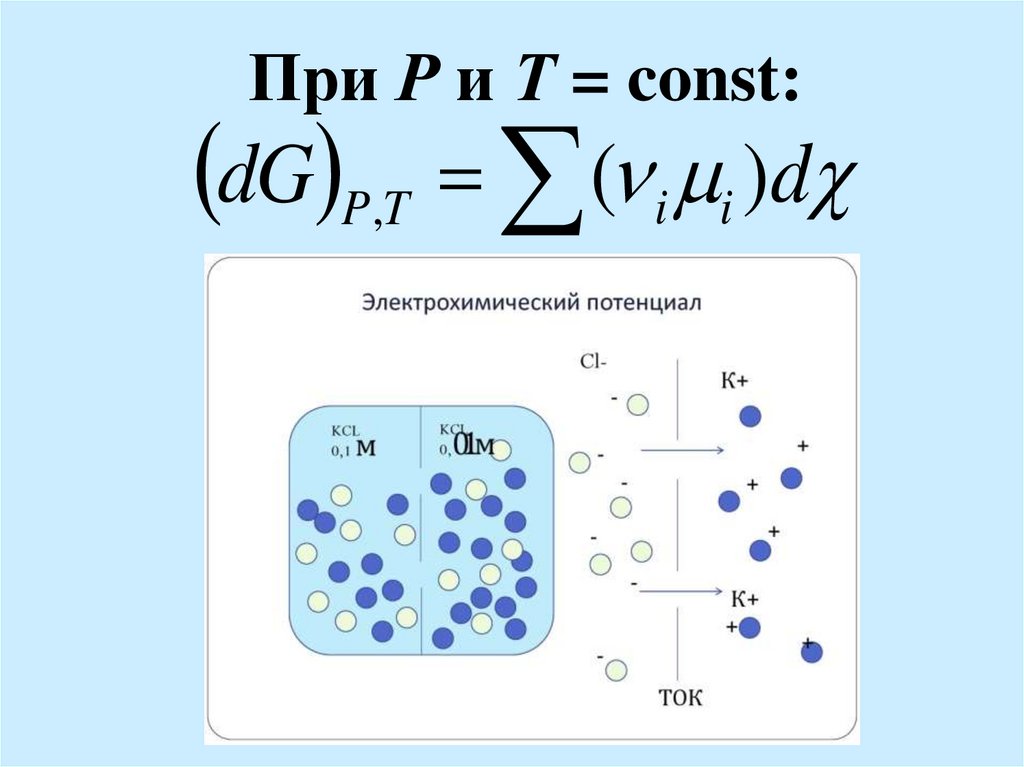
37. При Р и Т = const:
dG P,T ( i i )d38.
Из свойств полного дифференциала dGследует:
G
( i i )
P ,T
39.
В состоянии равновесия,величина G достигает
минимального значения и:
G
( i i ) 0
P,T
40. Продолжаем лекцию
41.
( ) ...i
i
1 1
2
2
3
3
n
n
1 1 2 2 3 3 .... m m 0
или
1 1 2 2 3 3 ... n n
1 1 2 2 3 3 .... m m
При равновесии сумма химических
потенциалов продуктов реакции равна
сумме химических потенциалов исходных
веществ (с учётом стехиометрии реакции)
42.
Это и есть условиеравновесия химической
реакции при P и T = const
43.
Для реакции протекающейсамопроизвольно при Р и Т = const
dG < 0
и следовательно ( i i) < 0.
Для обратной (несамопроизвольной)
реакции при Р и Т = const
dG > 0 и ( i i) > 0
44. Резюме:
Если сумма химических потенциаловисходных веществ больше, чем сумма
химических потенциалов продуктов
реакции, то реакция протекает в сторону
продуктов до тех пор, пока их
химические потенциалы не сравняются, и
наоборот, если преобладают химические
потенциалы продуктов, то реакция идёт в
сторону исходных веществ.
45.
Условие химического равновесияс учетом парциальных давлений
компонентов
46.
( ) 0i i
Химический потенциал компонента в смеси (мы
это вывели):
0
i i RT ln Pi
Напоминаю: здесь Р относительное давление
(отнесенное к стандартному давлению), оно
безразмерное.
Тогда:
(T ) RT ln P 0
i
0
i
i
i
Черта над Р означает, что давление равновесное.
47. Первое слагаемое – функция только температуры f(T)
48.
Запишем выражение по-другому:ln P
i
i
i (T )
0
i
RT
f (T )
Используя свойство логарифмов,
преобразуем выражение:
ln P
i
i
i (T )
0
i
RT
f (T )
49.
Сумма логарифмов равна логарифмупроизведений:
i
ln Pi
Обозначим:
i (T )
0
i
RT
f (T )
i
Pi К Р
Здесь для продуктов положительны (в
числителе), а для исходных веществ
отрицательны (в знаменателе).
Сейчас требуют
обозначать К
50. Это термодинамическая константа равновесия, выраженная через давления:
Это термодинамическаяконстанта равновесия, выраженная
через давления:
1
2
i
P1 P2 Pi
К Р 1 2
i
P1 P2 Pi
где все Рi = Pi/P0 относительные,
безразмерные давления.
КР она же К , она же Ка
51.
Окончательно имеем:i
ln Pi ln K P
i i0 (T )
или
Ka K K P e
0
RT
i io
RT
e
r G RT ln K P
r G 0
RT
0
Полученное выражение – изотерма
химической реакции или изотерма ВантГоффа. Она связывает константу равновесия
химической реакции и стандартную энергию
Гиббса реакции.
52.
rG0 – стандартная энергия Гиббсареакции.
Это разница энергий Гиббса
продуктов и исходных веществ при
условии, что парциальное давление
каждого участника реакции Р = 1 атм.
53.
Для реакции синтеза аммиака:N2 + 3H2 = 2NH3
В выражении для Δ






































































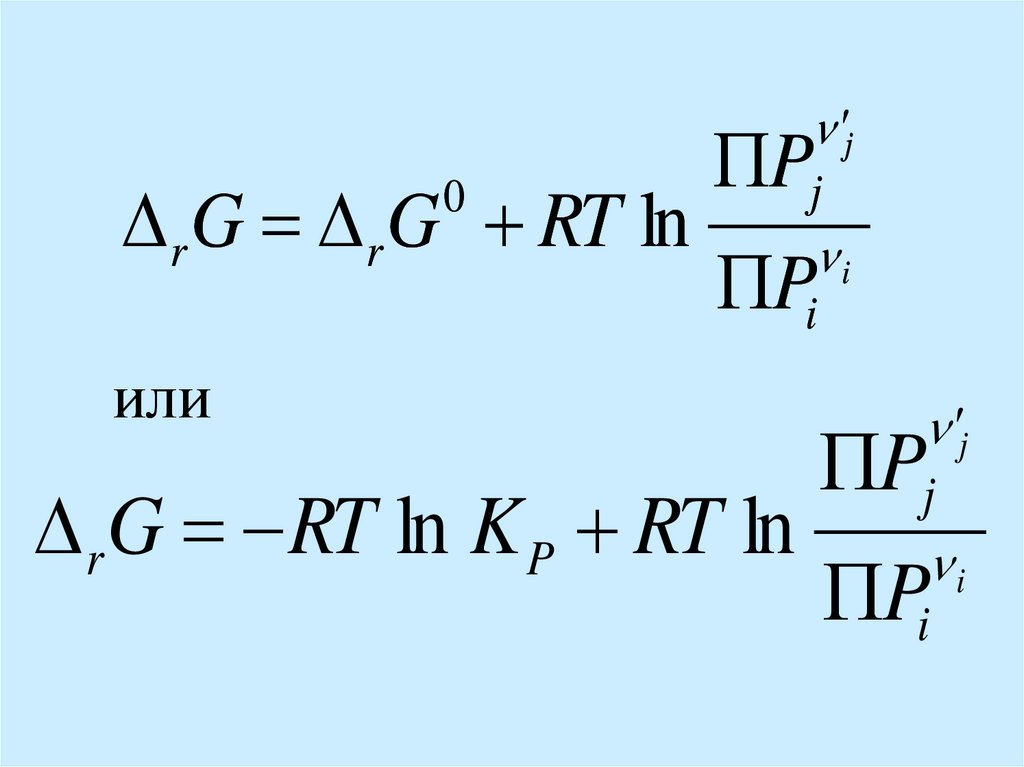


















































































































 chemistry
chemistry








