Similar presentations:
khim_svoystva_alkanov_alkenov_alkinov_dlya_zagruzki
1.
Состав, строение, свойства алифатическихуглеводородов
Алифатические углеводороды: алканы,
алкены, алкины. Физические свойства,
нахождение в природе, состав, строение,
химические свойства.
Сравнение химических свойств. Реакции
замещения в алканах, присоединения по
кратным связям, правило Марковникова,его
обоснование. СН-кислотность алкинов,
реакции присоединения нуклеофильных
реагентов по тройной связи
.
2.
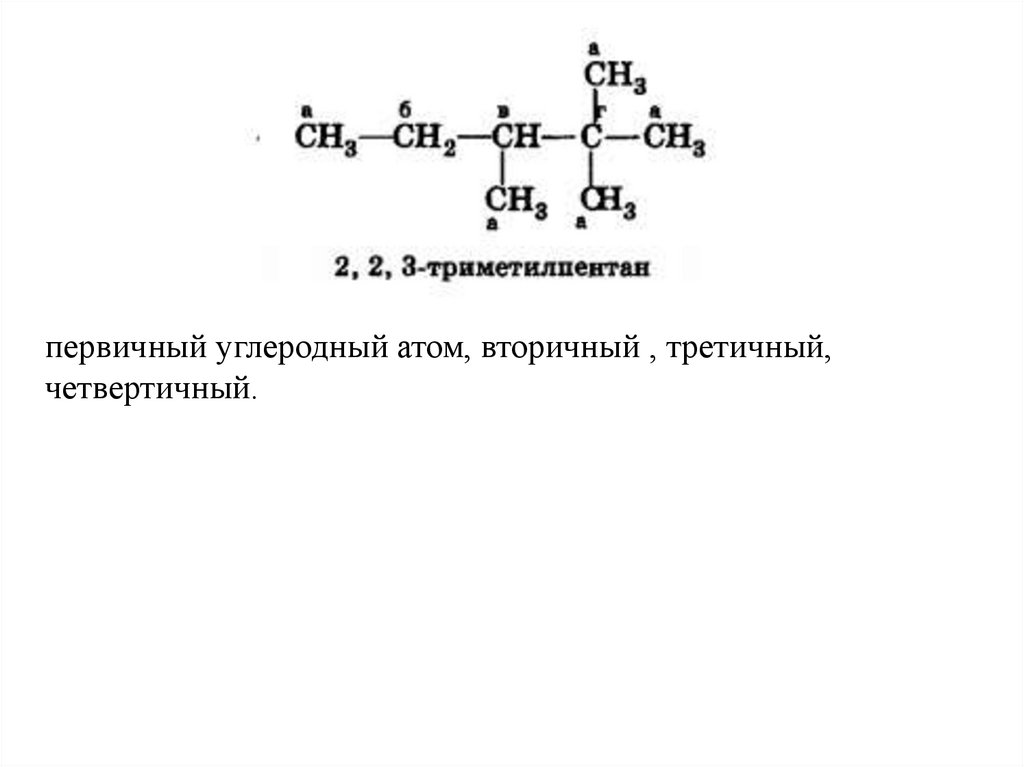
первичный углеродный атом, вторичный , третичный,четвертичный.
3.
Если от молекулы предельного углеводорода отнять один атомводорода, то остаток называется радикалом или алкилом (не
следует путать номенклатурное понятие радикал с истинными
свободными радикалами — соединениями с неспаренными
электронами). Название радикала образуют из названия
соответствующего алкана, заменяя окончание -ан на -ил.
втор- (вторичный) и трет- (третичный) указывают, у какого атома углерода
находится свободная валентность
Приставка изо- используется для названия соединений или
радикалов, в которых две метильные группы находятся на одном
конце цепи углеродных атомов, не имеющей других
ответвлений,приставка нео -указывает на наличие трех метильных
групп на конце неразветвленной цепи.
4.
Алканы, алкены, алкиныГомологи принадлежат к одному классу соединений,
имеют сходные химические свойства. Отличаются друг от
друга на одну или несколько СН2– групп.
общая формула
гомологического ряда
СnН2n+2
АЛКАНЫ
СnН2n
АЛКЕНЫ
СnН2n-2
АЛКИНЫ
4
5.
Гомологи должны иметь сходное строение.Нельзя
отнести
алканы
нормального
и
разветвлённого строения к одному и тому же
гомологическому ряду.
Метан, этан, пропан, бутан и т.д.
Все алканы нормального строения являются
гомологами.
Изобутан, изопентан, изогексан и т.д.
Этилен, пропилен, бутилен и т.д.
6.
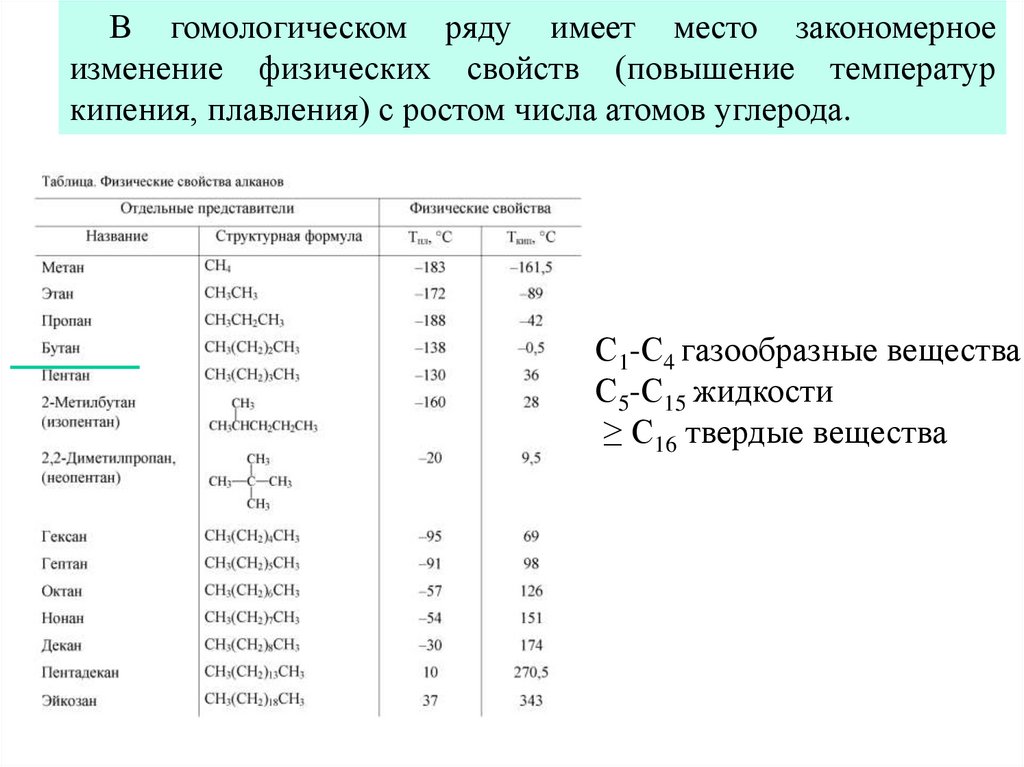
В гомологическом ряду имеет место закономерноеизменение физических свойств (повышение температур
кипения, плавления) с ростом числа атомов углерода.
С1-С4 газообразные вещества
С5-С15 жидкости
≥ С16 твердые вещества
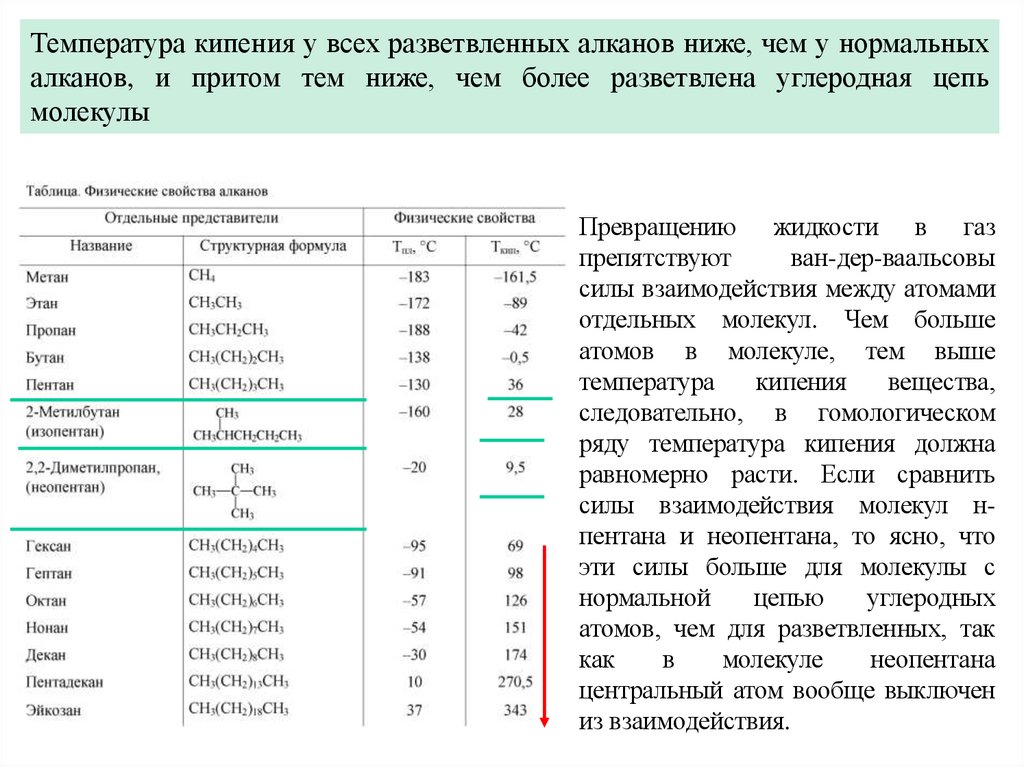
7.
Температура кипения у всех разветвленных алканов ниже, чем у нормальныхалканов, и притом тем ниже, чем более разветвлена углеродная цепь
молекулы
Превращению жидкости в газ
препятствуют
ван-дер-ваальсовы
силы взаимодействия между атомами
отдельных молекул. Чем больше
атомов в молекуле, тем выше
температура
кипения
вещества,
следовательно, в гомологическом
ряду температура кипения должна
равномерно расти. Если сравнить
силы взаимодействия молекул нпентана и неопентана, то ясно, что
эти силы больше для молекулы с
нормальной
цепью
углеродных
атомов, чем для разветвленных, так
как
в
молекуле
неопентана
центральный атом вообще выключен
из взаимодействия.
8.
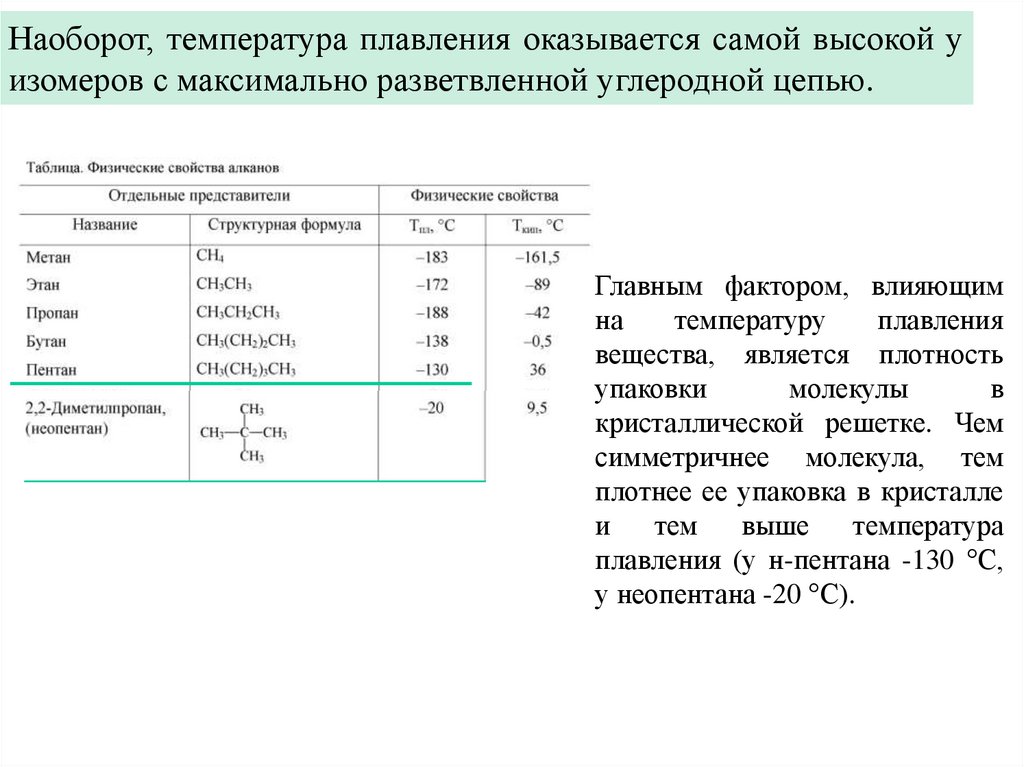
Наоборот, температура плавления оказывается самой высокой уизомеров с максимально разветвленной углеродной цепью.
Главным фактором, влияющим
на
температуру
плавления
вещества, является плотность
упаковки
молекулы
в
кристаллической решетке. Чем
симметричнее молекула, тем
плотнее ее упаковка в кристалле
и
тем
выше
температура
плавления (у н-пентана -130 °С,
у неопентана -20 °С).
9.
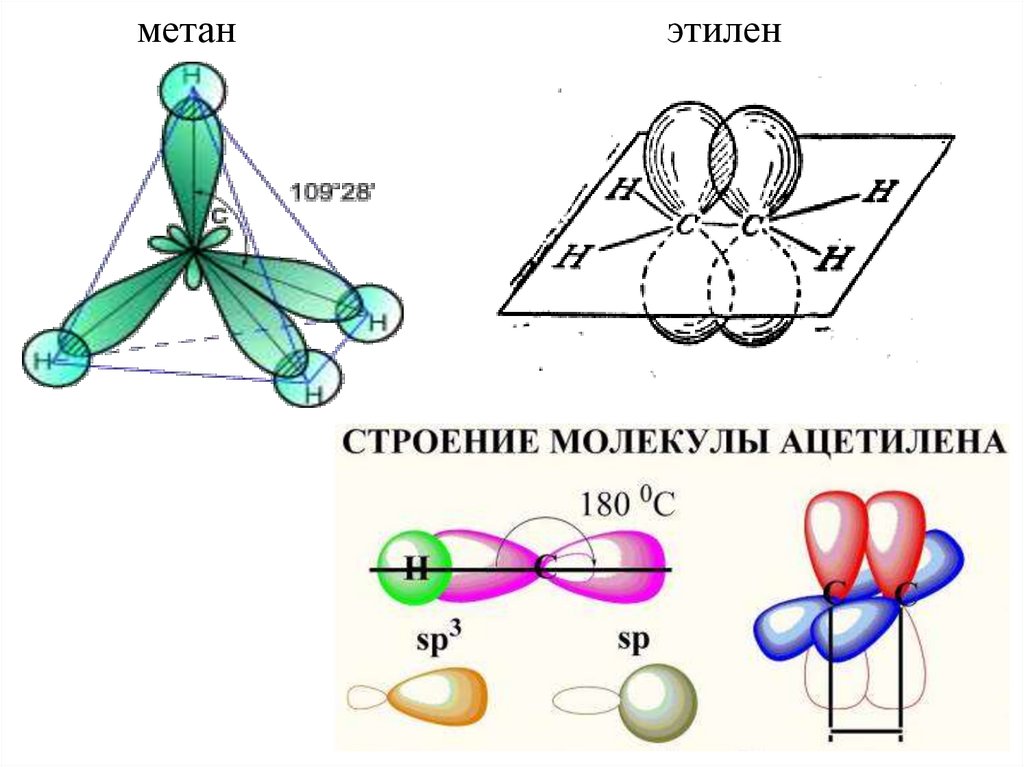
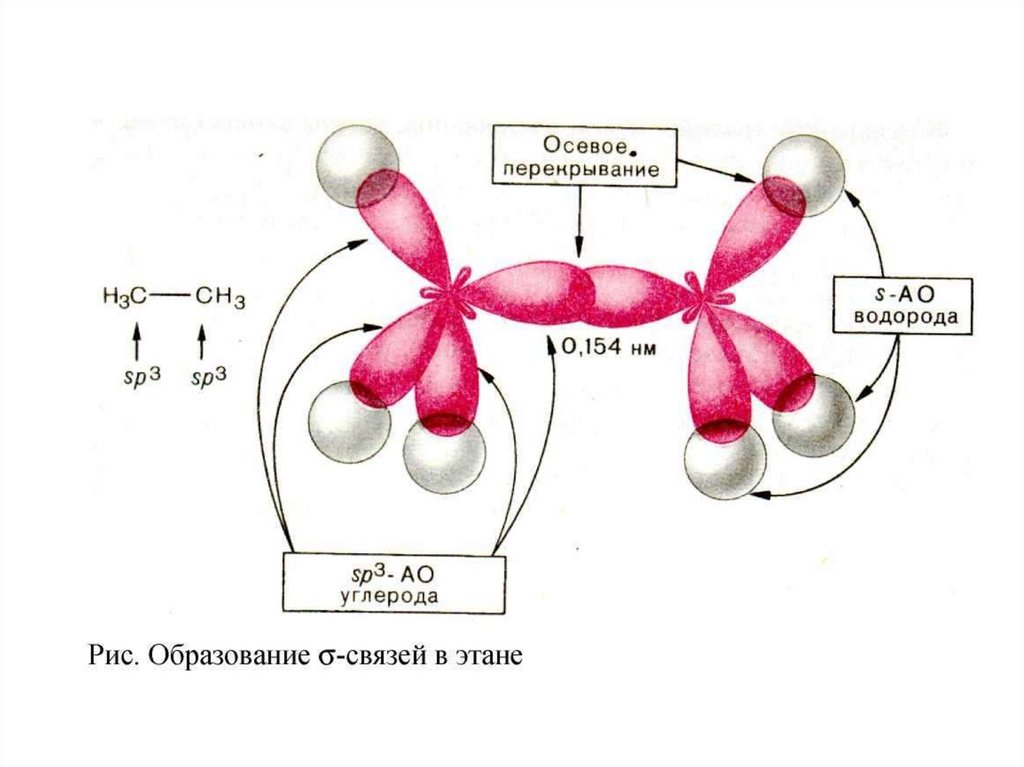
Строение алифатических углеводородов.АЛКАНЫ
Алканы имеют тетраэдрическое строение. Углеродная цепь
может изгибаться, возможно практически свободное
вращение вокруг С – С-связи.
АЛКЕНЫ
В молекулах алкенов имеется плоский фрагмент при
двойной связи. Свободное вращение вокруг С=С-связи
невозможно.
АЛКИНЫ
Алкины
имеют
линейное
расположение
(заместителей) при тройной связи.
атомов
10.
метанэтилен
11.
12.
Особенности СН-связей в алканах.Характеристики связей.
ДЛИНА
ЭНЕРГИЯ
l, нм
Е, ккал/моль
0,110÷0,111, нм
89÷102, ккал/моль
Прочность СН-связи зависит от природы атома
углерода. Наиболее прочна СН-связь при первичном
атоме углерода, наименее – при третичном.
Энергия СН-связи зависит от природы атома углерода. Легче всего
разрываются связи при третичном атоме углерода.
13.
Особенности СН-связей в алкенах иалкинах.
Полярность СН-связей в алкенах и особенно
алкинах выше, чем в алканах.
Увеличивается
электроотрицательность
атома
углерода и, соответственно, полярность СН-связи.
Алкины способны проявлять свойства СН-кислот.
АЛКЕНЫ
АЛКИНЫ
ДЛИНА СВЯЗИ
0,108 нм
Для алкинов характерна СН-кислотность, т.е.
способность к гетеролитическому разрыву СН-связи.
0,110 нм
14.
Номенклатура алканов.Систематическая номенклатура
Тривиальные
названия
первых
четырёх
представителей гомологического ряда, затем названия
образуют
путём
прибавления
суффикса
АН
к
соответствующим греческим числительным.
Рациональная номенклатура
Прототип – метан.
Составление названий для предельных углеводородов
разветвлённого строения подчиняется правилам.
15.
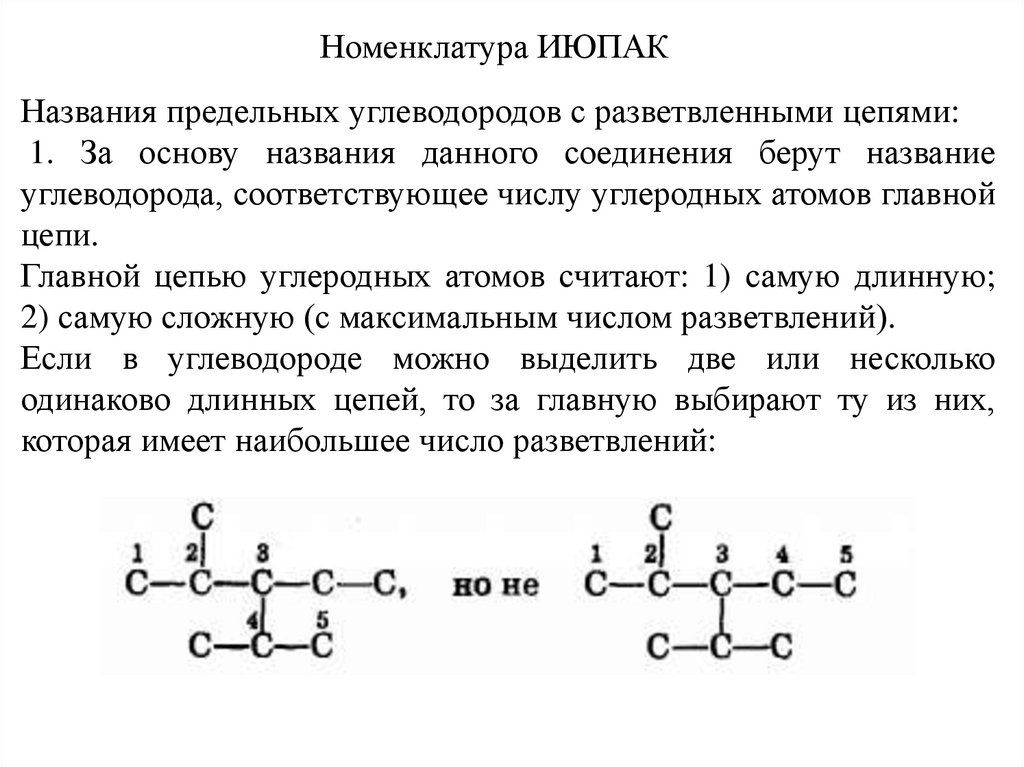
Номенклатура ИЮПАКНазвания предельных углеводородов с разветвленными цепями:
1. За основу названия данного соединения берут название
углеводорода, соответствующее числу углеродных атомов главной
цепи.
Главной цепью углеродных атомов считают: 1) самую длинную;
2) самую сложную (с максимальным числом разветвлений).
Если в углеводороде можно выделить две или несколько
одинаково длинных цепей, то за главную выбирают ту из них,
которая имеет наибольшее число разветвлений:
16.
2.Нумерацию начинают с того конца цепи, к которому ближепримыкает любой из алкилов.
Если разные алкилы находятся на равном расстоянии от обоих
концов цепи, то нумерацию определяет алкил по алфавитному
признаку.
17.
4. Называя соединение, сначала перечисляют заместители валфавитном порядке, причем перед названием радикала ставят
цифру, соответствующую номеру углеродного атома главной
цепи, при котором находится данный радикал. После этого
называют углеводород, соответствующий главной цепи
углеродных атомов, отделяя слово от цифр дефисом. Если
углеводород содержит несколько одинаковых радикалов, то
число их обозначают греческим числительным (ди, три, тетра и
т. д.) и ставят перед названием этих радикалов, а их положение
указывают, как обычно, цифрами, причем цифры разделяют
запятыми, располагают в порядке их возрастания и ставят перед
названием данных радикалов, отделяя их от него дефисом.
18.
Изомерия углеводородов.Структурная:
o Изомерия углеродной цепи.
o Изомерия положения кратной связи.
Пространственная:
Возможна при наличии стерического центра
(двойная связь или асимметрический атом
углерода).
Конформации.
19.
Источники углеводородов.АЛКАНЫ
Предельные углеводороды содержатся в нефти и
природном газе. Нефть состоит из предельных углеводородов
(алканы),
циклических
(циклоалканы,
нафтены)
и
ароматических (арены).
Природный
газ
–
метан.
Может
содержать
незначительное количество этана и пропана.
Попутные
нефтяные
углеводороды (до С4).
газы
–
лёгкие
предельные
20.
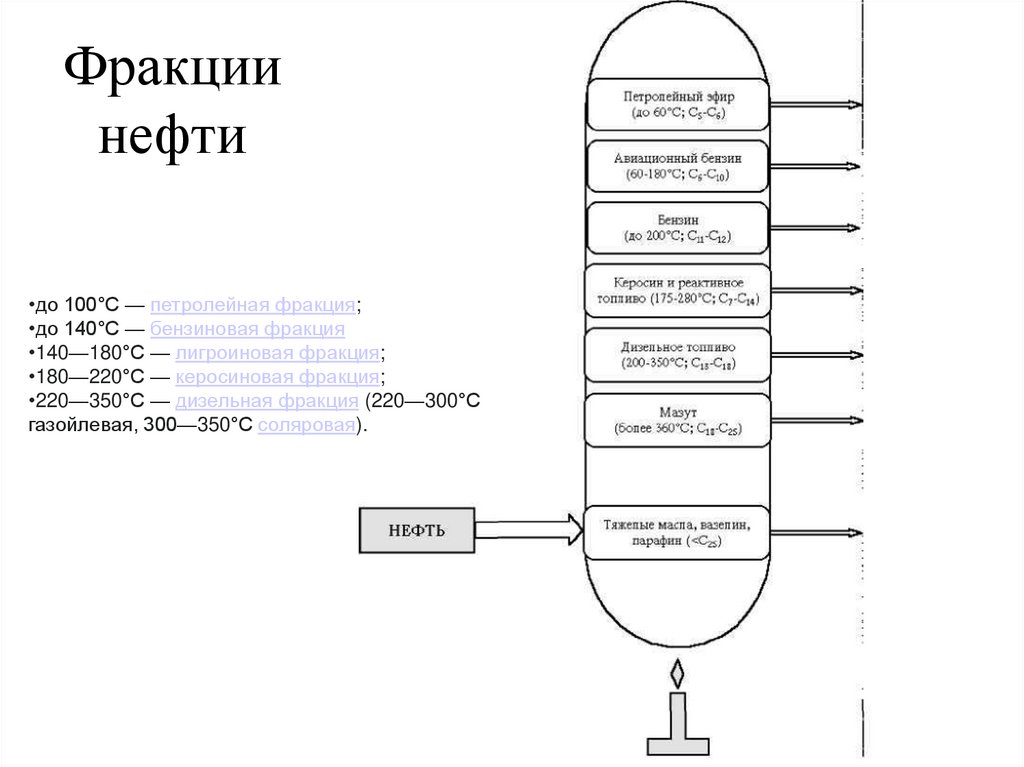
Фракциинефти
•до 100°С — петролейная фракция;
•до 140°С — бензиновая фракция
•140—180°С — лигроиновая фракция;
•180—220°С — керосиновая фракция;
•220—350°С — дизельная фракция (220—300°С
газойлевая, 300—350°С соляровая).
21.
Методы получения алканов1. Образуются при действии металлического
моногалогенопроизводные (реакция Вюрца):
2. Восстановление алкенов
присутствии катализаторов
или
алкинов
натрия
водородом
на
в
3. Восстановлением при высокой температуре иодоводородной
кислотой:
22.
Методы получения алканов4. При сплавлении солей карбоновых кислот со щелочью.
Образующийся при этом алкан содержит на один атом углерода
меньше, чем исходная карбоновая кислота:
5. Метод получения метана. Метан может быть получен
гидролизом карбида алюминия:
6. Синтез углеводородов из СО + Н2. Пропуская над мелко
раздробленным никелем смесь оксида углерода(П) и водорода при
250 °С, можно получить метан:
При применении железо-кобальтовых катализаторов и температ
уре 200 °С образуется смесь алканов — си н т и н :
23.
Источники углеводородов.АЛКЕНЫ, АЛКИНЫ
Непредельные углеводороды не содержатся в нефти и
природном газе.
Их получают путём дегидрирования или
крекинга алканов.
Реакция дегидрирования – отщепление водорода.
Крекинг – это термическое (каталитическое) разложение
алканов.
24.
Химические свойства алкановВ обычных условиях алканы химически инертны.
Они устойчивы к действию многих реагентов: не
взаимодействуют с концентрированными серной и азотной
кислотами, с концентрированными и расплавленными
щелочами, не окисляются сильными окислителями перманганатом калия KMnО4 и т.п.
Химическая устойчивость алканов объясняется высокой
прочностью s-связей С-С и С-Н, а также их неполярностью.
Неполярные связи С-С и С-Н в алканах не склонны к ионному
разрыву, но способны расщепляться гомолитически под
действием активных свободных радикалов.
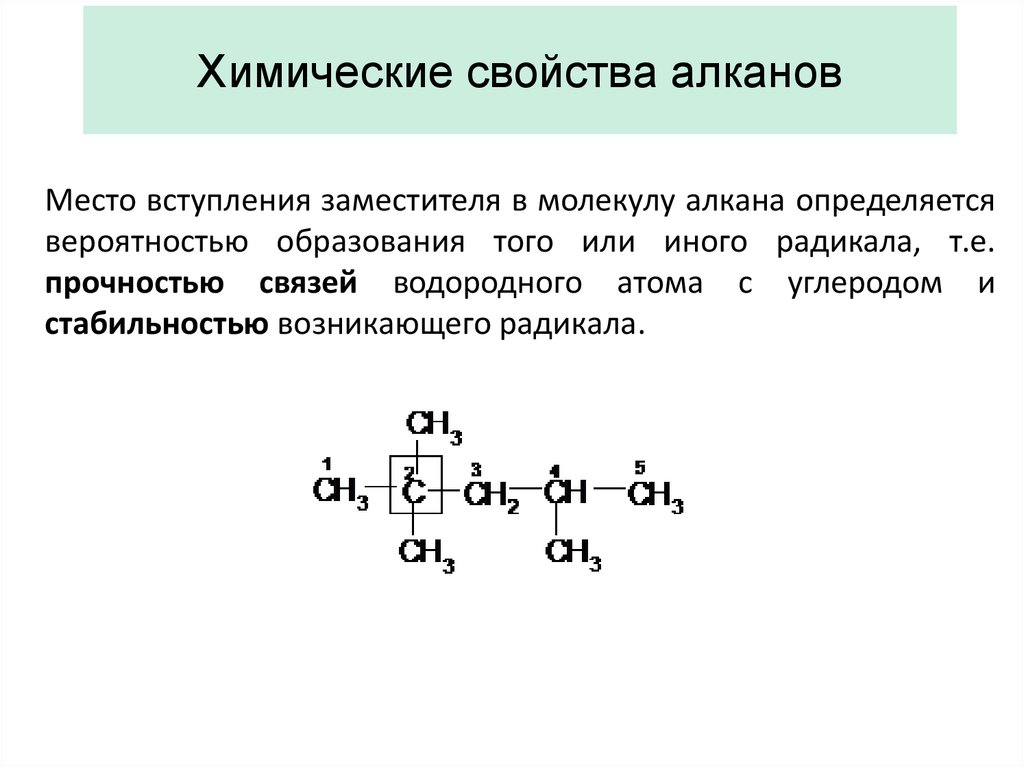
25. Химические свойства алканов
Место вступления заместителя в молекулу алкана определяетсявероятностью образования того или иного радикала, т.е.
прочностью связей водородного атома с углеродом и
стабильностью возникающего радикала.
26. Галогенирование алканов
Замещение водородных атомов на галоген – одна из наиболеехарактерных реакций предельных углеводородов.
С F2 реакция идет со взрывом, а с J2 – процесс ограничен
равновесием, т.к. йодистый водород восстанавливает
образующиеся йодистые алкилы.
Скорость галогенирования с одной стороны зависит от природы
галогена (F>>Cl>Br>J), а с другой от строения углеводорода.
Известно, что легче всего галогенирование протекает по
третичному углеродному атому, а труднее всего – по
первичному.
27. Условия галогенирования
• Нагревание или облучение УФ-излучением• Галогенирующие агенты – хлор, бром
• Реакции с бромом более селективны
(избирательны)
28. Реакции замещения в алканах
замена атомов водорода алкана на различные атомы и группы —реакции замещения.
• Замещение радикальное SR
SR (от англ, substitution radicalic)
Механизм реакции
Последовательность стадий реакции
Промежуточные частицы
Исходные вещества и продукты реакций
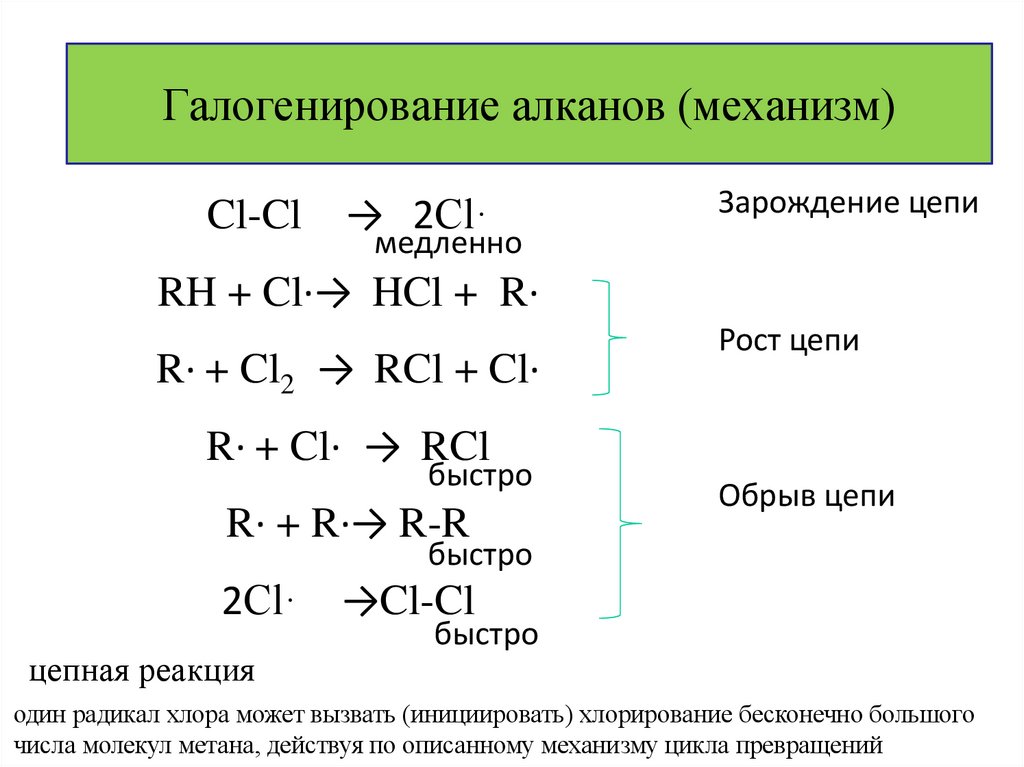
29. Галогенирование алканов (механизм)
Cl-Cl→ 2Cl·
Зарождение цепи
медленно
RH + Cl·→ HCl + R·
R· + Cl2 → RCl + Cl·
Рост цепи
R· + Cl· → RCl
быстро
R· + R·→ R-R
Обрыв цепи
быстро
2Cl·
цепная реакция
→Cl-Cl
быстро
один радикал хлора может вызвать (инициировать) хлорирование бесконечно большого
числа молекул метана, действуя по описанному механизму цикла превращений
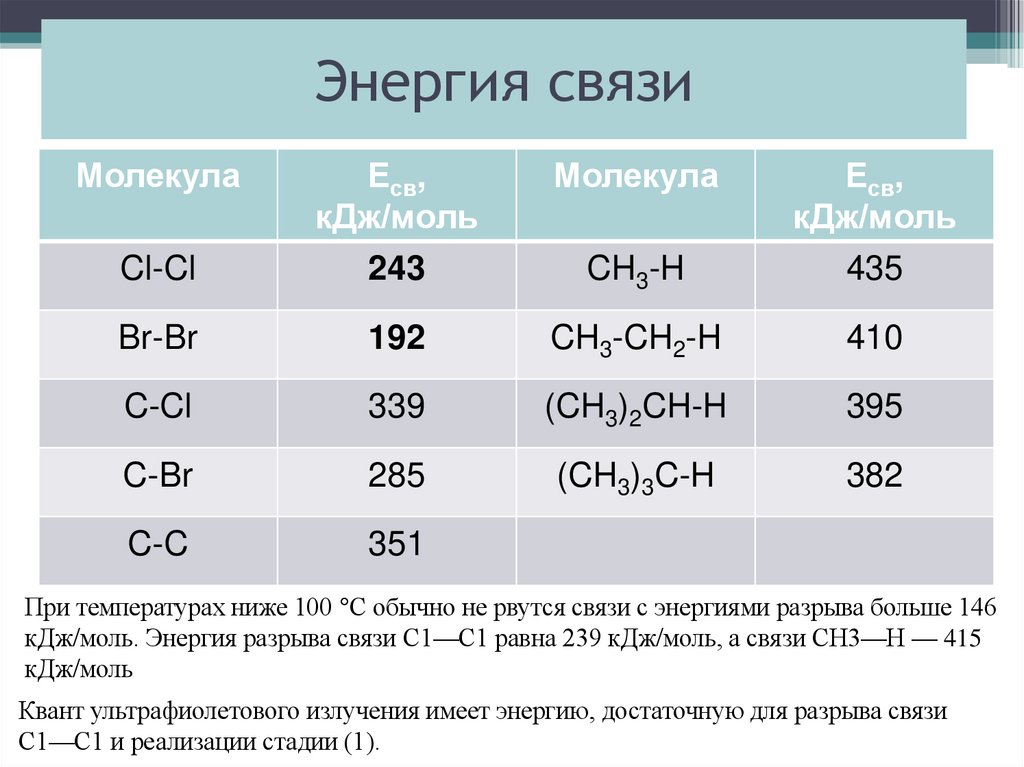
30. Энергия связи
МолекулаМолекула
Cl-Cl
Есв,
кДж/моль
243
CH3-H
Есв,
кДж/моль
435
Br-Br
192
CH3-CH2-H
410
C-Cl
339
(CH3)2CH-H
395
C-Br
285
(CH3)3C-H
382
C-C
351
При температурах ниже 100 °С обычно не рвутся связи с энергиями разрыва больше 146
кДж/моль. Энергия разрыва связи С1—С1 равна 239 кДж/моль, а связи СН3—Н — 415
кДж/моль
Квант ультрафиолетового излучения имеет энергию, достаточную для разрыва связи
С1—С1 и реализации стадии (1).
31. Энергия разрыва связи С – Н
• Энергия разрыва связи С – Н зависит отприроды атома углерода:
• СН3 – Н
435 кДж/моль
• СН3 – СН2 – Н
410 кДж/моль
• (СН3)2 СН – Н
395 кДж/моль
• (СН3)3С – Н
382 кДж/моль.
• Легкость образования радикалов увеличивается
в ряду:
∙СН3 < СН3 – СН2∙ < (СН3)2 СН∙ < (СН3)3С∙.
32.
Во всех случаях хлорирование преимущественно происходит потретичному атому углерода, затем по вторичному и потом по
первичному. Это связано с тем, что стадией, определяющей
скорость реакции, является атака радикала С1* на связь С— Н. Так
как третичные радикалы более стабильны (обладают меньшей
свободной энергией), чем вторичные и тем более первичные, то
галоген и атакует преимущественно связь третичного атома
углерода с водородом.
33. Монохлорирование бутана
34. Селективность реакций галогенирования алканов
• Реакционная способность первичных, вторичных и третичныхС – Н связей различна, но различия невелики, поэтому они
могут проявляться в мягких условиях.
• Для достаточно сильного галогенирующего агента – хлора –
природа связи сравнительно мало сказывается на результатах
хлорирования, тогда как для менее активного брома она
оказывает решающее влияние.
• При температуре 200 °С скорости замещения атомом хлора при
первичном, вторичном и третичном атомах углерода
соотносятся как 1 : 3.9 : 5.3, а атомами брома – как 1:32:1600.
35. Вопрос
• Сколько монобромзамещенныхуглеводородов можно получить
бромированием 2,2-диметилбутана?
3
• Какой продукт будет основным?
3-бром-2,2-диметилбутан
36. Нитрование алканов
реакция радикального типа и подчиняется тем же закономерностям, что и реакциягалогенирования, т. е. в случае несимметричной, разветвленной молекулы легче всего замещается
водород у третичного атома, затем у вторичного и труднее всего у первичного атома углерода
Азотная кислота при обычной температуре почти не действует на
предельные углеводороды; при нагревании же действует главным
образом как окислитель. В 1889 г. М. И. Коновалов нашел, что
при нагревании (около 140 °С) и под давлением разбавленная
азотная кислота действует как нитрующий агент, т. е. один из
атомов водорода предельного углеводорода замещается на остаток
—NО2 (нитрогруппа) и выделяется вода
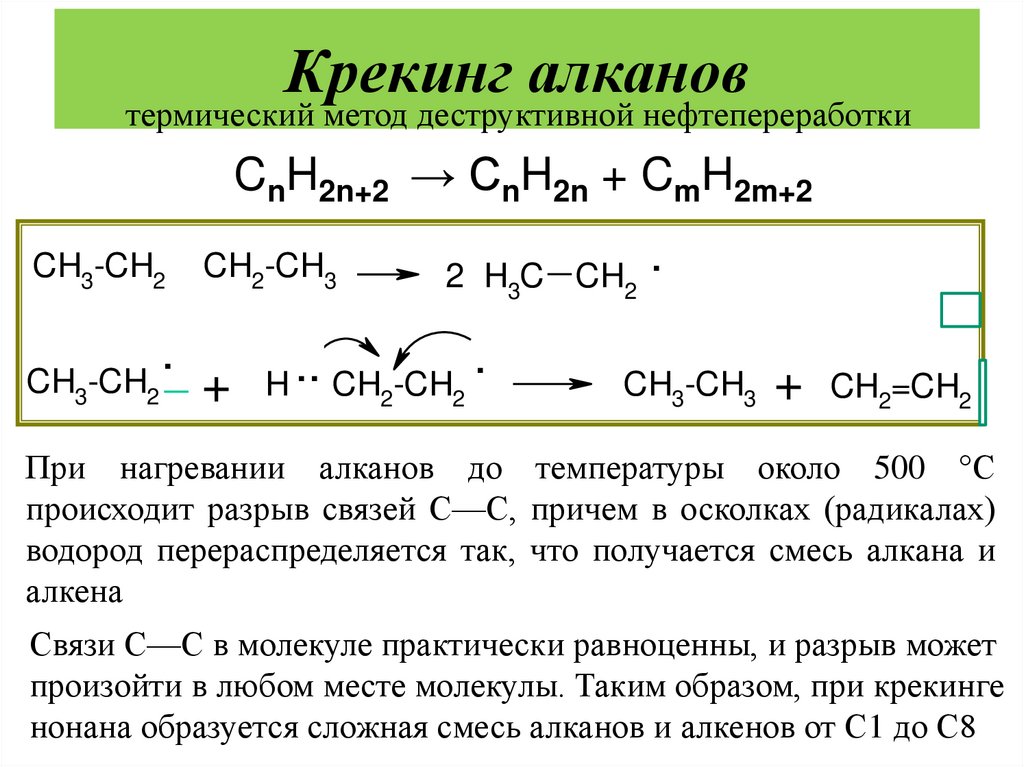
37. Крекинг алканов
термический метод деструктивной нефтепереработкиCnH2n+2 → CnH2n + CmH2m+2
CH3-CH2
CH3-CH2
.
CH2-CH3
2 H3C CH2 .
.
..
+ H CH2-CH2
CH3-CH3 + CH2=CH2
При нагревании алканов до температуры около 500 °С
происходит разрыв связей С—С, причем в осколках (радикалах)
водород перераспределяется так, что получается смесь алкана и
алкена
Связи С—С в молекуле практически равноценны, и разрыв может
произойти в любом месте молекулы. Таким образом, при крекинге
нонана образуется сложная смесь алканов и алкенов от С1 до С8
38.
Метод каталитического крекингаПри
каталитическом
крекинге
(на
алюмосиликатных
катализаторах) помимо превращения длинных углеводородов в
алканы и алкены с короткими цепями происходит изомеризация
углеродного скелета с образованием преимущественно
разветвленных молекул:
39. Окисление алканов
• Окислители, даже сильные, при обычныхтемпературах не действуют на предельные
углеводороды.
• При температуре выше 300оС предельные
углеводороды воспламеняются и сгорают с
образованием СО2 и Н2О.
Легче окисляются углеводороды, в молекулах которых имеется
третичный атом углерода.
При очень высоких температурах в промышленности
реализован процесс взаимодействия метана с водой:
40. Алкены
• Двойная связь состоит из σ-связи и π-связи. Более прочнойявляется σ-связь.
• Наиболее характерными для алкенов являются реакции
присоединения по двойной связи, сопровождающиеся
разрывом π-связи. Двойная связь представляет собой избыток
электронной плотности в молекуле алкена и к ней стремятся
присоединиться так называемые электрофилы («любящие»
электроны) .
• Электрофильные реагенты представляют собой катионные
частицы или частицы, имеющие частичный положительный
заряд. Реакция идет с разрывом двойной связи,
промежуточным образованием карбокатиона и последующим
присоединением противоиона.
41.
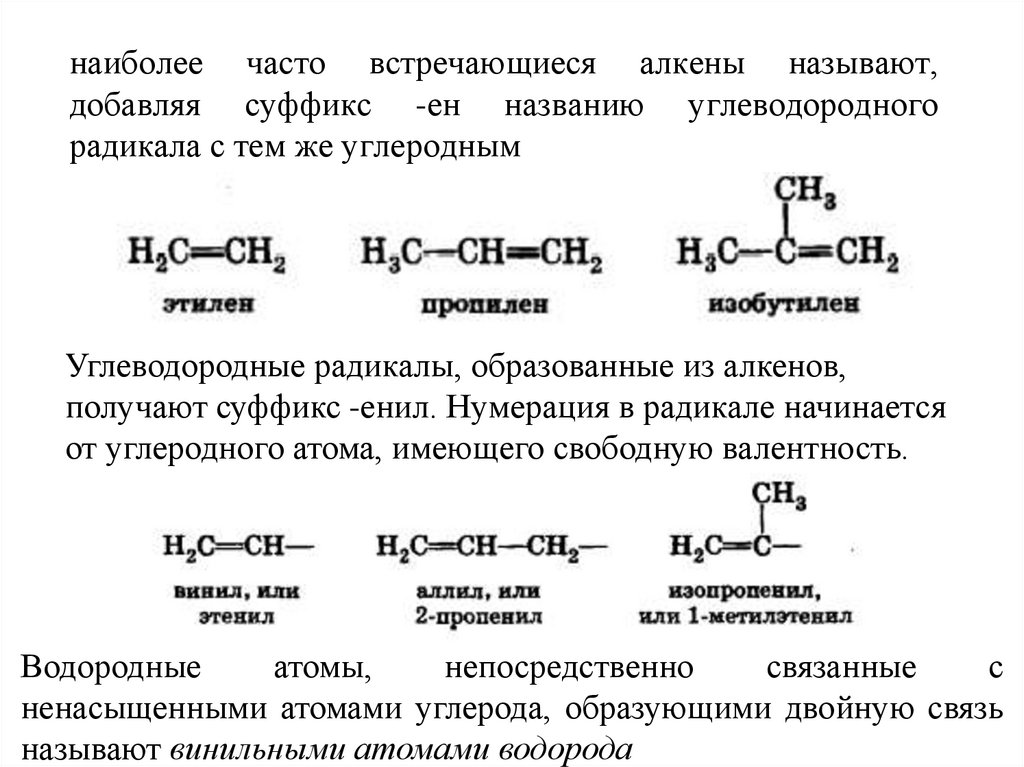
наиболее часто встречающиеся алкены называют,добавляя суффикс -ен названию углеводородного
радикала с тем же углеродным
Углеводородные радикалы, образованные из алкенов,
получают суффикс -енил. Нумерация в радикале начинается
от углеродного атома, имеющего свободную валентность.
Водородные
атомы,
непосредственно
связанные
с
ненасыщенными атомами углерода, образующими двойную связь
называют винильными атомами водорода
42.
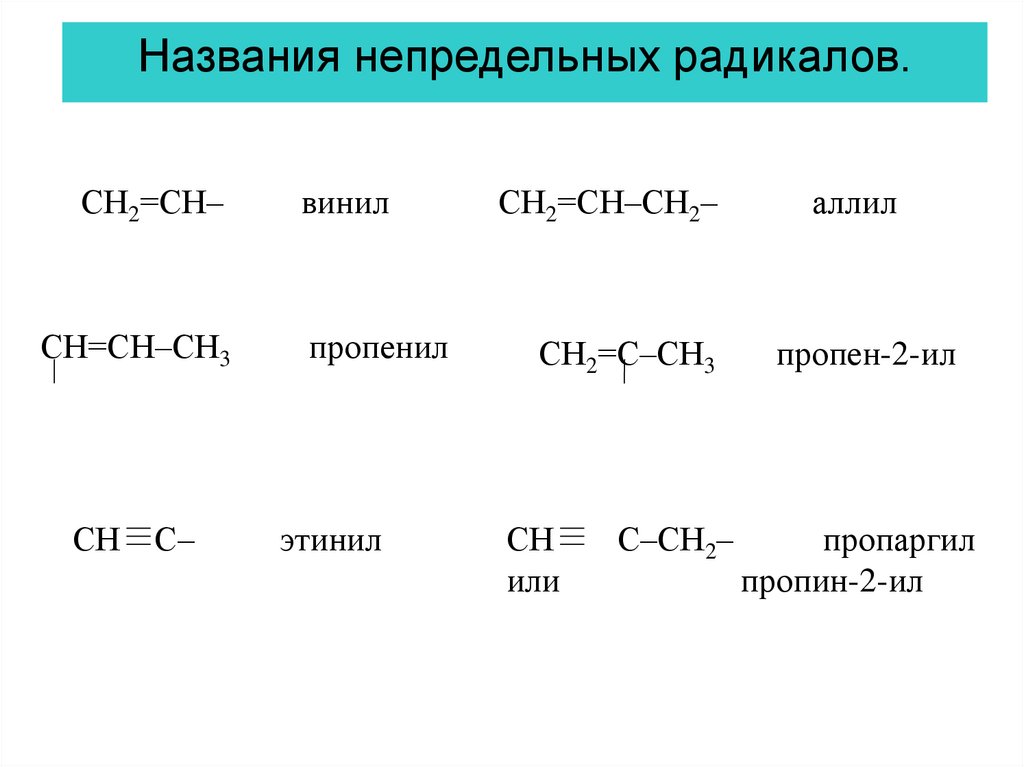
Названия непредельных радикалов.СН2=СН–
СН=СН–СН3
СН
С–
винил
пропенил
этинил
СН2=СН–СН2–
аллил
СН2=С–СН3
пропен-2-ил
СН
или
С–СН2–
пропаргил
пропин-2-ил
43.
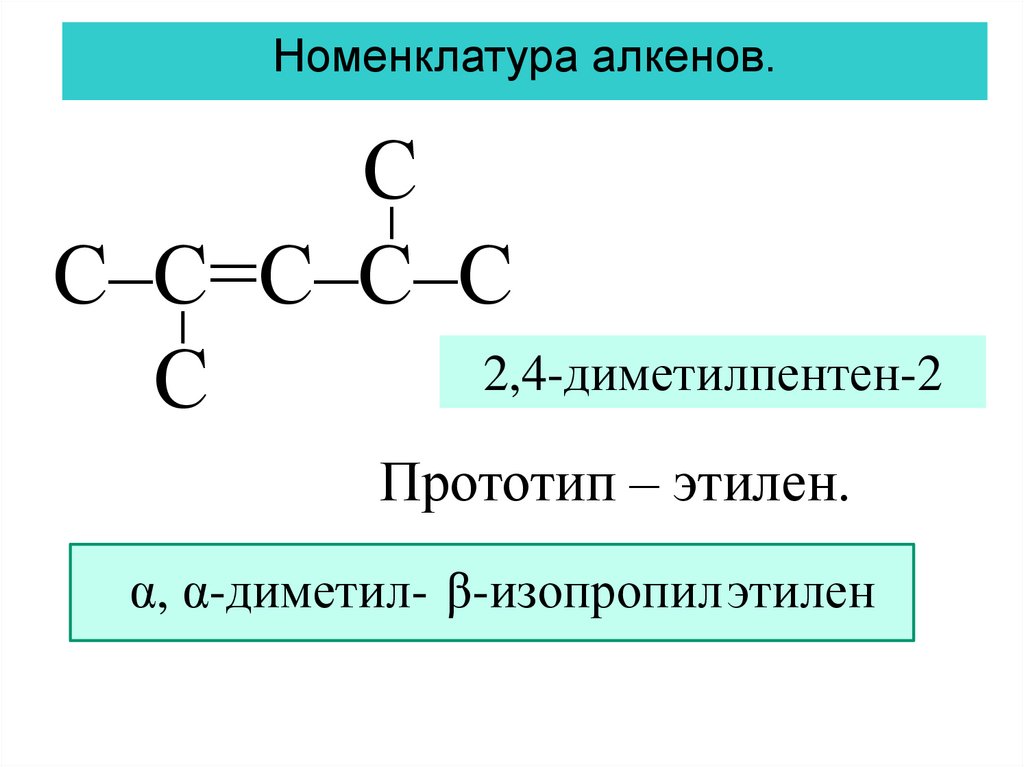
Номенклатура алкенов.С
С–С=С–С–С
2,4-диметилпентен-2
С
Прототип – этилен.
α, α-диметил- β-изопропилэтилен
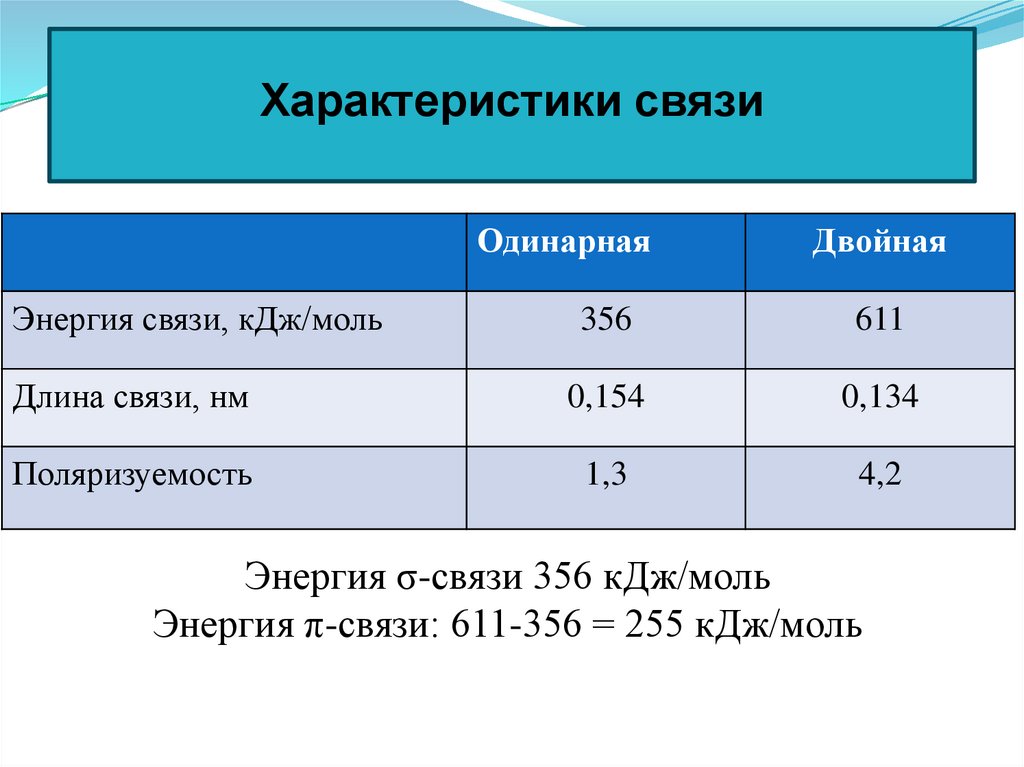
44. Характеристики связи
ОдинарнаяДвойная
Энергия связи, кДж/моль
356
611
Длина связи, нм
0,154
0,134
Поляризуемость
1,3
4,2
Энергия σ-связи 356 кДж/моль
Энергия π-связи: 611-356 = 255 кДж/моль
45. Получение алкенов
1. Основным промышленным источником получения первыхчетырех членов ряда алкенов являются газы крекинга и пиролиза
нефтепродуктов. Газы крекинга и пиролиза нефтепродуктов
содержат от 15 до 30 % олефинов. Так, крекинг бутана при 600 °С
приводит к смеси водорода, метана, этана и олефинов – этилена,
пропилена, псевдобутилена (бутена -2) с соотношением
олефинов ≈ 3,5 : 5 : 1,5 соответственно.
2. Значительные количества алкенов получают каталитической
дегидрогенизацией алканов при повышенной температуре
46.
3. В лабораторной практике наиболее распространеннымспособом
получения
алкенов
является
дегидратация
(отщепление
воды)
спиртов
при
нагревании
с
водоотнимающими средствами (концентрированная серная
кислота или пентаоксид фосфора) или при пропускании паров
спирта над катализатором (оксид алюминия)
Порядок дегидратации вторичных и третичных спиртов определяется
правилом Александра Михайловича Зайцева (1841-1910): при образовании
воды атом водорода отщепляется от наименее гидрогенизированного
соседнего атома углерода, то есть с наименьшим количеством водородных
атомов
47.
4. Реакция дегидрогалогенирования (отщепление галогеноводорода) изгалогенопроизводных при действии спиртового раствора щёлочи
5. Реакция дегалогенирования (отщепление двух атомов галогена от соседних
атомов углерода) при нагревании дигалогенидов с активными металлами
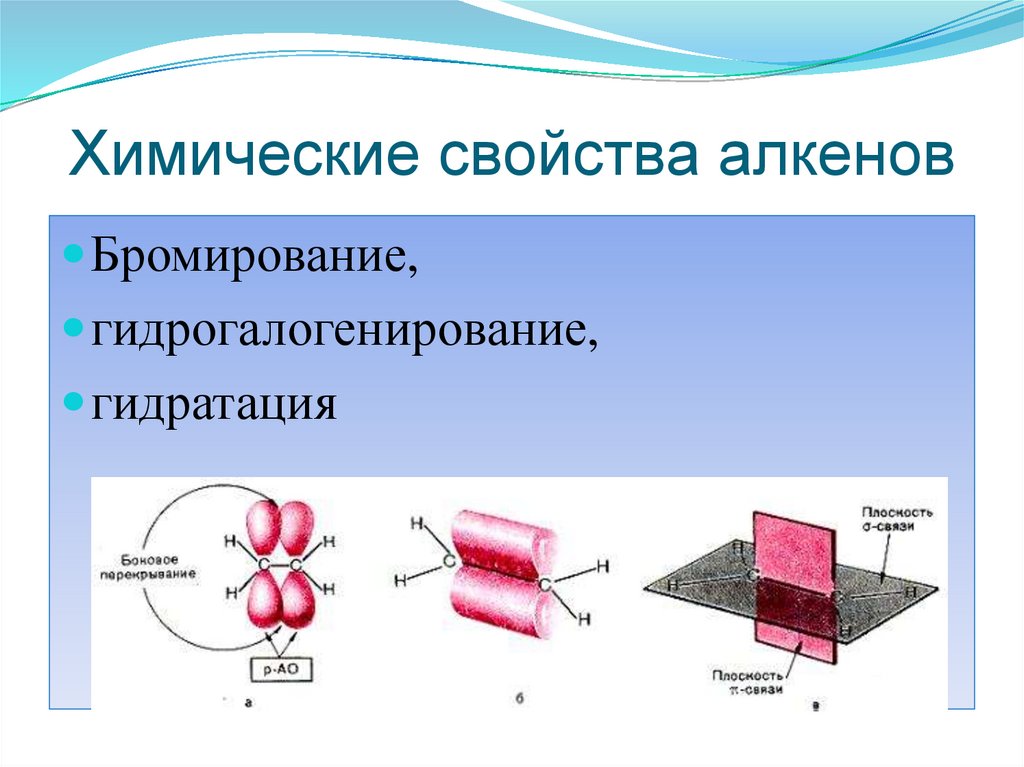
48. Химические свойства
Алкены ненасыщены, поэтому для ниххарактерны реакции присоединения
В качестве атакующей частицы может
быть электрофил (чаще всего) или
радикал
AdE
Алкены и алкины неустойчивы к действию многих реагентов:
окисляются сильными окислителями - перманганатом калия
KMnО4 и т.п., легко присоединяют бром (обесцвечивание
бромной воды), воду и другие реагенты.
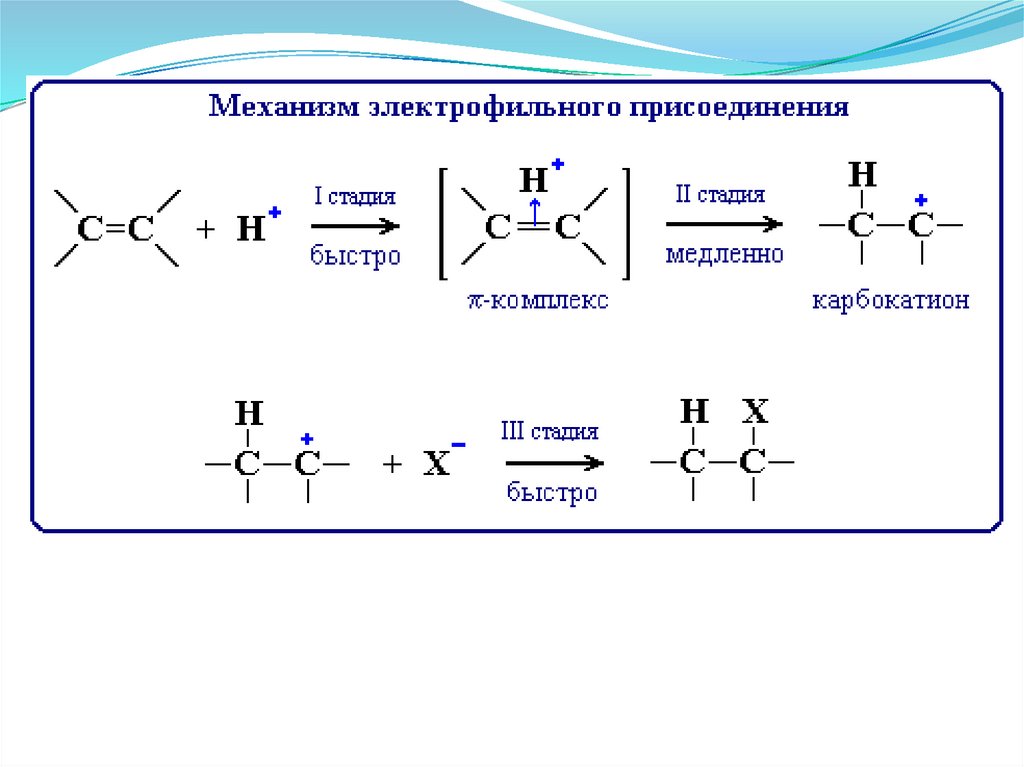
49. Химические свойства алкенов
Бромирование,гидрогалогенирование,
гидратация
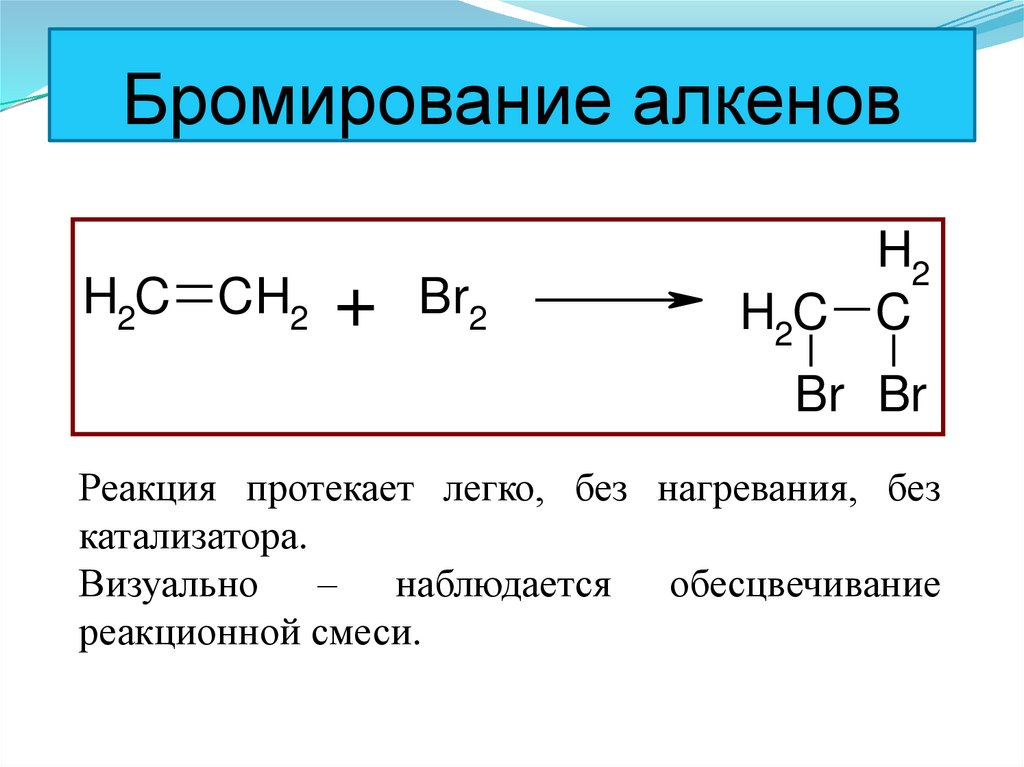
50. Бромирование алкенов
H2C CH2 + Br2H2
H2C C
Br Br
Реакция протекает легко, без нагревания, без
катализатора.
Визуально – наблюдается обесцвечивание
реакционной смеси.
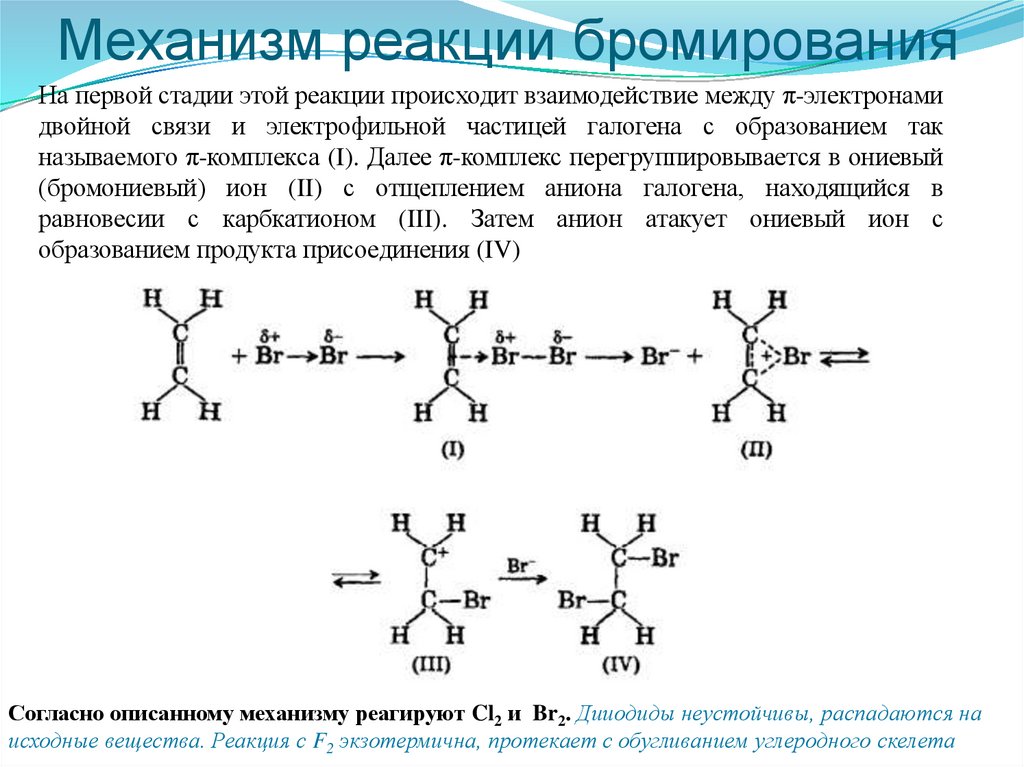
51.
Механизм реакции бромированияНа первой стадии этой реакции происходит взаимодействие между π-электронами
двойной связи и электрофильной частицей галогена с образованием так
называемого π-комплекса (I). Далее π-комплекс перегруппировывается в ониевый
(бромониевый) ион (II) с отщеплением аниона галогена, находящийся в
равновесии с карбкатионом (III). Затем анион атакует ониевый ион с
образованием продукта присоединения (IV)
Согласно описанному механизму реагируют Cl2 и Br2. Дииодиды неустойчивы, распадаются на
исходные вещества. Реакция с F2 экзотермична, протекает с обугливанием углеродного скелета
52.
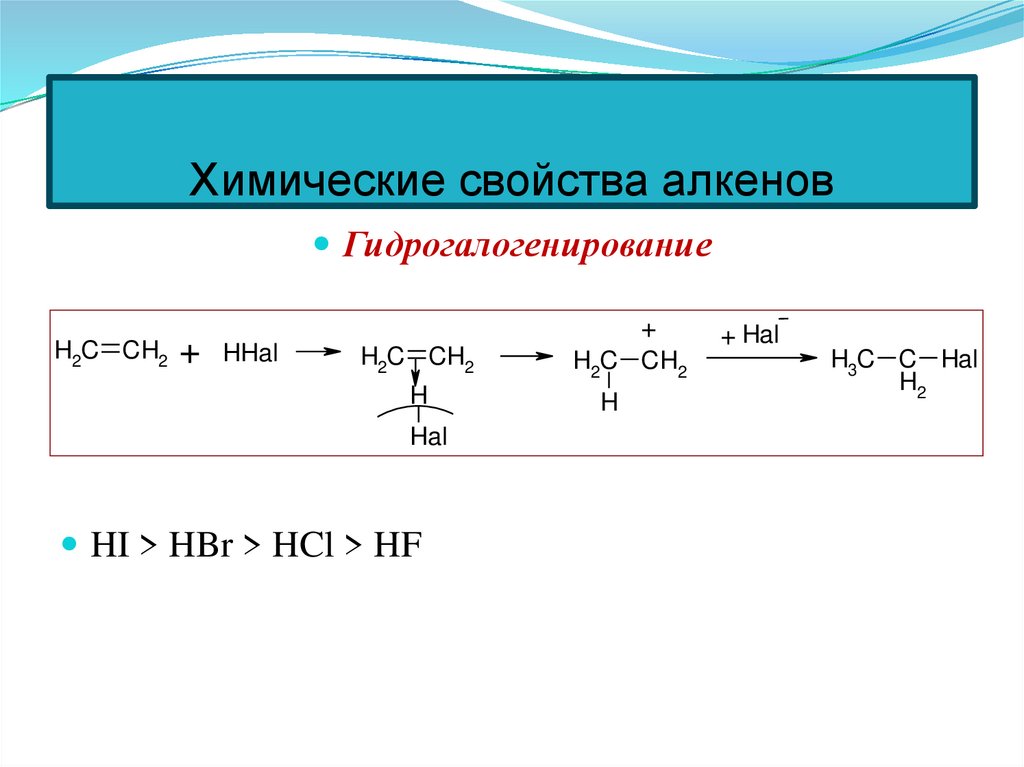
53. Химические свойства алкенов
ГидрогалогенированиеH2C CH2 + HHal
+
H2C CH2
H
Hal
HI > HBr > HCl > HF
H2C CH2
H
+ Hal
H3C C Hal
H2
54. Гидрогалогенирование
Правило Марковникова ( 1870):При присоединении соединений с подвижным атомом
водорода к алкенам несимметричного строения атом
водорода присоединяется к наиболее гидрированному
атому С по месту разрыва двойной связи.
Владимир Васильевич
Марковников (1837-1904)
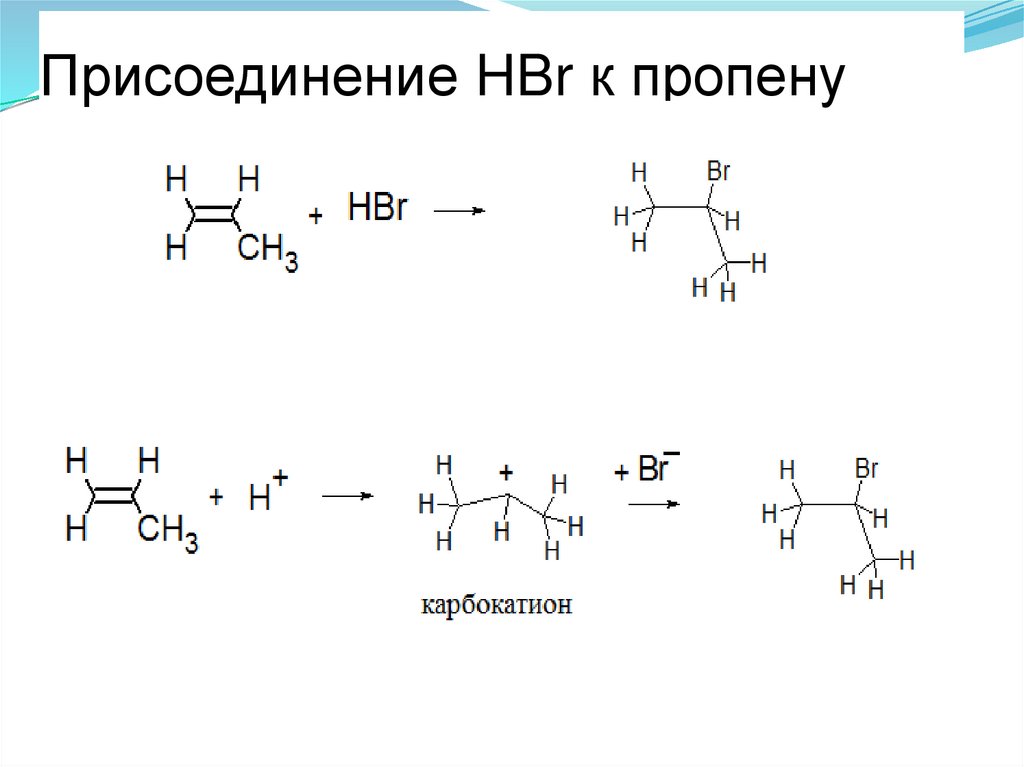
55. Присоединение HBr к пропену
56.
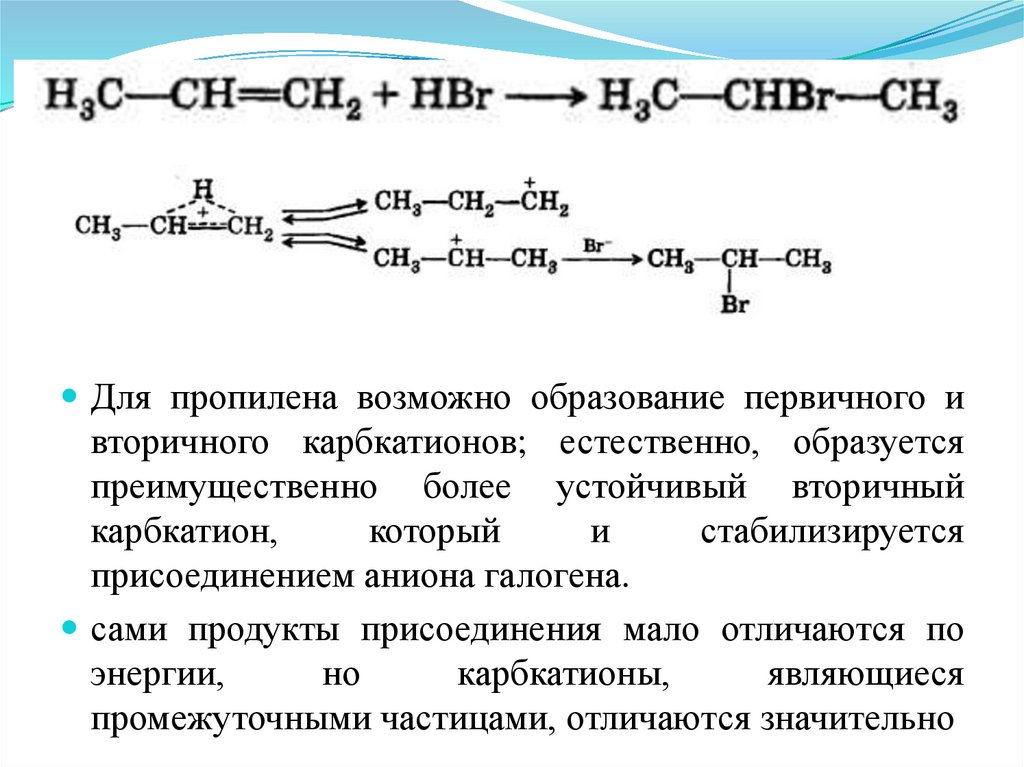
Для пропилена возможно образование первичного ивторичного карбкатионов; естественно, образуется
преимущественно более устойчивый вторичный
карбкатион,
который
и
стабилизируется
присоединением аниона галогена.
сами продукты присоединения мало отличаются по
энергии,
но
карбкатионы,
являющиеся
промежуточными частицами, отличаются значительно
57. Обоснование правила Марковникова
Статический фактор: распределение электроннойплотности в молекуле исходного алкена.
Динамический фактор: устойчивость промежуточных
частиц.
58.
59.
В присутствии перекисей бромоводород присоединяетсяправилу Марковникова:
не по
Эффект Хараша, перекисный эффект
Реакции радикального присоединения к алкенам
Присоединение HBr в свободнорадикальных
условиях:
CH3-CH=CH2
+ HBr
ROOR
CH3-CH2-CH2-Br
60. Механизм реакции радикального присоединения
Зарождение цепиHBr
H
+ Br
В присутствии перекисей реакция идет не по механизму
электрофильного присоединения, как выше, а по радикальному
механизму (Хараш). Первой стадией является атака перекисного
радикала на молекулу НВr.
Рост цепи Возникший радикал брома присоединяется к
пропилену c oбразованием нового радикалa:
.
CH3-CH=CH2 + Br
.
H3C
CH CH2Br
+ HBr
H3C
CH CH2Br
CH3-CH2-CH2-Br
+ Br
61.
направление процесса определяется устойчивостью радикаловбромпропана: образуется преимущественно более устойчивый,
приводя к 1-бромпропану.
62.
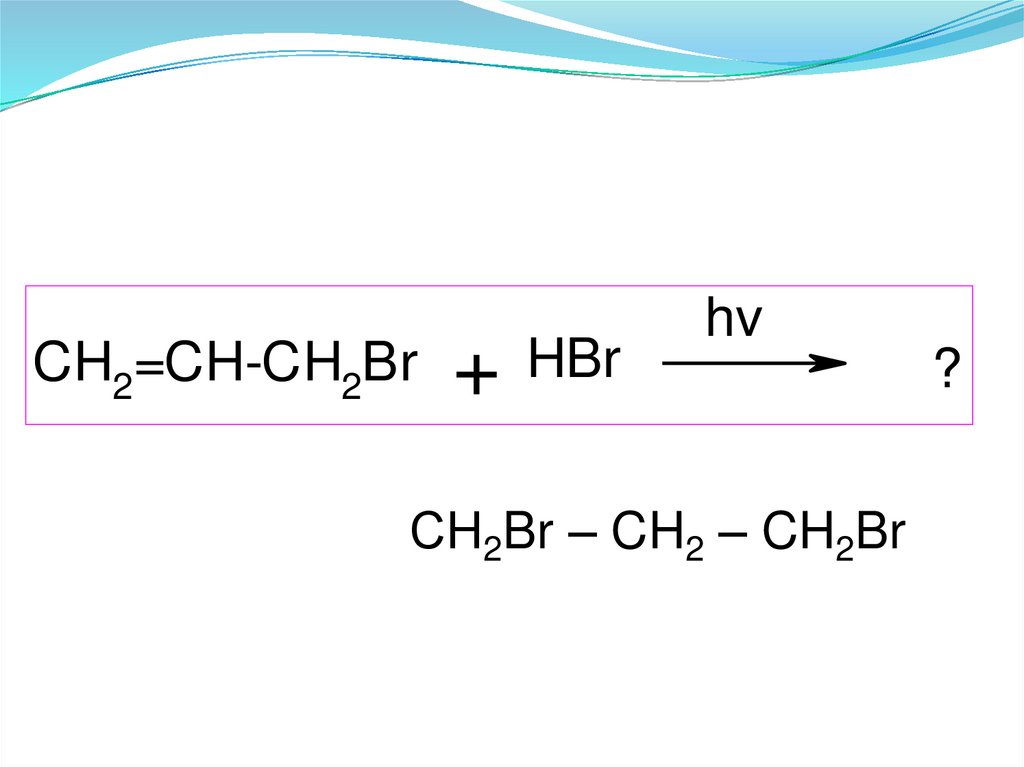
CH2=CH-CH2Br + HBrhv
СН2Br – CH2 – CH2Br
?
63. Гидратация алкенов
Присоединение воды по двойной связиКатализаторы – сильные минеральные кислоты
(например, серная кислота)
Продукты реакции - спирты
В присутствии кислот вода присоединяется по двойной связи
по правилу Марковникова
64. Другие реакции алкенов: окисление и восстановление
Окисление раствором перманганата калия:Мягкое окисление в нейтральной среде (по Вагнеру)
Более жесткое окисление в кислой среде.
65. Окисление этилена
при окислении алкенов разбавленным водным растворомперманганата калия образуются двухатомные спирты – гликоли
(реакция Евгения Евгеньевича Вагнера (1849-1903)). Реакция
протекает на холоде
C 2H 4
KMnO4
→
CH2OH–CH2OH
В ходе этой реакции происходит обесцвечивание фиолетовой окраски водного раствора
KMnO4. Поэтому она используется как качественная реакция на алкены.
3C2H4 + 2KMnO4+ 4H2O →3CH2OH–CH2OH + 2MnO2 + 2KOH
Евгений Евгеньевич Вагнер
(1849-1903)
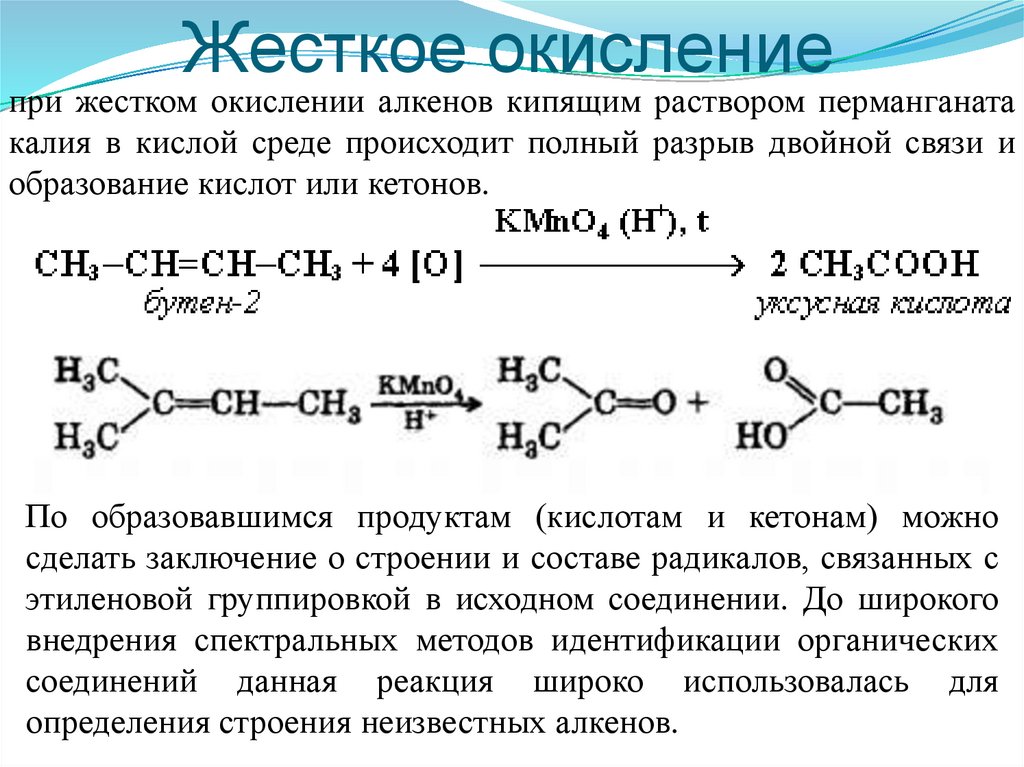
66. Жесткое окисление
при жестком окислении алкенов кипящим раствором перманганатакалия в кислой среде происходит полный разрыв двойной связи и
образование кислот или кетонов.
По образовавшимся продуктам (кислотам и кетонам) можно
сделать заключение о строении и составе радикалов, связанных с
этиленовой группировкой в исходном соединении. До широкого
внедрения спектральных методов идентификации органических
соединений данная реакция широко использовалась для
определения строения неизвестных алкенов.
67. Озонирование (р. Гарриеса)
Озонолиз — реакция, в которой полностью разрушаетсядвойная углерод-углеродная связь и молекула алкена
превращается в две меньшие молекулы. Алкены даже при
пониженных температурах легко окисляются озоном.
Реакция Гарриеса – обработка алкена озоном с
последующим
осторожным
разложением
образовавшегося
на
промежуточном
этапе
взрывчатого озонида водой в присутствии цинковой
пыли.
68. Восстановление алкенов
Присоединение водорода по изолированной двойнойуглерод-углеродной связи в присутствии благородных
металлов и никеля Ренея («скелетный никель» — твёрдый
микрокристаллический пористый никелевый катализатор),
обычно происходит легко при температуре 20–25°С и
давлении водорода 1–4 атм.
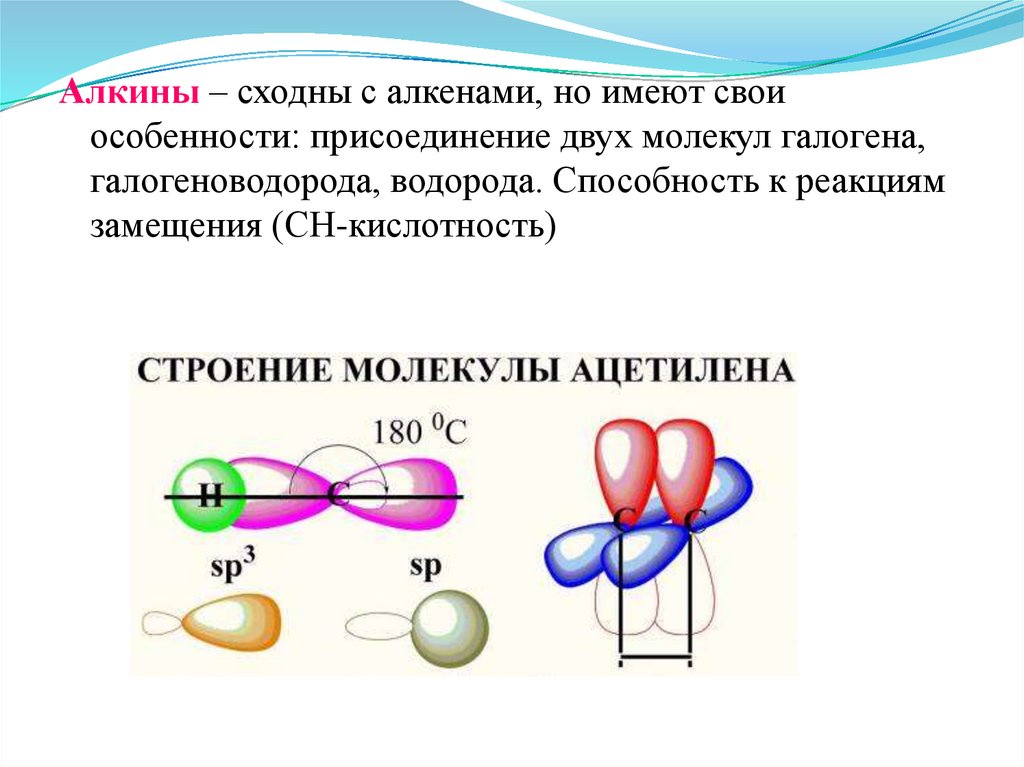
69.
Алкины – сходны с алкенами, но имеют своиособенности: присоединение двух молекул галогена,
галогеноводорода, водорода. Способность к реакциям
замещения (СН-кислотность)
70.
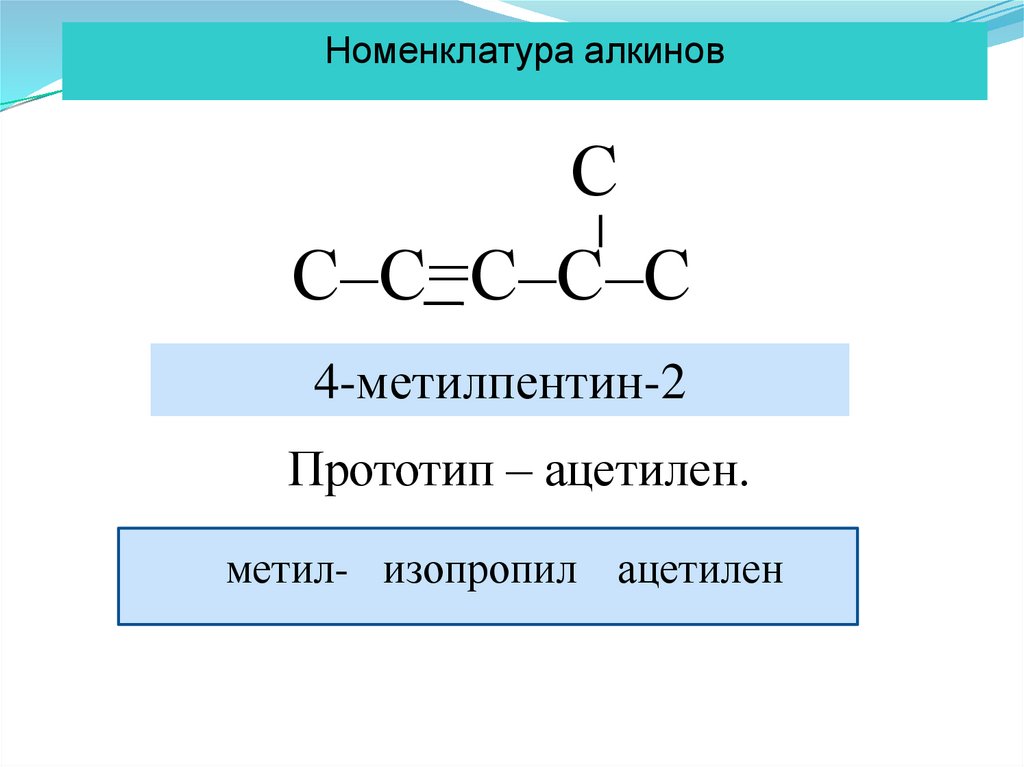
Номенклатура алкиновС
С–С=С–С–С
4-метилпентин-2
Прототип – ацетилен.
метил- изопропил ацетилен
71. Получение алкинов
Ацетиленможно получать непосредственно при
высокотемпературном крекинге (термическом или
электротермическом) метана или более сложных
углеводородов:
При гидролизе карбида кальция, который получают
взаимодействием при высоких температурах оксида кальция с
углеродом:
72.
Алкины можно получить из дигалогенопроизводныхпарафинов отщеплением галогеноводорода при
действии спиртового раствора щёлочи. Атомы
галогена при этом могут быть расположены как у
соседних атомов углерода, так и у одного углеродного
атома
В обычных условиях алкины С2–С3 – газы, С4–С16 –
жидкости, высшие алкины – твёрдые вещества.
73.
Так как энергия π-связи в алкенах равна 272 кДж/моль,то алкины
(247 кДж/моль) должны быть более
реакционноспособны в реакциях присоединения. Но
заметное укорачивание тройной связи (0,120 нм) по
сравнению с двойной (0,134 нм) приводит к заметному
уменьшению поляризуемости и, как следствие, к
понижению реакционной способности в отношении
электрофильных агентов (например, Hal2, HHal).
Присоединение нуклеофильных агентов, напротив,
протекает легче, чем к алкенам.
Однако у алкинов после присоединения первой молекулы
реагента остается еще одна π-связь (алкин превратился в
алкен), которая снова может вступить в реакцию
присоединения второй молекулы реагента
74. Химические свойства алкинов
Реакции электрофильного присоединения галогенов игалогеноводородов (по правилу Марковникова – обе
молекулы)
Реакция гидратации – по Кучерову, с образованием
карбонильных соединений
Реакции окисления – восстановления (подобны
алкенам)
СН-кислотные свойства
75. Реакции присоединения
Алкины похожи на алкены. Для них также наиболеехарактерными являются реакции электрофильного
присоединения.
Для несимметричных алкинов, как и для алкенов,
действует правило Марковникова. Существенным
отличием является меньшая реакционная способность
тройных связей по сравнению с двойными.
76. Примеры реакций присоединения
Гидрирование алкинов осуществляется при нагревании с теми жеметаллическими катализаторами (Ni, Pd или Pt), что и в случае
алкенов, но с меньшей скоростью
Галогенирование.
Алкины обесцвечивают бромную воду (качественная реакция
на тройную связь). Реакция галогенирования алкинов протекает
медленнее, чем алкенов
77. Реакция гидратации
Для гидратации алкинов необходим катализатор сочетание солей двухвалентной ртути и кислой среды.Реакция гидратации алкинов с использованием этого
катализатора называется реакцией Кучерова:
Михаил Григорьевич Кучеров
(1850-1911)
78. Гидратация гомологов ацетилена
Продуктами являются кетоны (присоединение НОН поправилу Марковникова)
Присоединение воды идет по правилу Марковникова,
образующийся при этом неустойчивый спирт с гидроксильной
группой при двойной связи (так называемый, енол) изомеризуется
в более стабильное карбонильное соединение – кетон
79. Полимеризация
Ацетиленовые углеводороды ввиду наличия тройной связи склонны креакциям полимеризации, которые могут протекать в нескольких
направлениях:
a) под воздействием комплексных солей меди происходит димеризация и
линейная тримеризация ацетилена;
б) наибольший интерес имеет тримеризация алкинов с образованием
ароматических углеводородов. При нагревании ацетилена в присутствии
активированного угля (реакция Николая Дмитриевича Зелинского (1861-1953))
осуществляется циклическая тримеризация с образованием бензола
Николай Дмитриевич Зелинский
(1861-1953)
80.
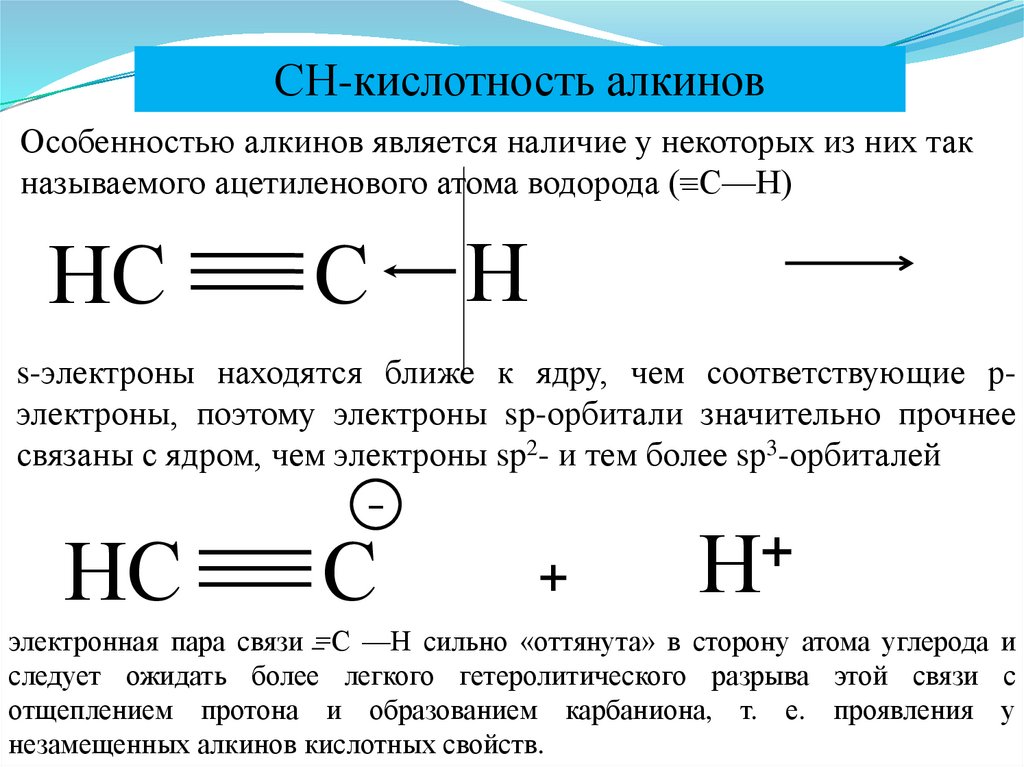
СН-кислотность алкиновОсобенностью алкинов является наличие у некоторых из них так
называемого ацетиленового атома водорода (=С—Н)
НС
С
Н
s-электроны находятся ближе к ядру, чем соответствующие рэлектроны, поэтому электроны sp-орбитали значительно прочнее
связаны с ядром, чем электроны sp2- и тем более sр3-орбиталей
–
НС
С
+
+
Н
электронная пара связи =С —Н сильно «оттянута» в сторону атома углерода и
следует ожидать более легкого гетеролитического разрыва этой связи с
отщеплением протона и образованием карбаниона, т. е. проявления у
незамещенных алкинов кислотных свойств.
81. Сила кислот
Поэтому для алкинов, имеющих ацетиленовый атом водорода,следует помимо реакций присоединения по тройной связи
ожидать и реакции замещения этого атома водорода на другие
группы.
Сила кислот
Константы кислотности некоторых соединений
Веществ
о
pKa
CH3COOH
4,8
HO-H
14
C2H5O
-H
HC≡C-H
16
22
NH2-H
36
H2C=CHH
36,5
CH3-H
40
Кислотные свойства: способность отдавать протон (Н+),
взаимодействие с активными металлами, с солями более
слабых кислот …
Это действительно происходит, хотя и в значительно меньшей
степени, чем для кислот обычного типа
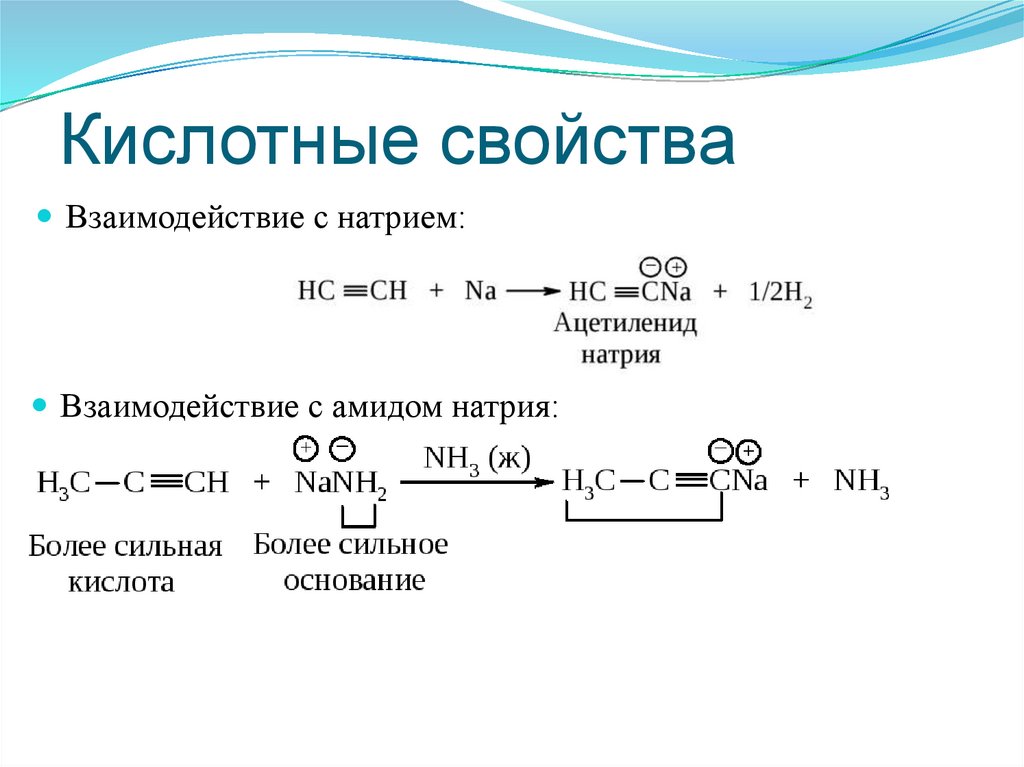
82. Кислотные свойства
Взаимодействие с натрием:Взаимодействие с амидом натрия:
83. Ацетилениды меди (I) и серебра (I)
Получают взаимодействием ацетилена и алкинов сконцевой тройной связью с аммиачным раствором
оксидов Аg+ и Cu+ .
Слабо желтая окраска
красного цвета
84. Алифатические углеводороды
Алканы – наиболее характерны реакции радикальногозамещения (SR)
Алкены – наиболее характерны реакции
электрофильного присоединения (AdE). Окисление и
восстановление, полимеризация.
Алкины – в основном сходны с алкенами.
Отличия – реакция гидратации, СН-кислотные свойства.
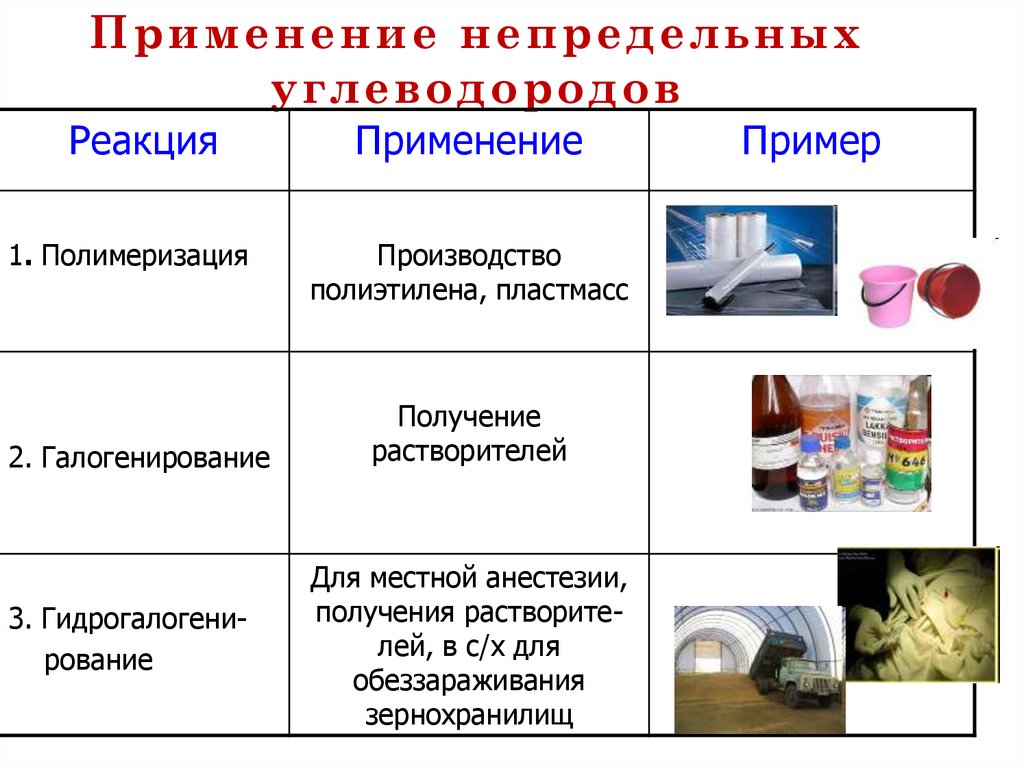
85. Применение непредельных углеводородов
РеакцияПрименение
1. Полимеризация
Производство
полиэтилена, пластмасс
2. Галогенирование
3. Гидрогалогенирование
Получение
растворителей
Для местной анестезии,
получения растворителей, в с/х для
обеззараживания
зернохранилищ
Пример
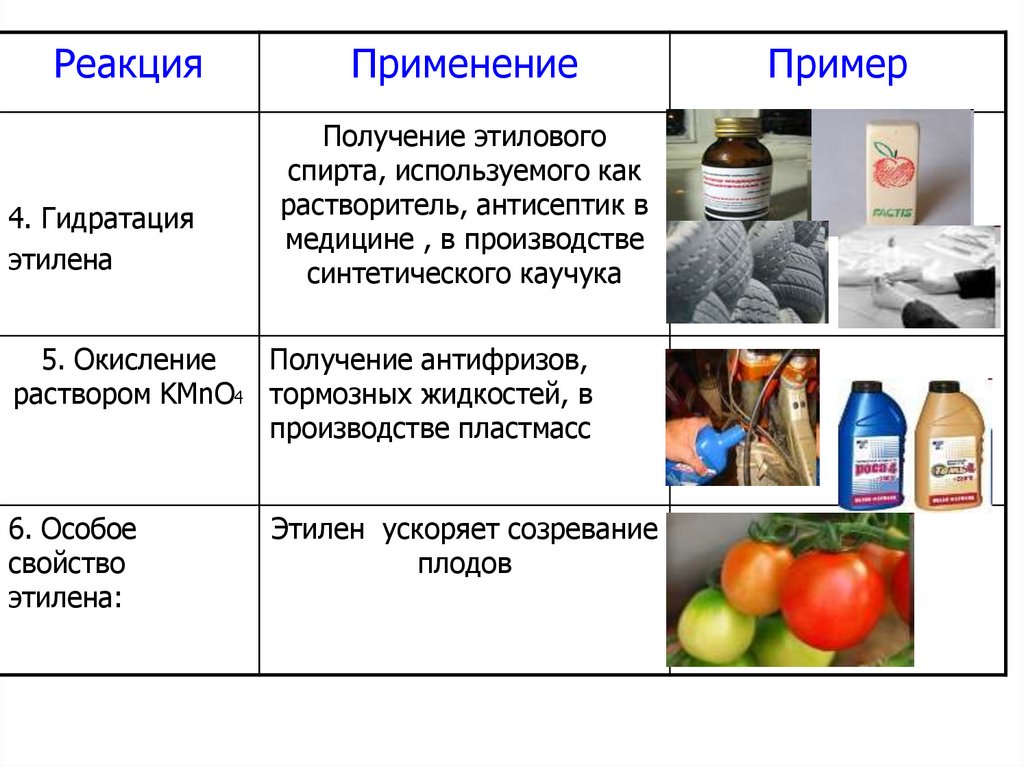
86.
Реакция4. Гидратация
этилена
Применение
Получение этилового
спирта, используемого как
растворитель, антисептик в
медицине , в производстве
синтетического каучука
5. Окисление
Получение антифризов,
раствором KMnO4 тормозных жидкостей, в
производстве пластмасс
6. Особое
свойство
этилена:
Этилен ускоряет созревание
плодов
Пример























































 chemistry
chemistry








