Similar presentations:
!!!галогенпроизводные
1. РЕАКЦИОННАЯ СПОСОБНОСТЬ ГАЛОГЕНОПРОИЗВОДНЫХ УГЛЕВОДОРОДОВ
12. Галогенопроизводные углеводородов - органические соединения, образующиеся при замещении водорода в углеводородах на атомы
галогенов(фтора, хлора, брома или йода)
2
3. Строение и классификация
Классифицироватьгалогенопроизводные можно
несколькими способами:
• В соответствии с общей
классификацией углеводородов:
алифатические, алициклические,
ароматические, предельные или
непредельные
галогенопроизводные
3
4. Строение и классификация
• В зависимости от числа атомовводорода, замещенных
галогеном, различают моно-, ди-,
тригалогенпроизводные и т.д.
CH3 Cl
метилхлорид
CH2 Cl2
метиленхлорид
CH Cl3
C Cl4
тетрахлорид
хлороформ углерода
4
5. Строение и классификация
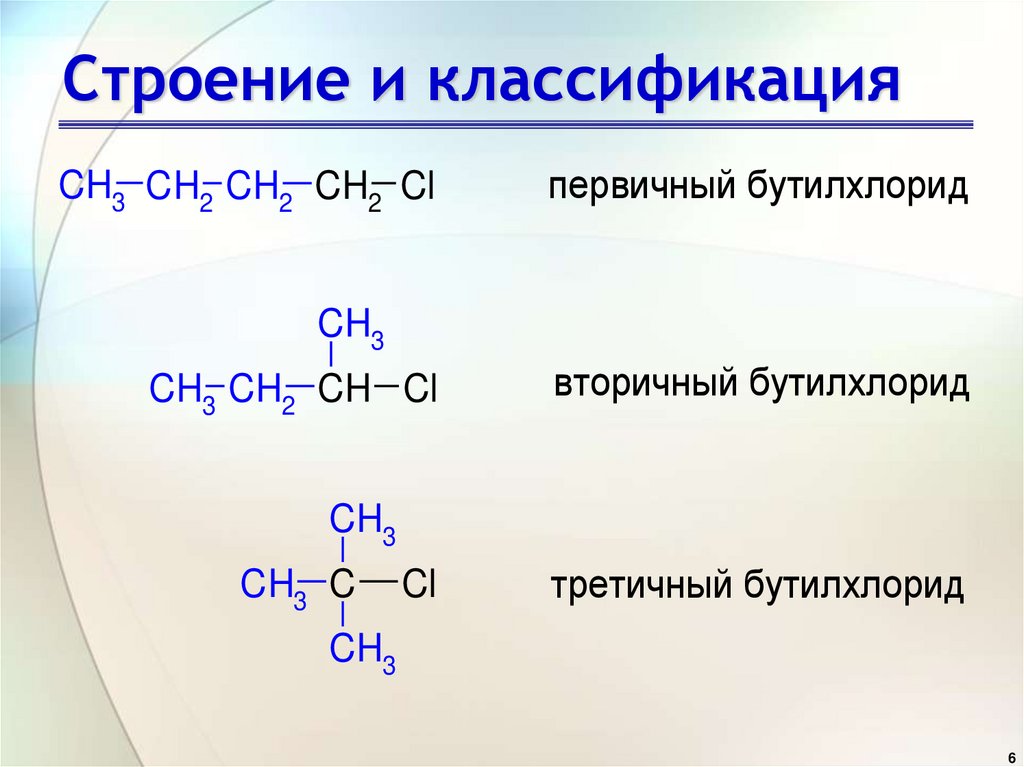
• По типу атома углерода, ккоторому присоединен атом
галогена: первичные,
вторичные, третичные
галогенопроизводные
5
6. Строение и классификация
CH3 CH2 CH2 CH2 Clпeрвичный бутилхлорид
CH3
CH3 CH2 CH Cl
вторичный бутилхлорид
CH3
CH3 C
Cl
трeтичный бутилхлорид
CH3
6
7. Строение и классификация
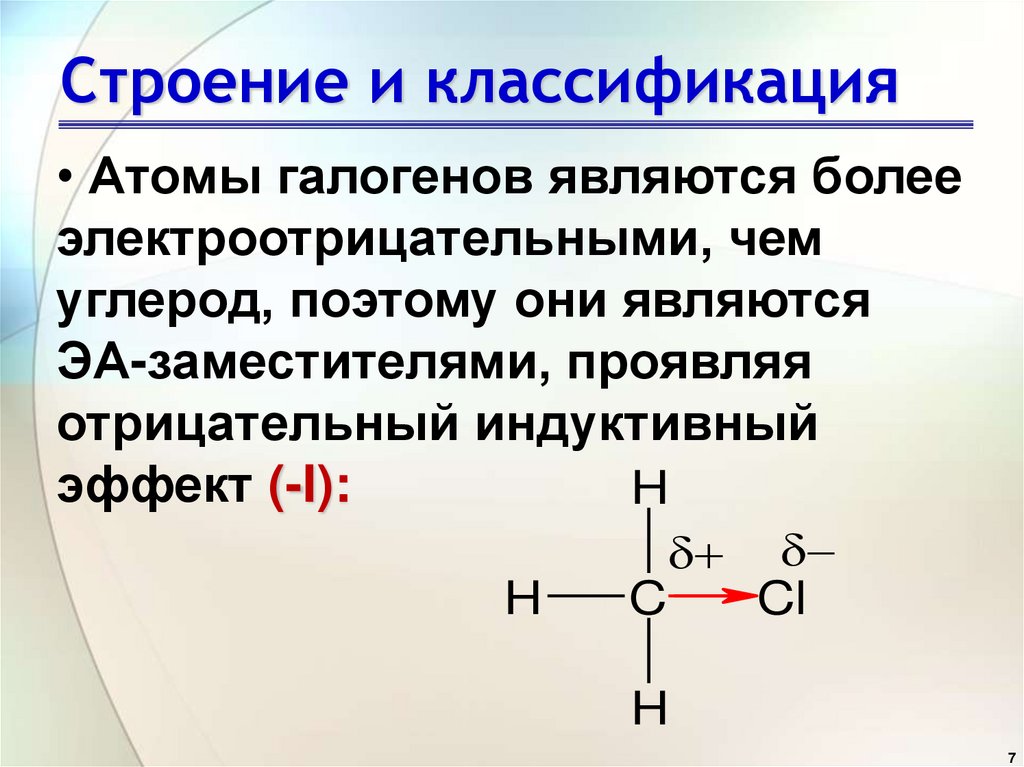
• Атомы галогенов являются болееэлектроотрицательными, чем
углерод, поэтому они являются
ЭА-заместителями, проявляя
отрицательный индуктивный
эффект (-I):
H
H
C
Cl
H
7
8. Строение и классификация
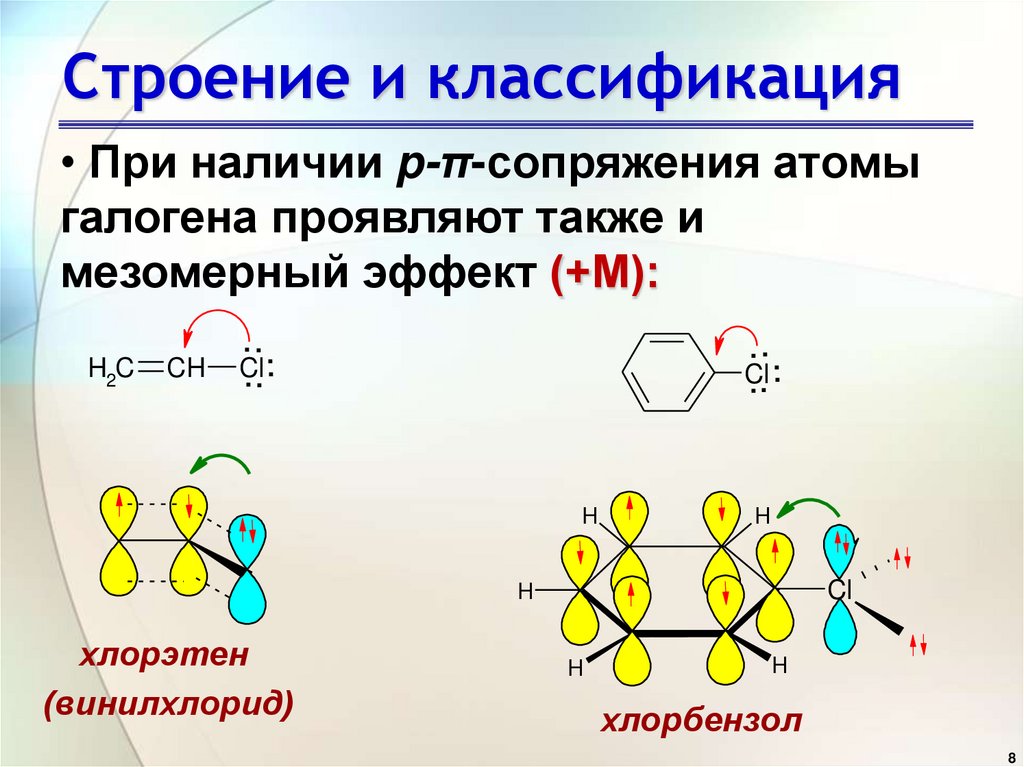
• При наличии p-π-сопряжения атомыгалогена проявляют также и
мезомерный эффект (+М):
H2C
CH
...
Cl
...
...
Cl
.. .
H
H
.
Cl
H
хлорэтен
(винилхлорид)
H
H
хлорбензол
8
9. Строение и классификация
• Таким образом, атомы галогеновпроявляют –I-эффект, и +M-эффект,
причем индуктивный эффект в
данном случае более выражен, чем
мезомерный –I > +M,
поэтому атомы галогена всегда
являются электроноакцепторными
заместителями
9
10. Номенклатура
• По номенклатуре ИЮПАКположение и название галогена
указывается в приставке
• Нумерация начинается с того
конца молекулы, к которому ближе
расположен атом галогена
10
11. Номенклатура
• Если присутствует двойная илитройная связь, то именно она
определяет начало нумерации,
а не атом галогена:
4
3
2
1
CH3 CH CH2 CH2 Cl
CH3
1
H2C
2
3
CH CH2 Br
3-бромпропен
3-метил-1-хлорбутан
11
12. Номенклатура
• При использовании радикальнофункциональной номенклатурыназвание галогенопроизводных
строится следующим образом:
углеводородный радикал + галогенид
CH3 CH2 Cl
CH3 CH2 CH2 CH2 Br
этилхлорид
бутилбромид
винилхлорид
(хлорэтан)
(1-бромбутан)
(хлорэтен)
H2C
CH Cl
12
13. Номенклатура
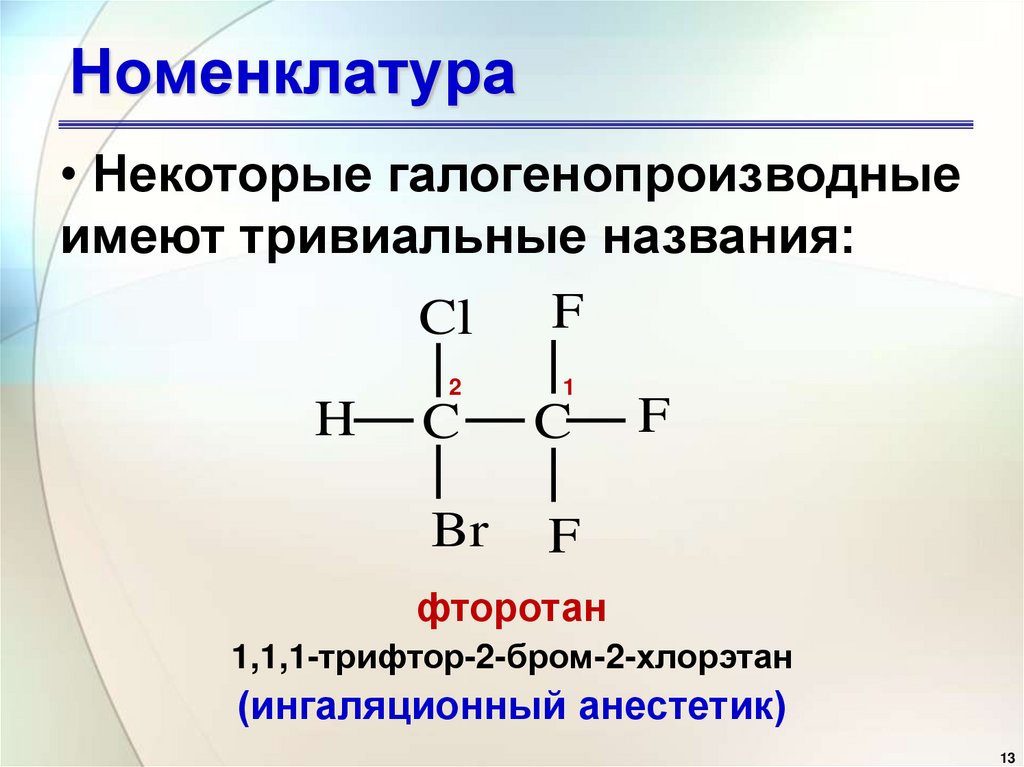
• Некоторые галогенопроизводныеимеют тривиальные названия:
F
Cl
H
2
1
C
C
Br
F
F
фторотан
1,1,1-трифтор-2-бром-2-хлорэтан
(ингаляционный анестетик)
13
14. Номенклатура
• Тригалогенметаны называютгалоформами:
CHCl3
хлороформ
CHBr3
CHI3
бромоформ
йодоформ
14
15. Изомерия галогенопроизводных
Структурная изомерия• Изомерия положения заместителей:
CH3 CH2 CH2 CH2
Br
1-бромбутан
CH3 CH2 CH CH3
Br
2-бромбутан
15
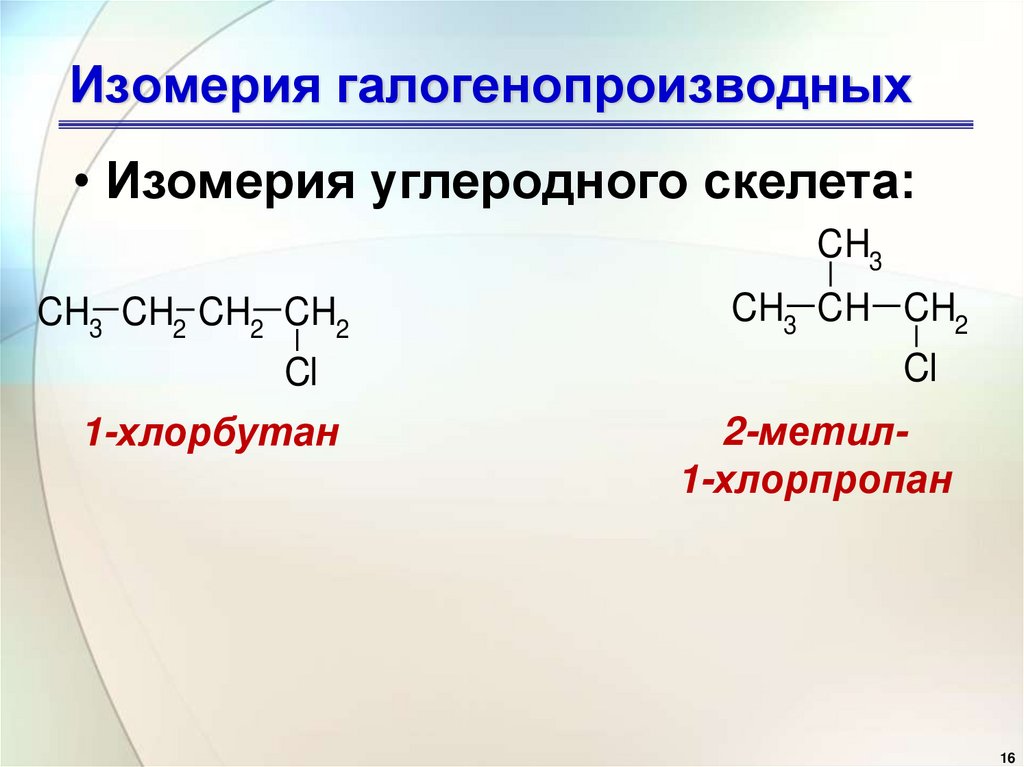
16. Изомерия галогенопроизводных
• Изомерия углеродного скелета:CH3
CH3 CH2 CH2 CH2
CH3 CH CH2
Cl
Cl
1-хлорбутан
2-метил1-хлорпропан
16
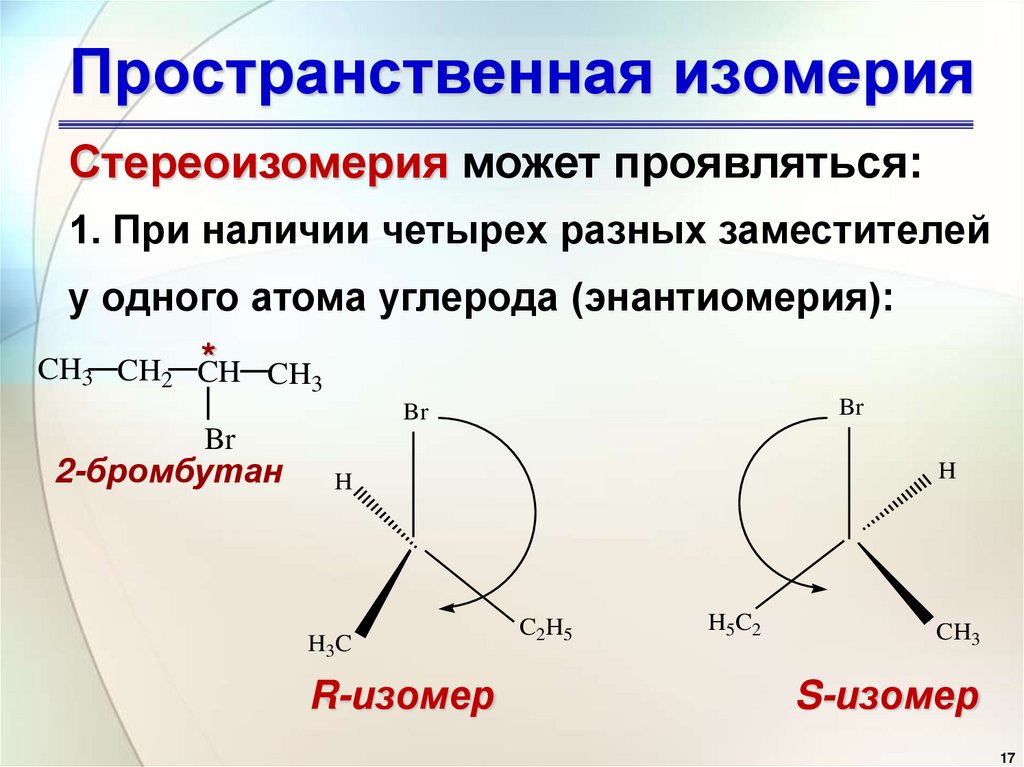
17. Пространственная изомерия
Стереоизомерия может проявляться:1. При наличии четырех разных заместителей
у одного атома углерода (энантиомерия):
* CH3
CH3 CH2 CH
Br
Br
Br
2-бромбутан
H
H
H3C
R-изомер
C2H5
H5C2
CH3
S-изомер
17
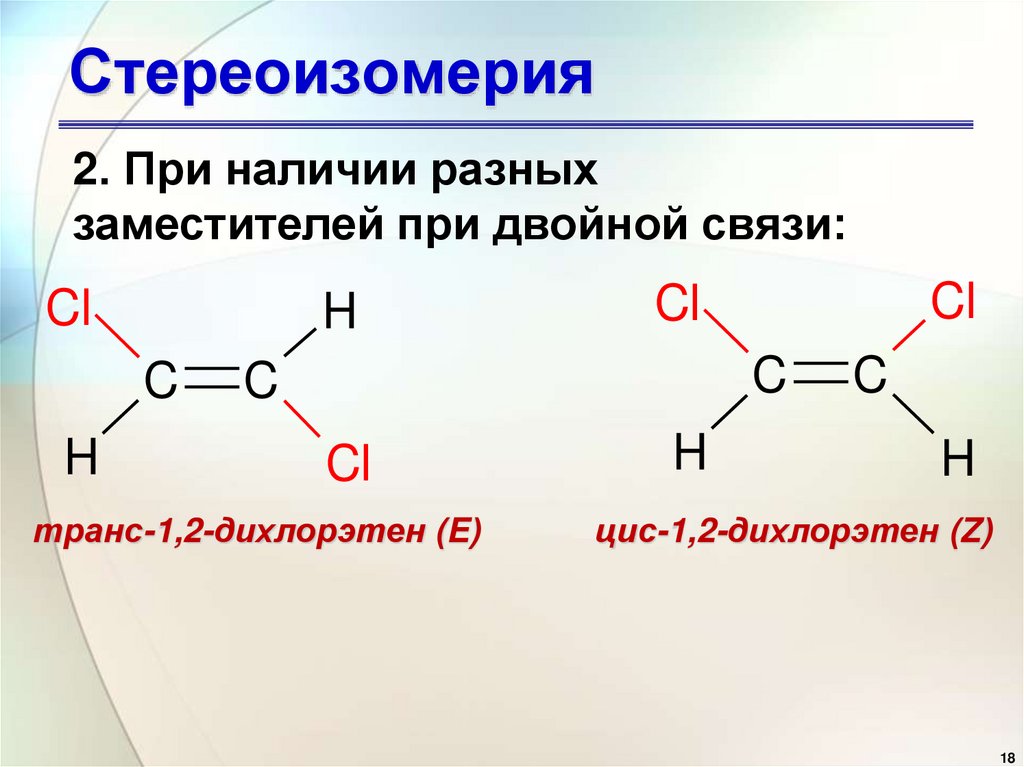
18. Стереоизомерия
2. При наличии разныхзаместителей при двойной связи:
Cl
H
C
H
Cl
Cl
C
C
Cl
транс-1,2-дихлорэтен (E)
H
C
H
цис-1,2-дихлорэтен (Z)
18
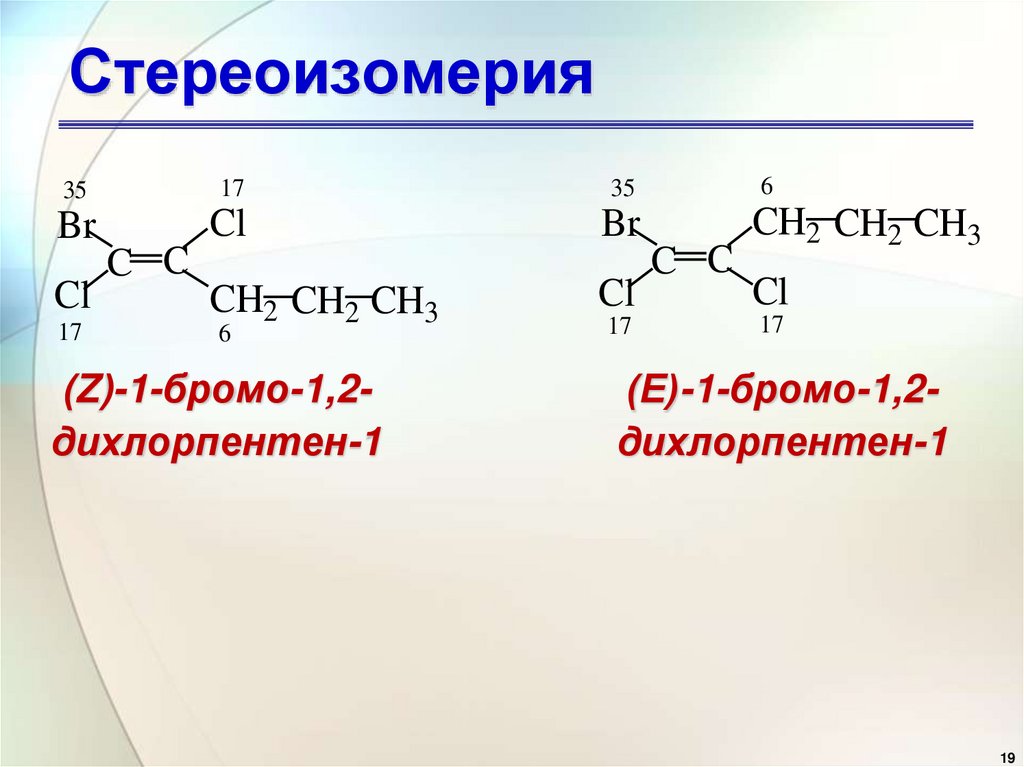
19. Стереоизомерия
3517
35
6
Br
Cl
Br
CH2 CH2 CH3
CH2 CH2 CH3
Cl
Cl
17
C C
6
(Z)-1-бромо-1,2дихлорпентен-1
17
C C
Cl
17
(Е)-1-бромо-1,2дихлорпентен-1
19
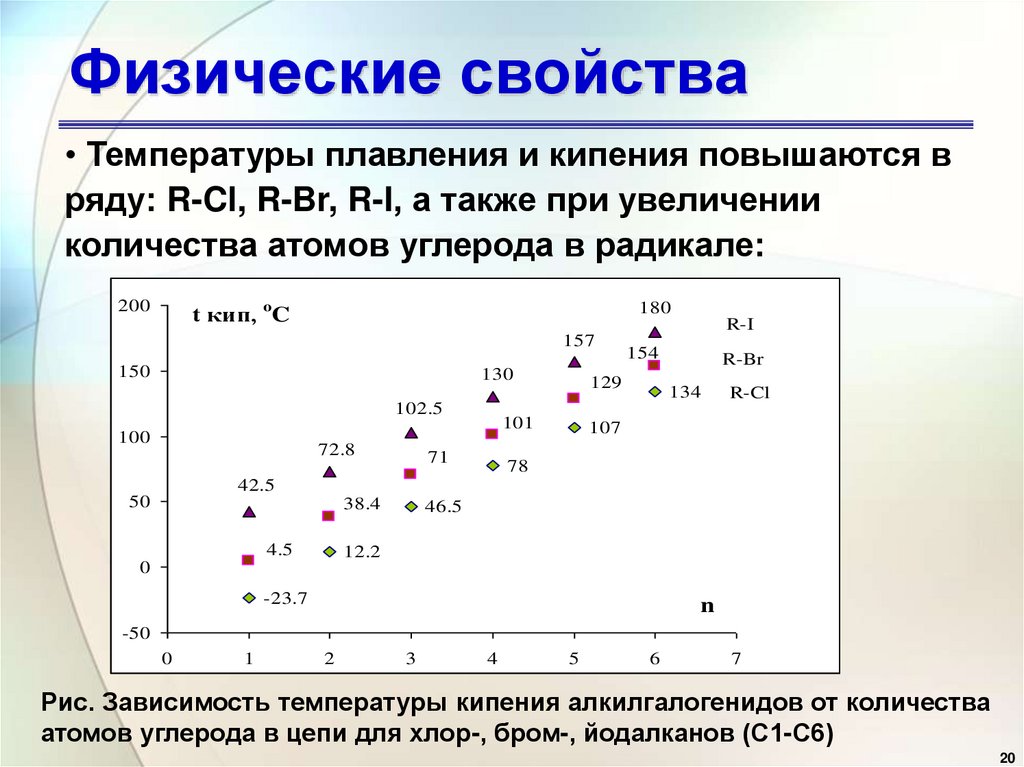
20. Физические свойства
• Температуры плавления и кипения повышаются вряду: R-Cl, R-Br, R-I, а также при увеличении
количества атомов углерода в радикале:
200
180
t кип, oC
R-I
157
150
130
102.5
100
72.8
129
101
71
154
R-Br
134
R-Cl
107
78
42.5
50
38.4
4.5
46.5
12.2
0
-23.7
n
-50
0
1
2
3
4
5
6
7
Рис. Зависимость температуры кипения алкилгалогенидов от количества
атомов углерода в цепи для хлор-, бром-, йодалканов (С1-С6)
20
21. Физические свойства
• Низшие алкилгалогениды –газообразные вещества (с характерным
запахом), средние – жидкости, высшие
(начиная с C17) – твердые тела
• Относительная плотность
галогензамещенных повышается с
увеличением атомной массы галогена,
входящего в состав молекулы
21
22. Физические свойства
• Относительная плотностьгалогензамещенных понижается, а
температура кипения повышается с
увеличением длины углеродной цепи
молекулы
• Алкилгалогениды почти нерастворимы
в воде и хорошо растворимы в
неполярных гидрофобных
растворителях
22
23. Физические свойства
• Многие галогенопроизводныеиспользуются как хорошие
растворители
• Хлористый метилен (CH2Cl2),
хлороформ (CHCl3),
четыреххлористый углерод (CCl4)
используются для растворения масел,
жиров, эфирных масел
23
24. Биологические свойства
• Галогенопроизводные алканов, какправило, обладают характерным
сладковатым запахом и выраженным
наркотическим эффектом. Так, раньше
очень широко использовался для
ингаляционного наркоза хлороформ. В
настоящее время для этой цели
используется фторотан – 1,1,1трифтор-2-бром-2-хлорэтан
24
25. Биологические свойства
• Многие галогенопроизводныеочень ядовиты
(крайне токсичен
четыреххлористый углерод CCl4)
25
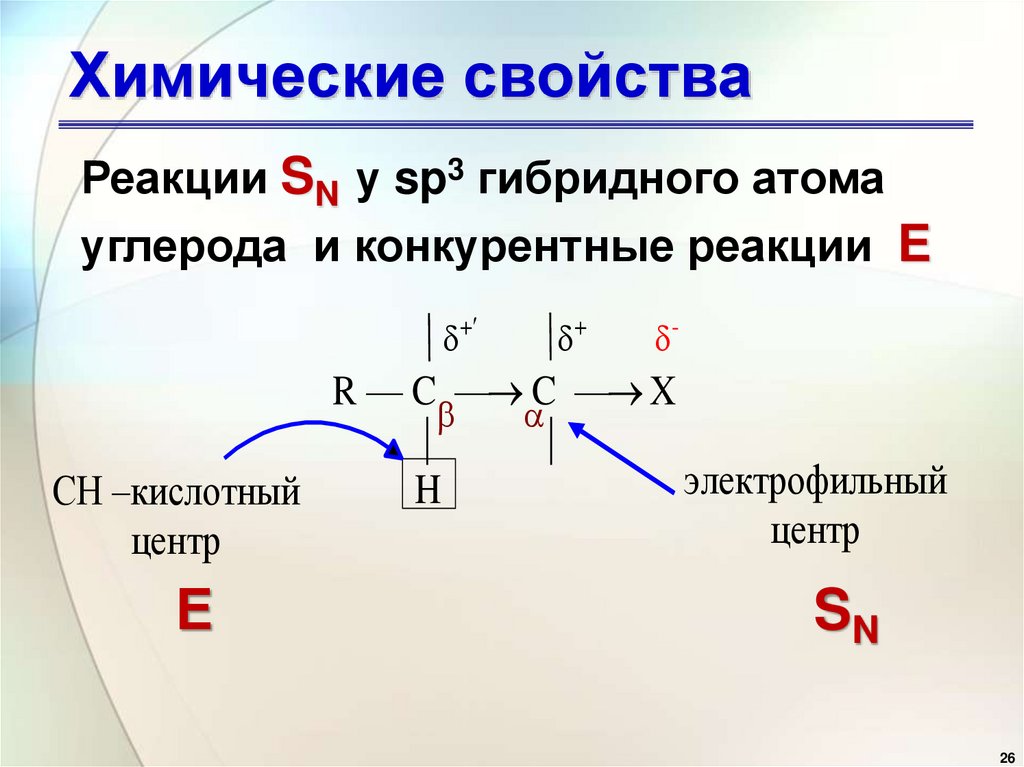
26. Химические свойства
Реакции SN у sp3 гибридного атомауглерода и конкурентные реакции E
+
+
-
R — C — C — X
СH –кислотный
центр
Е
H
электрофильный
центр
SN
26
27. Химические свойства
Реакции нуклеофильного замещения• Атомы галогенов довольно
подвижны и могут замещаться под
действием разнообразных
нуклеофилов, что используется
для синтеза разнообразных
производных
27
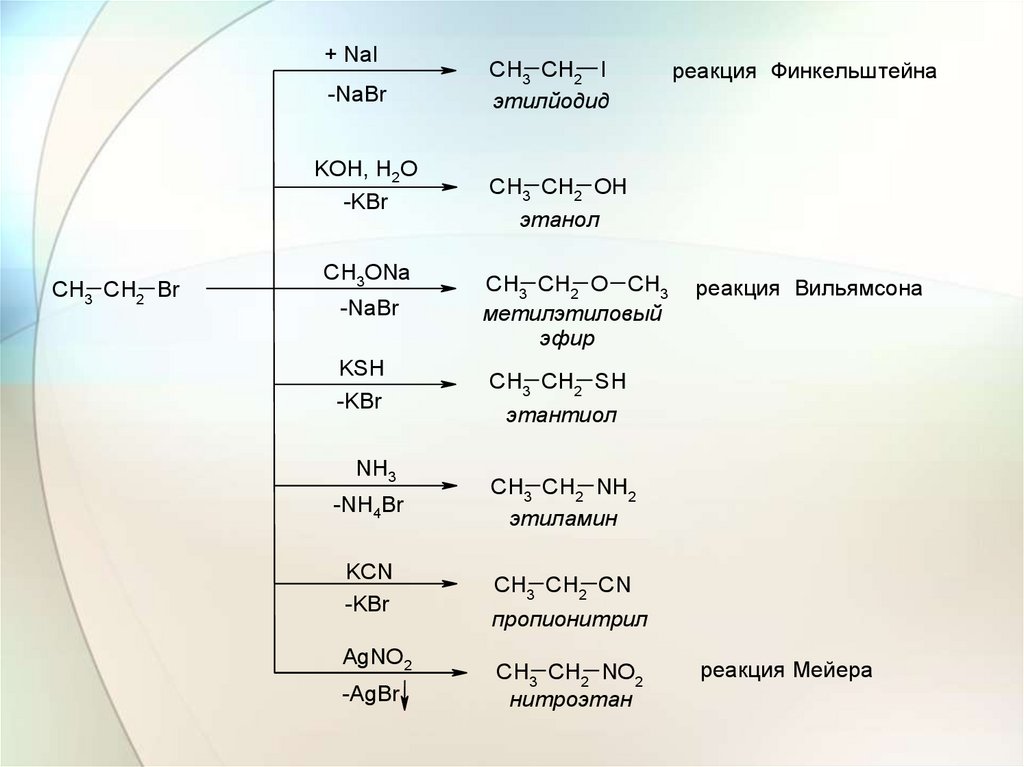
28.
+ NaICH3 CH2 Br
-NaBr
CH3 CH2 I
этилйодид
KOH, H2O
-KBr
CH3 CH2 OH
CH3ONa
этанол
-NaBr
CH3 CH2 O CH3
мeтилэтиловый
эфир
KSH
-KBr
CH3 CH2 SH
NH3
-NH4Br
KCN
-KBr
CH3 CH2 CN
-AgBr
рeакция Вильямсона
этантиол
CH3 CH2 NH2
этиламин
AgNO2
рeакция Финкeльштeйна
пропионитрил
CH3 CH2 NO2
нитроэтан
рeакция Мeйeра
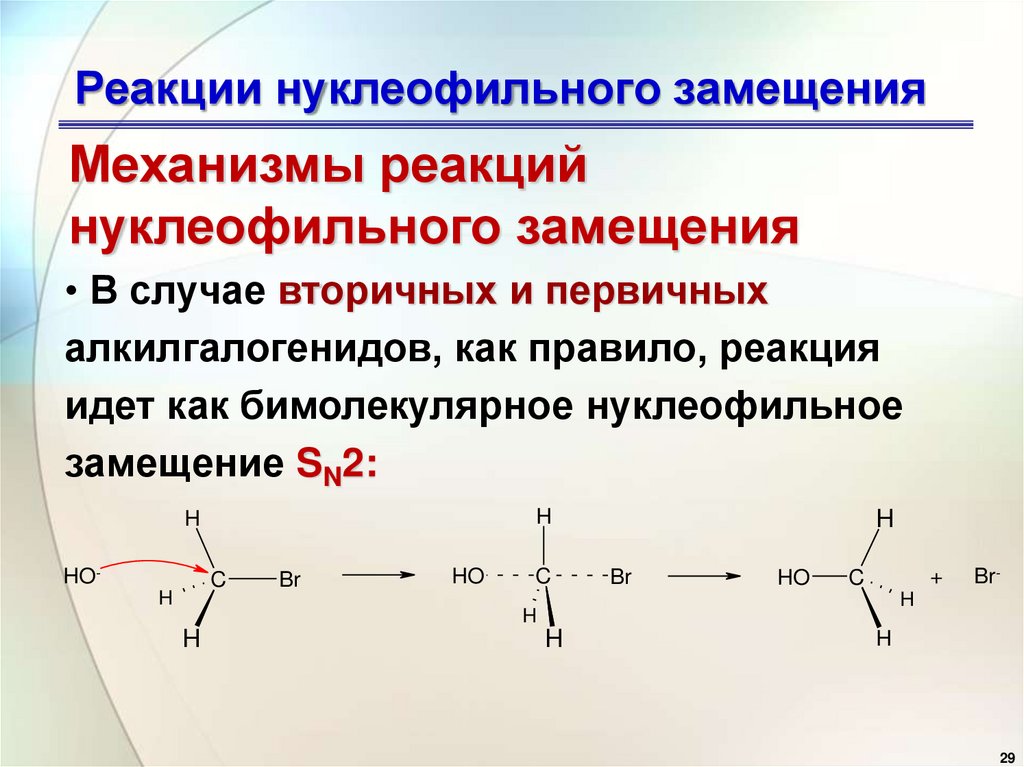
29. Реакции нуклеофильного замещения
Механизмы реакцийнуклеофильного замещения
• В случае вторичных и первичных
алкилгалогенидов, как правило, реакция
идет как бимолекулярное нуклеофильное
замещение SN2:
H
H
HO-
C
H
Br
HO
C
H
Br
HO
+
C
H
H
H
Br-
H
H
29
30. Реакции нуклеофильного замещения
SN2 реакции являются синхроннымипроцессами – нуклеофил (OH-) атакует
атом углерода, постепенно образуя с
ним связь; одновременно с этим
постепенно разрывается связь С-Br
Уходящий из молекулы субстрата
бромид-ион в называется уходящей
группой (нуклеофугом)
30
31. Реакции нуклеофильного замещения
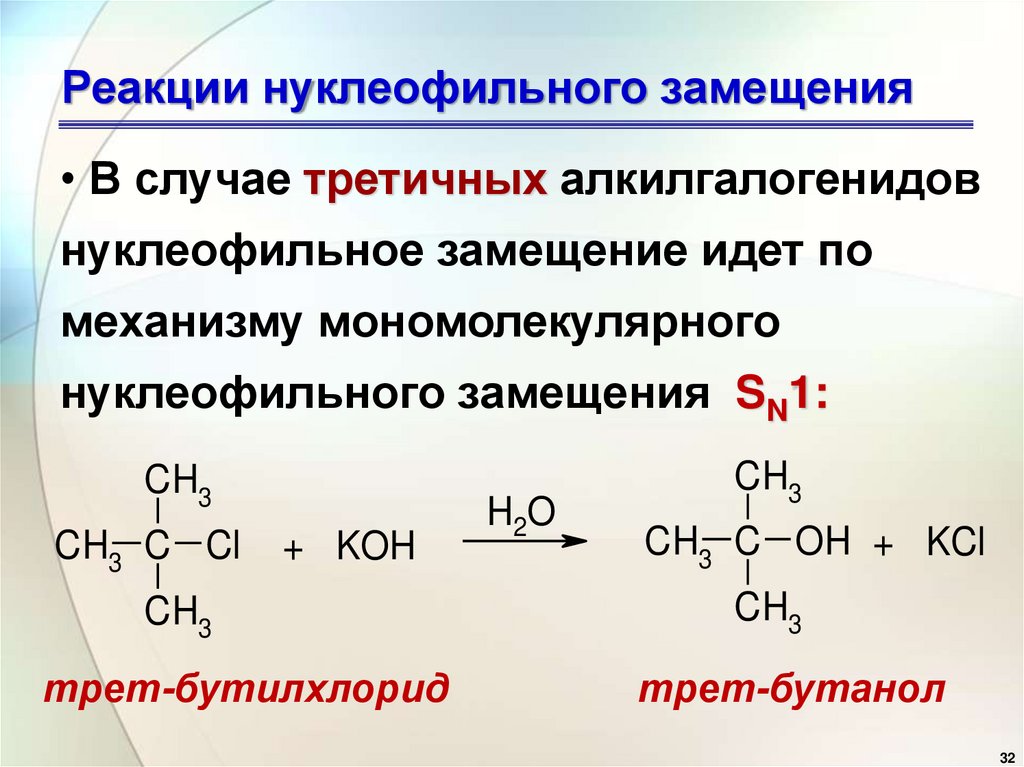
• В случае третичных алкилгалогенидовнуклеофильное замещение идет по
механизму мономолекулярного
нуклеофильного замещения SN1:
CH3
CH3 C Cl
+ KOH
CH3
трет-бутилхлорид
H2O
CH3
CH3 C OH + KCl
CH3
трет-бутанол
32
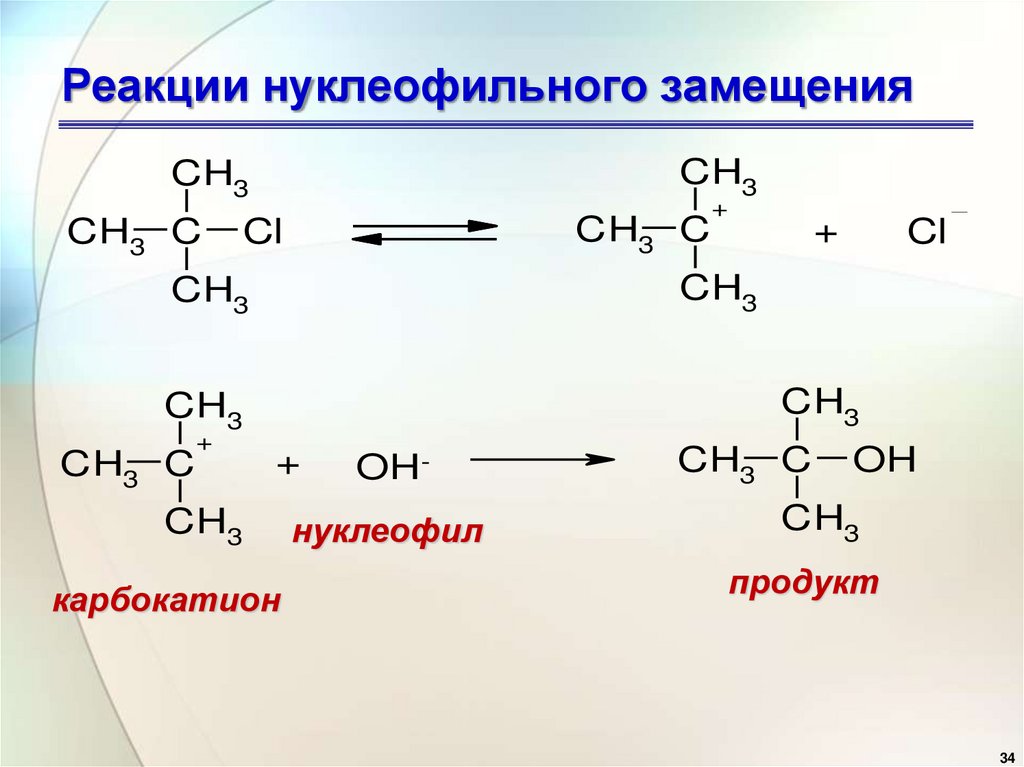
32. Реакции нуклеофильного замещения
Механизм SN1 реакциинапоминает механизм реакций
обмена в неорганической
химии, является
диссоциативным и идет в две
стадии:
33
33. Реакции нуклеофильного замещения
CH3CH3
CH3 C
CH3 C
Cl
Cl
CH3
CH3
CH3 C
+
CH3
CH3
+
+
+
CH3
карбокатион
OH-
нуклеофил
CH3 C
OH
CH3
продукт
34
34. Реакции нуклеофильного замещения
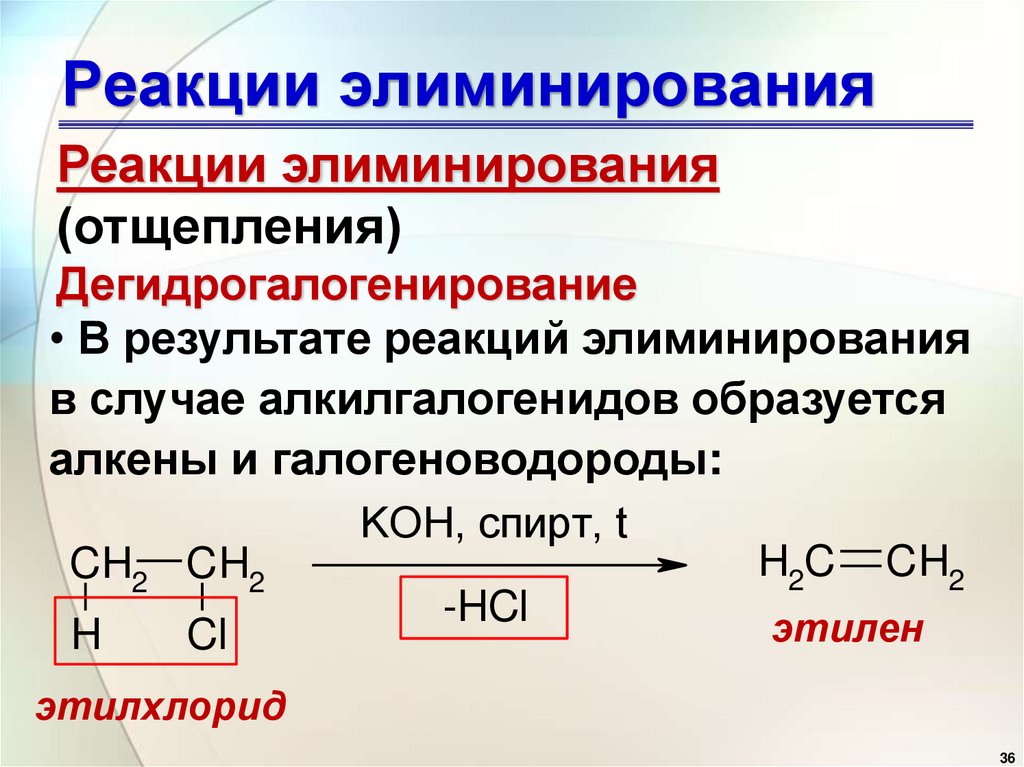
Реакции элиминированияРеакции элиминирования
(отщепления)
Дегидрогалогенирование
• В результате реакций элиминирования
в случае алкилгалогенидов образуется
алкены и галогеноводороды:
KOH, спирт, t
CH2 CH2
H
Cl
-HCl
H2C
CH2
этилен
этилхлорид
36
35. Реакции нуклеофильного замещения
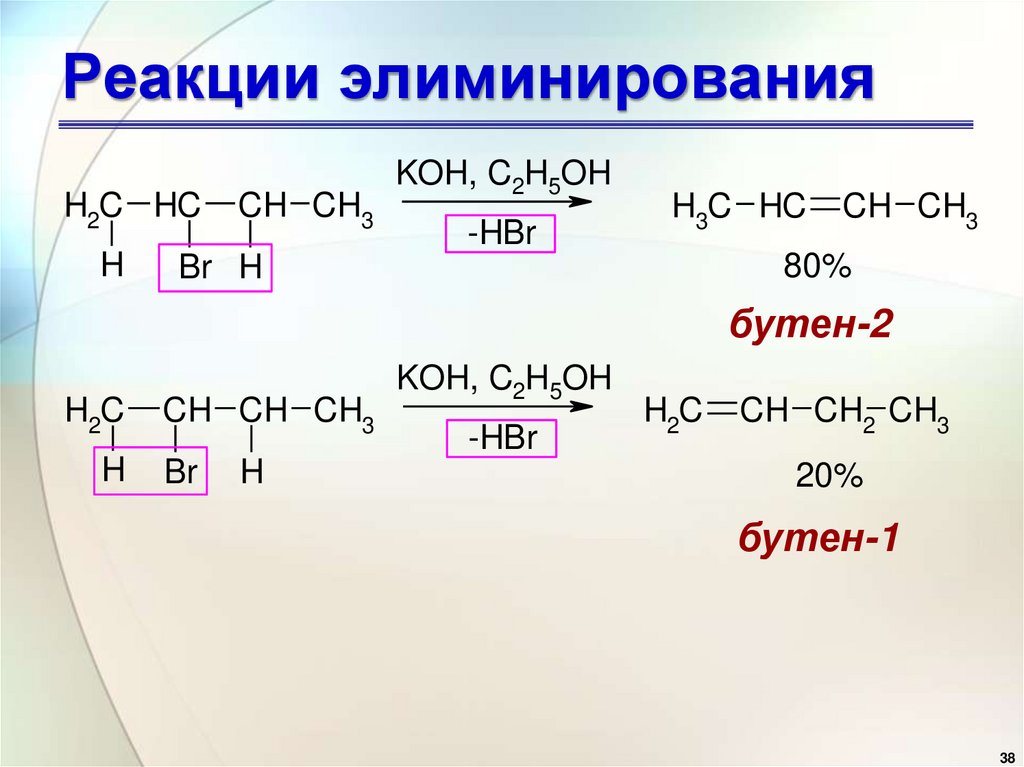
Реакции элиминирования• В случае несимметричных
алкилгалогенидов реакции
дегидрогалогенирования идут в
соответствии с правилом Зайцева:
отщепление атома водорода в
реакциях отщепления НХ
происходит от наименее
гидрогенизированного атома
углерода
37
36. Реакции элиминирования
H2C HCH
CH CH3
KOH, C2H5OH
-HBr
H3C HC
CH CH3
80%
Br H
бутен-2
H2C
H
CH CH CH3
Br
H
KOH, C2H5OH
-HBr
H2C
CH CH2 CH3
20%
бутен-1
38
37. Реакции элиминирования
Механизмы реакцийэлиминирования
Элиминирование
галогеноводородов может
осуществляться
по 2-м основным механизмам:
E1 и E2
39
38. Реакции элиминирования
Механизм Е1характерен для третичных
алкилгалогенидов
1. Алкилгалогенид диссоциирует с
образованием карбокатиона и
галогенид-иона
40
39. Реакции элиминирования
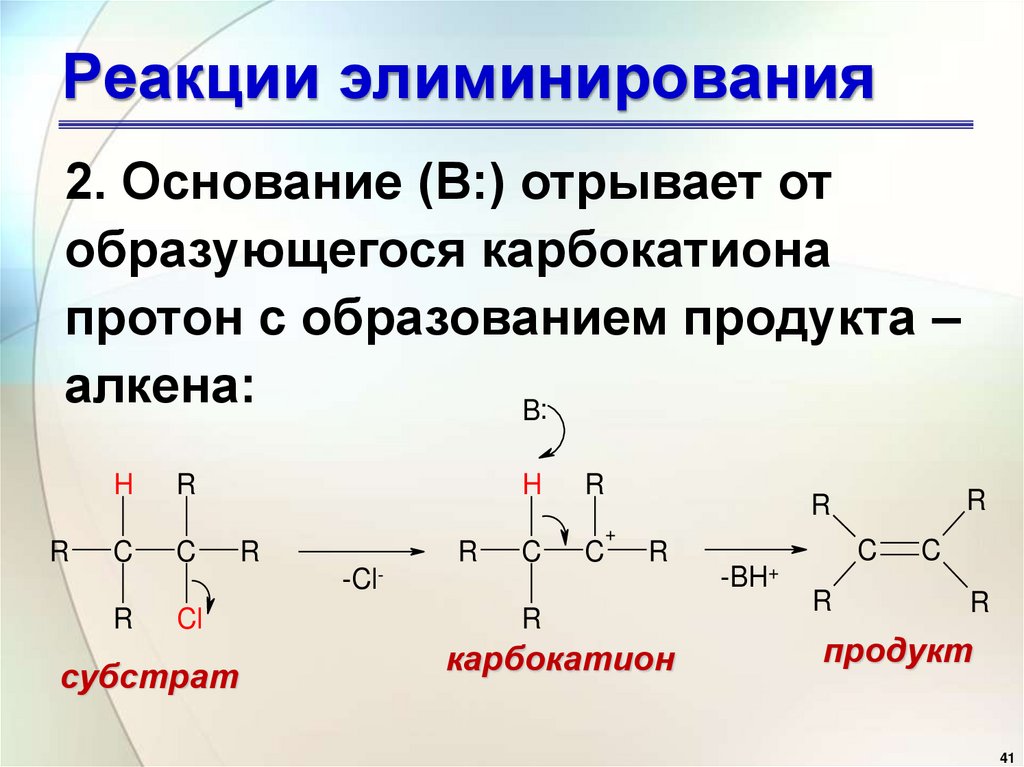
2. Основание (B:) отрывает отобразующегося карбокатиона
протон с образованием продукта –
алкена:
B:
H
R
C
R
C
H
R
R
C
R
C
+
R
-ClR
Cl
субстрат
R
R
R
карбокатион
-BH+
C
R
C
R
продукт
41
40. Реакции элиминирования
Механизм E1 для полизамещенныхгалогенопроизводных может иметь
обратную последовательность:
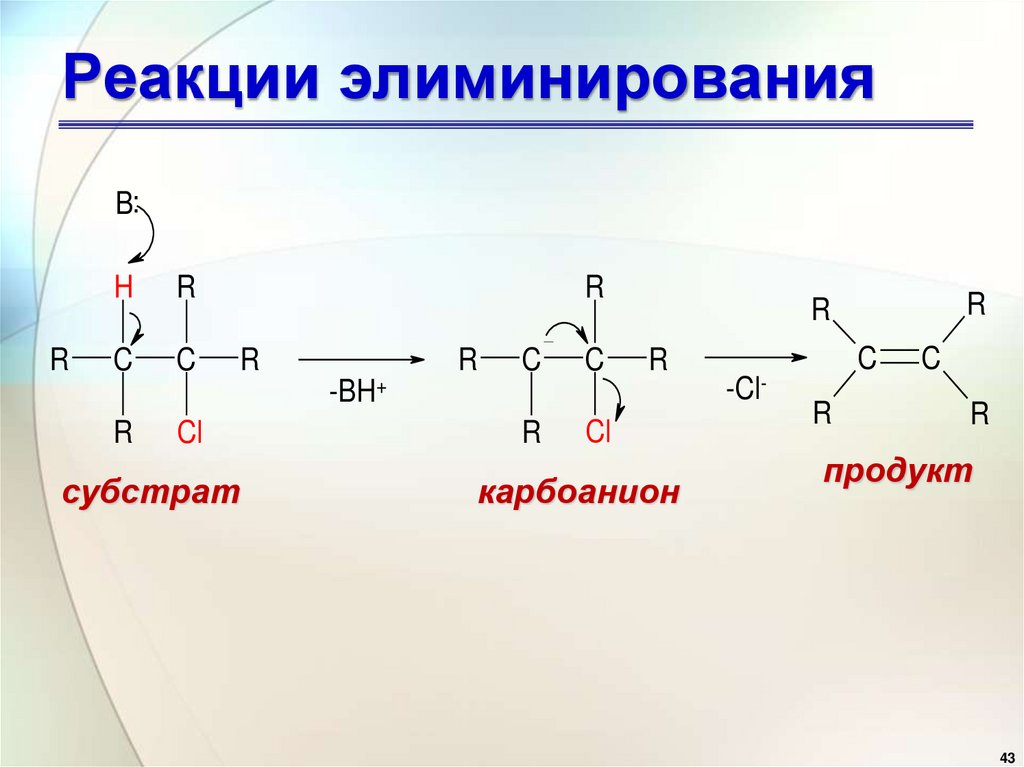
• Основание отрывает от
алкилгалогенида протон с образованием
карбоаниона, от которого потом
отщепляется галогенид-ион с
образованием алкена
42
41. Реакции элиминирования
B:R
H
R
C
C
R
R
R
C
C
R
Cl
R
-BH+
R
Cl
субстрат
R
R
карбоанион
-Cl-
C
R
C
R
продукт
43
42. Реакции элиминирования
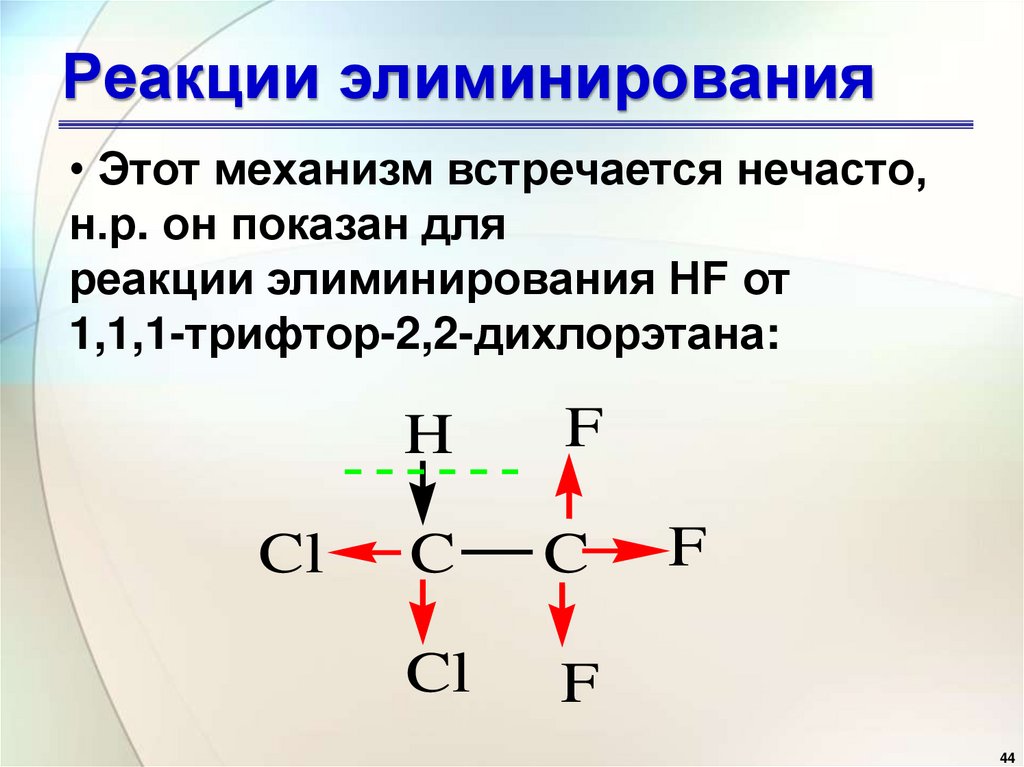
• Этот механизм встречается нечасто,н.р. он показан для
реакции элиминирования HF от
1,1,1-трифтор-2,2-дихлорэтана:
Cl
H
F
C
C
Cl
F
F
44
43. Реакции элиминирования
Механизм E2 характерен дляпервичных и вторичных
алкилгалогенидов
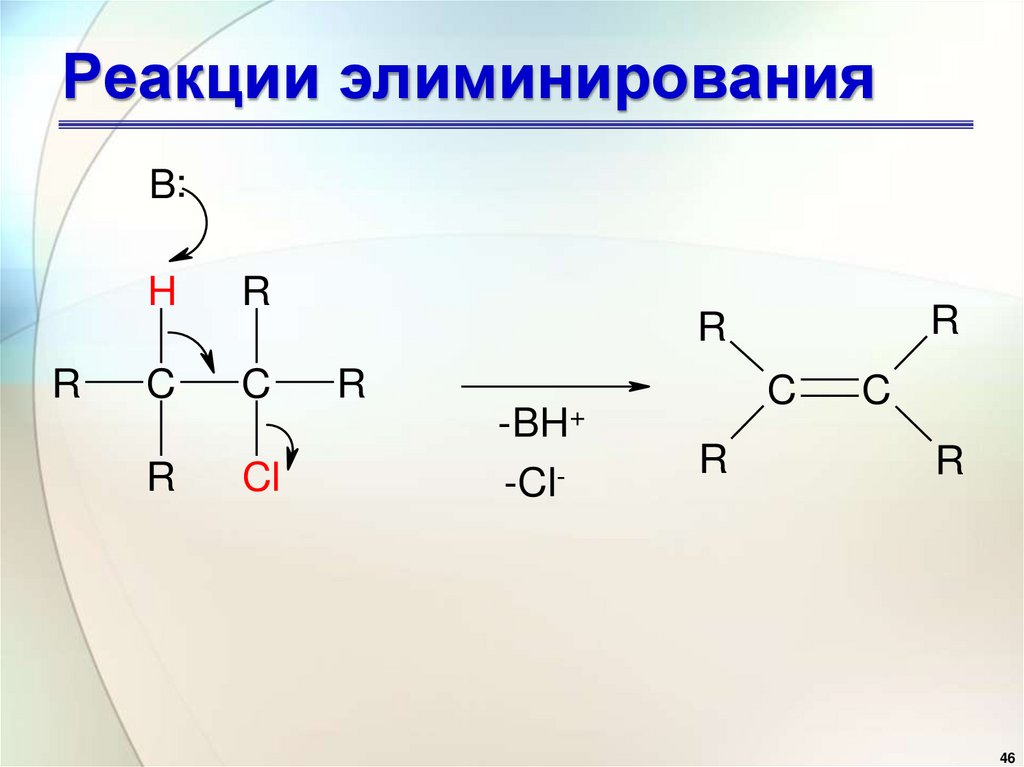
• В этом случае отрыв протона
и галогенид-иона происходит
синхронно (одновременно):
45
44. Реакции элиминирования
B:R
H
R
C
C
R
-BH+
R
Cl
R
R
-Cl-
C
R
C
R
46
45. Реакции элиминирования
Взаимодействие с металламиВзаимодействие с металлами
• При взаимодействии
алкилгалогенидов
со щелочными металлами
происходит реакция Вюрца
с образованием алканов:
CH3 Br + Br CH3 + 2Na
бромметан
CH3 CH3 + 2NaBr
этан
47
46. Реакции элиминирования
Взаимодействие с металлами• Реакция Вюрца протекает
через образование
натрийорганических соединений
и не идет с третичными
алкилгалогенидами
48
47. Взаимодействие с металлами
• При взаимодействии с активнымидвухвалентными металлами
образуются очень полезные
в синтетическом плане
металлоорганические соединения:
CH3 CH2 I
+
Zn
CH3 CH2 Zn I
2 CH3 CH2 I
+
Zn
CH3 CH2 Zn CH2 CH3
+
ZnI2
49
48. Взаимодействие с металлами
• Большее значение имеют Mgорганические соединения –реактивы Гриньяра
• Реактивы Гриньяра образуются
при выдерживании металлического
магния в эфирном растворе,
содержащем алкилгалогенид
50
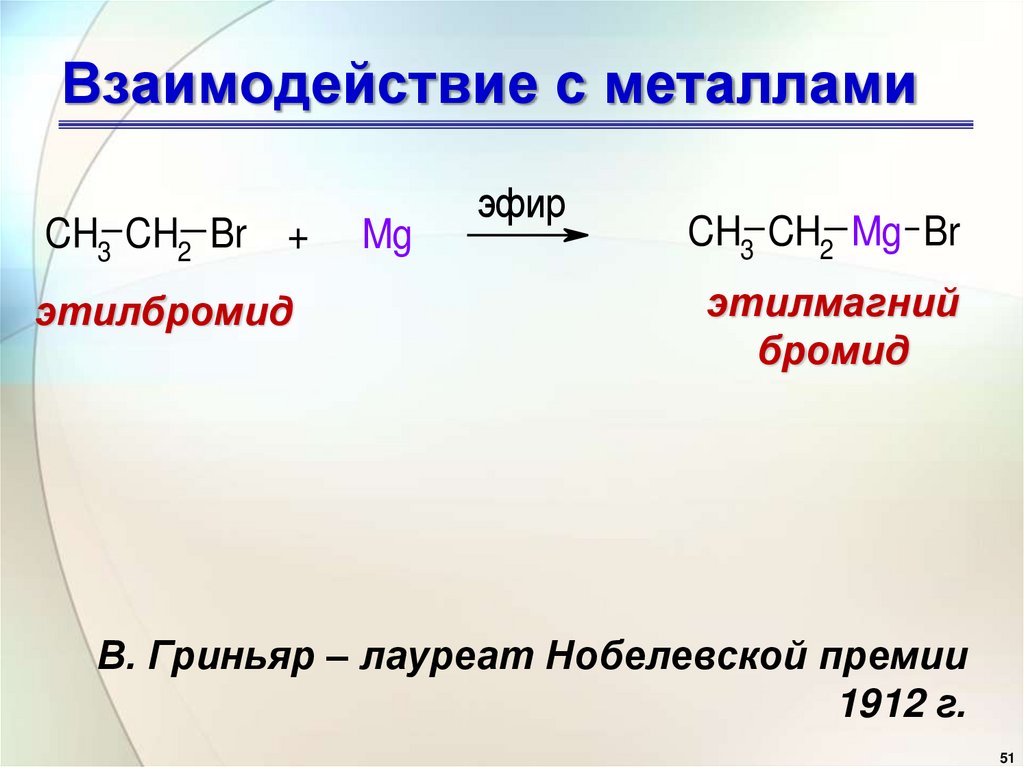
49. Взаимодействие с металлами
CH3 CH2 Br +этилбромид
Mg
эфир
CH3 CH2 Mg Br
этилмагний
бромид
В. Гриньяр – лауреат Нобелевской премии
1912 г.
51
50. Взаимодействие с металлами
• Реактивы Гриньяра в отличие отцинкорганических соединений не
воспламеняются на воздухе и
являются очень удобными для
органического синтеза
52
51. Взаимодействие с металлами
• Используя реактивы Гриньяра,можно получить самые
разнообразные производные:
алканы, спирты, карбоновые
кислоты, меркаптаны,
металлоорганические соединения
53
52. Взаимодействие с металлами
Реакции окисленияРеакции окисления
Галогенопроизводные горят,
образуя углекислый газ, воду и
галогеноводороды:
C2H5Cl + 3 O2
2 CO2 + 2 H2O + HCl
54
53. Взаимодействие с металлами
Реакции окисления• При нагревании галогенопроизводного
с медью, атомы галогена отщепляются
с образованием летучих галогенидов
меди, окрашивающих пламя в зеленый
или сине-зеленый цвет – качественная
реакция на галогенопроизводные
(проба Бейльштейна)
55
54. Реакции окисления
• Галогенопроизводные, содержащиебольшое количество атомов галогена,
практически не горят. Н.р., фторопласт
(тефлон) является материалом
чрезвычайно устойчивым к действию
кислот, щелочей, окислителей и
воздуха, поэтому он применяется в
производстве изделий
электротехнической, радиотехнической
и химической промышленности
56
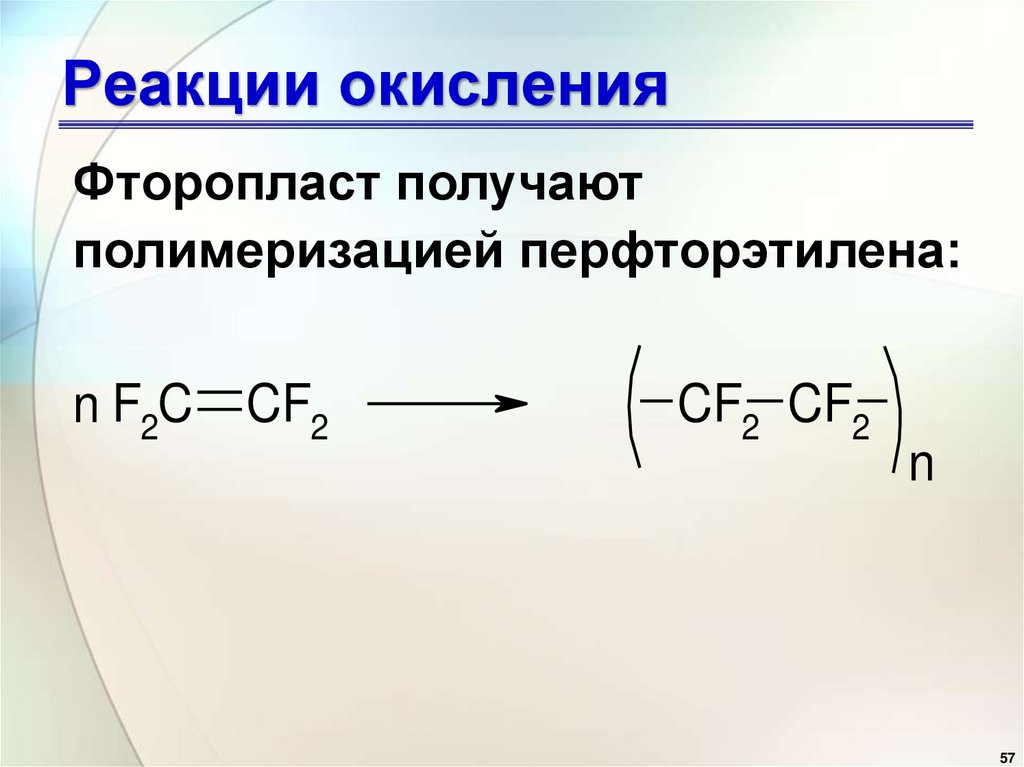
55. Реакции окисления
Фторопласт получаютполимеризацией перфторэтилена:
n F2C
CF2
CF2 CF2
n
57
56. Реакции окисления
Идентификация• Чаще всего присутствие галогенов
в молекуле органического
соединения доказывают пробой на
галоген по Бейльштейну или
восстановлением вещества
натрием в спирте с последующим
определением иона Hal- реакцией с
нитратом серебра в кислой среде
58
57. Реакции окисления
Галогенопроизводные ИдентификацияПроба Бейльштейна
(реакция Бейльштейна) качественная реакция на
галогены (хлор, бром, иод) в
органических соединениях
59
58. Идентификация
Проба Бейльштейна• На конце тонкой медной
проволоки делают петлю и
прокаливают ее в пламени горелки,
пока она не перестанет окрашивать
пламя в зеленый цвет;
• Проволоку охлаждают, петлю
смачивают или посыпают
испытуемым веществом и снова
вносят в пламя
60
59. Галогенопроизводные Идентификация
Проба Бейльштейна• В случае присутствия в пробе
галогена пламя окрашивается в
зеленый (или сине-зеленый)
цвет
61
60. Проба Бейльштейна
6261. Проба Бейльштейна
6362. Проба Бейльштейна
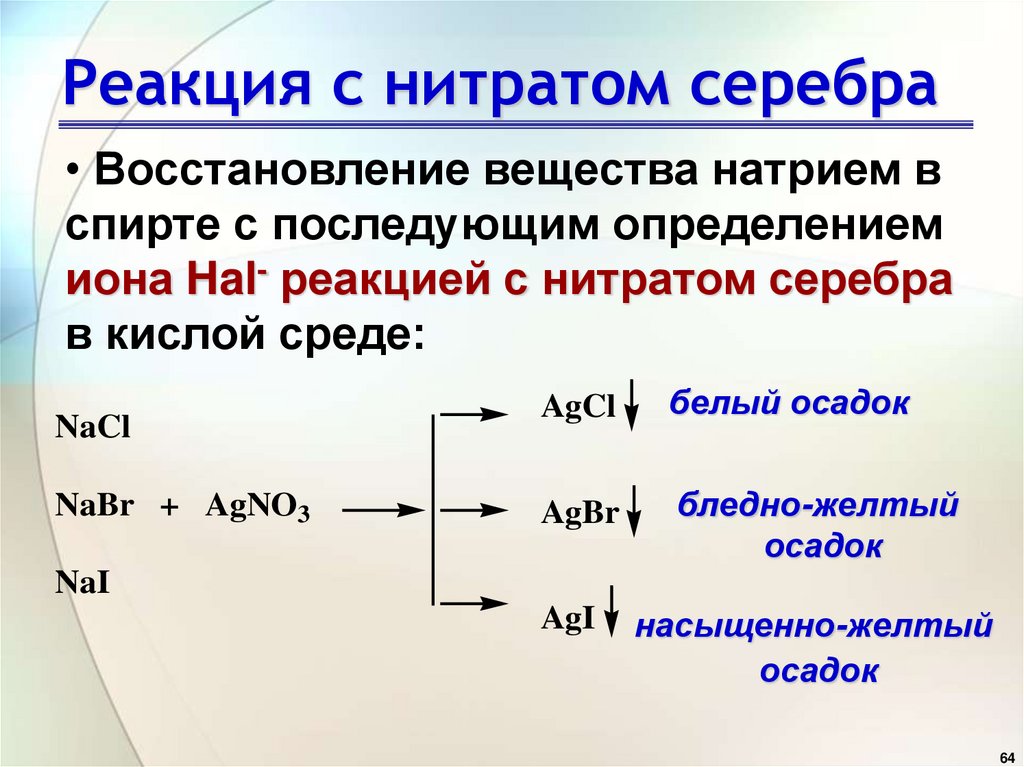
Реакция с нитратом серебра• Восстановление вещества натрием в
спирте с последующим определением
иона Hal- реакцией с нитратом серебра
в кислой среде:
NaCl
NaBr + AgNO3
AgCl
белый осадок
AgBr
бледно-желтый
осадок
AgI
насыщенно-желтый
осадок
NaI
64
63. Проба Бейльштейна
ИК-спектрСвязь С-F проявляется в ИК-спектре
в области 1350-1000 см-1,
связь С-Cl в области 800-600 см-1,
а связи С-Br и С-I поглощают еще
при более низких частотах, которые
находятся вне диапазона,
доступного для спектрометров
с оптикой из хлорида натрия
65
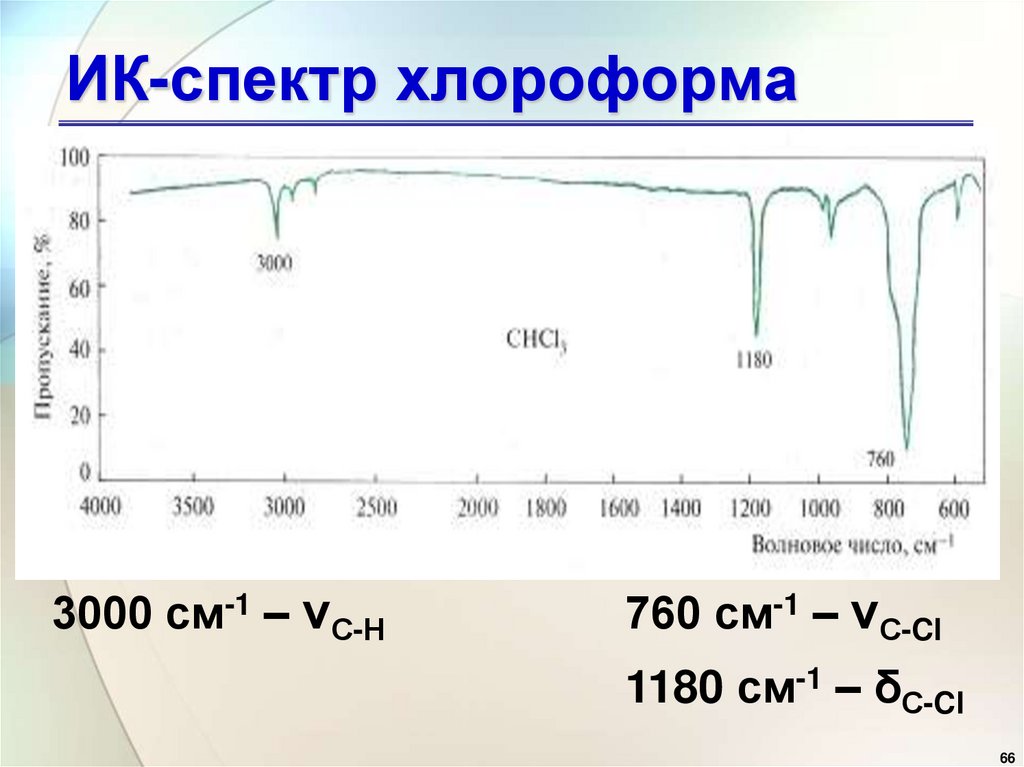
64. Реакция с нитратом серебра
ИК-спектр хлороформа3000 см-1 – νС-Н
760 см-1 – νС-Cl
1180 см-1 – δС-Cl
66
65. ИК-спектр
ПМР-спектрДезэкранирующий эффект
атомов галогена приводит к
сильному сдвигу сигналов
протонов, находящихся у
этого же атома углерода,
в слабые поля в спектрах ПМР
до 3 м.д.
67
66. ИК-спектр хлороформа
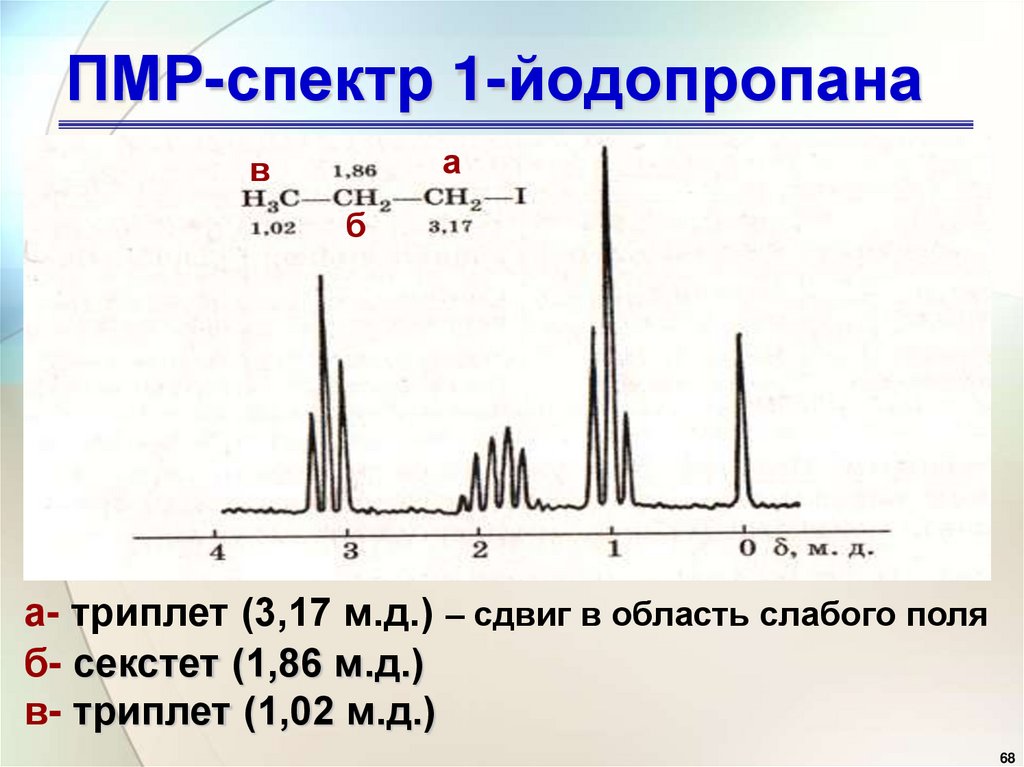
ПМР-спектр 1-йодопропанаа
в
б
а- триплет (3,17 м.д.) – сдвиг в область слабого поля
б- секстет (1,86 м.д.)
в- триплет (1,02 м.д.)
68
67. ПМР-спектр
УФ-спектрВ УФ-области галогенопроизводные
имеют очень слабые полосы
поглощения (ε < 300) в следующих
областях:
хлорпроизводные – 172 нм
бромпроизводные – 204 нм
йодпроизводные – 257 нм
69
68. ПМР-спектр 1-йодопропана
Заключение•Химия галогенопроизводных
очень разнообразна и включает
в себя несколько важных
практических и теоретических
аспектов:
70
69. УФ-спектр
Заключение1. В результате изучения
реакционной способности
галогенопроизводных были
сформулированы некоторые
общие принципы теоретической
органической химии и
исследованы механизмы
реакций
71
70. Заключение
2. Галогенопроизводные имеютбольшое синтетическое
значение, а сами
галогенопроизводные можно
легко получить из доступного
сырья
72
71. Заключение
3. Галогенопроизводныешироко используются на
практике – в медицине,
промышленности и быту
73
72. Заключение
4. Химия галогенопроизводныхтесно связана с экологическими
проблемами современности – с
парниковым эффектом и
разрушением озонового слоя
74















































 chemistry
chemistry








