Similar presentations:
10 лекция
1. Лекция 10. ОСНОВЫ ЭЛЕКТРОХИМИИ
Ермоленко Анастасия Алексеевна, к.х.н.,старший преподаватель кафедры аналитической химии
2.
ПЛАН ЛЕКЦИИ• I. Электродный потенциал
металлов.
• II. Ряд напряжений металлов.
• III. Гальванические элементы.
• IV. Электролиз.
• V. Закон Фарадея.
3.
I. Электродный потенциал металлов• Электрохимия – это наука, изучающая процессы взаимного превращения
химической и электрической энергии.
Электродный потенциал металлов в растворах их солей.
• При погружении пластинки металла в водный раствор его соли, на поверхности
пластинки происходит взаимодействие атомов металла с полярными
молекулами воды. В итоге на поверхности пластины катионы металла,
находящиеся в узлах кристаллической решетки, гидратируются и переходят в
раствор, оставляя в металле избыточные электроны, т.е.
• Параллельно, с процессом перехода катионов из металлической решётки в
раствор, всегда возможен обратный процесс, т.е. переход гидратированных
катионов из раствора на поверхность отрицательно заряженной пластинки
металла, с потерей гидратной оболочки:
4.
• Когда скорости обоих процессовдинамическое равновесие:
выравниваются,
то
устанавливается
• Возникает двойной электрический слой, количественной характеристикой
которого является электродный потенциал металла.
• При погружении пластинки активного металла (Zn,
Fe, Cd) в водный раствор его соли металл пластинки
приобретает отрицательный заряд, а раствор в
приповерхностной области – положительный.
• При погружении малоактивного металла (Cu, Ag,
Au) в раствор его соли преобладает процесс перехода
гидратированных катионов на металлическую
пластинку, заряжая её положительно, а раствор
электролита за счёт избытка противоионов отрицательно.
5.
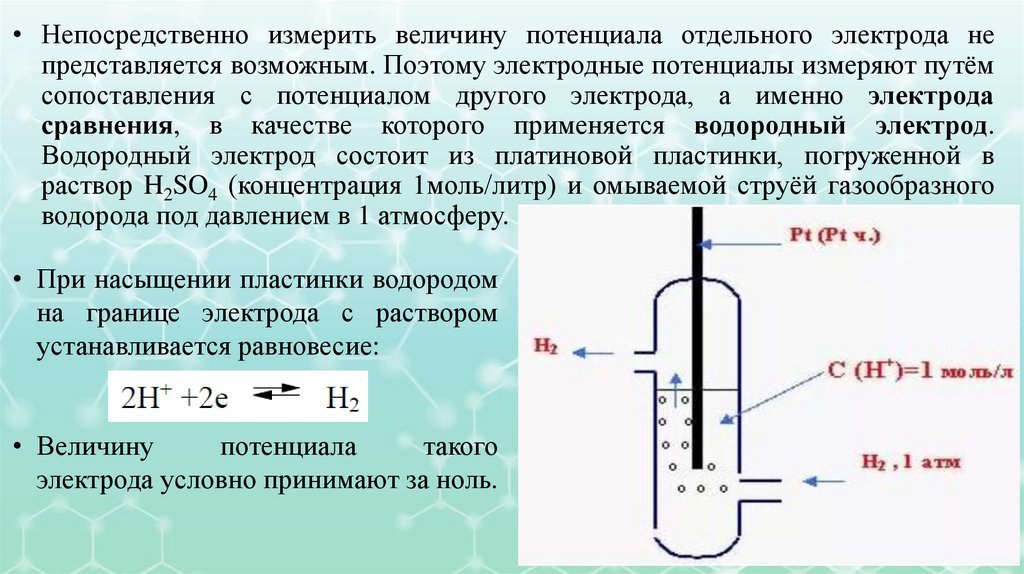
• Непосредственно измерить величину потенциала отдельного электрода непредставляется возможным. Поэтому электродные потенциалы измеряют путём
сопоставления с потенциалом другого электрода, а именно электрода
сравнения, в качестве которого применяется водородный электрод.
Водородный электрод состоит из платиновой пластинки, погруженной в
раствор H2SO4 (концентрация 1моль/литр) и омываемой струёй газообразного
водорода под давлением в 1 атмосферу.
• При насыщении пластинки водородом
на границе электрода с раствором
устанавливается равновесие:
• Величину
потенциала
такого
электрода условно принимают за ноль.
6.
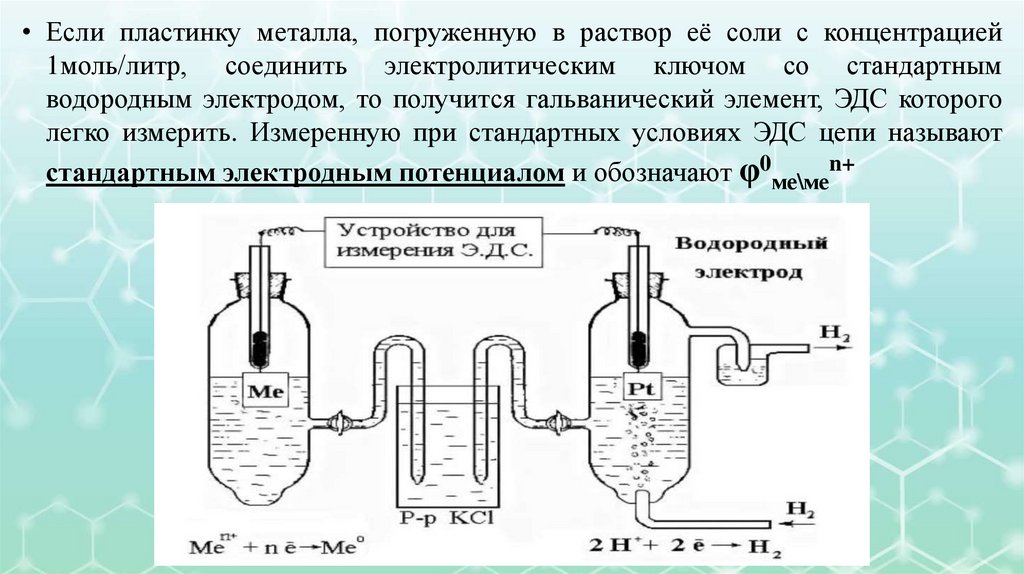
• Если пластинку металла, погруженную в раствор её соли с концентрацией1моль/литр, соединить электролитическим ключом со стандартным
водородным электродом, то получится гальванический элемент, ЭДС которого
легко измерить. Измеренную при стандартных условиях ЭДС цепи называют
стандартным электродным потенциалом и обозначают φ0ме\меn+
7.
• Пример: φ0zn/zn2+ = -0.76 в; φ0Ag/Ag+ = +0.86 в. Стандартные потенциалы техметаллов, которые отдают электроны водородному электроду имеют знак (―),
а металлы, которые принимают электроны от водородного электрода имеют
знак (+). Эти значения приводятся в справочниках.
• Потенциал каждого электрода зависит от природы металла, концентрации его
ионов в растворе и температуры и для нестандартных условий
рассчитывается по уравнению Нернста:
где n-число электронов, участвующих в электродном процессе;
• Уравнение Нернста упрощается при стандартных условиях и зависит только
от молярной концентрации ионов металла Меn+ в растворе:
• при Т = 298 К; F = 96500 кл/моль-экв; R = 8.31 Дж*Моль/К
8.
II. Ряд напряжений металлов• Рассматривая металлы в порядке возрастания их стандартных электродных
потенциалов, получают электрохимический ряд напряжений металлов, или
точнее ряд стандартных электродных потенциалов:
• Ряд напряжений металлов характеризует их химические свойства.
1. Чем левее в ряду напряжений находится металл, тем он химически активнее,
тем легче окисляется и труднее восстанавливается из своих ионов. Например,
литий, имеющий наиболее отрицательный стандартный потенциал, относится к
наиболее сильным восстановителям. И наоборот, чем положительнее потенциал
металлического электрода, тем более сильной окислительной способностью
обладают его ионы. К наиболее сильным окислителям принадлежат ионы
золота, серебра и ртути.
9.
2. Каждый металл этого ряда, не разлагающий воду, вытесняет всеследующие за ним металлы из растворов их солей.
3. Все металлы, стоящие в ряду напряжений левее водорода, вытесняют
его из разбавленных кислот, анионы которых не проявляют
окислительных свойств, а стоящие правее водорода, его не вытесняют.
4. Чем дальше расположены друг от друга в ряду напряжений два данных
металла, тем большую ЭДС будет иметь составленный из них
гальванический элемент, т.е., используя стандартные электродные
потенциалы, можно легко вычислить ЭДС гальванического элемента. Для
этого из потенциала электрода с большей алгебраической величиной φ01,
вычитают потенциал электрода с меньшей алгебраической величиной
φ02. При этом способе расчёта ЭДС всегда положительна.
10.
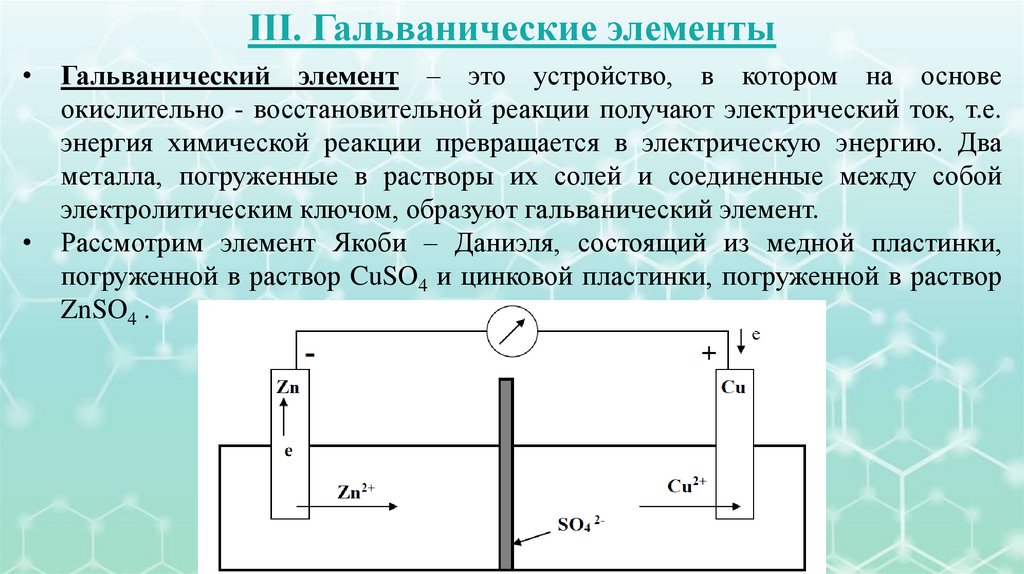
III. Гальванические элементыГальванический элемент – это устройство, в котором на основе
окислительно - восстановительной реакции получают электрический ток, т.е.
энергия химической реакции превращается в электрическую энергию. Два
металла, погруженные в растворы их солей и соединенные между собой
электролитическим ключом, образуют гальванический элемент.
Рассмотрим элемент Якоби – Даниэля, состоящий из медной пластинки,
погруженной в раствор CuSO4 и цинковой пластинки, погруженной в раствор
ZnSO4 .
11.
• Оба раствора соприкасаются друг с другом, но для предупреждениясмешивания они разделены пористой перегородкой. На поверхности цинковой
пластинки возникает двойной электрический слой, устанавливается равновесие
и возникает электродный потенциал цинка:
• На поверхности медной пластинки также возникает двойной электрический
слой, устанавливается равновесие и возникает электродный потенциал меди:
• Так как потенциал Zn электрода имеет более отрицательное значение, чем
медного, то при замыкании внешней цепи электроны будут переходить от
цинка к меди.
• При работе элемента Якоби-Даниэля протекают следующие процессы:
1) реакция окисления цинка Zn - 2e → Zn2+ (анодный процесс). Процессы
окисления в электрохимии называют анодными (анодом называют электрод,
уводящий электроны из данной системы, а катодом называют электрод,
вводящий электроны в систему.
12.
2) реакция восстановления меди, Cu2+ + 2e → Cu (катодный процесс), т.к.процессы восстановления в электрохимии называются катодными.
3) движение электронов во внешней цепи.
4) движение ионов в растворе:
- анионов SO42- к аноду,
- катионов Cu2+ и Zn2+ к катоду.
• Движение ионов в растворе замыкает электрическую цепь гальванического
элемента.
• Суммарное уравнение процесса можно получить, сложив уравнения:
13.
• Уравнение процесса в молекулярном виде:• Вследствие этой химической реакции в гальваническом элементе возникает
движение электронов во внешней цепи и ионов внутри элемента, т.е.
электрический ток.
• Гальванический элемент можно записать в виде краткой электрической схемы,
например:
где одна черта означает границу между электродом и раствором электролита,
а две черты – границу между растворами, при этом анод записывают слева,
катод – справа.
• Максимальное значение напряжения гальванического элемента называется
ЭДС данного элемента - величина постоянная. ЭДС можно вычислить по
разности электродных потенциалов – для этого из величины более
положительного потенциала вычесть величину менее положительного
потенциала. Для элемента Якоби – Даниэля это будет:
14.
IV. Электролиз• Электролизом называются химические процессы, происходящие на
электродах под действием электрического тока. Электрод, подключённый к
отрицательному полюсу источника тока, называется катодом, а к
положительному - анодом.
Электродные процессы
• На катоде протекает реакция восстановления, т.е. приём электронов
окислителем. Поэтому в первую очередь должны реагировать наиболее
сильные окислители. Для катодного восстановления все окислители можно
разделить на 3 группы:
1) Ионы металлов, потенциал которых существенно более отрицателен, чем
водородного электрода. К ним относятся ионы щелочных, щелочноземельных
металлов и алюминия. В водных растворах разряд этих ионов на катоде не
происходит, а восстанавливаются молекулы воды:
15.
2) Окислители, потенциал которых более положителен, чем потенциалводородного электрода (Cu+2, Ag+1, Аu+3 и т.д.) разряжаются в первую очередь,
а молекулы воды не восстанавливаются.
3) Ионы, потенциал которых относительно мало отличается от потенциала
водородного электрода (Sn2+, Cd2+ и т.д.) разряжаются на катоде одновременно
с молекулами воды.
• На аноде протекает реакция оксиления, т.е. отдача электронов
восстановителем. На аноде окисляются те ионы и молекулы, электродные
потенциалы которых ниже, при этом анионы бескислородных кислот
окисляются достаточно легко. Если же в растворе находятся анионы
кислородосодержащих кислот (SO42-, NО3-, СО32-), то на аноде окисляются не
эти ионы, а молекулы воды.
16.
• Рассмотрим пример электролиза раствора CuSO4 с инертным электродом.• Возможные реакции на катоде:
• Согласно правилу разряда ионов, на катоде будет проходить реакция
восстановления меди.
• Возможные реакции на аноде:
• На аноде будет происходить реакция окисления молекул воды, т.к. ее
электродный потенциал наименьший.
17.
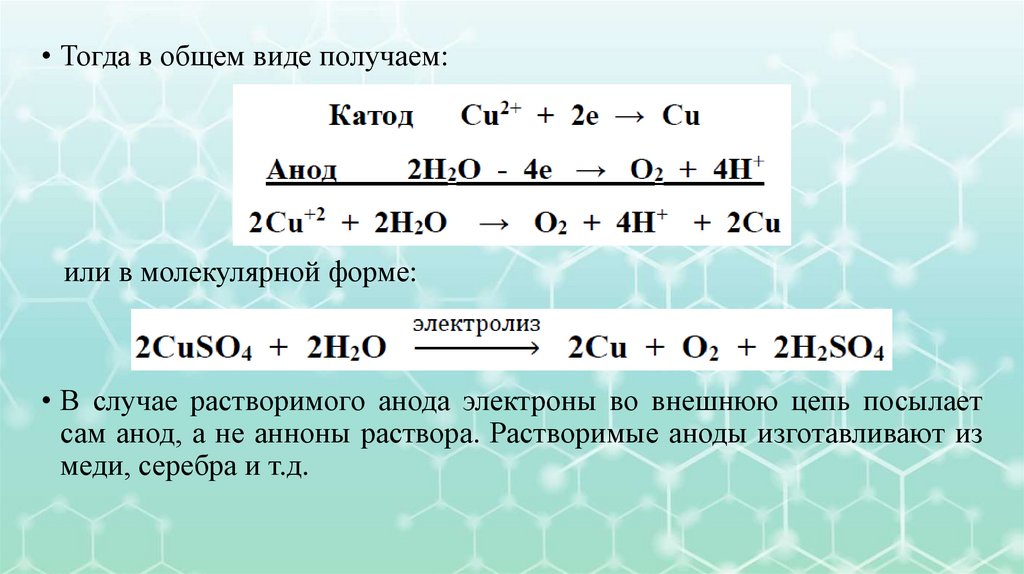
• Тогда в общем виде получаем:или в молекулярной форме:
• В случае растворимого анода электроны во внешнюю цепь посылает
сам анод, а не анноны раствора. Растворимые аноды изготавливают из
меди, серебра и т.д.
18.
V. Закон Фарадея• Масса электролита, подвергшаяся химическому превращению, а также
массы веществ, выделившиеся на электродах, прямо пропорциональны
количеству протекшего через раствор электричества и эквивалентным
массам веществ:
m - масса электролита, подвергшаяся химическому превращению, или
масса веществ, выделившиеся на электродах.
mэ - эквивалентная масса (г/моль-экв) вещества или иона,
подвергающихся электролизу.
J - cила тока, A.
t - продолжительность процесса электролиза, секунд.
F - число Фарадея (96500 кл/моль-экв).














 chemistry
chemistry