Similar presentations:
семинар_методы_разделения_ЖС_2025
1. Методы разделения и очистки веществ
2. Химические методы разделения веществ
семинар3.
4. Характеристики процесса разделения
1.Коэффициент распределения DПри значениях D>1 вещество можно
Di = Ci/Ci
сконцентрировать в извлекающей фазе
2. Коэффициент разделения β
Разделение веществ возможно
при β>1
Di- коэфф. распределения основного в-ва
Dj- коэфф. распределения примеси
Чем больше β отличается от единицы, тем более
избирателен (селективен) метод разделения.
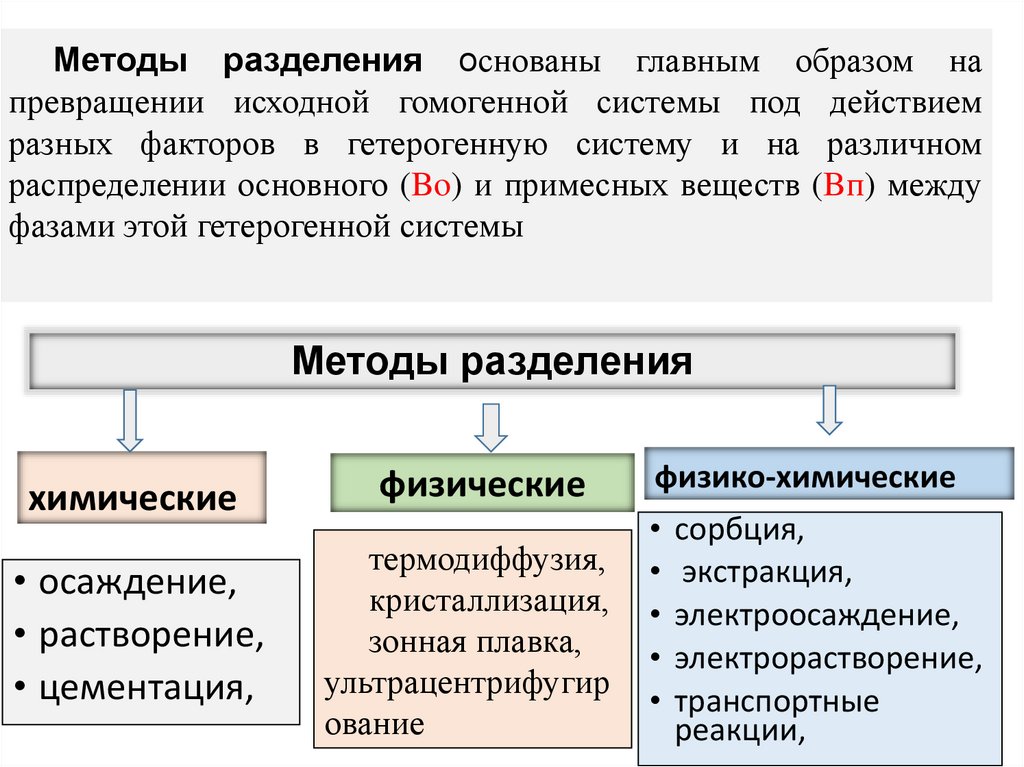
5. Методы разделения
основаны главным образом напревращении исходной гомогенной системы под действием
разных факторов в гетерогенную систему и на различном
распределении основного (Bo) и примесных веществ (Bп) между
фазами этой гетерогенной системы
Методы разделения
химические
физические
физико-химические
• осаждение,
• растворение,
• цементация,
термодиффузия,
кристаллизация,
зонная плавка,
ультрацентрифугир
ование
• сорбция,
• экстракция,
• электроосаждение,
• электрорастворение,
• транспортные
реакции,
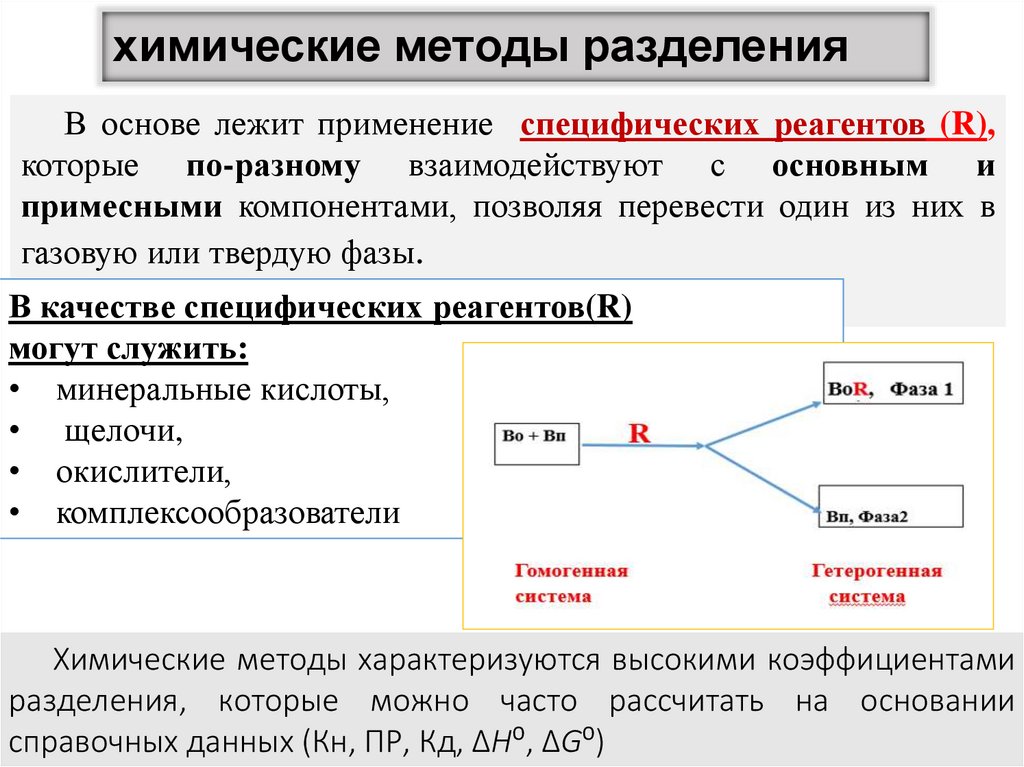
6. химические методы разделения
В основе лежит применение специфических реагентов (R),которые по-разному взаимодействуют с основным и
примесными компонентами, позволяя перевести один из них в
газовую или твердую фазы.
В качестве специфических реагентов(R)
могут служить:
• минеральные кислоты,
• щелочи,
• окислители,
• комплексообразователи
Химические методы характеризуются высокими коэффициентами
разделения, которые можно часто рассчитать на основании
справочных данных (Кн, ПР, Кд, ∆H⁰, ∆G⁰)
7. Осаждение
Методы основаны на различной растворимости компонентоврастворов.
Очистку методами осаждения проводят путем перевода
примесей в осадок.
Процесс зависит от состава водной фазы, рН, температуры,
последовательности смешивания компонентов и т.д .В ряде случаев
процесс разделения осложняется образованием коллоидных растворов
и соосаждением примесей с основным веществом
Для отделения от примесей используют селективные
осадители и промывку полученных осадков на фильтре.
Коэффициент разделения для процессов осаждения
β = ПРi/ПРj
где i и j – разделяемые компоненты
β разделения AgBr↓и РbBr2 ↓
β = 9,1 ∙10-6/5,3∙10-13 = 1,7∙107
Ag++Cl- → AgCl↓,
Ba2++SO42- → BaSO4↓
8.
отделение скандия от РЗЭ и торияМетод осаждения используют не только для очистки, но и для
разделения в технологии редких и рассеянных элементов.
В химических методах осаждения используются различные
процессы: обмена , ОВР, гидролиз, комплексообразования, и
совокупность различных процессов.
отделение скандия от РЗЭ и тория
основано на его способности образовывать растворимый
фторидный комплекс, что для РЗЭ и тория не характерно.
ScF3 ↓ +3NH4F → (NH4)3[ScF6]
растворим
РЗЭF3 ↓ + 3NH4F →
ThF4 ↓ + 3NH4F →
9.
Метод карбонатной очисткивыщелачивание
U O
MnO
4
H
SO
3 UO SO MnSO 4 H О
3 8
2 4
2
2 4
4
2
примеси
примеси
Способность U(VI) легко образовывать растворимые
комплексные соединения с CO32- используется для отделения
урана от сопутствующих ему в природе примесей, к числу которых
относятся РЗЭ, торий, кальций, магний, хром, железо, марганец,
цинк, медь и др., методом очистки карбонатом натрия.
бразование
Na SO
UO SO 3Na CO (изб ) комплексоо
Na [UO (CO ) ]
4
2
3
3
р
р
2
4
2 4
2
3
Th(SO4)2+4Na2CO3(изб) Na4[Th(CO3)4]+2Na2SO4
полный
смешанный
гидролиз
2CuSO 2 Na CO H O (CuOH ) CO 2 Na SO CO
4
2 3
2
2 3
2 4
2
полный
смешанный
гидролиз
Fe2 (SO 4 )3 3Na 2CO3 3H 2O 2Fe(OH)3 3Na 2SO 4 3CO2
РЗЭ 2 (SO 4 )3 3Na 2 CO3 обмен
РЗЭ 2 (CO3 )3 3Na 2SO 4
Получили: U(+6), Th(+4) в растворе; примеси в осадке
10.
ОВР (с образованием осадка) цементацияв качестве осадителей могут применяться металлы, которые
вытесняют из растворов более электроположительные металлы.
извлечение металла путем вытеснения из раствора его соли
другим металлом (цементатором), имеющим более
отрицательный электродный потенциал , называется цементацией
получение меди из ее разбавленных р-ров:
CuSO4+Fe
Cu↓+FeSO4
очистка сульфатно-цинковых растворов от примеси меди и кадмия:
CuSO4+Zn
Cu↓+ZnSO4
ПДК (Cd) 0,001
мг
л
CdSO4+Zn
Cd↓+ZnSO4
ПДК ( Zn ) 1,0
мг
л
Метод осаждения часто сочетают с использованием
окислительно-восстановительных реакций.
11.
Метод осаждения часто сочетают с использованиемокислительно-восстановительных реакций.
ОВР применяют для выделения из смеси тех элементов,
которые могут существовать в растворах в различных
степенях окисления
Восстановление Eu3+ до 2-валентного состояния
Отделение европия от сульфатов трехвалентных РЗЭ
2EuCl3+Zn↓+2H2SO4→2EuSO4↓+ZnCl2+4HCl
Eu3+ +e Eu2+ 2 окислитель
Еок= -0.55 В;
Zn0-2e Zn2+ 1 восстановитель Евост.= -0.762 В;
Ер=Еок-Евост=0.212 В;
LnCl3+Zn↓+H2SO4 →
Доочистка от соосадившихся сульфатов 3-валентных РЗЭ
EuSO4+4NH4OH→[Eu(NH3)4]SO4+4H2O
Ln2(SO4)3+3NH4OH→ Ln(OH)3↓ + 3(NH4)2SO4
EuC2+ 2H2O Eu(OH)2 +C2H2(ацетилен)
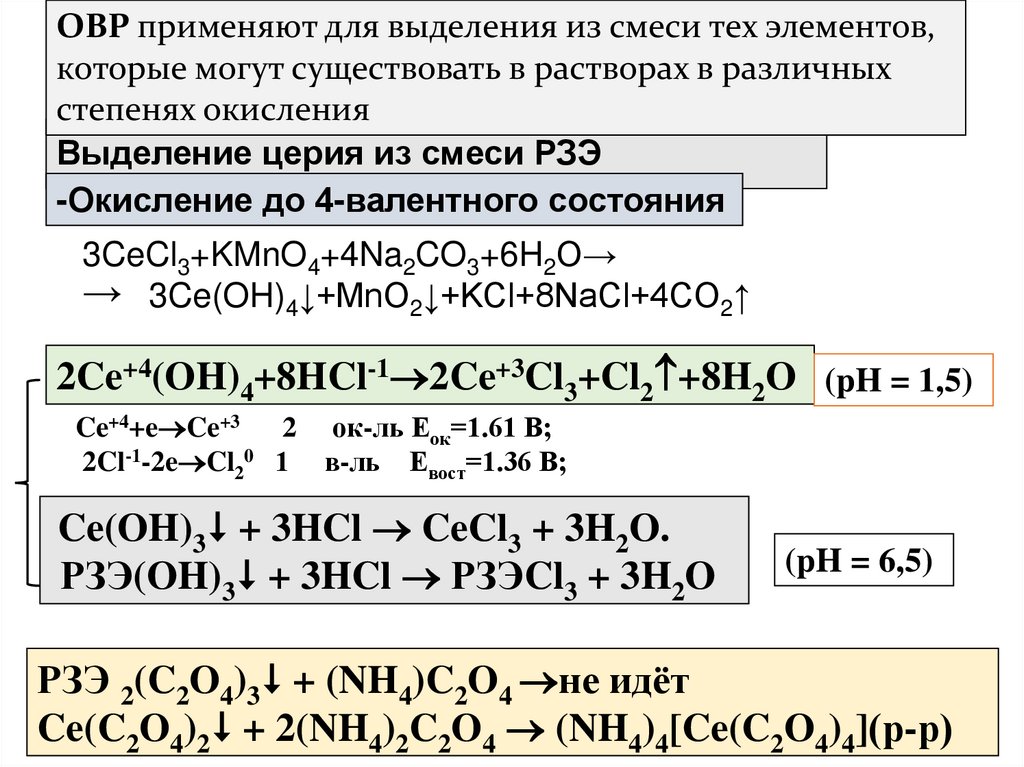
12. Выделение церия из смеси РЗЭ
ОВР применяют для выделения из смеси тех элементов,которые могут существовать в растворах в различных
степенях окисления
Выделение церия из смеси РЗЭ
-Окисление до 4-валентного состояния
3CeCl3+KMnO4+4Na2CO3+6H2O→
→ 3Ce(OH)4↓+MnO2↓+KCl+8NaCl+4CO2↑
2Ce+4(OH)4+8HCl-1 2Ce+3Cl3+Cl2 +8H2O (pH = 1,5)
Ce+4+e Ce+3 2 ок-ль Еок=1.61 В;
2Cl-1-2e Cl20 1 в-ль Евост=1.36 В;
Ce(OH)3 + 3HCl CeCl3 + 3H2O.
РЗЭ(OH)3 + 3HCl РЗЭCl3 + 3H2O
(pH = 6,5)
РЗЭ 2(C2O4)3 + (NH4)C2O4 не идёт
Ce(C2O4)2 + 2(NH4)2C2O4 (NH4)4[Ce(C2O4)4](р-р)
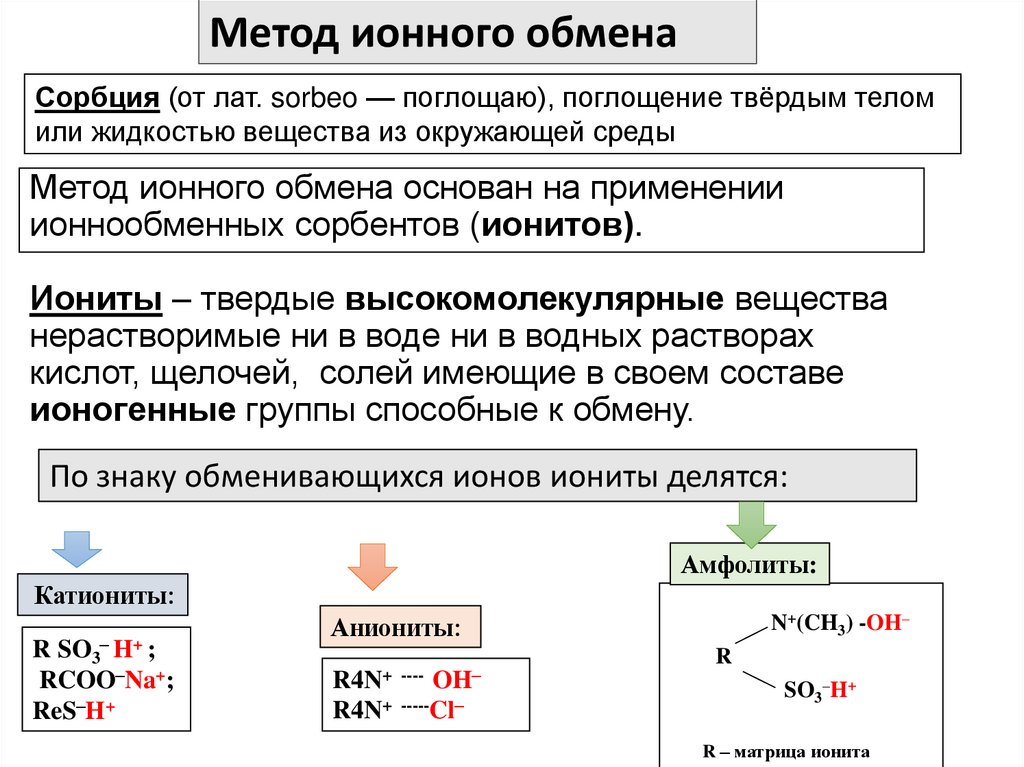
13. Метод ионного обмена основан на применении ионнообменных сорбентов (ионитов). Иониты – твердые высокомолекулярные вещества
Метод ионного обменаСорбция (от лат. sorbeo — поглощаю), поглощение твёрдым телом
или жидкостью вещества из окружающей среды
Метод ионного обмена основан на применении
ионнообменных сорбентов (ионитов).
Иониты – твердые высокомолекулярные вещества
нерастворимые ни в воде ни в водных растворах
кислот, щелочей, солей имеющие в своем составе
ионогенные группы способные к обмену.
По знаку обменивающихся ионов иониты делятся:
Амфолиты:
Катиониты:
R SO3– H+ ;
RCOO–Na+;
ReS–H+
N+(CH3) -OH–
Аниониты:
R4N+ ---- OH–
R4N+ -----Cl–
R
SO3–H+
R – матрица ионита
14.
Катионит: RSO3 HТипичная реакция на катионите
(на полимерной кислоте):
RSO3 H + Kt+ ⇄ RSO3Kt+H+
2RSO3 H+Ca2+⇄(RSO3)2Ca+2H+
2RSO3 H+UO22+⇄(RSO3)2UO2+2H+
Анионит:
R4N+ ----- ОН
Типичная реакция на анионите
(на полимерном основании):
RNH3 OH + An– ⇄ RNH3An + OH–
R OH + Na+ + Cl- ⇄ RCl +OH- + Na+
4R4N+ Cl–+[UO2(SO4)3]4– ⇄(R4N)4[UO2(SO4)3]+4Cl–
процесс ионного обмена является обратимым,











 chemistry
chemistry








