Similar presentations:
2024_Аммиак_МОЙ
1.
§17.Аммиак.Соли аммония
2.
Цель урока.Формирование умений характеризовать строение молекул,
физические и химические свойства аммиака и солей
аммония, их распознавание; лабораторное и
промышленное получение аммиака; применение аммиака и
солей аммония.
Проблемный вопрос урока
Какими особенными физическими и химическими
свойствами обладают аммиак и соли аммония? Как можно
распознать аммиак и соли аммония? Как можно получить
аммиак в лаборатории?
3.
Химическая разминка«Составь формулы»
1.Гидроксид аммония
2. Сульфат аммония
3. Карбонат аммония
4. Хлорид аммония
4.
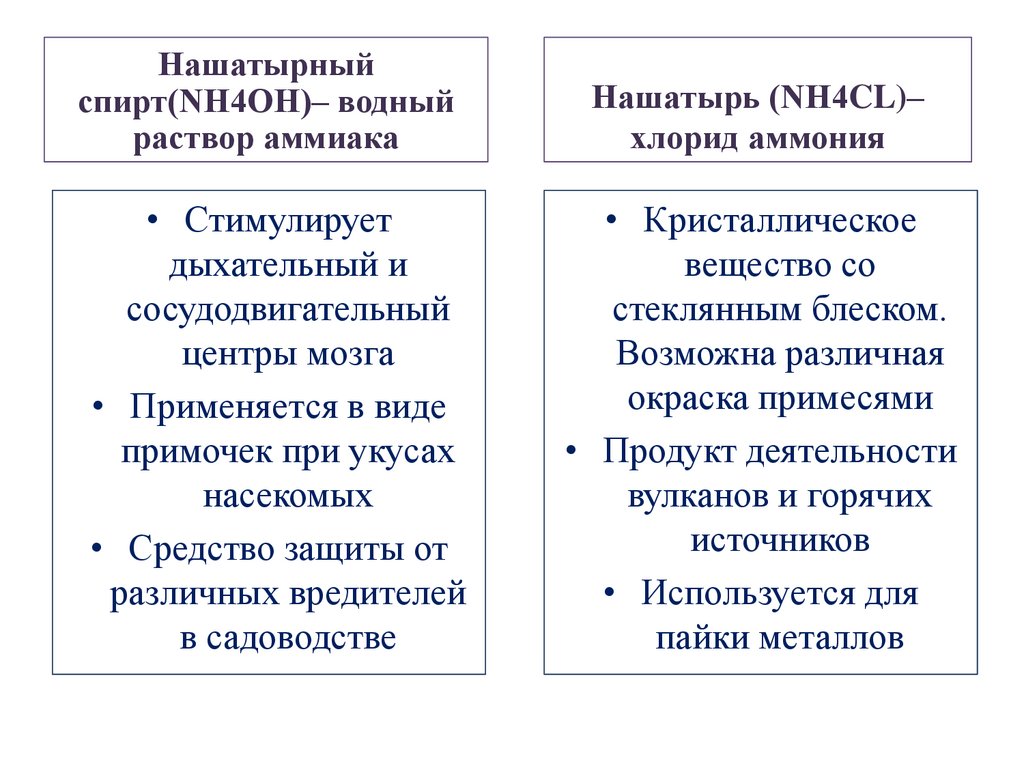
Нашатырныйспирт(NH4OH)– водный
раствор аммиака
Нашатырь (NH4CL)–
хлорид аммония
• Стимулирует
дыхательный и
сосудодвигательный
центры мозга
• Применяется в виде
примочек при укусах
насекомых
• Средство защиты от
различных вредителей
в садоводстве
• Кристаллическое
вещество со
стеклянным блеском.
Возможна различная
окраска примесями
• Продукт деятельности
вулканов и горячих
источников
• Используется для
пайки металлов
5.
Почему при укусах муравьев или ожогахкрапивой часто рекомендуют использовать
примочки с нашатырным спиртом?
6.
Нашатырный спирт нейтрализуетдействие муравьиной кислоты,
которая входит в состав выделений
муравьев и в состав крапивы.
Составьте уравнение реакции.
Формула муравьиной кислоты:
НСОО-Н+
7.
Как известно, при сильных кровотечениях, атакже ушибах или укусах насекомых, врачи
рекомендуют использовать гипотермические пакет
«Снежок».
Как, с точки зрения химии, можно объяснить
действие данного пакета?
8.
Как известно, при сильных кровотечениях, атакже ушибах или укусах насекомых, врачи
рекомендуют использовать гипотермические пакет
«Снежок».
Пакеты «СНЕЖОК»
предназначены для
местного охлаждения
тканей организма,
способствуя тем самым
снижению
воспалительной реакции
в тканях и остановки
кровотечения.
9.
В основе принципа действия гипотермическогопакета «Снежок» лежит химическая реакция, в
результате которой происходит резкое понижение
температуры.
Внутри пакета находится хрупкий пакет с водой, а
вокруг него расположена аммиачная селитра (нитрат
аммония).
При перемешивании данных веществ содержимого
пакета температура воды понижается до 0-5 °С.
Происходит эндотермическая реакция
10.
О каком веществе идет речь?Когда то в давние времена арабские алхимики у оазиса Амон
нашли бесцветные кристаллы неизвестного вещества. Для
исследования его свойств алхимики растерли это вещество в
ступке и слегка нагрели. При этом выделялся газ с резким
запахом. Они назвали это вещество –Нушадир. О каком
веществе идет речь?
11.
О каком веществе идет речь?Когда то в давние времена арабские алхимики у оазиса Амон
нашли бесцветные кристаллы неизвестного вещества. Для
исследования его свойств алхимики растерли это вещество в
ступке и слегка нагрели. При этом выделялся газ с резким
запахом. Они назвали это вещество –Нушадир. О каком
веществе идет речь?
Хлорид аммониясоль аммиака
12.
13.
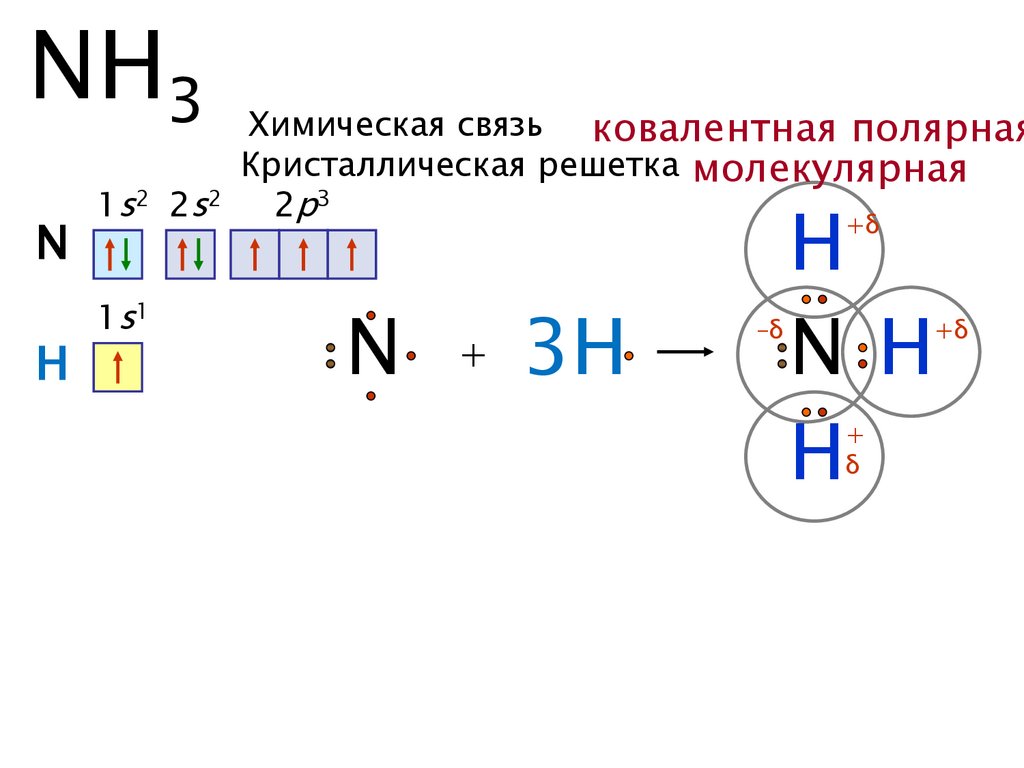
NH3N
H
Химическая связь ковалентная полярная
Кристаллическая решетка молекулярная
1s2 2s2
2p3
H
N H
H
+δ
1s1
N
+
3H
–δ
+δ
+
δ
14.
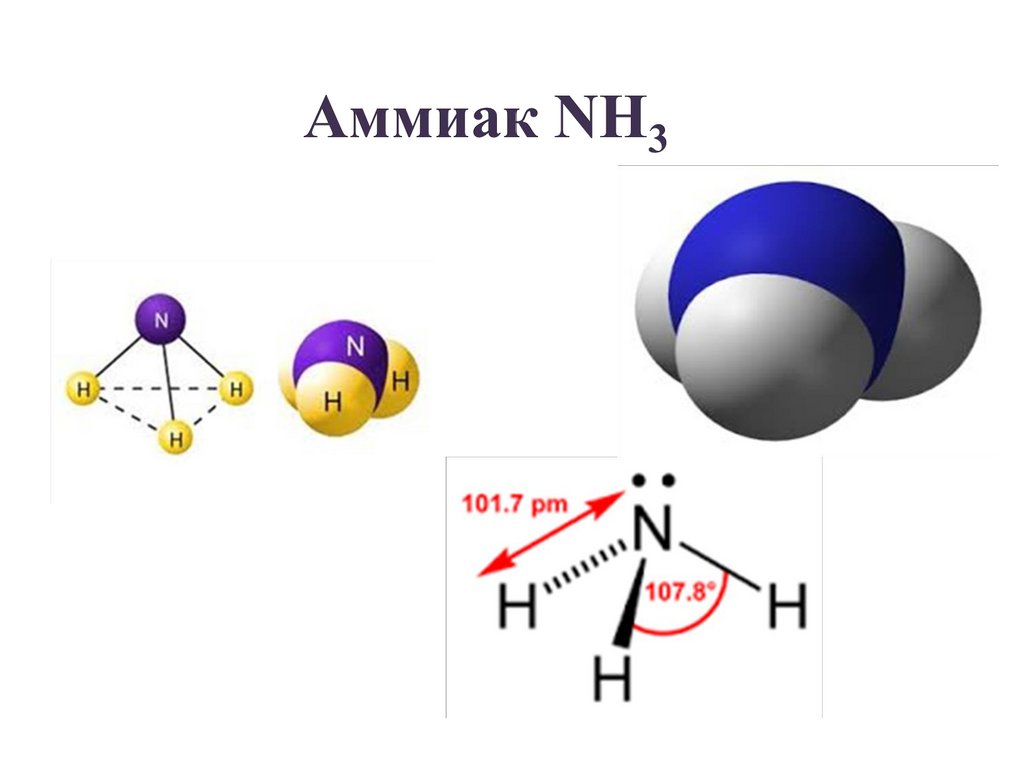
Физические свойства (при н.у. )бесцветный газ
с резким характерным запахом (запах
нашатырного спирта)
легче воздуха (М=17 г/моль)
хорошо растворяется в воде (1200
объёмов при 0 °C) и 700 объёмов (при
20 °C) в объёме воды
температура плавления -77.73 °C
температура кипения
-33.34 °C
ЯДОВИТ!
15.
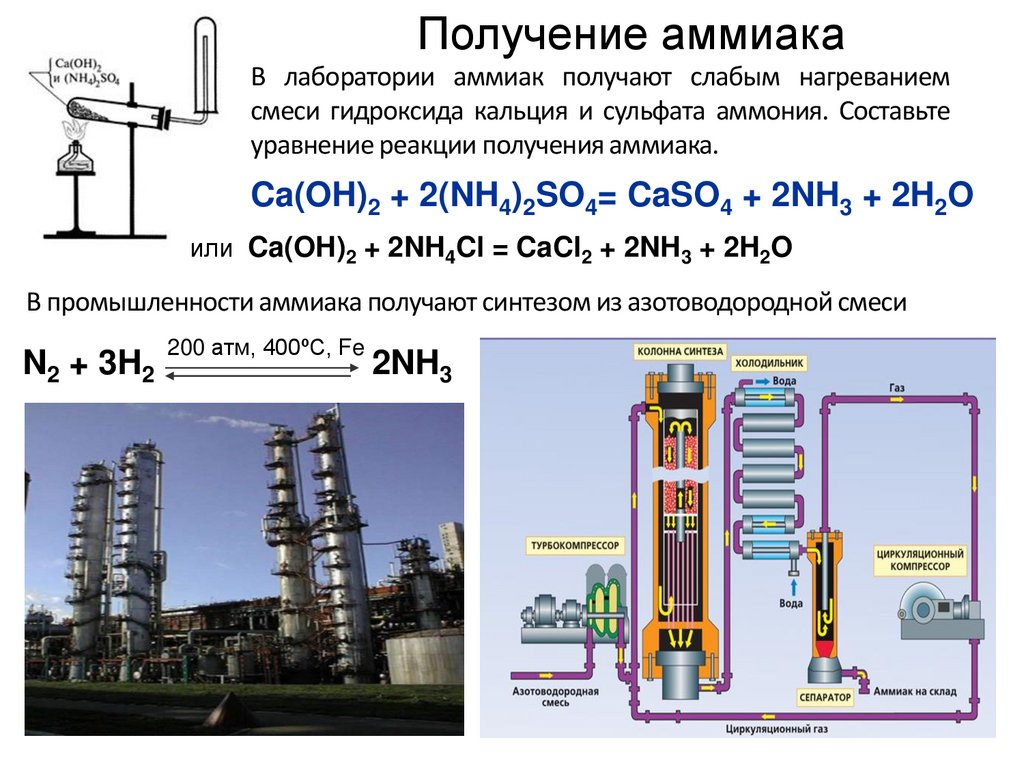
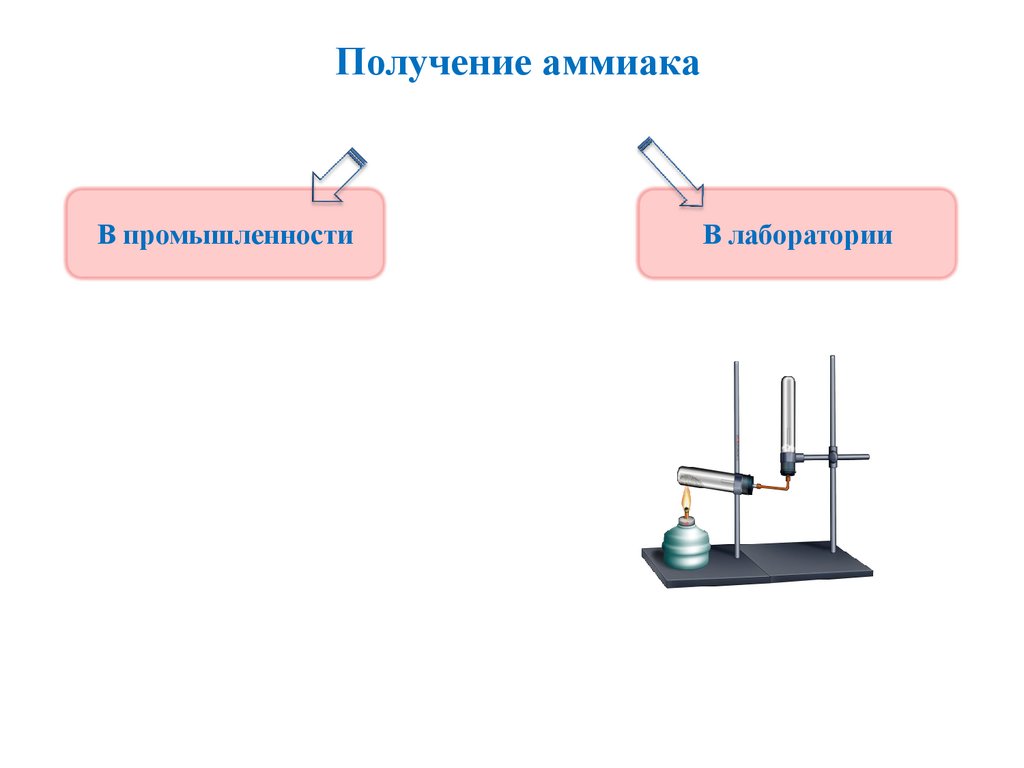
Получение аммиака16.
Получение аммиакаВ лаборатории аммиак получают слабым нагреванием
смеси гидроксида кальция и сульфата аммония. Составьте
уравнение реакции получения аммиака.
Ca(OH)2 + 2(NH4)2SO4= CaSO4 + 2NH3 + 2H2O
или Ca(OH)2 + 2NH4Cl = CaCl2 + 2NH3 + 2H2O
В промышленности аммиака получают синтезом из азотоводородной смеси
N2 + 3H2
200 атм, 400ºС, Fe
2NH3
17.
Получение аммиакаВ промышленности
В лаборатории
18.
Получение аммиакаДля получения аммиака в лаборатории используют
действие сильных щелочей на соли аммония:
2NH4Cl + Ca(OH)2= 2NH3↑ + СaCl2+ 2H2O
(NH4)2SO4 + 2NaOH = 2NH3↑ + Na2SO4 + 2H2O
Гидроксид аммония неустойчивое основание,
разлагается:
NH4OH ↔ NH3↑ + H2O
При получении аммиака держите пробирку - приёмник
дном кверху, так как аммиак легче воздуха:
19.
Промышленный способ получения аммиакаоснован на прямом взаимодействии
водорода и азота:
N2(г) + 3H2(г) ↔ 2NH3(г) + 45,9 кДж
Условия:
катализатор – пористое железо
температура – 450 – 500 ˚С
давление – 25 – 30 МПа
Это так называемый процесс Габера
(немецкий физик, разработал физикохимические основы метода).
20.
Химические свойства аммиакаДля аммиака характерны реакции:
1) с изменением степени окисления
атома азота (реакции окисления);
2) без изменения степени
окисления атома азота
(присоединение).
21.
с кислородомГорение аммиака (при нагревании)
4NH3 + 3O2 → 2N2 + 6H20
Каталитическое окисление
аммиака (катализатор Pt – Rh,
температура)
4NH3 + 5O2 → 4NO + 6H2O
22.
с оксидами металлов2NH3 +3CuO =3Cu + N2 +3H2O
23.
с сильными окислителями2NH3 + 3Cl2 = N2 + 6HCl
(при нагревании)
24.
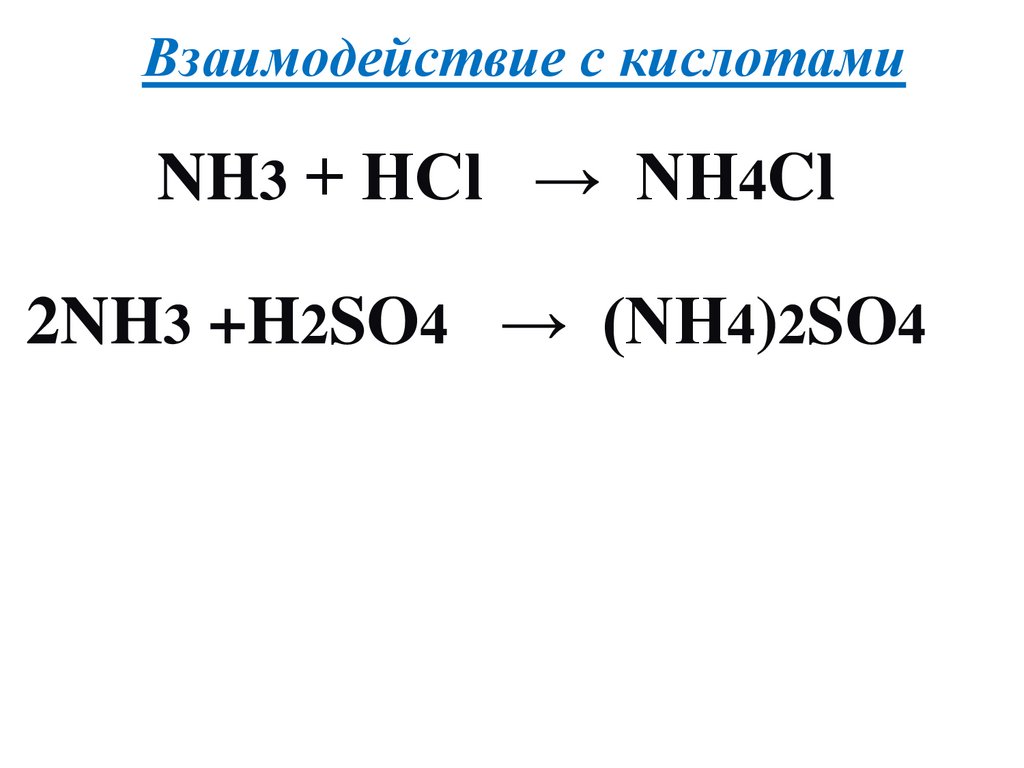
Взаимодействие с кислотамиNH3 + HCl → NH4Cl
2NH3 +H2SO4 → (NH4)2SO4
25.
Взаимодействие с водойNH3 + H2O = NH4OH
При добавлении фенолфталеина- раствор
становится малиновым, так как при
растворении аммиака частично образуется
гидроксид аммония NH4OH.
NH3 + H2O = NH3 · H2O
NH3 · H2O ↔ NH4+ + OH-
26.
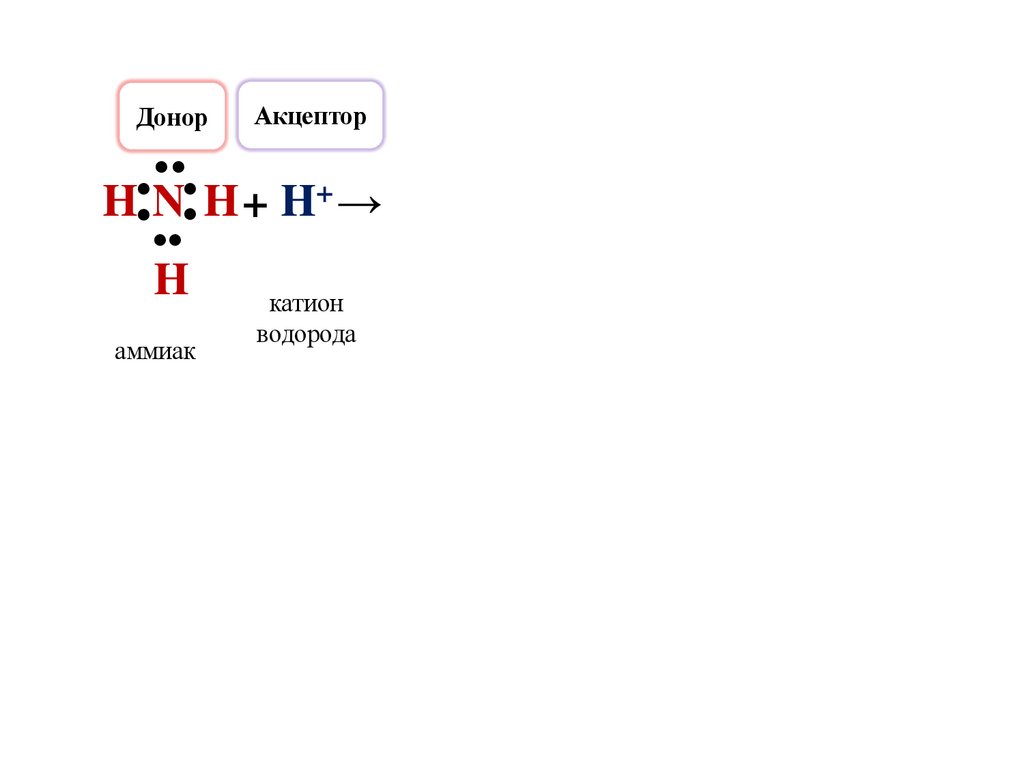
ДонорАкцептор
●
●
●
●
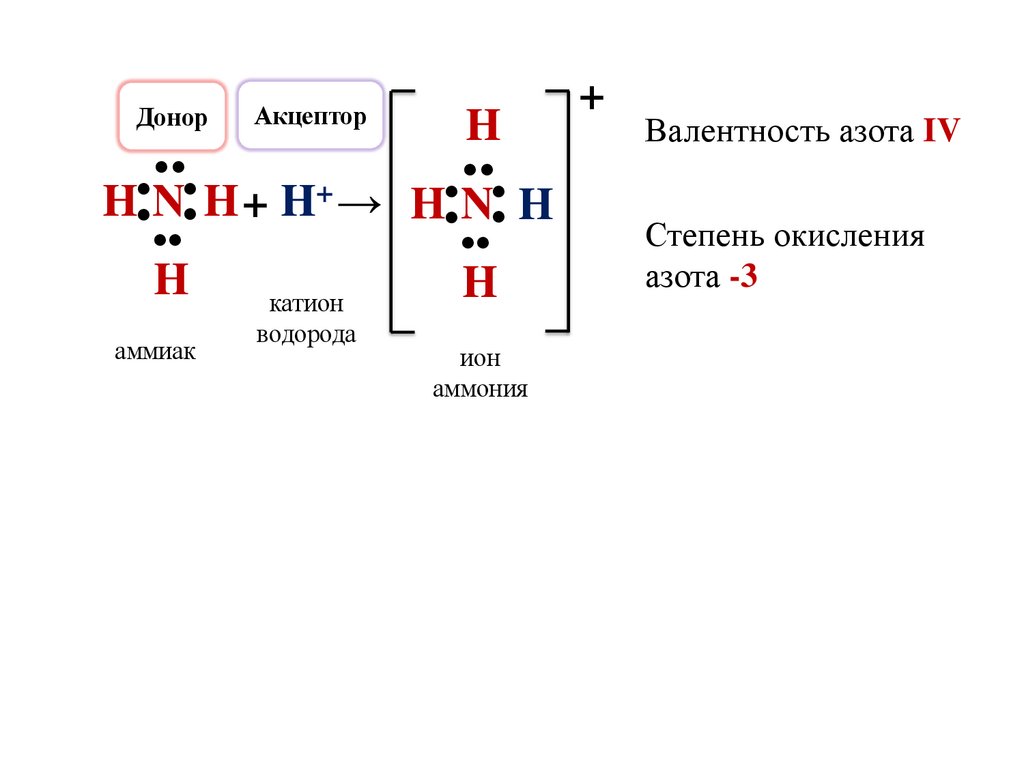
H N H + H+ →
H
аммиак
катион
водорода
27.
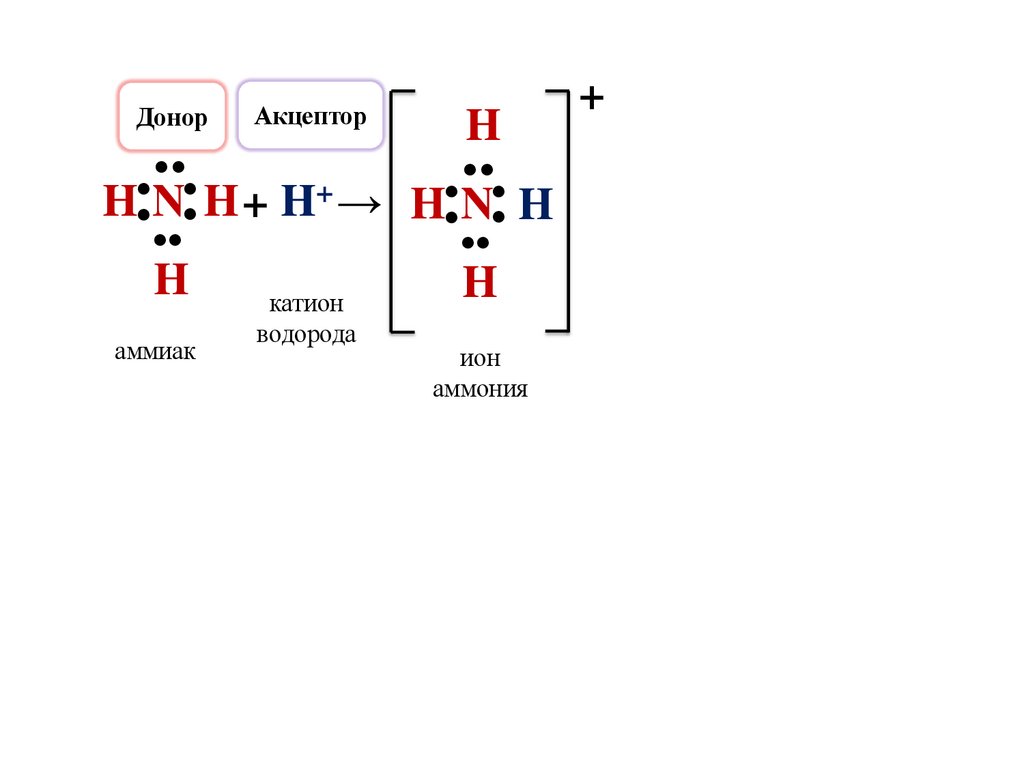
ДонорАкцептор
●
●
●
●
H
●
●
●
●
H N H + H+ → H N H
H
аммиак
катион
водорода
H
ион
аммония
+
28.
ДонорАкцептор
●
●
●
●
H
●
●
●
●
H N H + H+ → H N H
H
аммиак
катион
водорода
H
ион
аммония
+
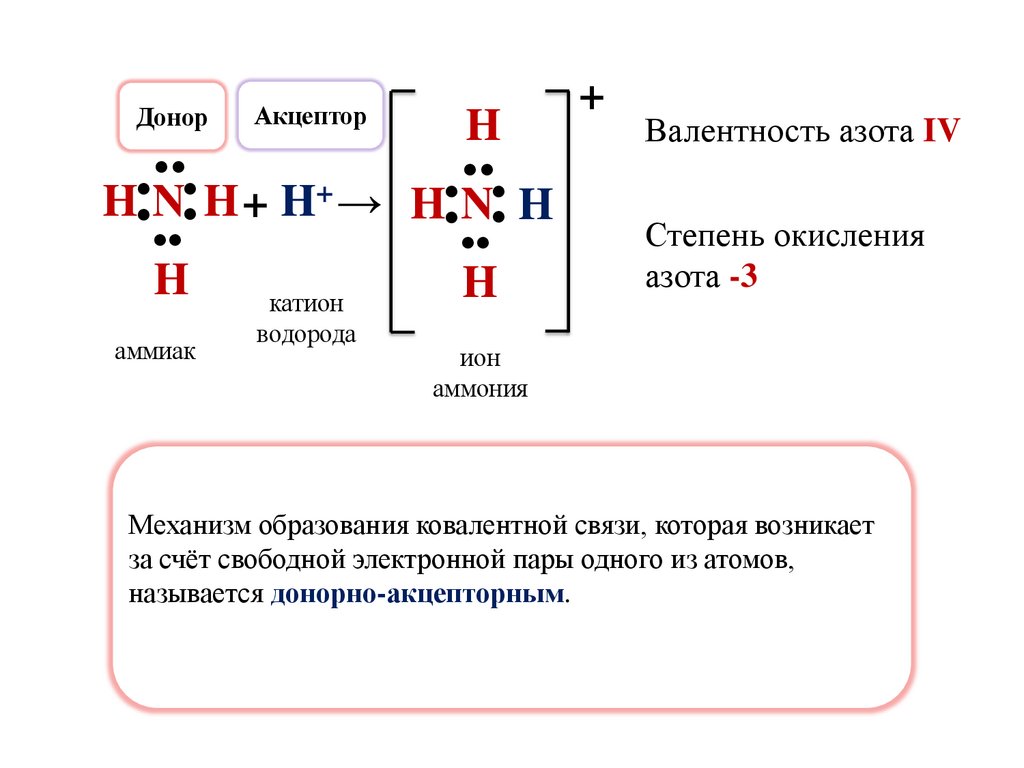
Валентность азота IV
Степень окисления
азота -3
29.
ДонорАкцептор
●
●
●
●
H
●
●
●
●
H N H + H+ → H N H
H
аммиак
катион
водорода
H
+
Валентность азота IV
Степень окисления
азота -3
ион
аммония
Механизм образования ковалентной связи, которая возникает
за счёт свободной электронной пары одного из атомов,
называется донорно-акцепторным.
30.
Это интересноПары нашатырного спирта
способны изменять окраску цветов.
Например, голубые и синие
лепестки становятся зелеными,
ярко красные — черными.
Облака Юпитера состоят из
аммиака.
31.
Применение аммиака1. Производство пластмасс и волокон
2. В составе моющих средств
3. Производство азотных удобрений
4. В сельском хозяйстве
5. Производство азотной кислоты
6. Получение взрывчатых веществ
7. В медицине
32.
12
3
4
NH3
5
6
7
33.
IV. Подведение итоговКакими особенными физическими и химическими
свойствами обладают аммиак и соли аммония? Как
можно распознать аммиак и соли аммония? Как можно
получить аммиак в лаборатории?
Домашнее задание: §17, выполнитьупр1-5после
§ 17.























 chemistry
chemistry








