Similar presentations:
d96da5d0886f4054a85c0546c8e49ae9
1. ОБЩАЯ ХАРАКТЕРИСТИКА V ГРУППЫ ГЛАВНОЙ ПОДГРУППЫ
2.
В главной подгруппе (подгруппе азота) расположены N,P, As, Sb, Bi.
Элементы имеют следующие электронные формулы:
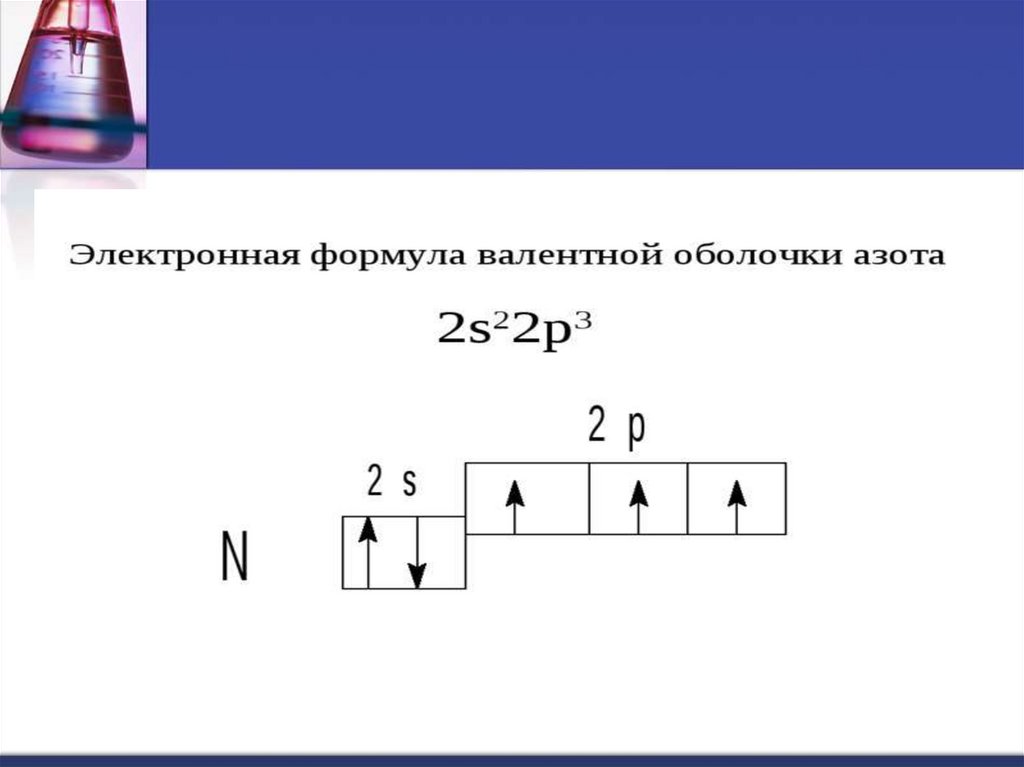
1s22s22p3
7N
1s22s22p63s23p33d0
15P
1s22s22p63s23p63d104s24p34d0
33 As
1s22s22p63s23p63d104s24p64d105s25p35d0
51 Sb
145d106s26p36d0
Bi
…………4f
83
3. Типичные представители
N, P – типичные неметаллыAs, Sb – амфотерные
Bi – преобладают металлические свойства.
Восстановительные свойства нейтральных атомов
усиливаются от N к Bi, и в этой последовательности ослабевают
неметаллические свойства. У Sb – в равной степени выражены
металлические свойства и свойства неметаллов.
4. Водородные соединения
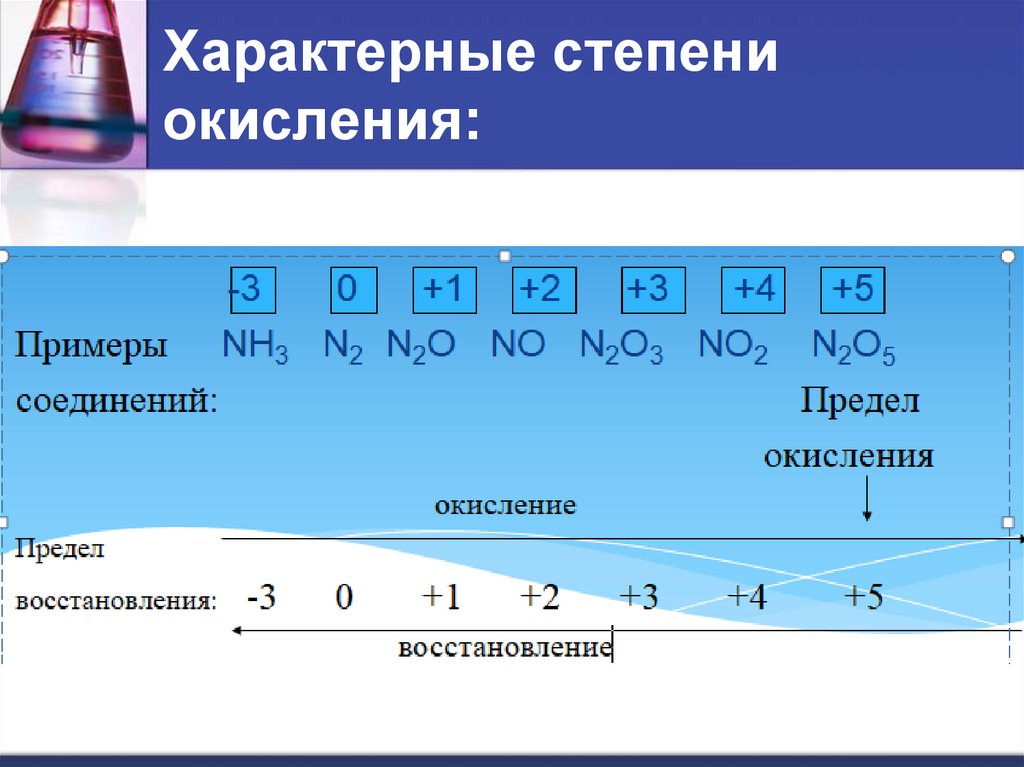
От N к Bi растет устойчивость соединений со с.о. = - 3.С водородом элементы V группы образуют соединения c общей
формулой ЭН3:
NH3 - аммиак
РН3 – фосфин
AsH3 – арсин
SbH3 – стибин
5. Важнейшие формы кислотных оксидов элементов данной группы: Э2О3 и Э2О5, например: N2О3 и P2О5
КИСЛОРОДНЫЕ СОЕДИНЕНИЯВажнейшие формы кислотных оксидов
элементов данной группы:
Э2О3 и Э2О5,
например:
N2О3 и P2О5
6. Кислоты
Способныобразовывать
кислородосодержащие
соединения, в которых имеют с.о. = +3 и +5.
HNO2
HNO3
H3PO3
H3PO4
Bi(OH)3
НBiO3
NaBiO3
Основные свойства молекул (т.е. свойства оснований)
увеличиваются по мере изменения электроотрицательности и
увеличения радиусов атомов. Все кислоты со с.о.=+5
являются сильными окислителями, кроме H3PO4
7. Азот
https://resh.edu.ru/subject/lesson/2078/main/РЭШ
8. Из приведенных утверждений выберите те, которые относятся к характеристике химического элемента азота
Менее электроотрицательный элемент, чемфосфор
В виде простого вещества может проявлять только
окислительные свойства
Его соединение с водородом проявляет основные
свойства
На внешнем энергетическом уровне содержит пять
электронов
Имеет больший радиус атома, чем фосфор
Обладает более выраженными окислительными
свойствами, чем фосфор
9. АЗОТ
Азот – неметалл главной подгруппы пятойгруппы.
Атомный (порядковый) номер 7.
Относительная атомная масса 14.
Простое вещество азот состоит из
двухатомных молекул N2
10. Азот
NaNO2 NH 4Cl N 20 NaCl 2H 2OT0
NH 4 NO2 N 20 2 H 2O
T0
Азот
Tкип ( N 2 ) 1960 C , Tпл ( N 2 ) 210 0 C
11. Ковалентная неполярная связь
12. Характерные степени окисления:
13. Получение азота
Азот - распространенный элемент: 4/5 атмосферноговоздуха состоит из азота, поэтому в промышленности его
получают фракционной перегонкой жидкого воздуха. В
лаборатории можно получить из солей при нагревании
NaNO2 NH 4Cl N 20 NaCl 2H 2O
T0
или
NH 4 NO2 N 20 2 H 2O
T0
Tкип ( N 2 ) 1960 C , Tпл ( N 2 ) 210 0 C
В 1 л H2O растворяется 23 мл азота и 330 мл O2
14. Физические свойства
При обычных условиях азот N2- газ без цвета, запаха и вкуса,
немного легче воздуха,
плохо растворяется в воде.
Температура кипения азота - 196°С.
В 1 л H2O растворяется 23 мл азота и 330 мл O2
15. Химические свойства
При обычных условиях азот – химическималоактивное вещество. Поэтому он вступает в
реакции только при высоких температурах.
В химических реакциях азот N2 может быть и
окислителем, и восстановителем
16. Азот N20 взаимодействует как окислитель:
а) с водородом:t, Р, кат.
-3 +1
2NH3 Аммиак
N20 + 3Н20
б) с металлами:
t0
N2 + 3Ca0
+2 -3
Ca3N2 Нитрид кальция
17. Азот N20 взаимодействует как восстановитель:
а) с кислородом:N20 + О20
t0 +2 -2
→ 2NO Оксид азота (II)
б) с фтором:
+3 -1
N20 + 3F20 = 2NF3 Фторид азота (III)
18. Домашнее задание
Параграф 16, пересказ.Сообщение по теме «Азотные
удобрения»
Задание 3,4 письменно.

















 chemistry
chemistry








