Similar presentations:
1_1__proteine_ru_2023-2024_stud-118606
1. БИОХИМИЯ
Svetlana Protopopdoctor în științe medicale,
conferențiar universitar
2. Рекомендованная литература
1. Северин Е.С. Биохимия. Учебник длявузов, 2004, 2011
2. Тюкавкина Н.А. Биоорганическая химия,
2009
3. http://biochimia.usmf.md/ru/infostudenti/biochimie-descriptiva/suportulteoretic
4. https://themedicalbiochemistrypage.org/
5. Лекционный материал
3. Биохимия
(bios – жизнь) – химия жизни;наука о структуре химических веществ,
входящих в состав живой материи, их
превращении и физико-химических
процессах, лежащих в основе
жизнедеятельности.
Задачи биохимии – полное понимание на
молекулярном уровне природы всех
химических процессов, связанных с
жизнедеятельностью клеток.
4. Особенности живой материи
1.2.
3.
4.
Высокий уровень структурной
организации.
Способность к преобразованию и
использованию энергии.
Обмен веществ с окружающей средой и
саморегуляция химических превращений.
Передача генетической информации.
5.
БИОЭЛЕМЕНТЫ И БИОМОЛЕКУЛЫ.ФУНКЦИОНАЛЬНЫЕ ГРУППЫ И
ХИМИЧЕСКИЕ СВЯЗИ, ПРИСУЩИЕ
БИОМОЛЕКУЛАМ
6.
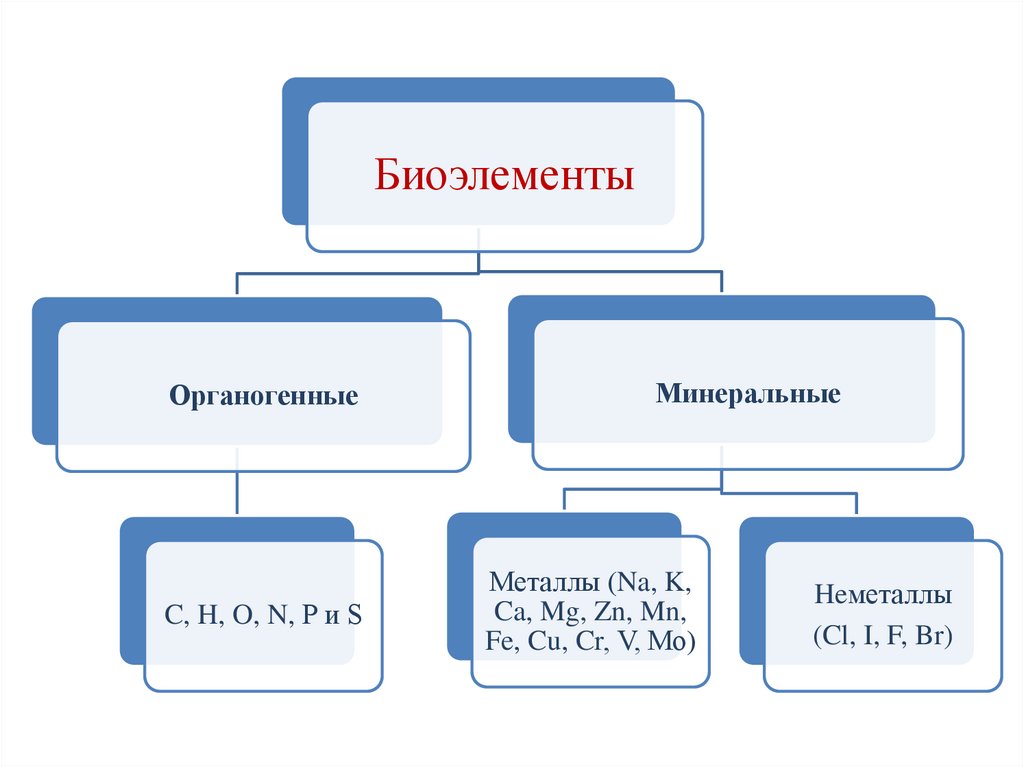
БиоэлементыОрганогенные
C, H, O, N, P и S
Минеральные
Металлы (Na, K,
Ca, Mg, Zn, Mn,
Fe, Cu, Cr, V, Мо)
Heметаллы
(Cl, I, F, Br)
7.
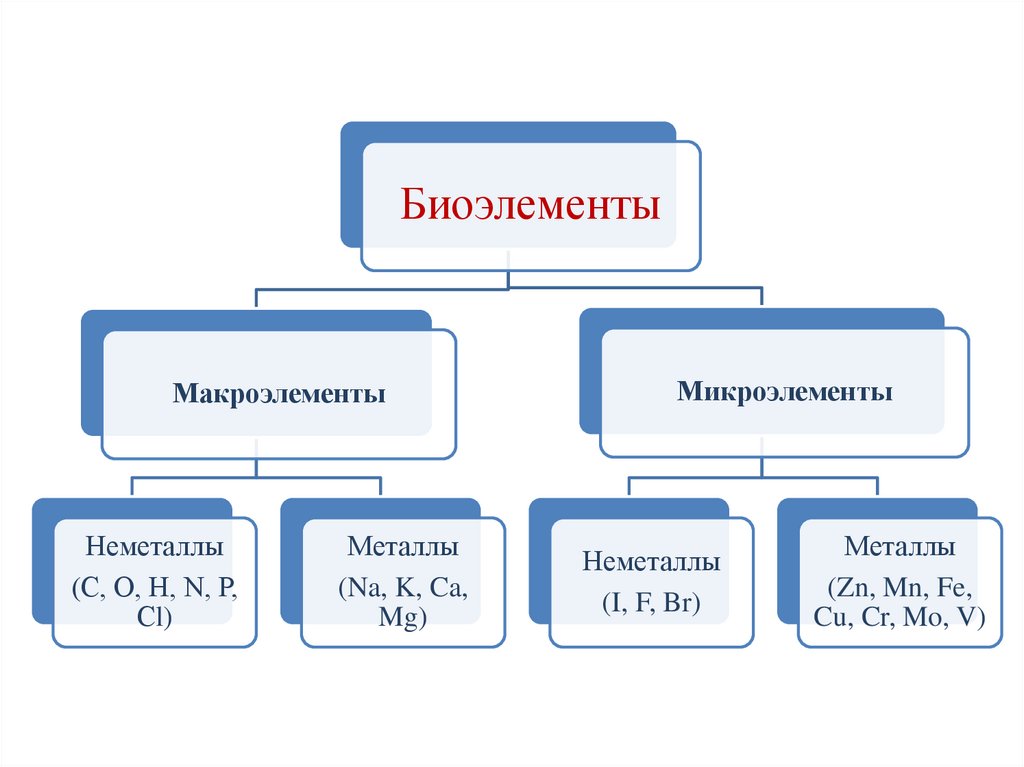
БиоэлементыМакроэлементы
Неметаллы
(С, О, Н, N, Р,
Сl)
Металлы
(Na, K, Ca,
Mg)
Микроэлементы
Неметаллы
(I, F, Br)
Металлы
(Zn, Mn, Fe,
Cu, Cr, Mo, V)
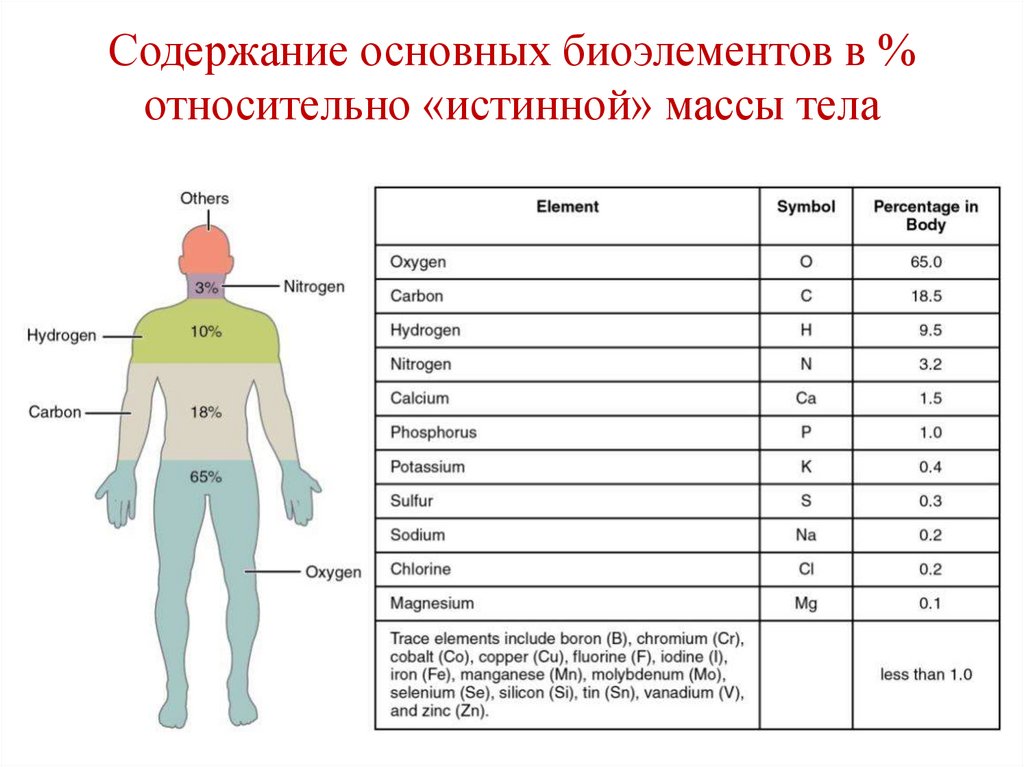
8. Содержание основных биоэлементов в % относительно «истинной» массы тела
9.
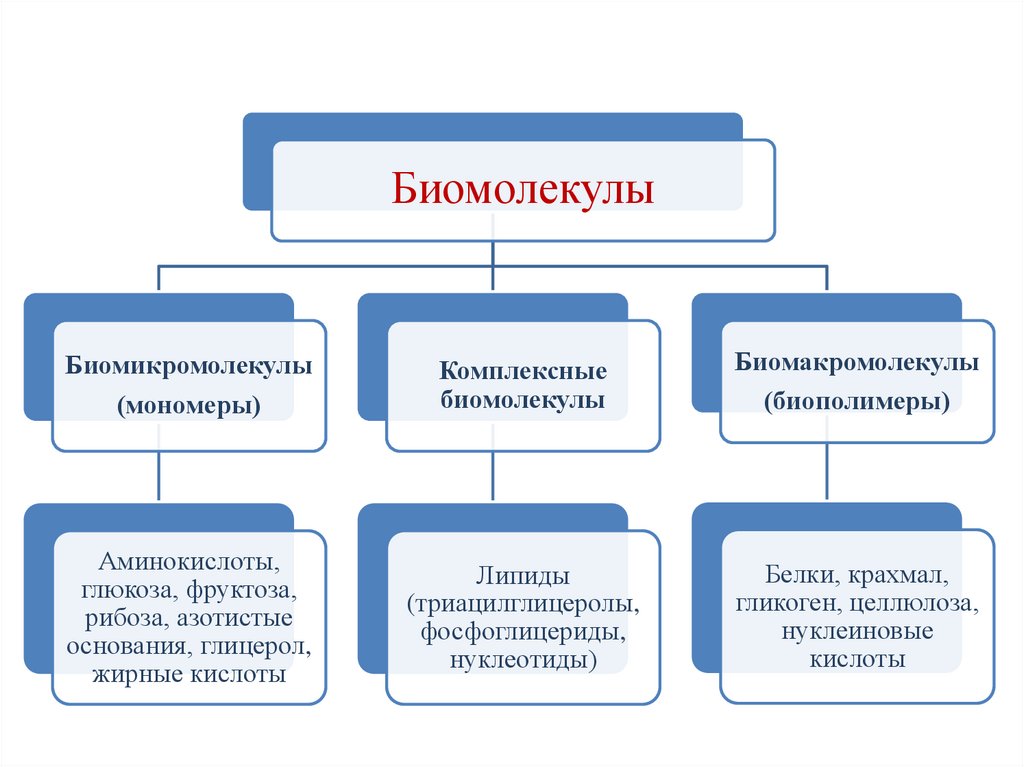
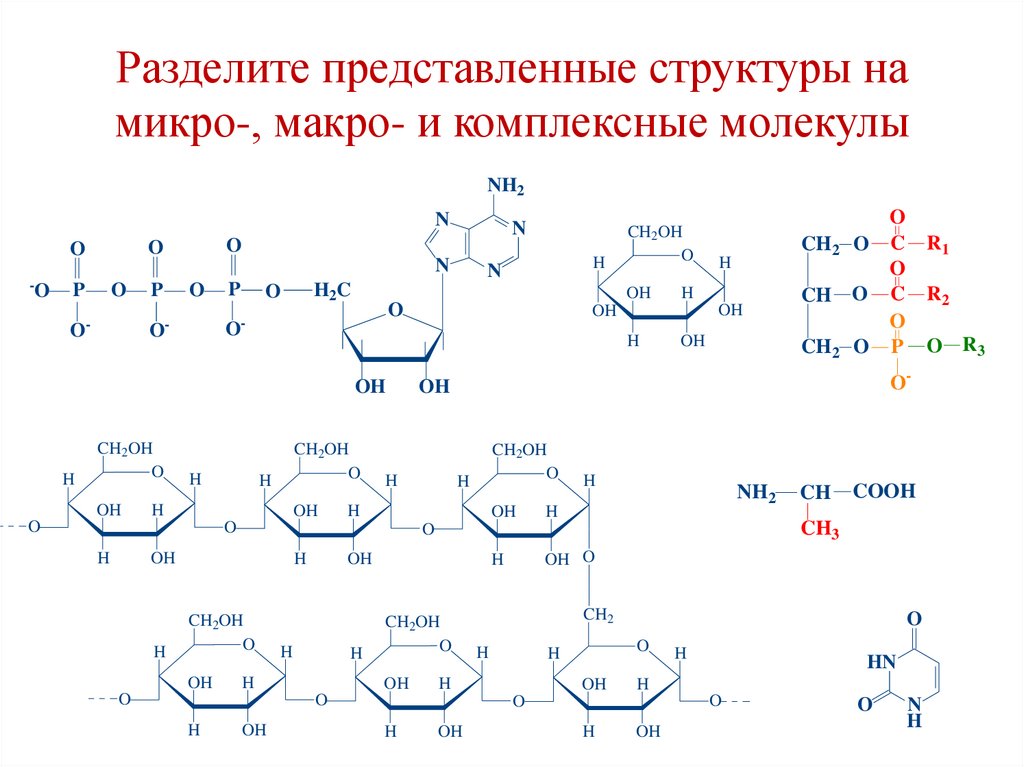
БиомолекулыБиомикромолекулы
(мономеры)
Комплексные
биомолекулы
Биомакромолекулы
(биополимеры)
Аминокислоты,
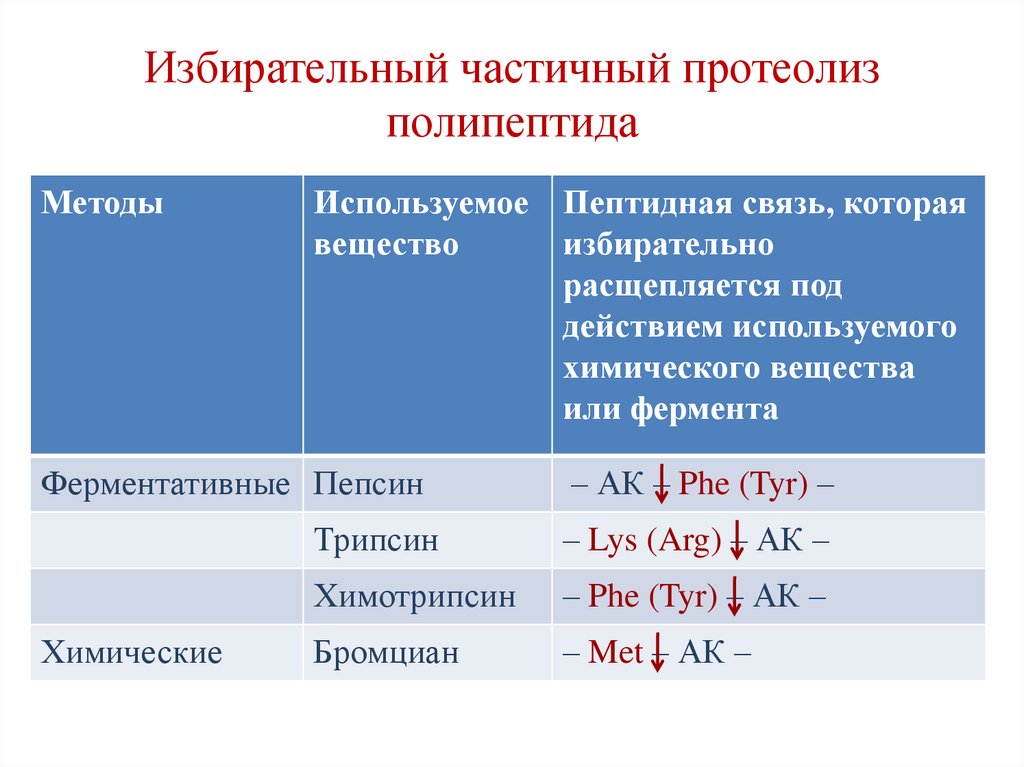
глюкоза, фруктоза,
рибоза, азотистые
основания, глицерол,
жирные кислоты
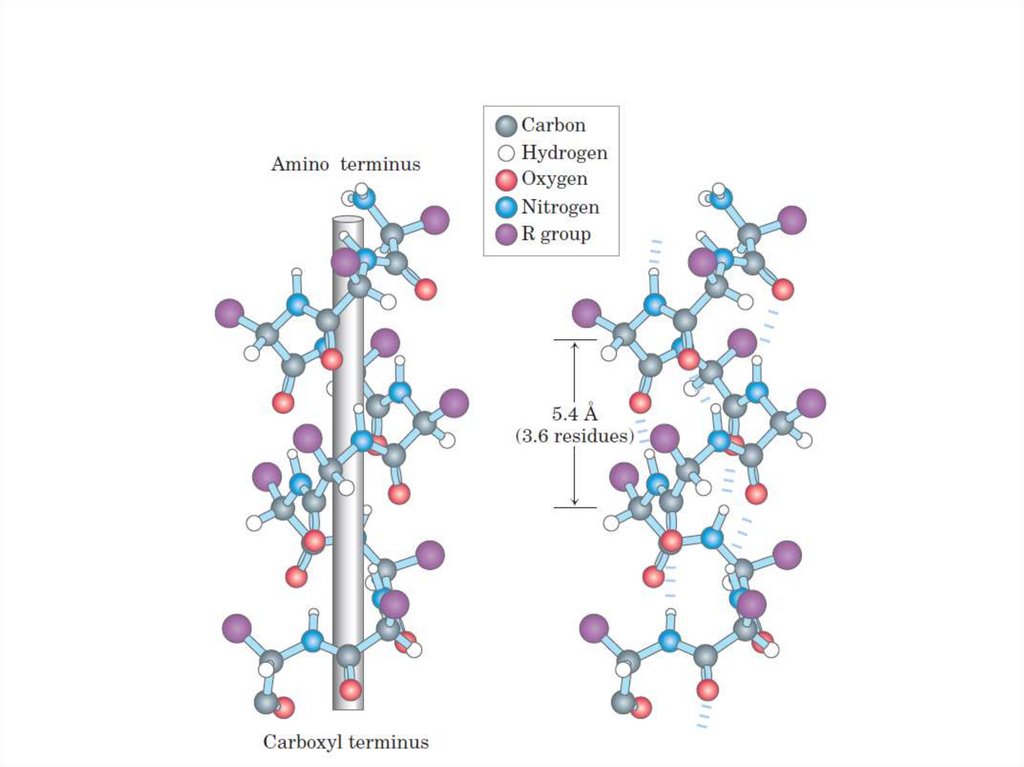
Липиды
(триацилглицеролы,
фосфоглицериды,
нуклеотиды)
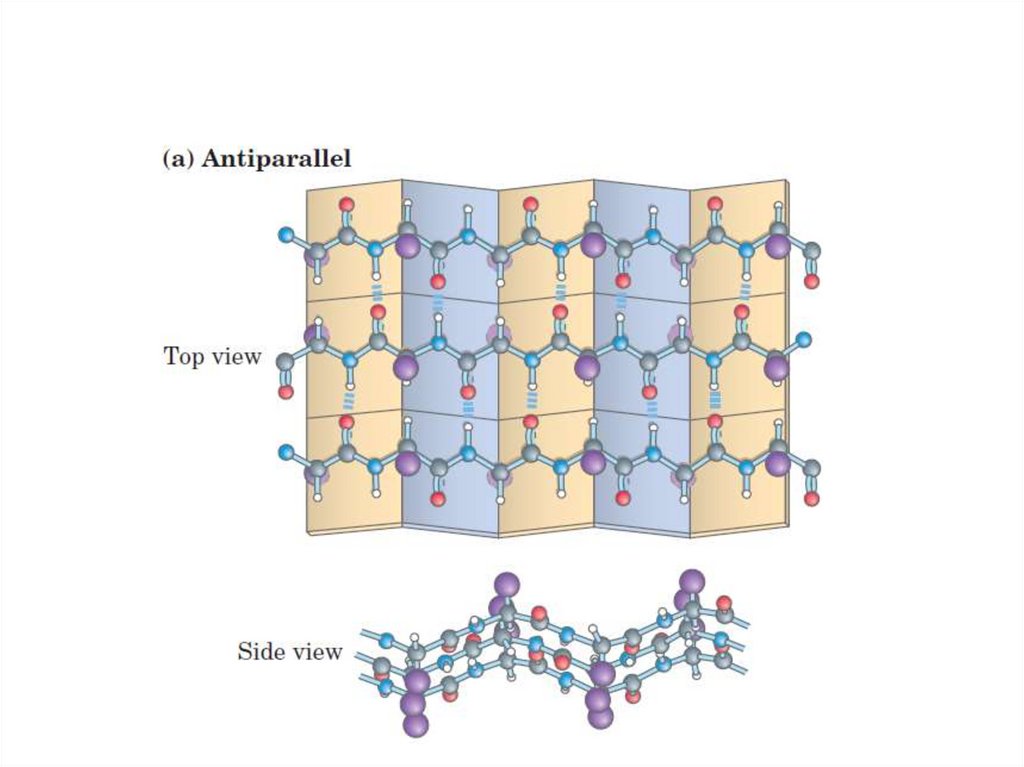
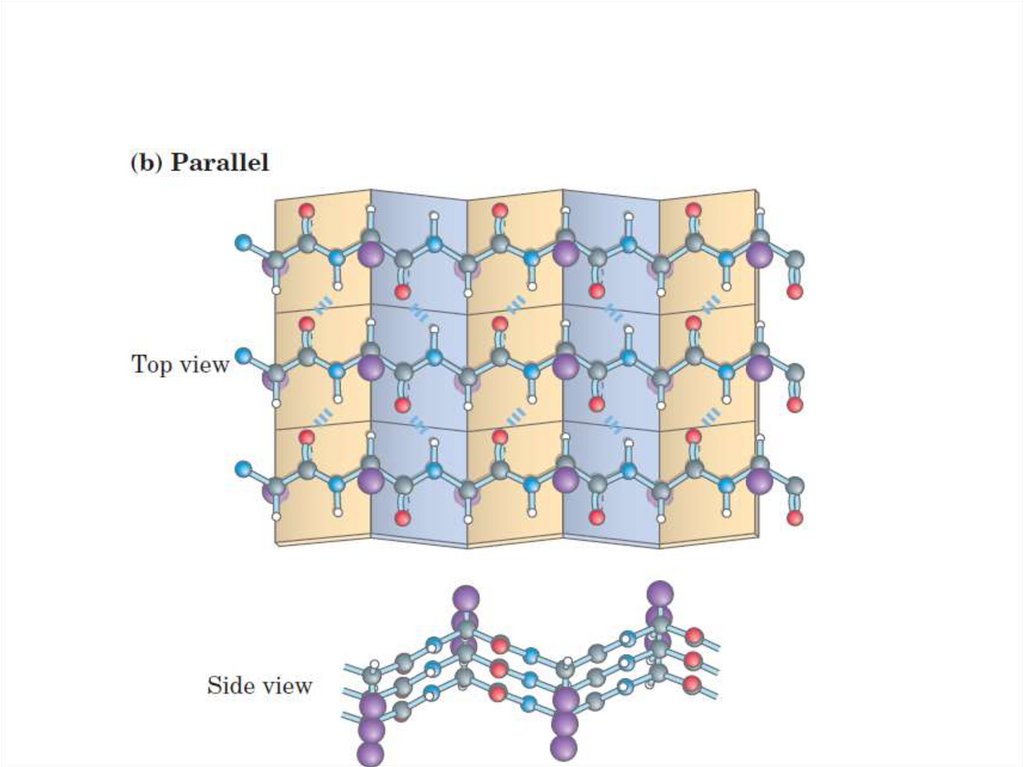
Белки, крахмал,
гликоген, целлюлоза,
нуклеиновые
кислоты
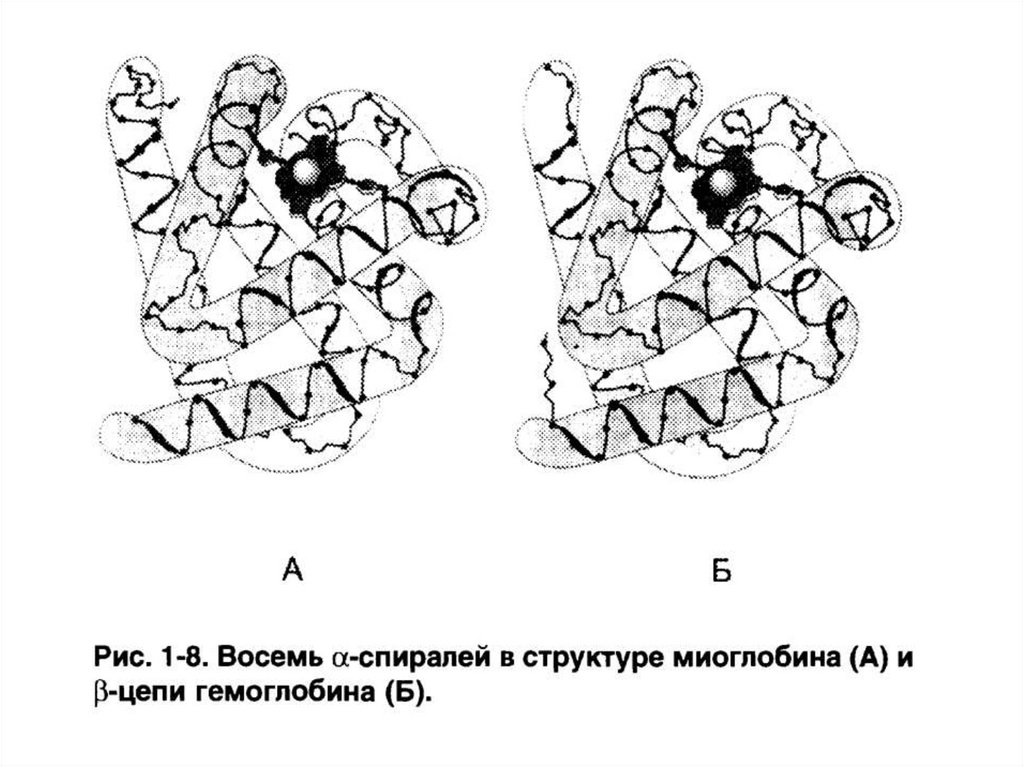
10. Разделите представленные структуры на микро-, макро- и комплексные молекулы
NH2N
-O
O
O
O
P
O
O-
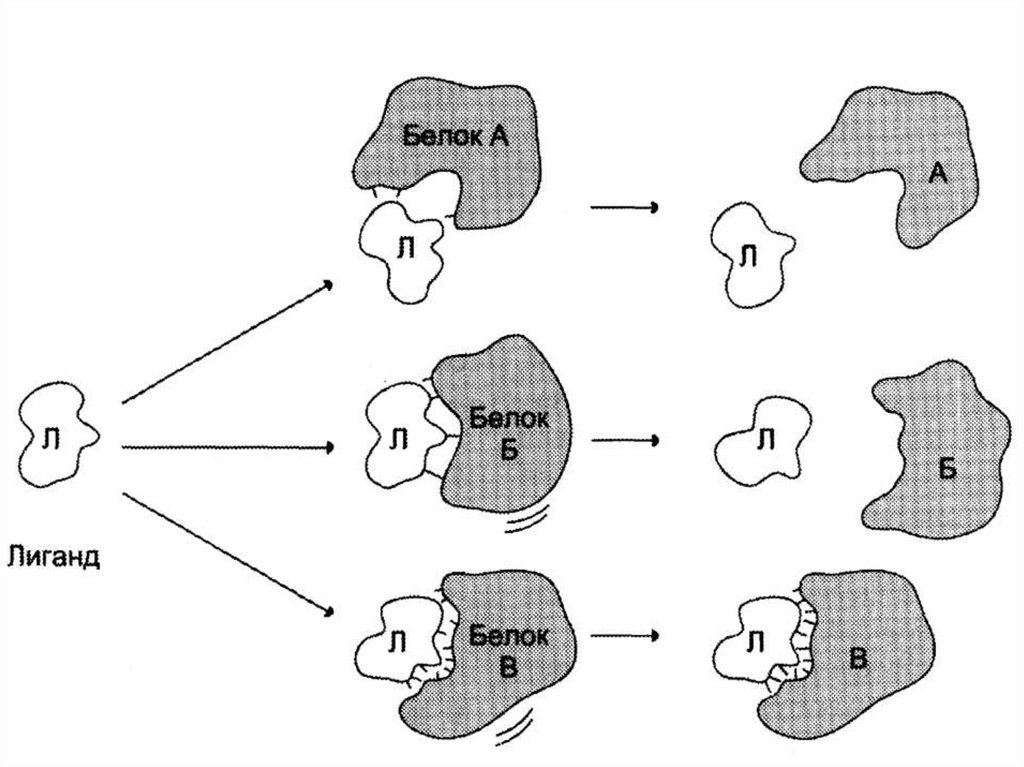
P
N
O
P
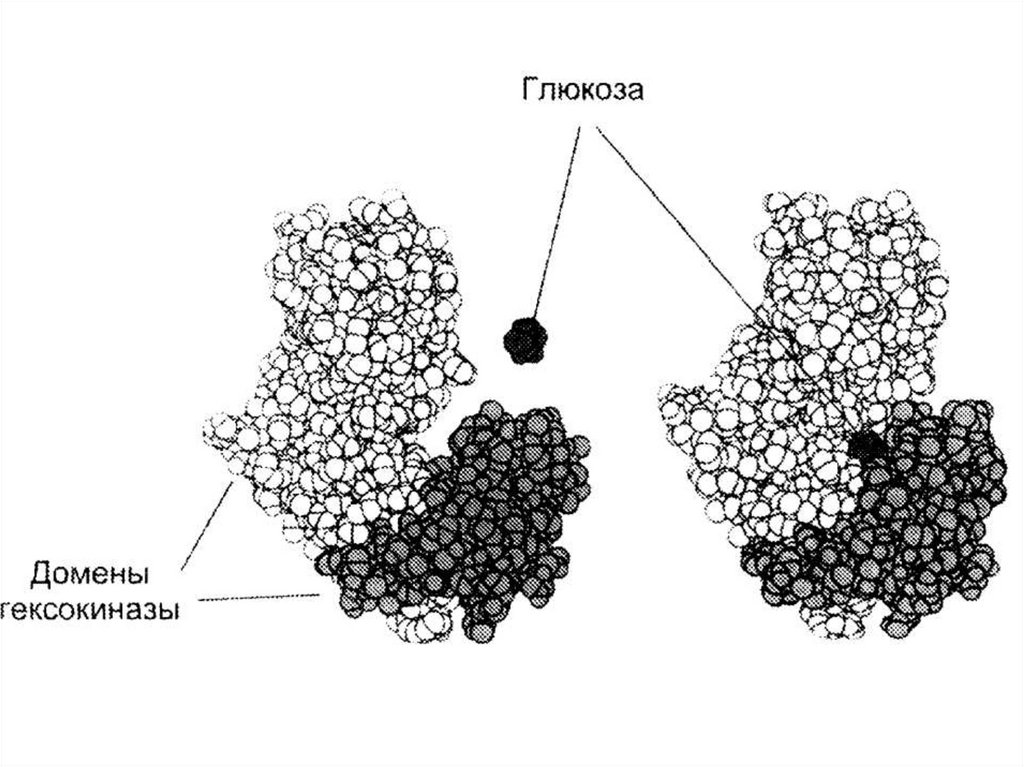
H2C
O
OH
H
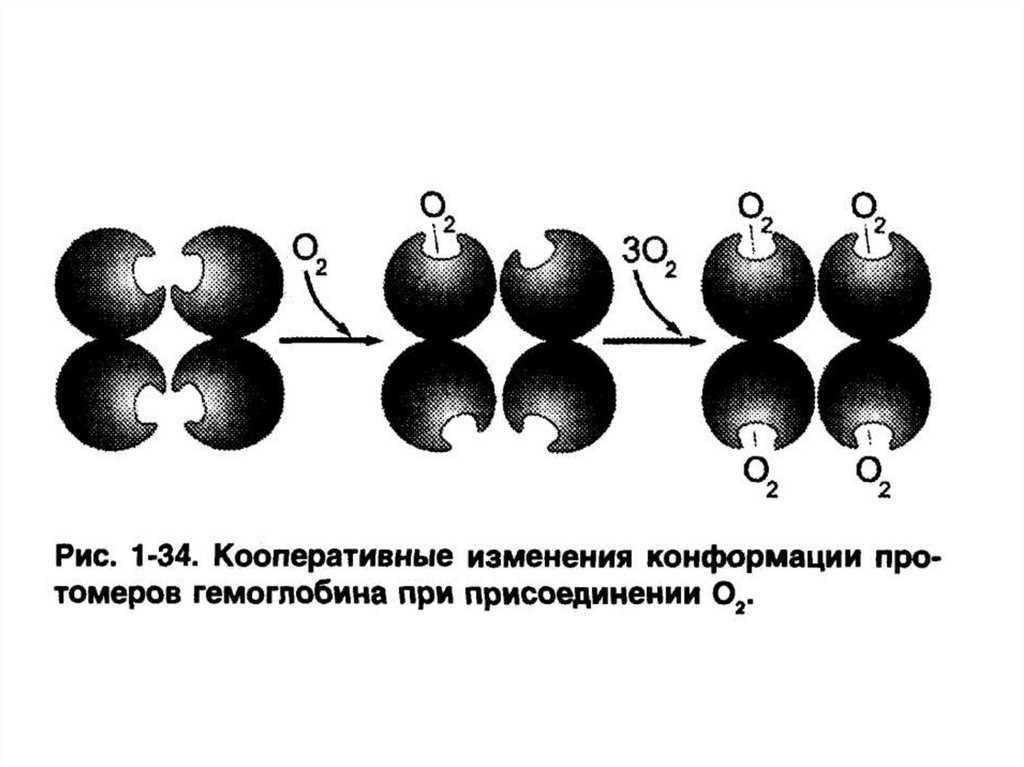
CH2OH
O
H
OH
H
H
CH2OH
O
OH
OH
H
CH2OH
O
H
H
H
OH
CH2 O
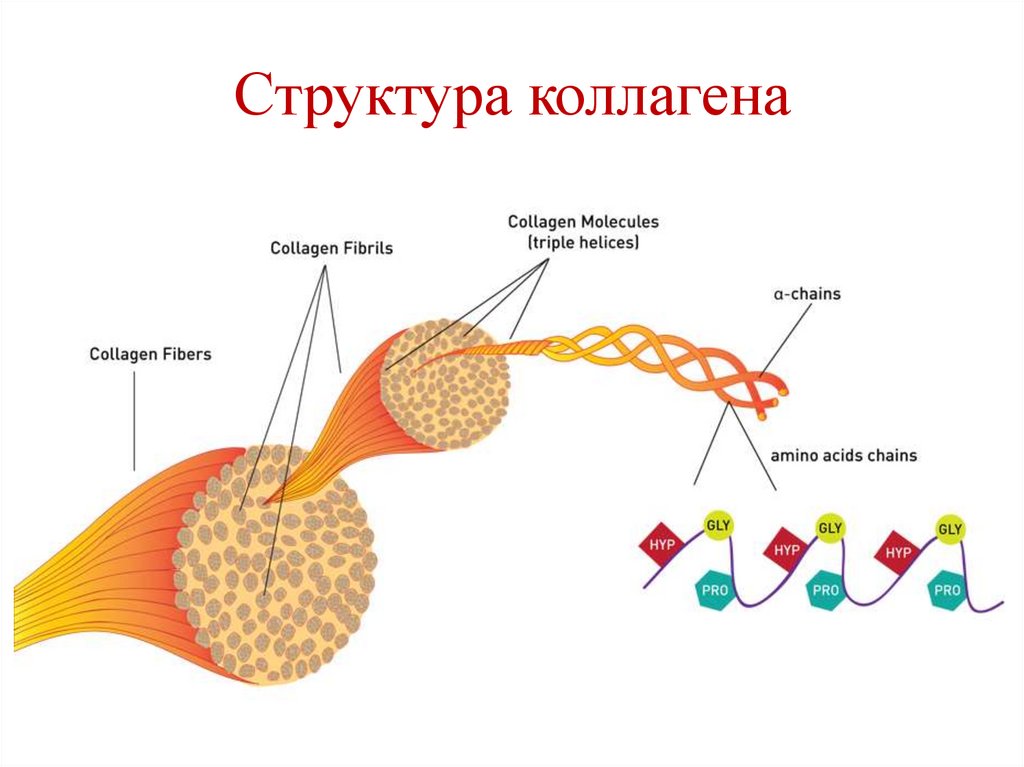
CH2OH
O
H
NH2
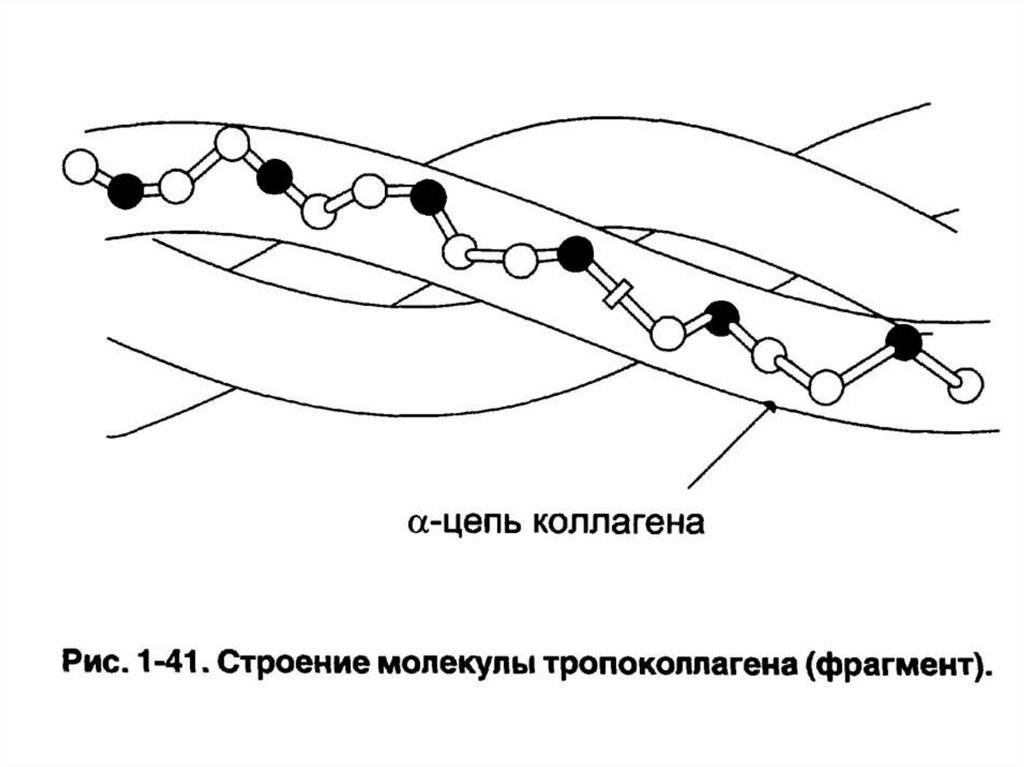
H
CH
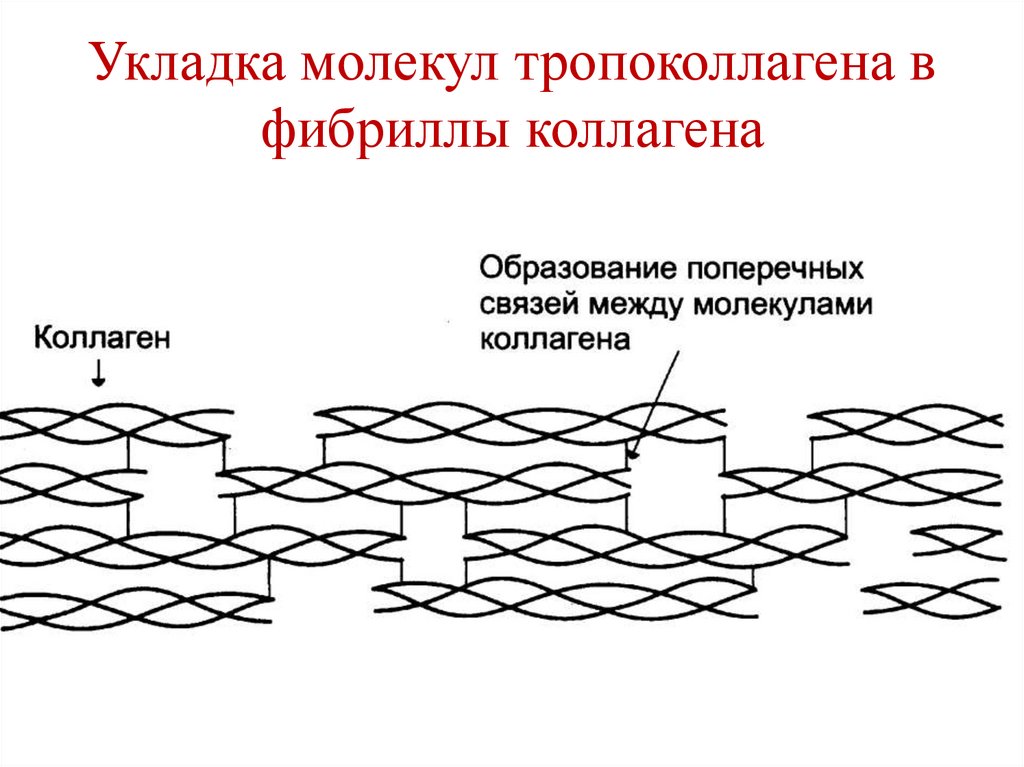
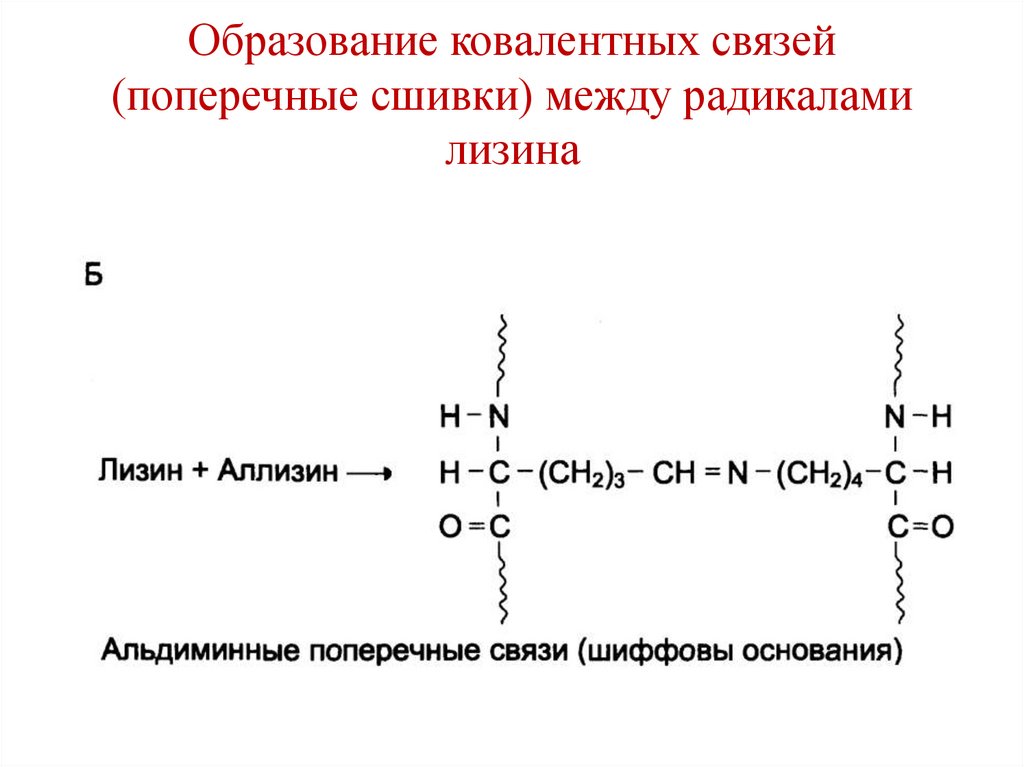
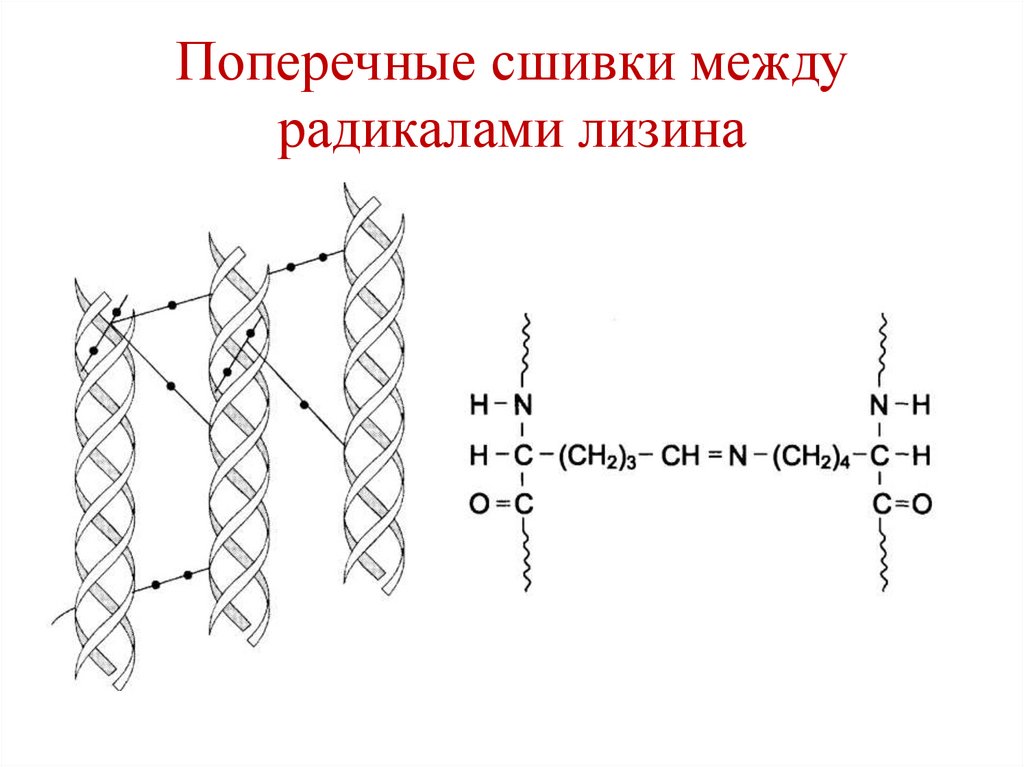
O R3
COOH
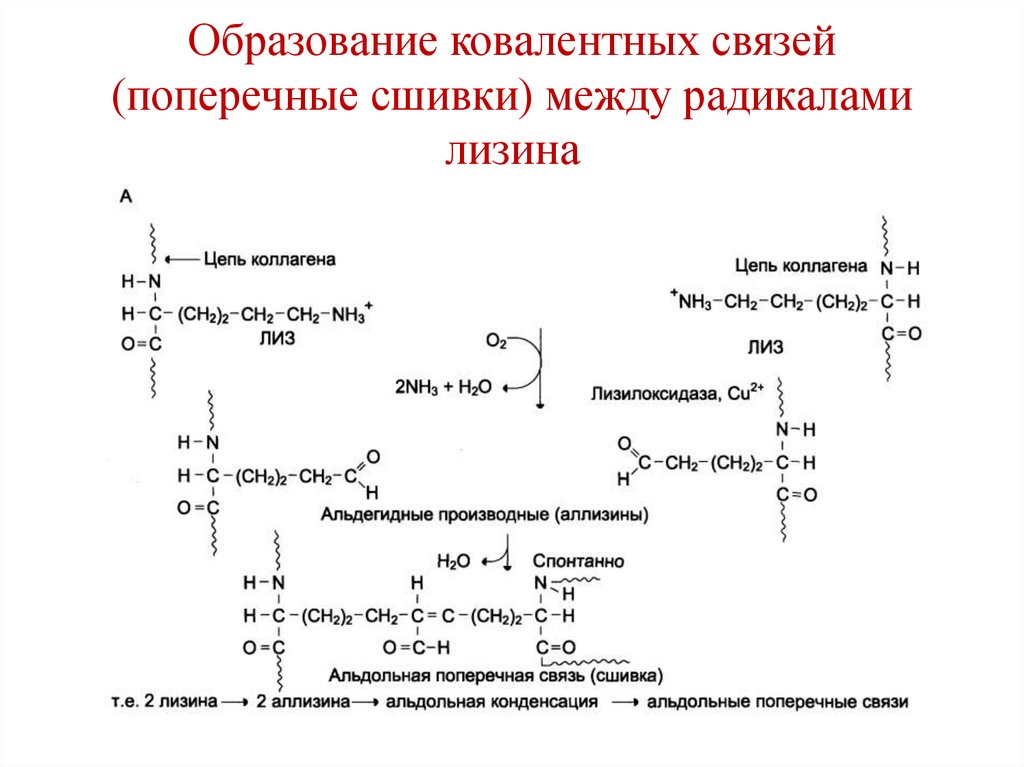
CH2
H
O
O
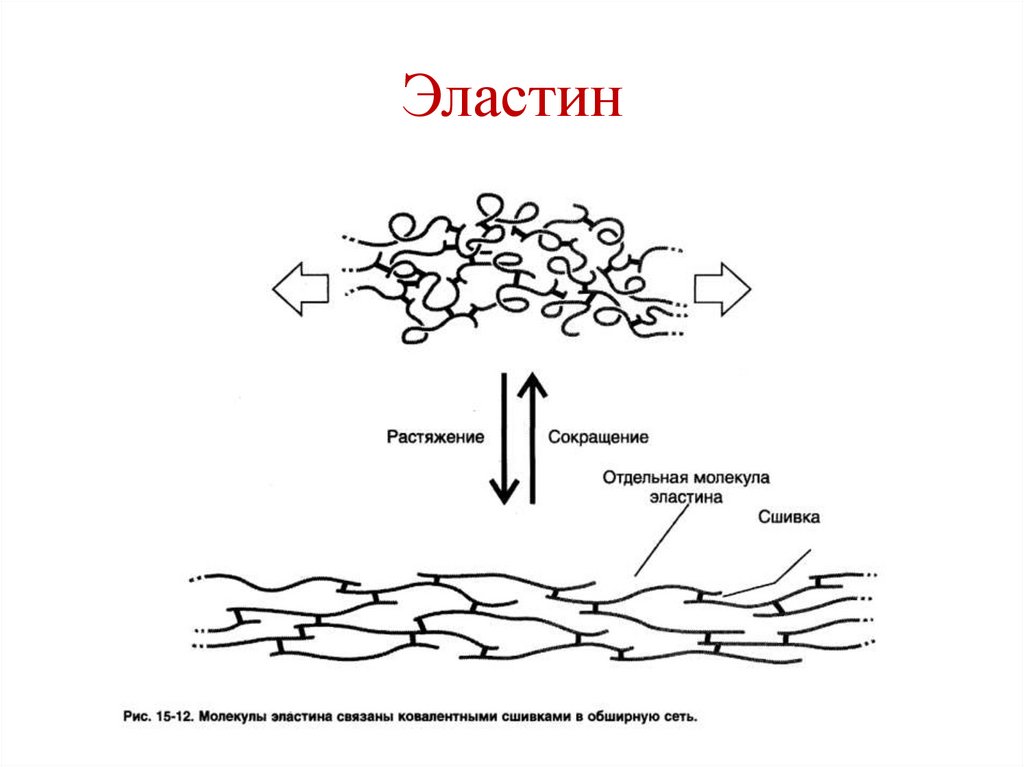
H
OH
OH
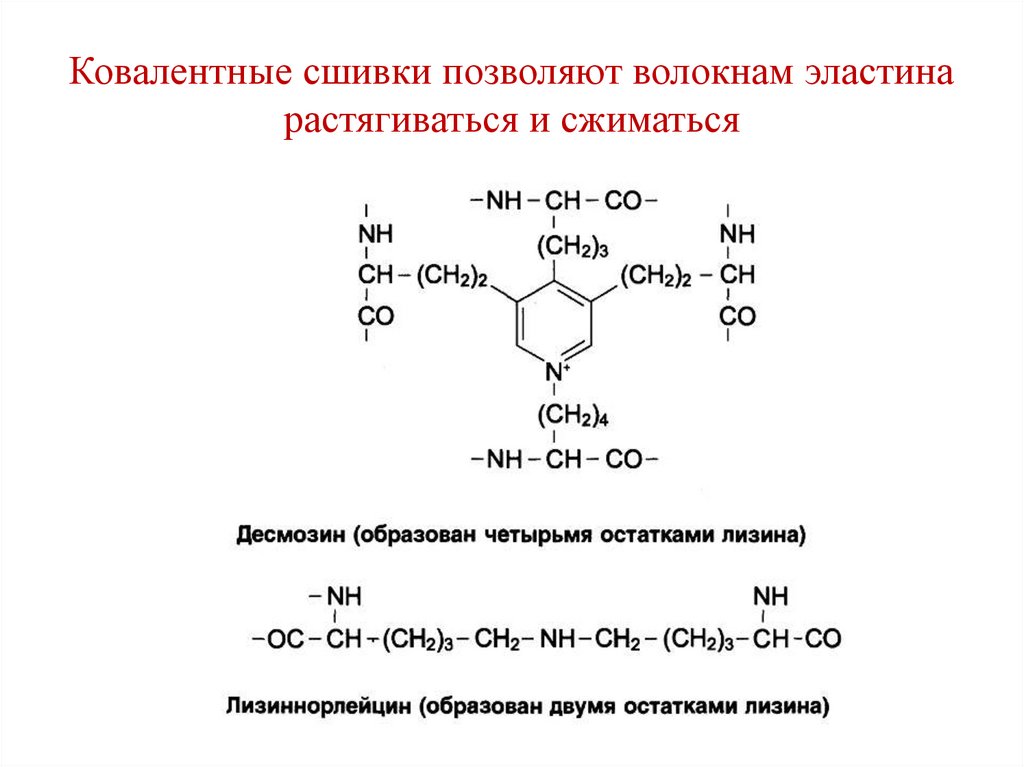
H
HN
H
O
O
H
R2
OH O
H
O
OH
R1
CH3
H
OH
CH O
O
C
O
C
O
P
O-
OH
H
O
H
OH
O
OH
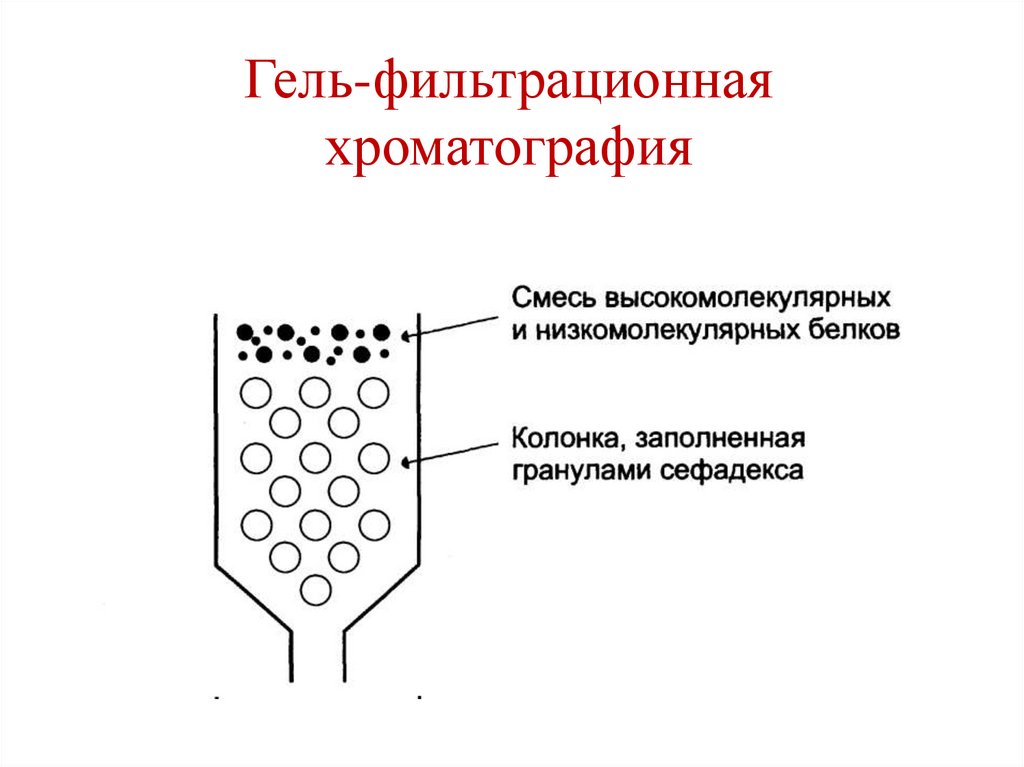
H
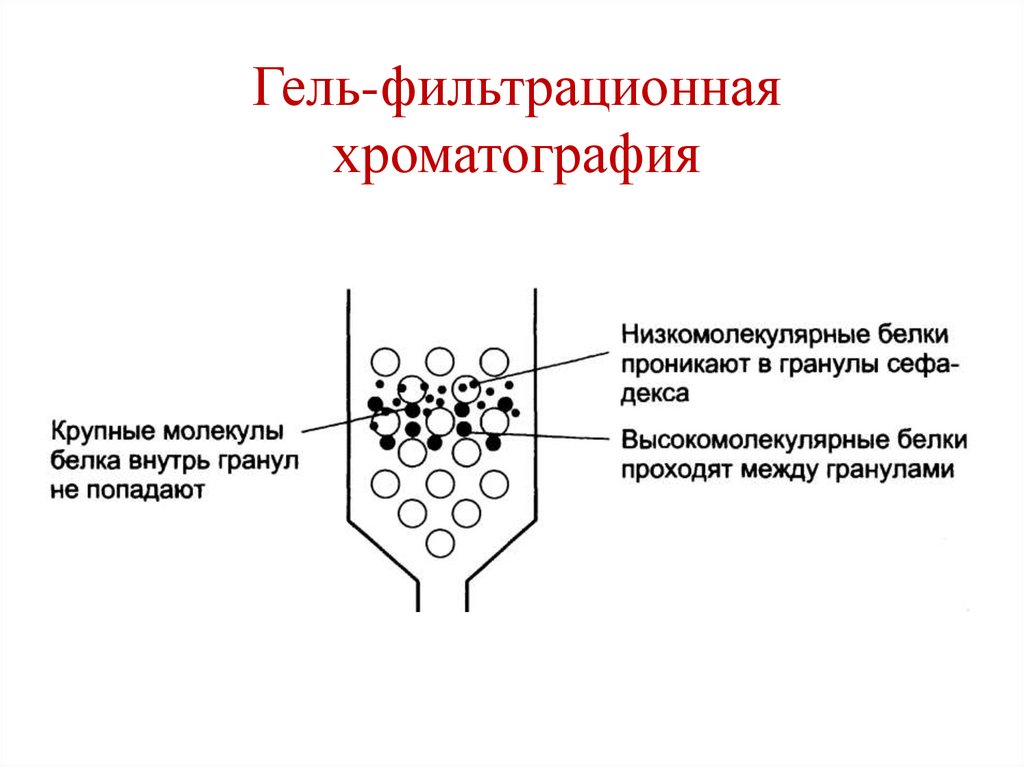
H
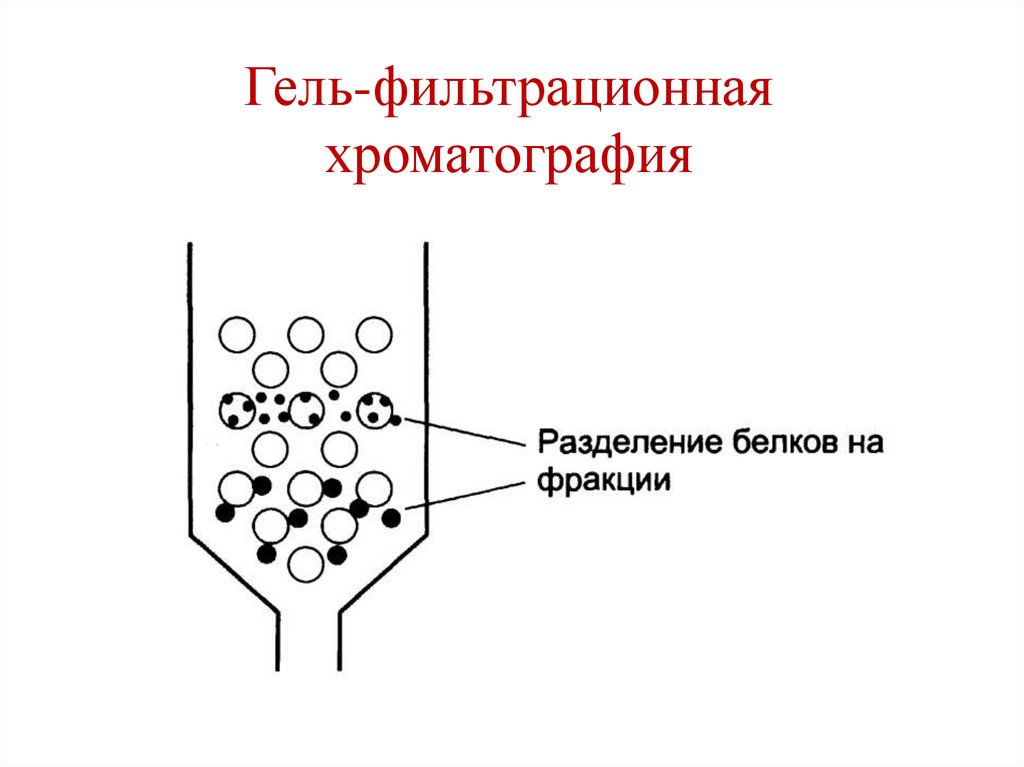
OH
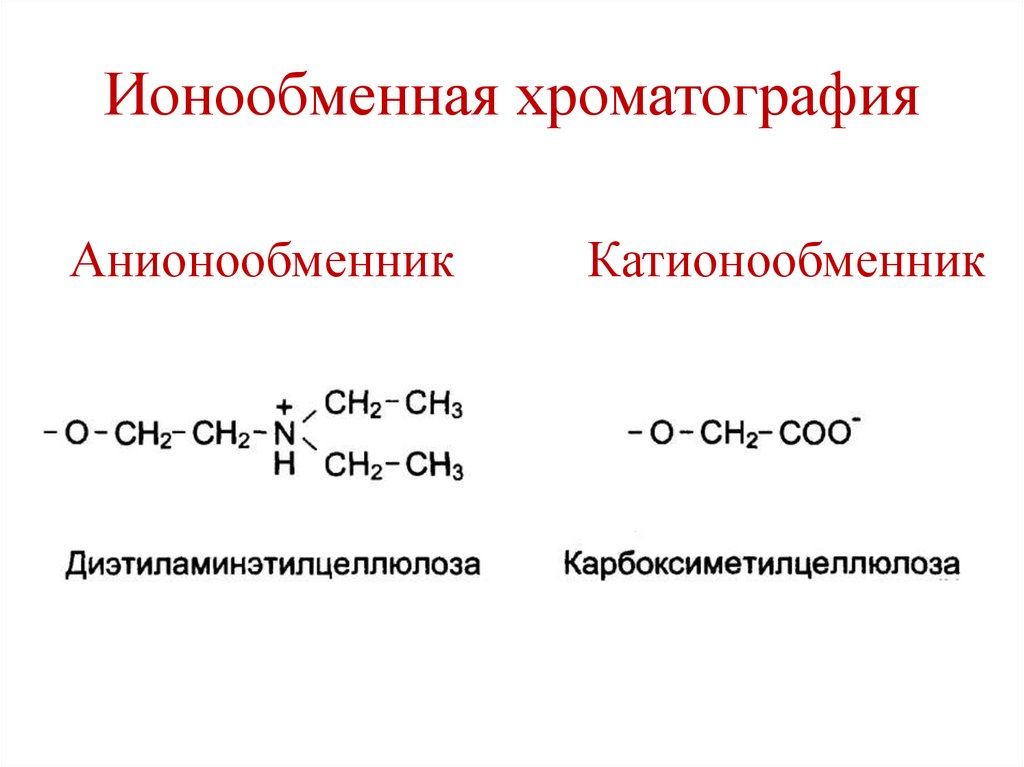
H
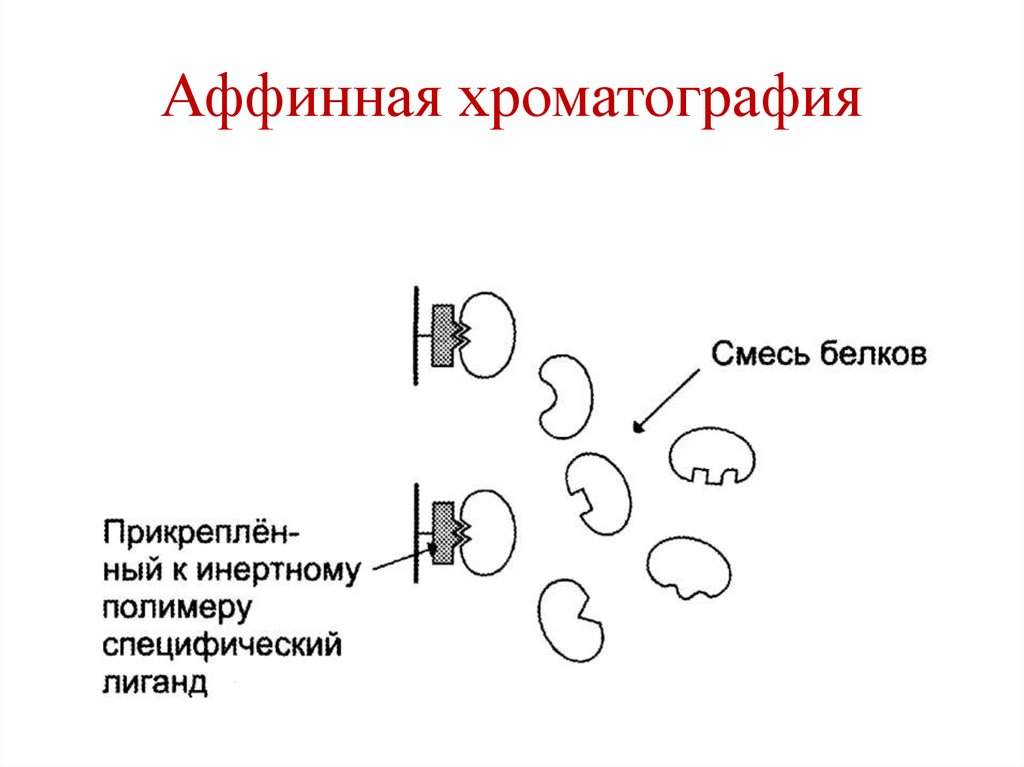
O
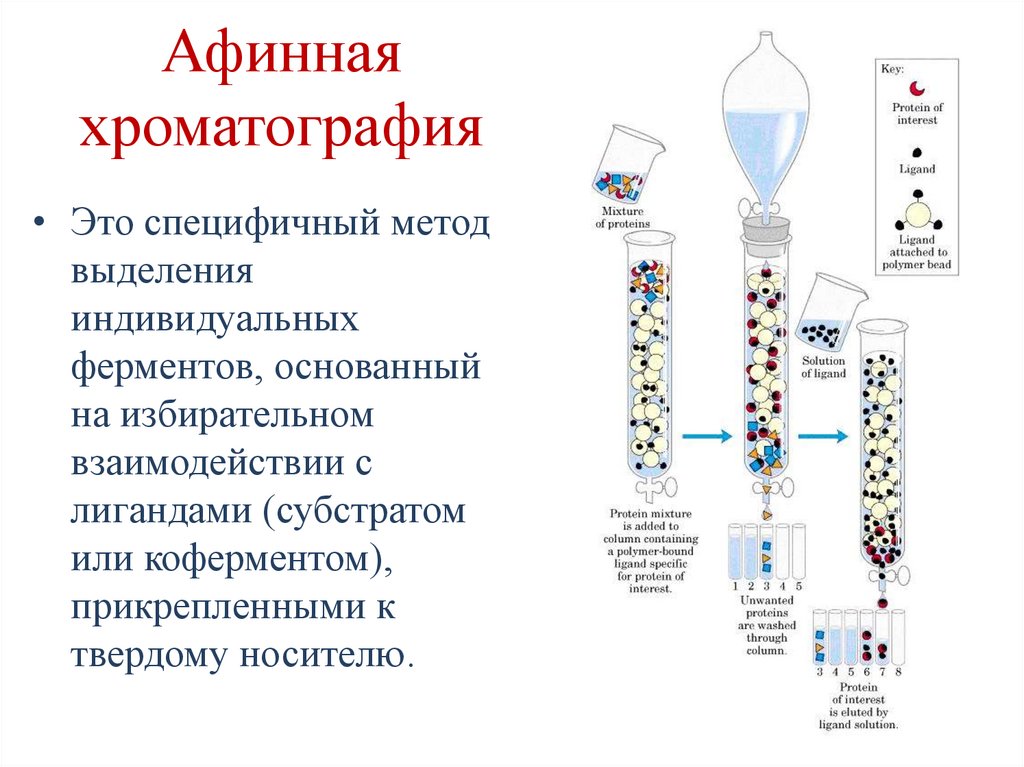
CH2 O
H
OH
H
H
O
CH2OH
O
OH
OH
H
H
N
O
O-
O-
CH2OH
O
N
H
OH
O
N
H
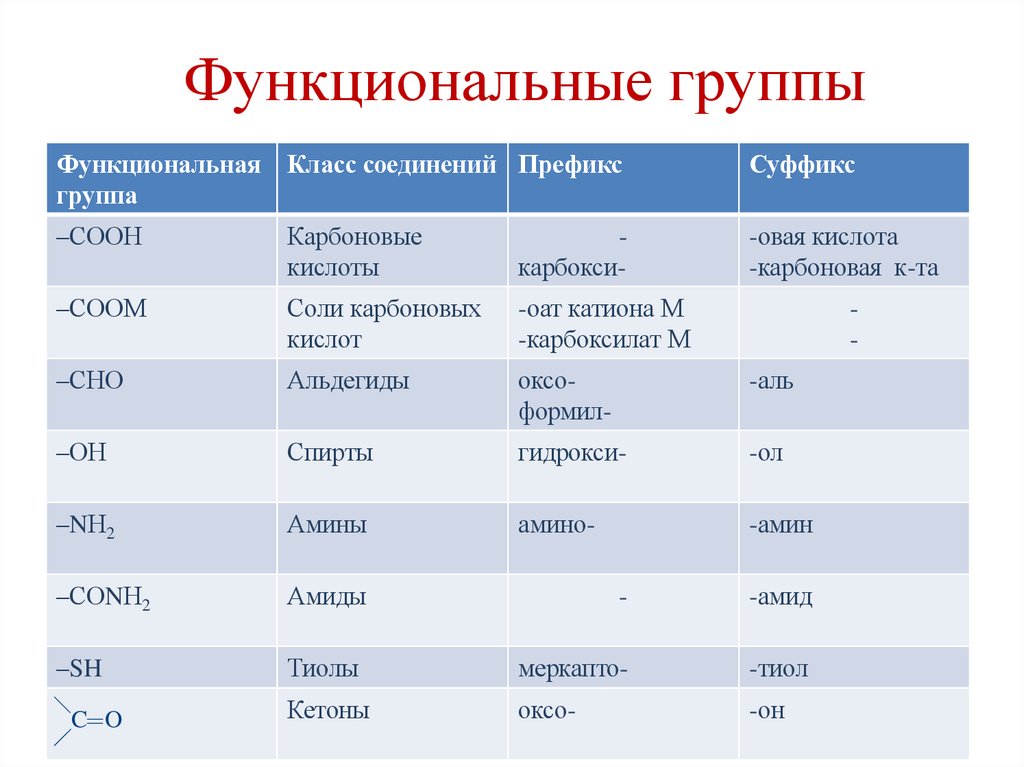
11. Функциональные группы
Функциональнаягруппа
Класс соединений Префикс
Суффикс
–СООН
Карбоновые
кислоты
карбокси-
-овая кислота
-карбоновая к-та
–СООМ
Соли карбоновых
кислот
-оат катиона М
-карбоксилат М
–СНО
Альдегиды
оксоформил-
-аль
–ОН
Спирты
гидрокси-
-ол
–NН2
Амины
амино-
-амин
–СОNН2
Амиды
-
-амид
–SH
Тиолы
меркапто-
-тиол
C O
Кетоны
оксо-
-он
-
12. Назовите химические соединения
CH2 OHCH OH
CH2 OH
O
C H
CH OH
CH2 OH
O
C OH
CH OH
CH2 OH
H3C CH2 CH2 CH3
H2N CH2 CH2 OH
H3C CH2 CH2 CH2 OH
CH3 CH COOH
NH2
H3C CH2 CH2 COOH
CH2 OH
C O
CH2 OH
H3C C CH3
O
H3C CH2 CH2 CHO
HO CH2 CH COOH
NH2
CH3 CH COOH
OH
H3C CH2 C COOH
O
HS CH2 CH COOH
NH2
CH3 C COOH
O
13. СТРОЕНИЕ, СВОЙСТВА И ФУНКЦИИ БЕЛКОВ
14.
АМИНОКИСЛОТЫ.ПОЛИПЕПТИДНАЯ ТЕОРИЯ
СТРОЕНИЯ БЕЛКОВ
15. Аминокислоты
– гетерофункциональные соединения,содержащие аминогруппу и карбоксильную
группу (производные карбоновых кислот, у
которых один атом водорода замещен на
аминогруппу).
• В зависимости от положения аминогруппы
различают α-, β-, γ-аминокислоты.
• В природе существует около 300
аминокислот.
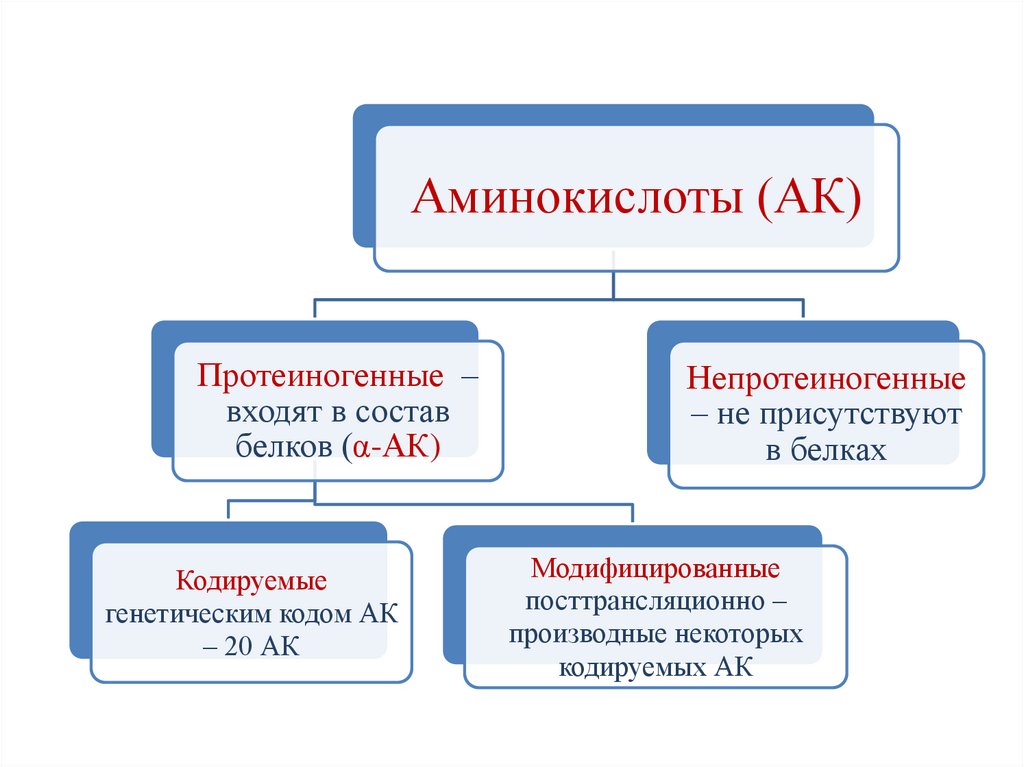
16.
Аминокислоты (АК)Протеиногенные –
входят в состав
белков (α-АК)
Кодируемые
генетическим кодом АК
– 20 АК
Непротеиногенные
– не присутствуют
в белках
Модифицированные
посттрансляционно –
производные некоторых
кодируемых АК
17. α-аминокислоты
– производные карбоновых кислот, укоторых один атом водорода в α-положении
замещен на аминогруппу.
R CH2 COOH
α
R
CH
NH2
COOH
Карбоновая кислота
Аминокислота
18. Стереоизомерия аминокислот
• За исключением глицина, у всехаминокислот 4 группы, связанные с αуглеродным атомом, различны.
• Протеиногенные АК имеют абсолютную
конфигурацию L-глицеральдегида и
поэтому являются L-α-аминокислотами.
COOH
COOH
H2N C H
H C NH2
R
R
L-α-аминокислота
D-α-аминокислота
19. Классификация аминокислот
• Структурный принцип1. Алифатические аминокислоты:
А. Моноаминомонокарбоновые – Gly, Ala, Val,
Leu, Ile.
В. Моноаминодикарбоновые – Asp, Asn, Glu, Gln.
С. Диаминомонокарбоновые – Lys, Arg.
Д. Гидроксиаминокислоты – Ser, Thr.
Е. Тиоаминокислоты – Cys, Met.
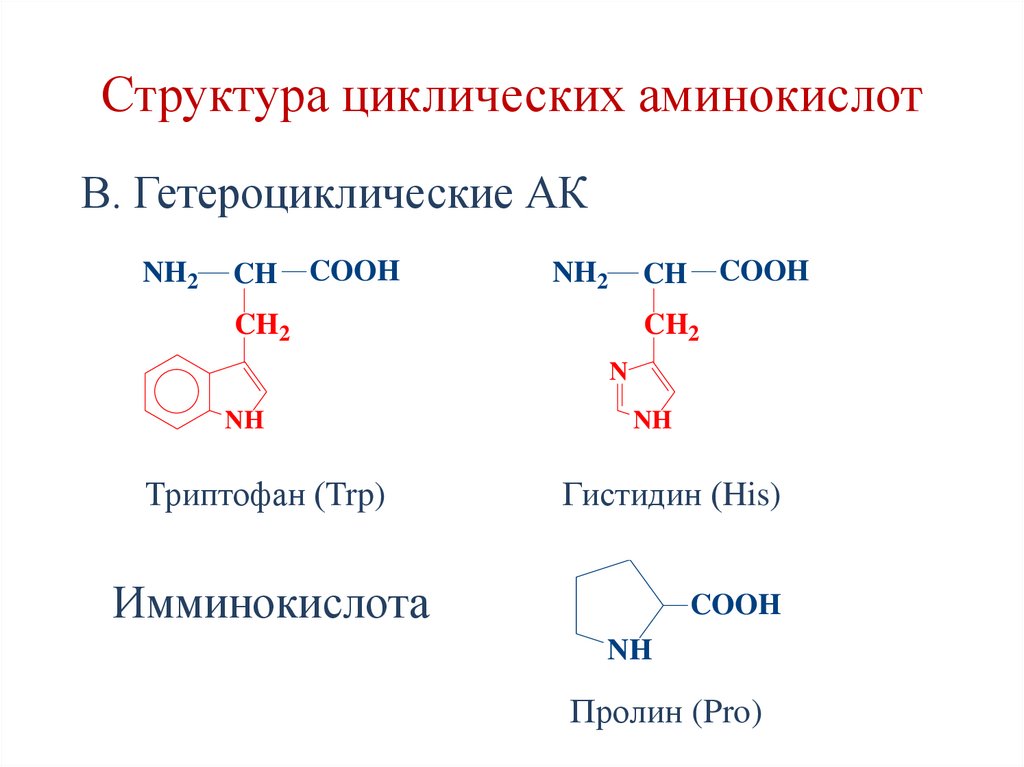
2. Циклические аминокислоты:
А. Ароматические – Phe, Tyr.
В. Гетероциклические – Trp, His, Pro.
20. Структура алифатических аминокислот
А. Моноаминомонокарбоновые АКNH2
CH
COOH
NH2
CH
COOH
H
CH3
Глицин (Gly)
Аланин (Ala)
NH2
CH
COOH
CH CH3
CH3
Валин (Val)
NH2
CH
COOH
NH2
CH
COOH
CH2
CH CH3
CH CH3
CH2
CH3
CH3
Лейцин (Leu)
Изолейцин (Ile)
21. Структура алифатических аминокислот
В. Моноаминодикарбоновые АК и их амидыNH2
CH
COOH
CH
COOH
CH2
CH2
COOH
CONH2
Аспарагиновая кислота (Asp)
NH2
NH2
CH
COOH
Аспарагин (Asn)
NH2
CH
COOH
CH2
CH2
CH2
CH2
COOH
CONH2
Глутаминовая кислота (Glu)
Глутамин (Gln)
22. Структура алифатических аминокислот
С. Диаминомонокарбоновые АКNH2
CH
COOH
NH2
CH
COOH
CH2
CH2
CH2
CH2
CH2
CH2
CH2
NH
NH2
C NH
NH2
Лизин (Lys)
Аргинин (Arg)
23. Структура алифатических аминокислот
Д. ГидроксиаминокислотыNH2
CH
COOH
NH2
COOH
CH
CH2
CH OH
OH
CH3
Серин (Ser)
Треонин (Thr)
Е. Тиоаминокислоты
NH2
CH
COOH
NH2
CH
COOH
CH2
SH
CH2
S
CH3
Цистеин (Cys)
Метионин (Met)
CH2
24. Структура циклических аминокислот
А. Ароматические АКNH2
CH
COOH
CH2
NH2
CH
COOH
CH2
OH
Фенилаланин (Phe)
Тирозин (Tyr)
25. Структура циклических аминокислот
В. Гетероциклические АКNH2
CH
COOH
NH2
COOH
CH
CH2
CH2
N
NH
Триптофан (Trp)
NH
Гистидин (His)
Имминокислота
COOH
NH
Пролин (Pro)
26. Классификация аминокислот
• Биологический принцип1. Незаменимые (не синтезируются в тканях
человеческого организма) – Val, Leu, Ile, Lys,
Thr, Met, Phe, Trp.
2. Полузаменимые – Arg, His.
3. Заменимые – остальные.
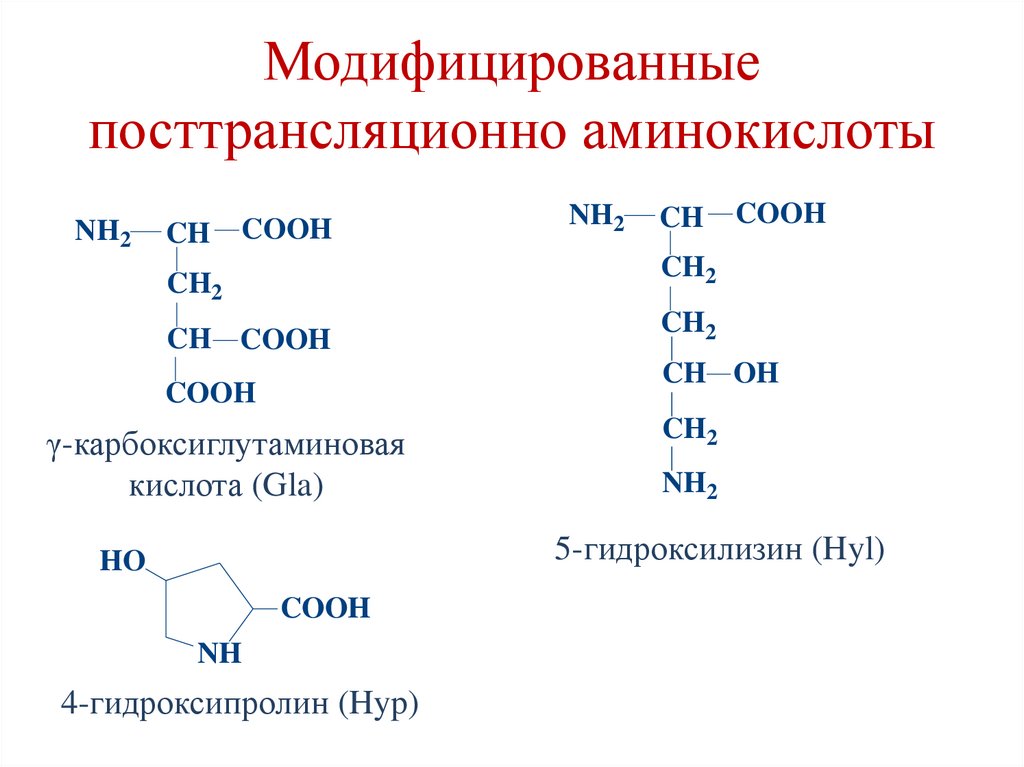
27. Модифицированные посттрансляционно аминокислоты
NH2CH
COOH
NH2
CH
COOH
CH2
CH2
CH COOH
CH2
CH OH
COOH
γ-карбоксиглутаминовая
кислота (Gla)
CH2
NH2
5-гидроксилизин (Hyl)
HO
COOH
NH
4-гидроксипролин (Hyp)
28. Модифицированные посттрансляционно аминокислоты
• 4-гидроксипролин и 5-гидроксилизинсинтезируются из пролина и лизина в ходе
посттрансляционных изменений
(гидроксилирования) в составе коллагена (с
участием витамина С).
• γ-карбоксиглутаминовая кислота образуется в
результате посттрансляционного
карбоксилирования глутаминоой кислоты в
составе кальций-связывающих белков (с
участием витамина К).
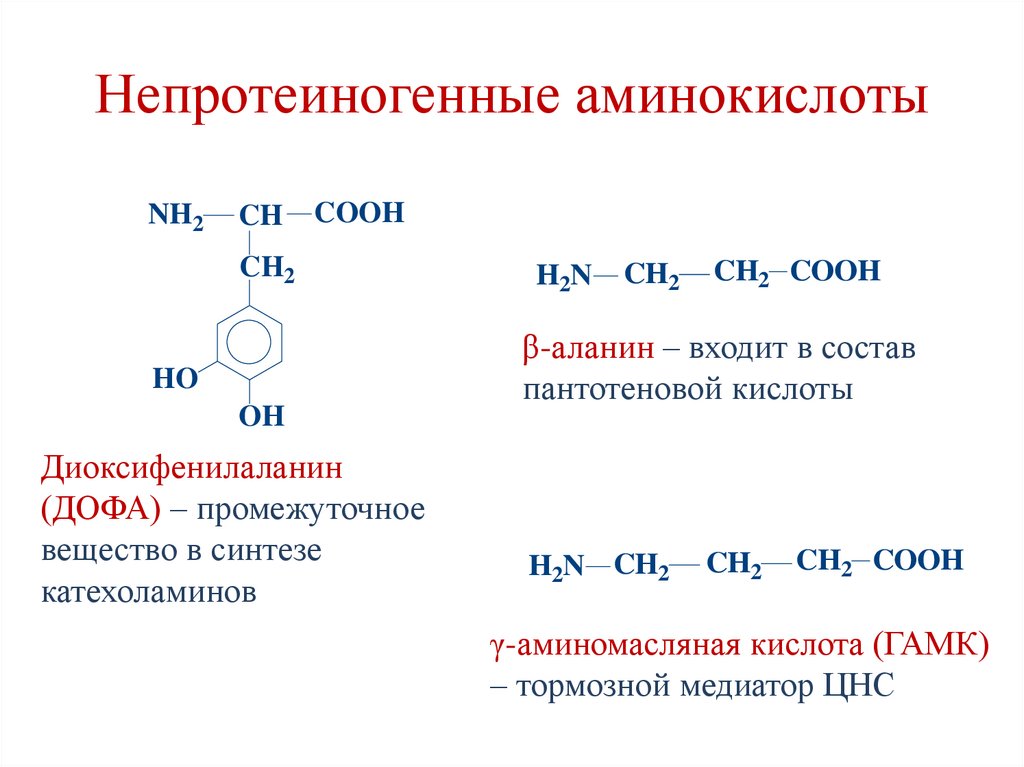
29. Непротеиногенные аминокислоты
NH2CH
COOH
NH2
CH
COOH
NH2
CH
CH2
CH2
CH2
CH2
CH2
CH2
SH
CH2
CH2
Гомоцистеин –
промежуточное
вещество в обмене
метионина;
фактор риска
атеросклероза
NH2
NH
Орнитин –
промежуточное
вещество в
синтезе мочевины
C O
COOH
NH2
Цитруллин –
промежуточное
вещество в синтезе
мочевины
30. Непротеиногенные аминокислоты
NH2CH
COOH
CH2
HO
OH
Диоксифенилаланин
(ДОФА) – промежуточное
вещество в синтезе
катехоламинов
H2N
CH2
CH2 COOH
β-аланин – входит в состав
пантотеновой кислоты
H2N CH2
CH2
CH2 COOH
γ-аминомасляная кислота (ГАМК)
– тормозной медиатор ЦНС
31. Электрохимические свойства аминокислот
• Аминокислоты имеют минимум однукарбоксильную (кислую) группу и одну
аминогруппу (основную), поэтому
обладают амфотерными свойствами.
• В растворах аминокислоты находятся в виде
биполярных ионов (амфиион, цвиттер-ион).
H3N+
CH
R
COO-
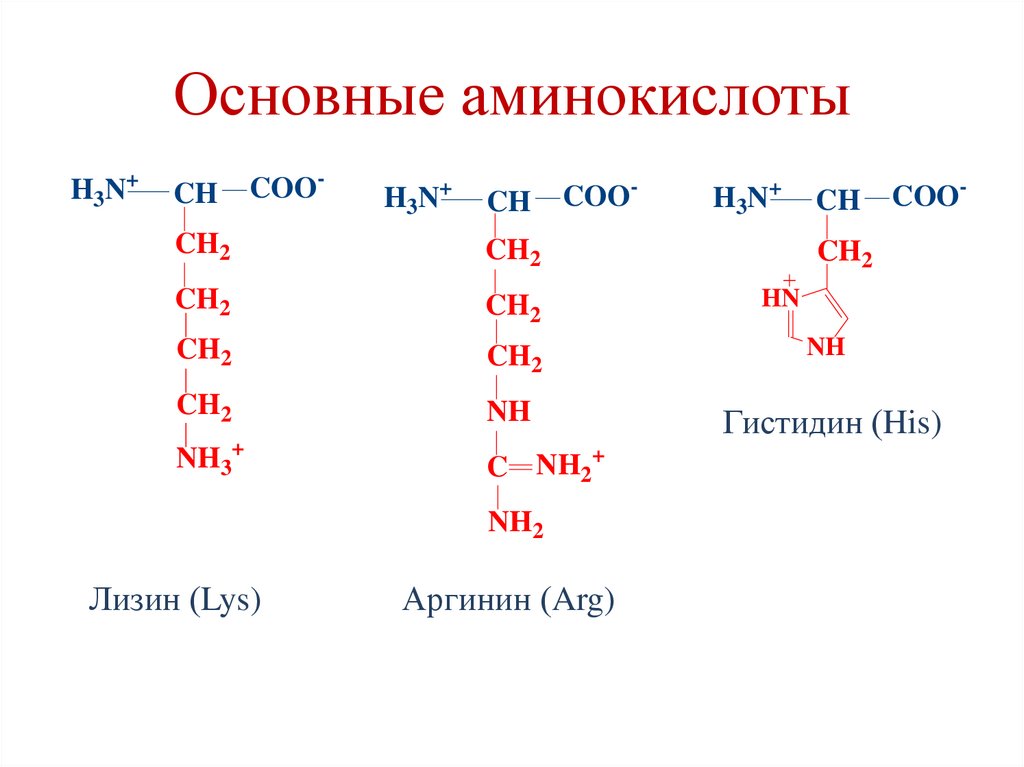
32. Электрохимический принцип классификации аминокислот
1. Нейтральные аминокислоты.2. Кислые аминокислоты – Glu, Asp.
3. Основные аминокислоты – Lys, Arg, His.
33. Кислые аминокислоты
H3N+CH
COO-
CH2
COO-
Аспарагиновая кислота (Asp )
H3N+
CH
COO-
CH2
CH2
COO-
Глутаминовая кислота (Glu)
34. Основные аминокислоты
H 3N +CH
COO-
H 3N +
CH
COO-
H3N+
CH
COO-
CH2
CH2
CH2
CH2
CH2
CH2
NH
CH2
NH
NH3+
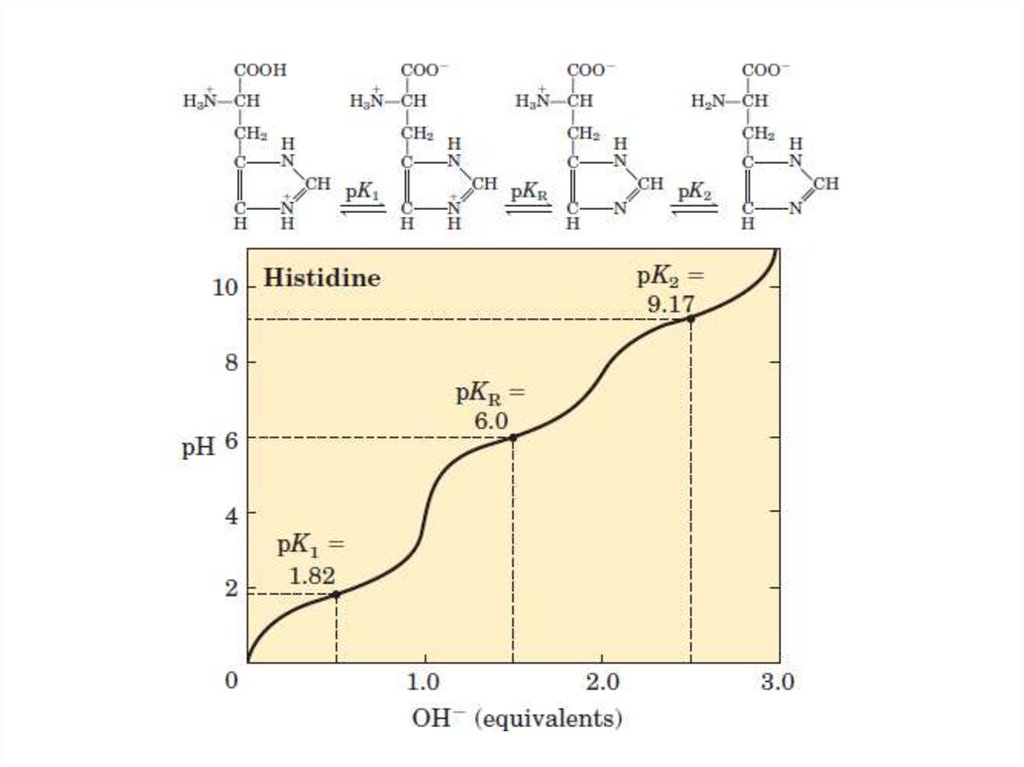
Гистидин (His)
C NH2+
NH2
Лизин (Lys)
Аргинин (Arg)
CH2
HN
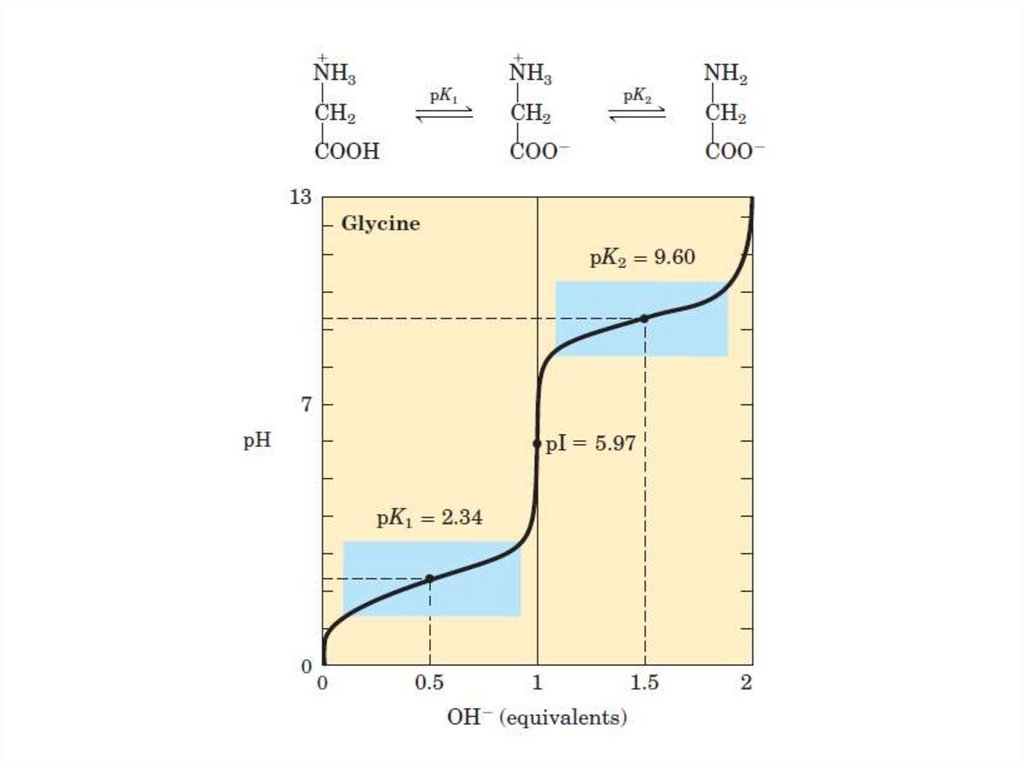
35. Электрохимические свойства аминокислот
• Суммарный заряд АК зависит от рН.• Значение рН, при котором суммарный заряд
АК равен нулю, называется ее
изоэлектрической точкой (рI).
• рI находится посредине между
ближайшими значениями рК (рК –
отрицательный логарифм константы
диссоциации) диссоциирующих групп.
36.
37.
38.
39. Электрохимические свойства аминокислот
• рI нейтральных АК – рН около 6.• рI кислых АК – кисляя среда (рН ˂ 7).
• рI основных АК – щелочная среда (рН ˃7).
• Электрохимические свойства аминокислот
используются для их разделения в
электрическом поле – электрофорез.
40. Электрохимические свойства аминокислот
1.В изоэлектрической точке суммарный зарядаминокислоты = 0, аминокислота не
перемещается в электрическом поле.
2.При значении рН, ниже его рI,
аминокислота приобретает «+» заряд
(катион) и движется к «–» электроду
(катоду).
3.При значении рН, выше его рI,
аминокислота приобретает «-» заряд
(анион) и движется к «+» электроду (аноду).
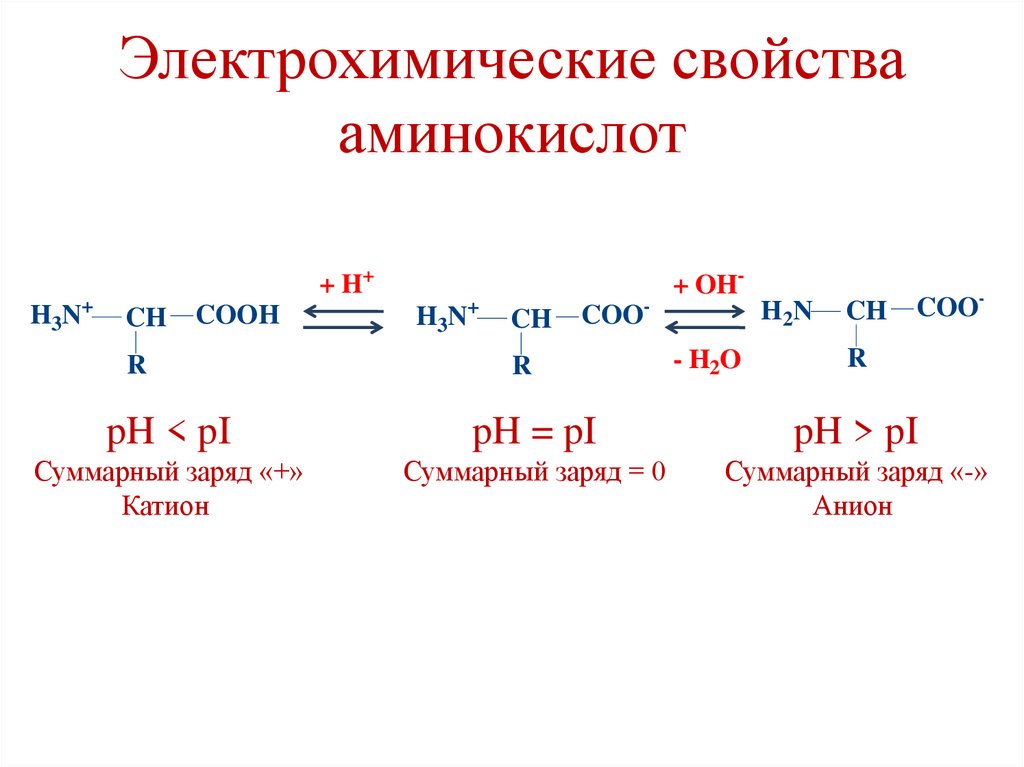
41. Электрохимические свойства аминокислот
+H3N
+ H+
CH
COOH
R
+
H3N
CH
-
+ OHH2N
COO
R
- H2O
CH
COO-
R
pH < pI
pH = pI
pH > pI
Суммарный заряд «+»
Катион
Суммарный заряд = 0
Суммарный заряд «-»
Анион
42. Растворимость аминокислот
• Аминокислоты содержат полярныезаряженные и незаряженные группы,
поэтому хорошо растворяются в полярных
растворителях (вода, этанол).
43. Классификация аминокислот
• по растворимости радикалов в воде:1. Неполярные (гидрофобные) – Gly, Ala, Val,
Leu, Ile, Met, Phe, Trp, Pro.
2. Полярные (гидрофильные):
А. Незаряженные –Asn, Gln, Ser, Thr, Cys, Tyr.
В. Отрицательно заряженные – Asp, Glu.
C. Положительно заряженные – Lys, Arg, His.
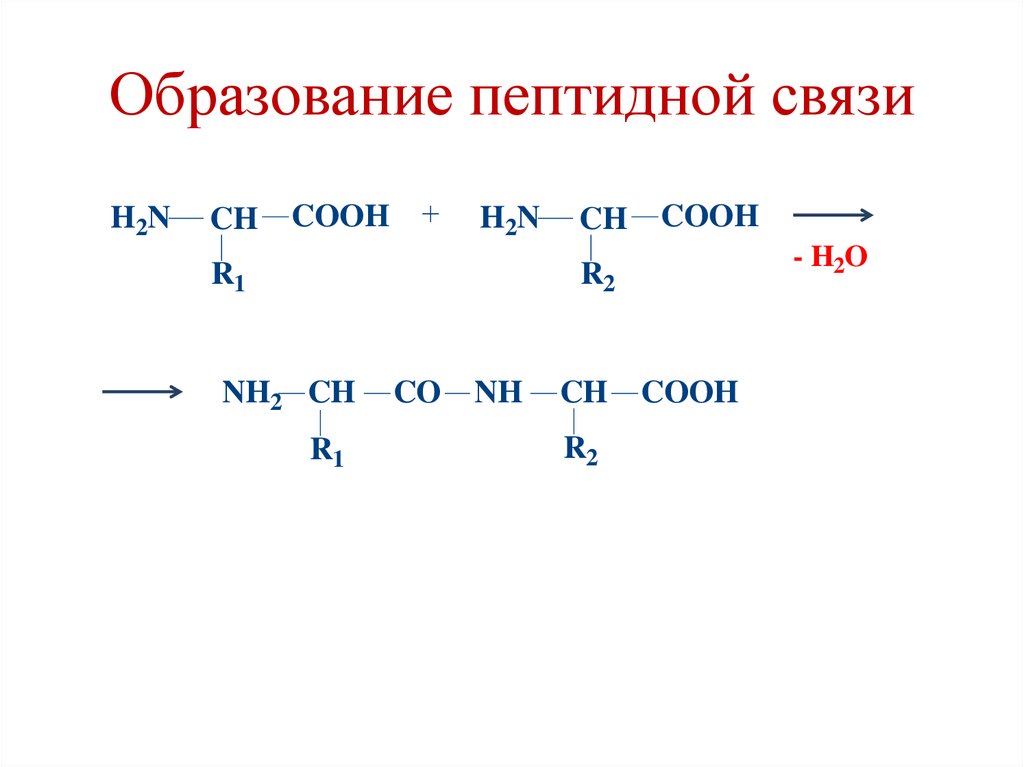
44. Полипептидная теория строения белков (Фишер, 1902)
• Белки являются полипептидами, в которыхаминокислоты связаны между собой
пептидными связями.
• Пептидная связь образуется между αкарбоксильной группой одной
аминокислоты и α-аминогруппой
следующей аминокислоты.
45. Образование пептидной связи
H2NCH
COOH
H2N
R1
CH
COOH
- H2O
R2
NH2 CH
R1
CO
NH
CH
R2
COOH
46.
• Каждый пептид имеет одну свободную αаминогруппу (N-конец) и одну свободнуюα-карбоксильную группу (С-конец).
• Направление пептидов N→С.
• Название пептида – название аминокислоты
+ окончание –ил, последняя аминокислота –
полное название.
• Пример: Ala-Met-Ser-Asn (аланилметионил-серил-аспарагин).
47. Биологически важные пептиды
• Глутатион• Карнозин и ансерин
• Ангиотензины
• Брадикинины
• Окситоцин и вазопрессин
• Гастрин, секретин, панкреозимин
• Кортикотропин и другие гормоны
гипоталамуса
• Антибиотики – пенициллин, грамицидин и др.
48.
СТРУКТУРА БЕЛКОВ.КЛАССИФИКАЦИЯ БЕЛКОВ
49.
• Белки – высокомолекулярныеазотсодержащие органические вещества,
состоящие из аминокислот, соединенных
пептидными связями и обладающие
сложной структурной организацией.
• ≪протеины≫ от греч. protos – первый,
важнейший.
• Белки составляют 25% от сырой массы или
45% от сухой массы человеческого
организма.
• Содержание азота в белках постоянно и
составляет 16% от сухой массы белка.
50. Функции белков
• Структурная• Опорная, механическая
• Каталитическая
• Гормональная, регуляторная
• Рецепторная
• Иммунологическая
• Транспортная
• Сократительная
• Резервная
• Энергетическая
51. Уровни структурной организации белков
• Первичная структура• Вторичная структура
• Третичная структура
• Четвертичная структура
52. Первичная структура белка
• состав и последовательностьаминокислотных остатков в полипептидной
цепи.
• Генетически детерминирована, т.е.
закодирована в ДНК.
• Определяет укладку полипептидной цепи в
определенную пространственную
структуру.
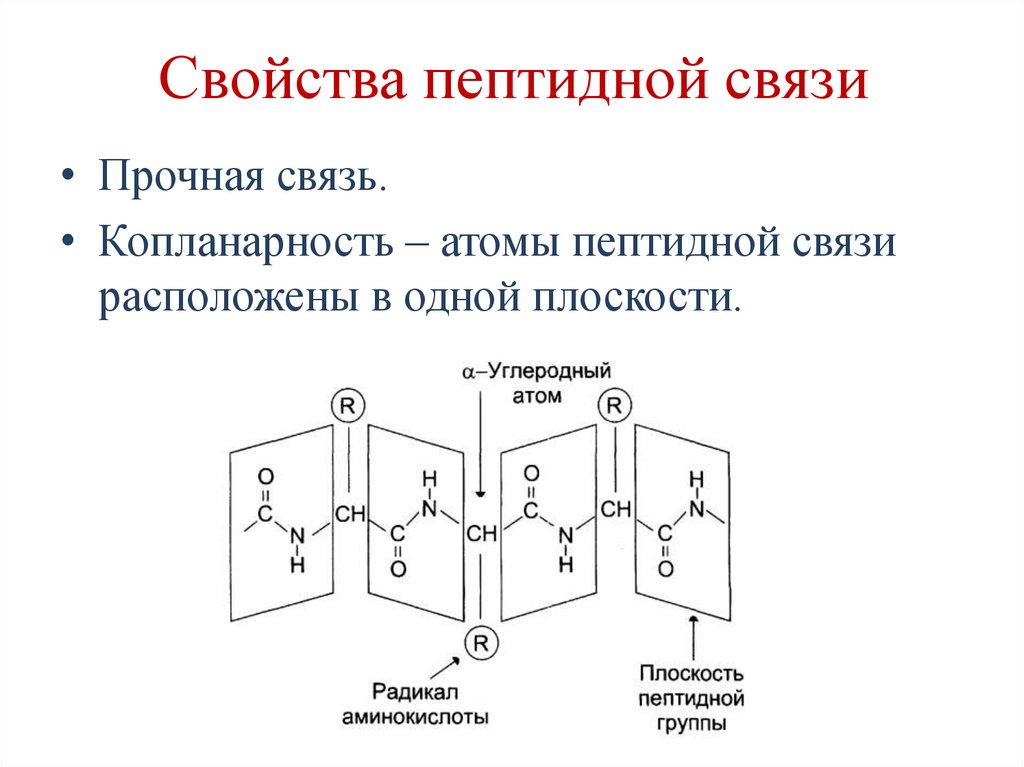
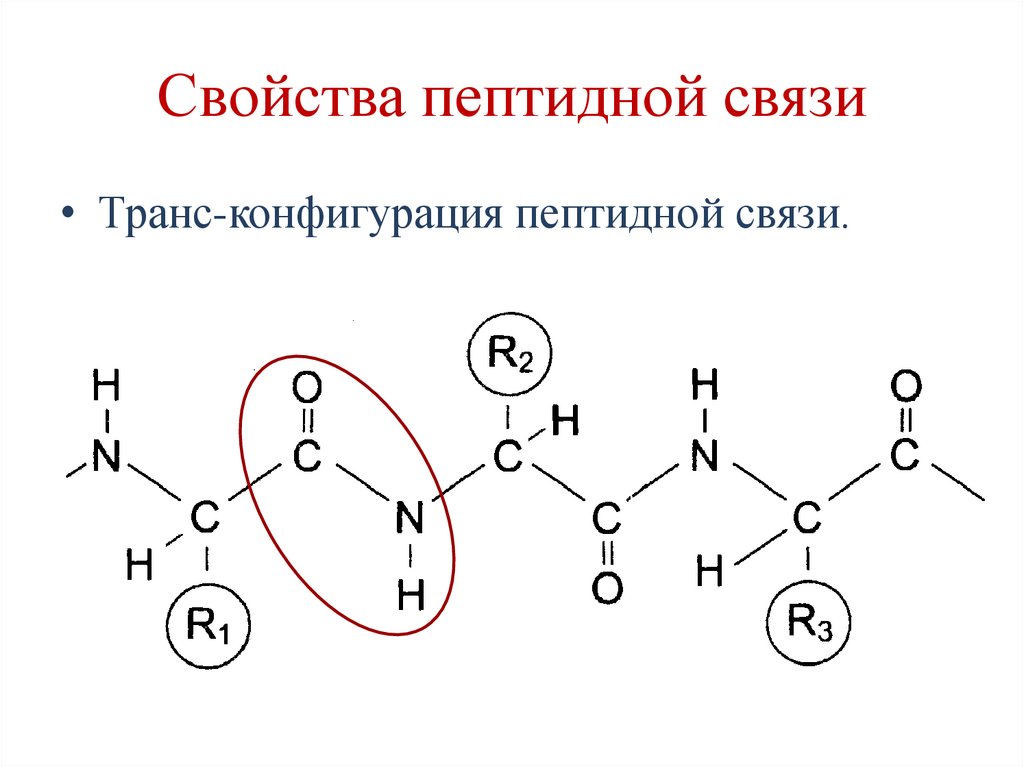
53. Свойства пептидной связи
• Частично двойная связь (1,32А), поэтомуона короче, чем остальные связи
пептидного остова, и вследствие этого мало
подвижна.
• Связь между α-углеродным атомом и αкарбоксильной или α-аминогруппой
одинарная и способна к свободным
вращениям, что позволяет белку принимать
определенную конформацию.
54. Свойства пептидной связи
• Прочная связь.• Копланарность – атомы пептидной связи
расположены в одной плоскости.
55. Свойства пептидной связи
• Транс-конфигурация пептидной связи.56. Свойства пептидной связи
• Способность образовать 2 водородныесвязи.
• Способность существовать в 2-х
таутомерных формах (кето-енол):
O
C N
H
OH
C N
кето
енол
57. Определение первичной структуры белка
• Два основных этапа:1. Определение аминокислотного состава;
2. Определение аминокислотной
последовательности.
58. Определение аминокислотного состава белка – этапы
1. Полный гидролиз белка (кислотныйгидролиз).
2. Разделение аминокислот (ионообменная
хроматография).
3. Количественный анализ полученных
фракций (спектрофотометрическое
измерение).
• 2 и 3 этапы – используются
аминокислотные анализаторы.
59. Определение аминокислотной последовательности в белке – этапы
1. Определение N-концевой аминокислоты.2. Определение С-концевой аминокислоты.
3. Избирательный частичный протеолиз
полипептида с определением
аминокислотной последовательности в
каждом фрагменте.
4. Получение аминокислотной
последовательности полипептида с
помощью перекрывающихся фрагментов.
60. Определение N-концевой аминокислоты
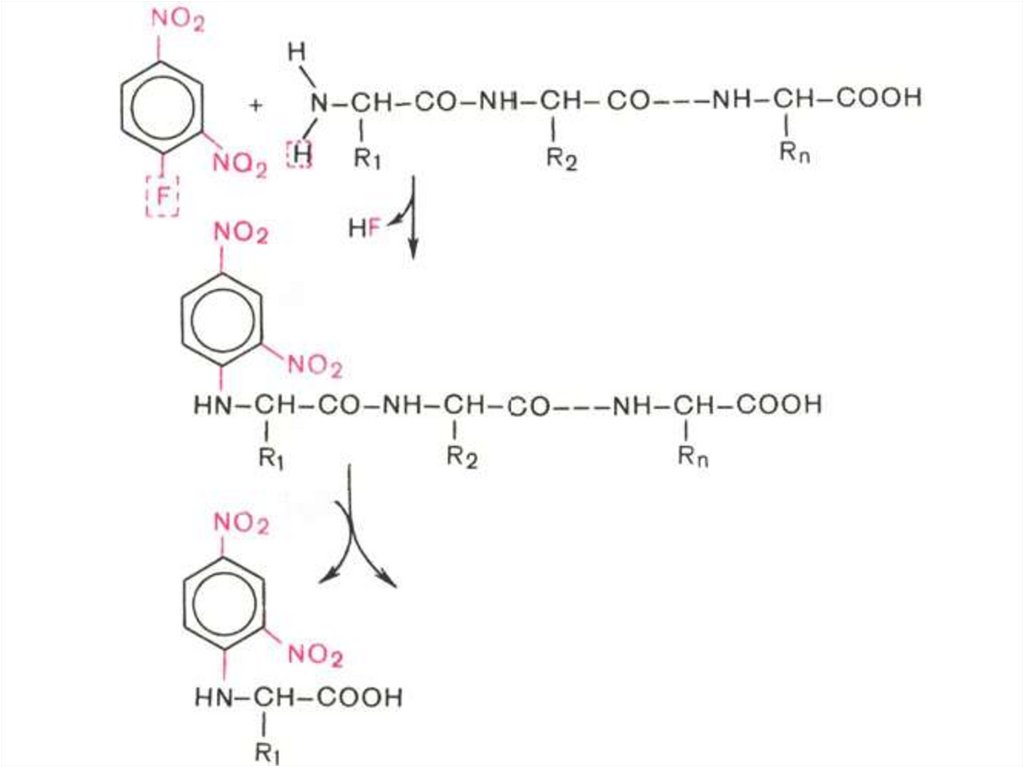
• Метод Сэнгера.• Метод Эдмана.
61. Определение N-концевой аминокислоты
Метод Сэнгера:Используют 2,4-динитрофторбензол,
который образует с N-концевой
аминокислотой окрашенное в желтый цвет
производное, которое идентифицируют
методом хроматографии.
62.
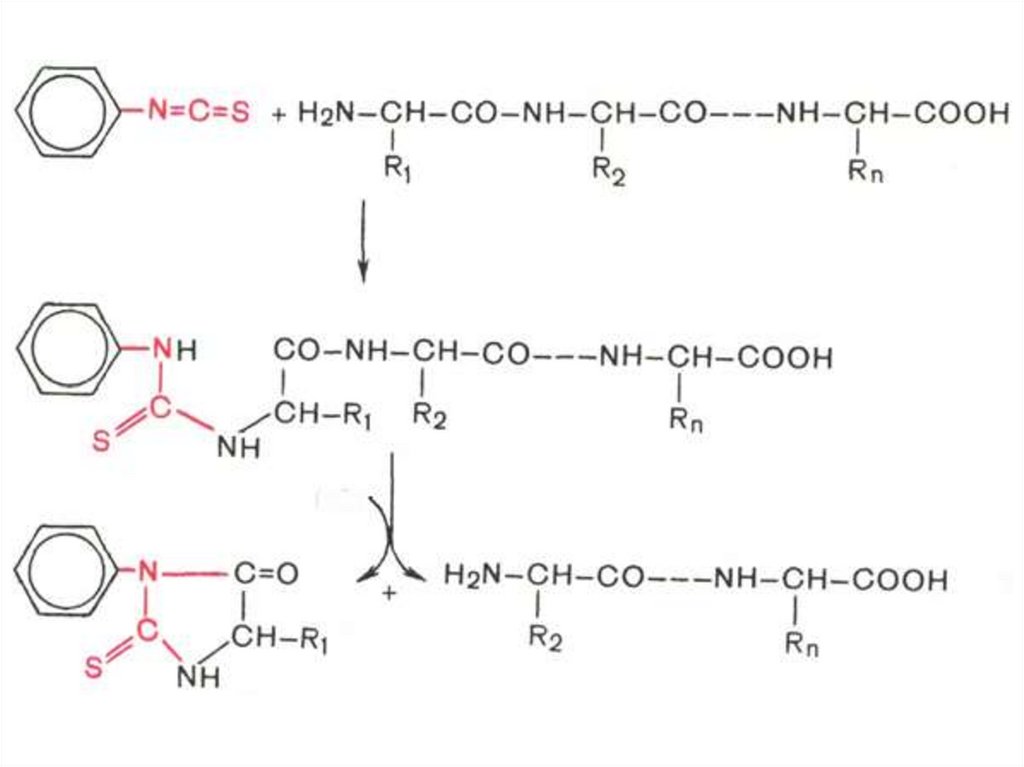
63. Определение N-концевой аминокислоты
Метод Эдмана:• Фенилизотиоцианат реагирует со
свободной α-аминогруппой N-концевой
аминокислоты полипептида с образованием
фенилтиокарбамоилпептида.
64. Определение N-концевой аминокислоты
Метод Эдмана• Обрабатывают продукт реакции кислотой,
что приводит к циклизации и
освобождению фенилтиогидантоина Nконцевой аминокислоты, природу которого
устанавливают хроматографически.
• Укороченный на одну аминокислоту
полипептид подвергают дальнейшему
анализу.
65.
66. Определение N-концевой аминокислоты
• Метод Эдмана является основой дляопределения первичной структуры белков и
пептидов в специальном приборе –
секвенаторе (от англ. sequence –
последовательность), работающем в
автоматическом режиме и позволяющем
определить с N-конца пептида до 50-60
аминокислот.
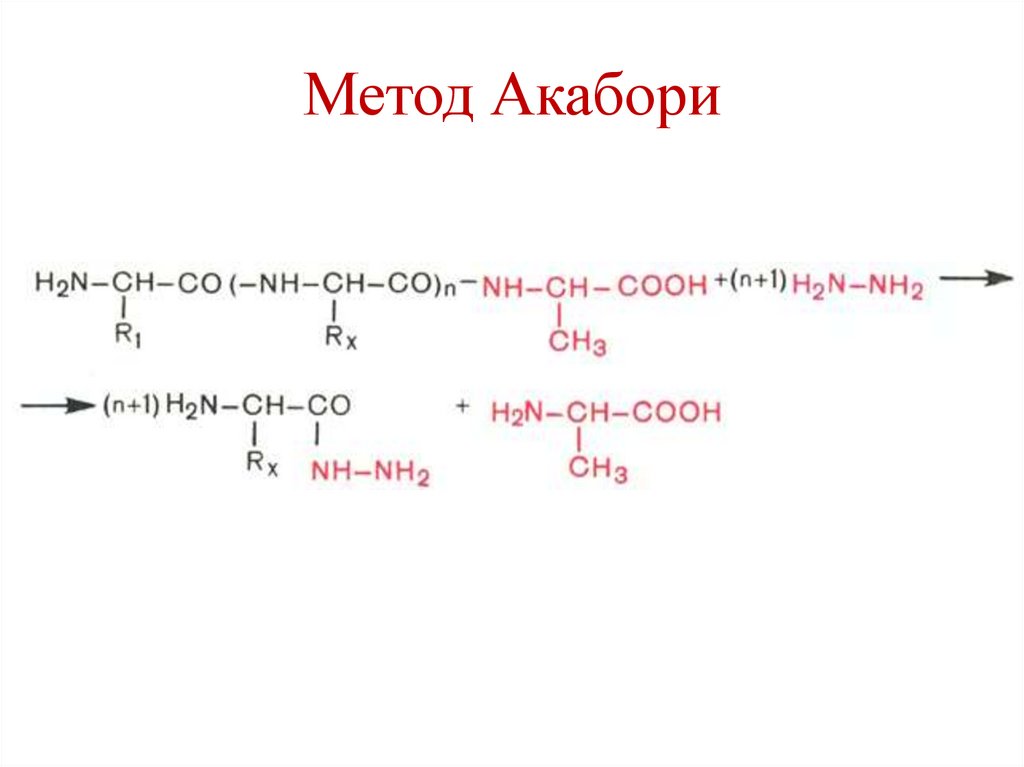
67. Определение С-концевой аминокислоты
• Метод Акабори (гидразин).• Обработка боргидридом натрия.
• Ферментативный метод
(карбоксипептидазы).
68. Метод Акабори
69. Избирательный частичный протеолиз полипептида
МетодыИспользуемое Пептидная связь, которая
вещество
избирательно
расщепляется под
действием используемого
химического вещества
или фермента
Ферментативные Пепсин
– АК – Phe (Tyr) –
Трипсин
– Lys (Arg) – АК –
Химотрипсин
– Phe (Tyr) – АК –
Бромциан
– Met – АК –
Химические
70. Установление аминокислотной последовательности пептида
71. Биомедицинское значение определения аминокислотной последовательности белка
• Изучение закономерностей образованияпространственной структуры белков.
• Диагностика и прогнозирование
генетических болезней.
• Возможность химического синтеза белков.
72. Вторичная структура белка
• Упаковка полипептидной цепи вупорядоченную структуру.
• Стабилизируется водородными связями
между атомами пептидных связей.
• 2 типа:
• α-спираль;
• -структура.
73. α-спираль
• Правозакрученная спираль.• 1 виток – 3,6 аминокислот.
• Водородные связи – между атомами
пептидных групп 1 и 4, 2 и 5 и т.д.
аминокислот.
• Радикалы аминокислот расположены с
наружной стороны пептидного остова.
74.
75.
76. Аминокилоты, дестабилизирующие α-спираль
• Пролин и гидроксипролин;• Одинаково заряженные радикалы;
• Объемные радикалы.
77. -структура (-складчатый слой)
-структура ( -складчатый слой)• Образуется между несколькими
полипептидными цепями или в пределах
одной полипептидной цепи, делающей
изгиб.
2 типа:
• Параллельные;
• Антипараллельные.
78.
79.
80.
81. Классификация белков по содержанию разных типов вторичных структур
1. Состоящие только из α-спиралей (примеры– миоглобин, гемоглобин).
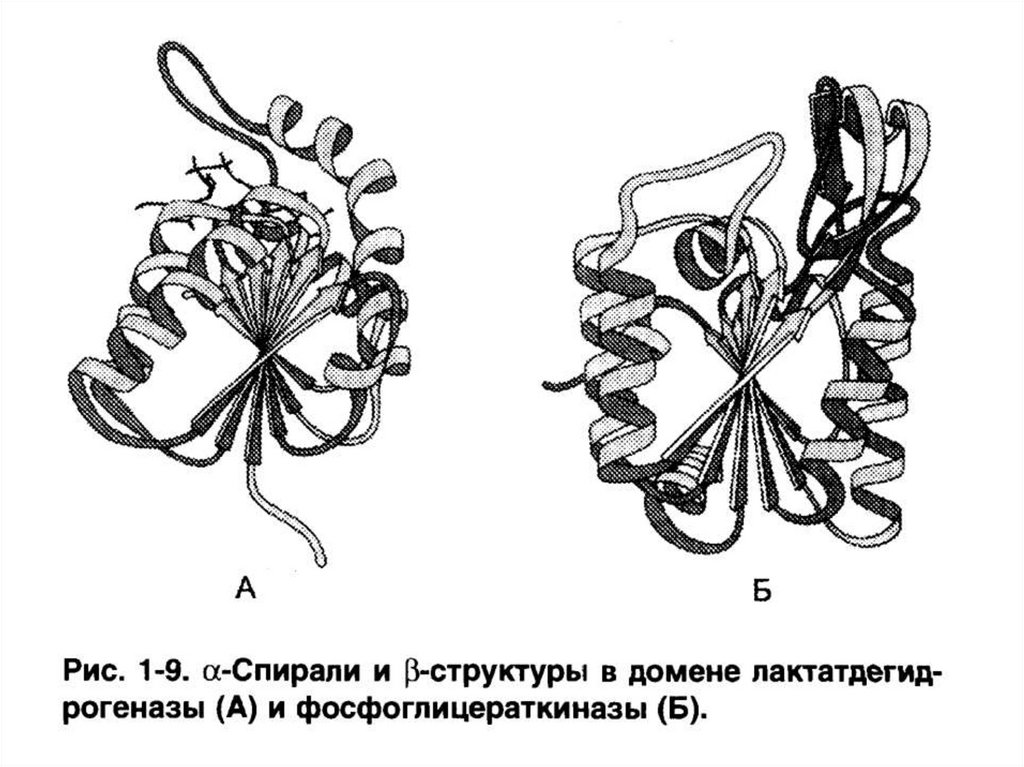
2. Состоящие из сочетаний α-спиралей и структур (ЛДГ, фосфоглицераткиназа).
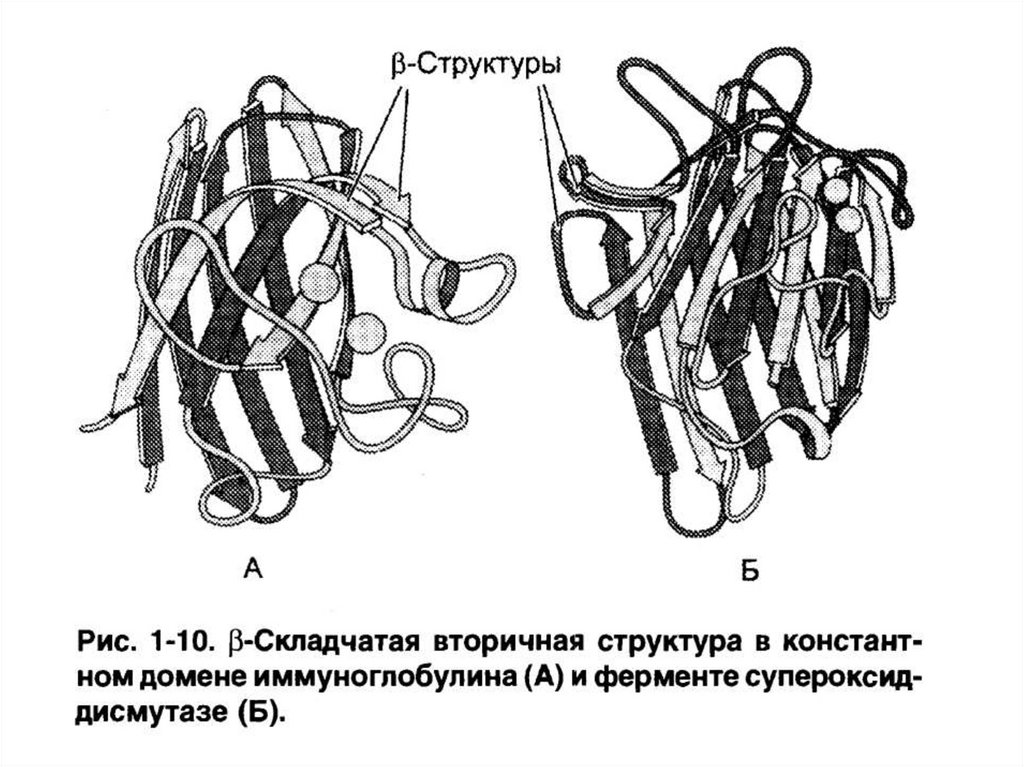
3. Имеющие только -структуры
(иммуноглобулины, СОД).
4. Состоящие в основном из беспорядочных
структур.
82.
83.
84.
85. Третичная структура белка
• Пространственная структура (укладкаполипептидной цепи в определенную
конформацию).
• Стабилизируется за счет связей между
радикалами аминокислот, которые могут
располагаться на значительном расстоянии
друг от друга в полипептидной цепи.
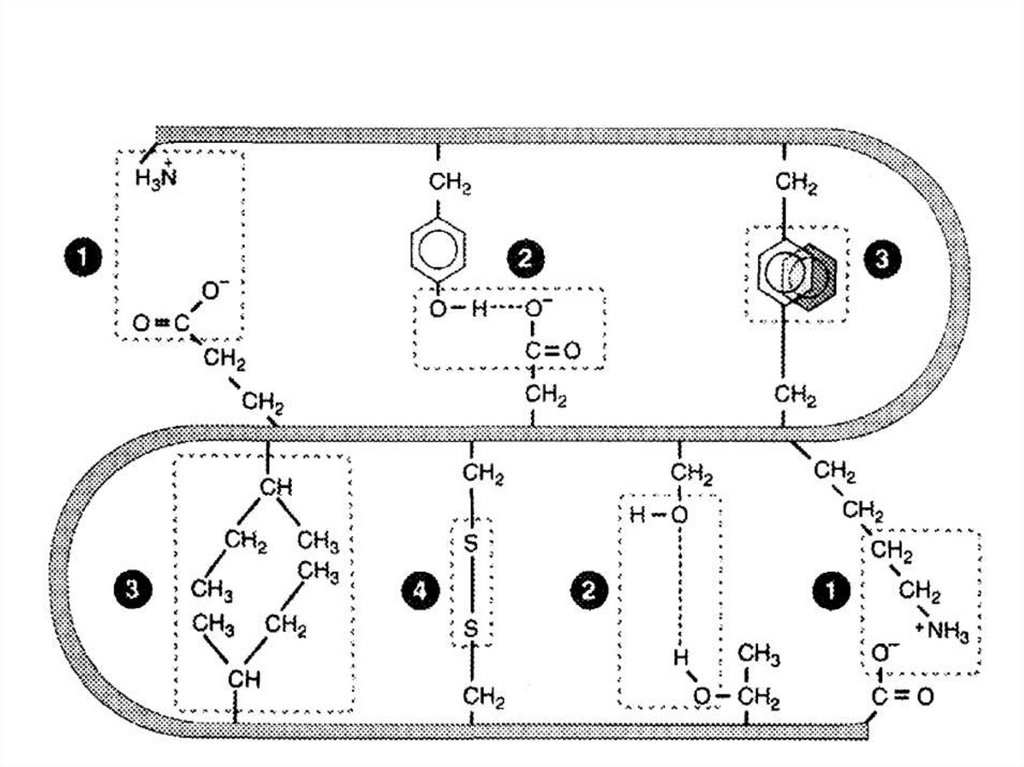
86. Связи, участвующие в формировании третичной структуры белка
• Ковалентные связи:• Дисульфидные;
• Эфирные;
• Псевдопептидные.
• Нековалентные связи:
• Ионные;
• Водородные;
• Гидрофобные.
87.
88. Третичная структура
функционально активная конформация,«нативная структура»!!!
89. Конформационная лабильность белков
• – склонность к небольшим изменениямконформации за счет разрыва одних и
образования других слабых связей.
• Конформация белка может меняться при
изменении химических и физических
свойств среды, а также при взаимодействии
белка с другими молекулами.
• Конформационные изменения лежат в
основе функционирования белков.
90. Функционирование белков
• осуществляется за счет связывания белка слигандом.
• Высокая специфичность связывания белка с
лигандом обеспечивается
комплементарностью структуры активного
центра белка структуре лиганда.
91.
92.
93. Доменная структура белков
• Домен – участок полипептидной цепи,который в процессе формирования
пространственной структуры приобрел
независимо от других участков той же цепи
конформацию глобулярного белка.
Примеры белков, обладающих доменной
структурой:
• Иммуноглобулины;
• Кальмодулин.
94. Четвертичная структура белков
• характерна для белков, состоящих их 2-хили более полипептидных цепей, каждая из
которых обладает собственной третичной
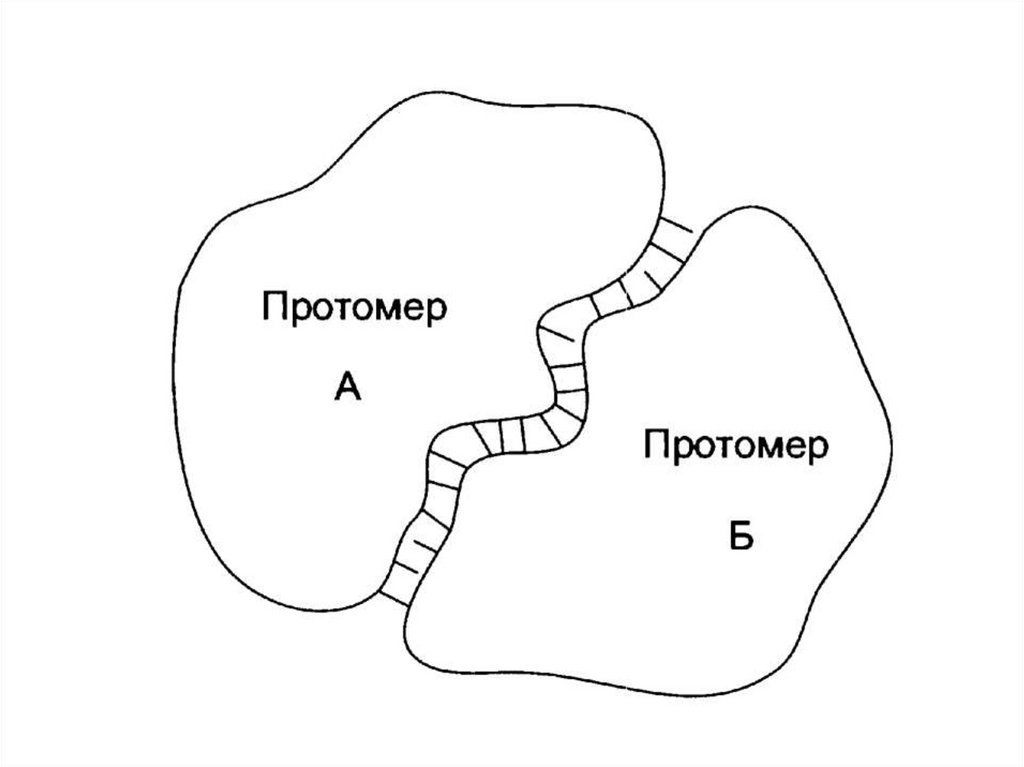
структурой.
• Отдельные полипептидные цепи –
субъединицы, протомеры.
• Белок с четвертичной структурой –
олигомер.
• Связи между протомерами – нековалентные,
ковалентные.
95. Четвертичная структура белков
• протомеры могут быть одинаковые илиразные;
• количество протомеров – от 2-х до десятков.
• Примеры:
• Гексокиназа – 2 одинаковых протомера;
• Гемоглобин, ЛДГ – тетрамеры, состоящие из
2-х типов протомеров.
• Активная форма – олигомерный белок.
96. Комплементарность протомеров
• Сборка олигомерного белка осуществляетсяза счет контактных участков.
• Специфичность связывания контактных
участков определяется их
комплементарностью.
• Комплементарность – пространственное и
химическое соответствие.
97.
98. Особенности функционирования олигомерных белков
– кооперативность изменения конформациипротомеров.
Пример – гемоглобин.
99. Классификация белков (структурный принцип)
• Простые:• Гистоны;
• Альбумины;
• Эластин.
• Сложные – холопротеины:
1. Белковая часть (апобелок);
2. Небелковая часть (простетическая группа).
100. Классы сложных белков
Нуклеопротеины = белок + нуклеиновыекислоты.
• Примеры – хроматин, рибосомы.
• Связи между белком и нуклеиновыми
кислотами – ионные.
Гликопротеины = белок + углеводы.
• Примеры – коллаген, иммуноглобулины,
фибриноген.
• Связи между белком и углеводами –
гликозидные.
101. Классы сложных белков
Липопротеины = белок + липиды.• Пример – клеточные мембраны.
• Связи между белком и липидами – ионные,
водородные, гидрофобные.
Металопротеины = белок + различные
металлы.
• Примеры – трансферрин (транспортный
белок для железа; церуллоплазмин –
содержит медь).
102. Классы сложных белков
Фосфопротеины = белок + фосфорная кислота.• Пример – казеин молока.
• Связи между белком и фосфорной кислотой
– эфирные.
103. Классы сложных белков
Хромопротеины – окрашенные белки:А) Гемопротеины = белок + гем (содержит
железо) – красный цвет.
• Примеры – гемоглобин, миоглобин, каталаза,
цитохромы.
Б) Флавопротеины = белок + ФАД или ФМН
(содержат рибофлавин, витамин В2) –
желтый цвет.
• Примеры – сукцинат дегидрогеназа.
104. Классификация белков (по форме молекул)
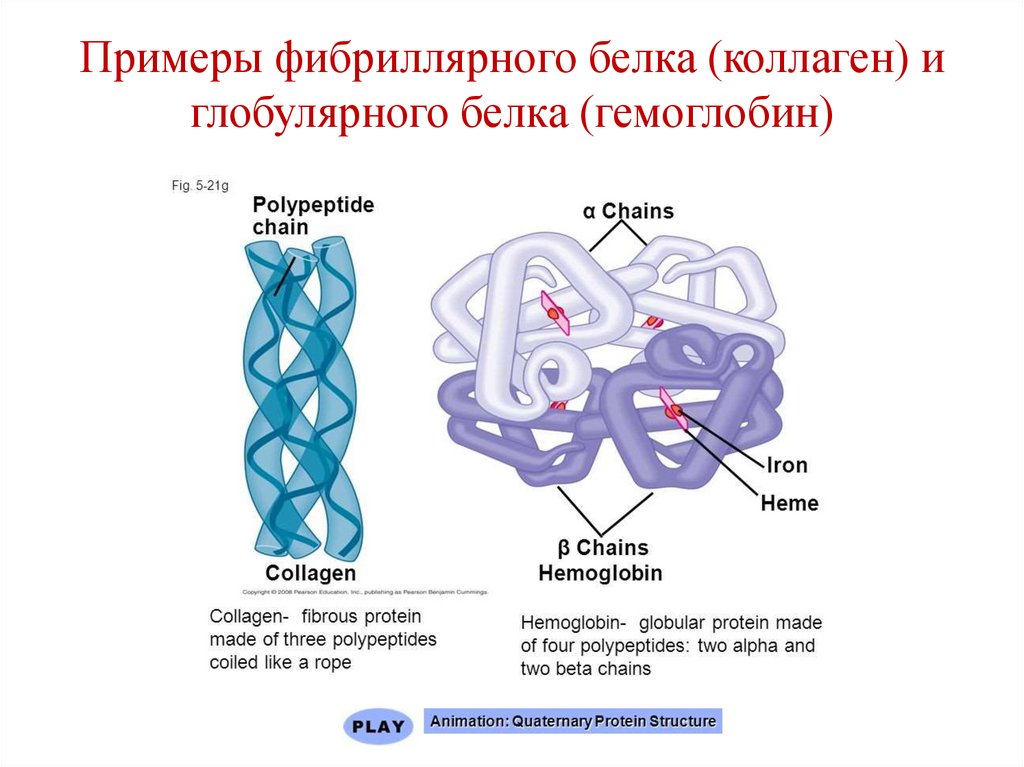
• Глобулярные:• Миоглобин;
• Гемоглобин.
• Фибриллярные:
• Коллаген;
• Кератин;
• Миозин;
• Фибриноген.
105. Примеры фибриллярного белка (коллаген) и глобулярного белка (гемоглобин)
106. Миоглобин
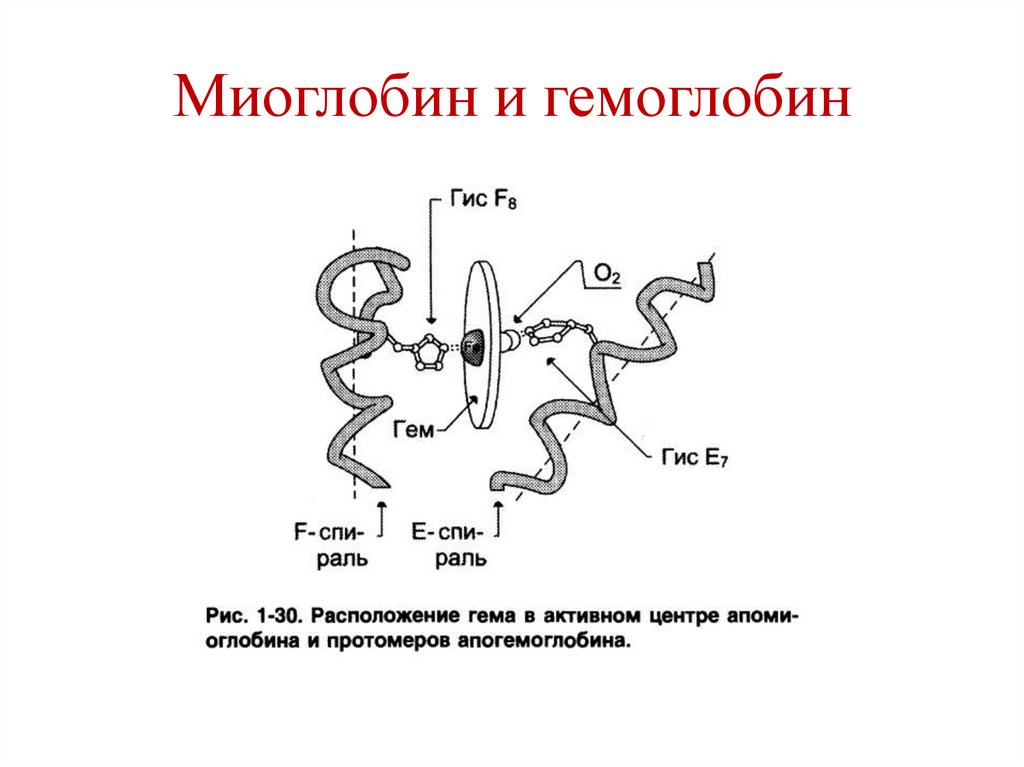
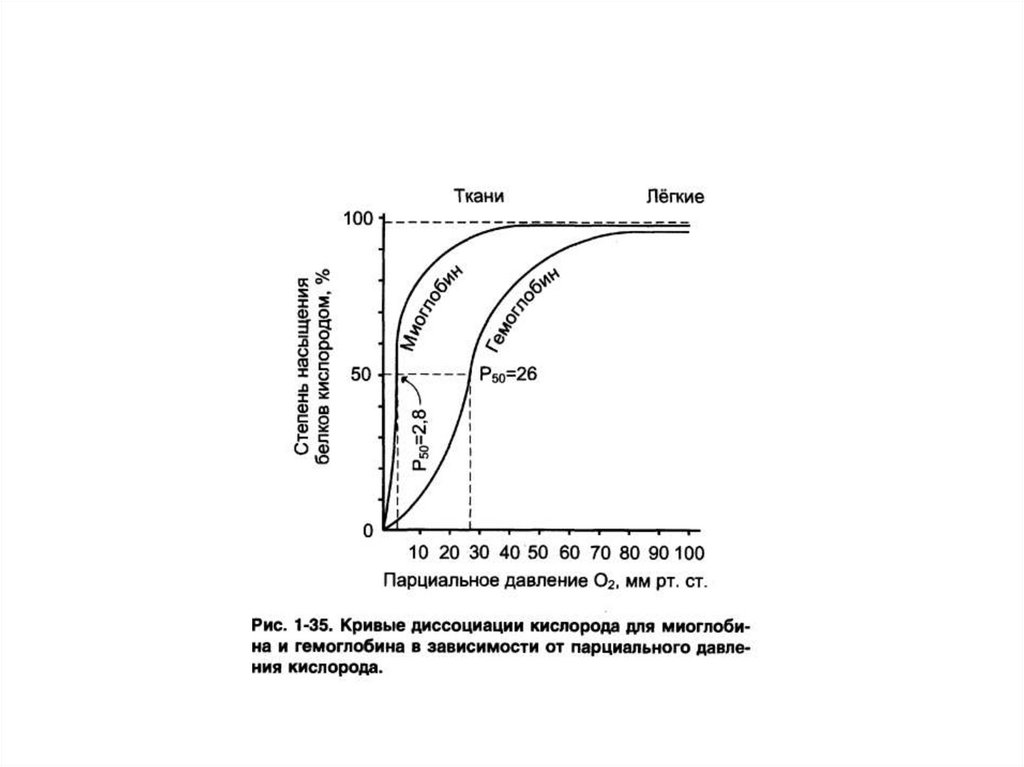
• Содержится в мышцах.• Функция – запасание О2.
• Глобулярный белок с
третичной структурой.
Состоит из 153
аминокислот,
уложенных в 8 альфаспиралей.
• Содержит гем.
107. Гемоглобин (Hb)
• Содержится в эритроцитах.• Функция – перенос О2 из легких к тканям и
участие в переносе СО2 и Н+ от тканей к легким.
• Глобулярный белок с четвертичной структурой –
состоит из 4-х полипептидных цепей.
108. Гемоглобины человека
Типы гемоглобинаПолипептидные цепи
Содержание
Hb А
2α2β
Взрослый, 90-95%
Hb А2
2α2δ
Взрослый, 2,5%
Hb А1с
Hb А гликированный
3-5%
Hb Е
2ξ2ε
Эмбриональный
Hb F
2α2γ
Фетальный
109. Миоглобин и гемоглобин
110.
111.
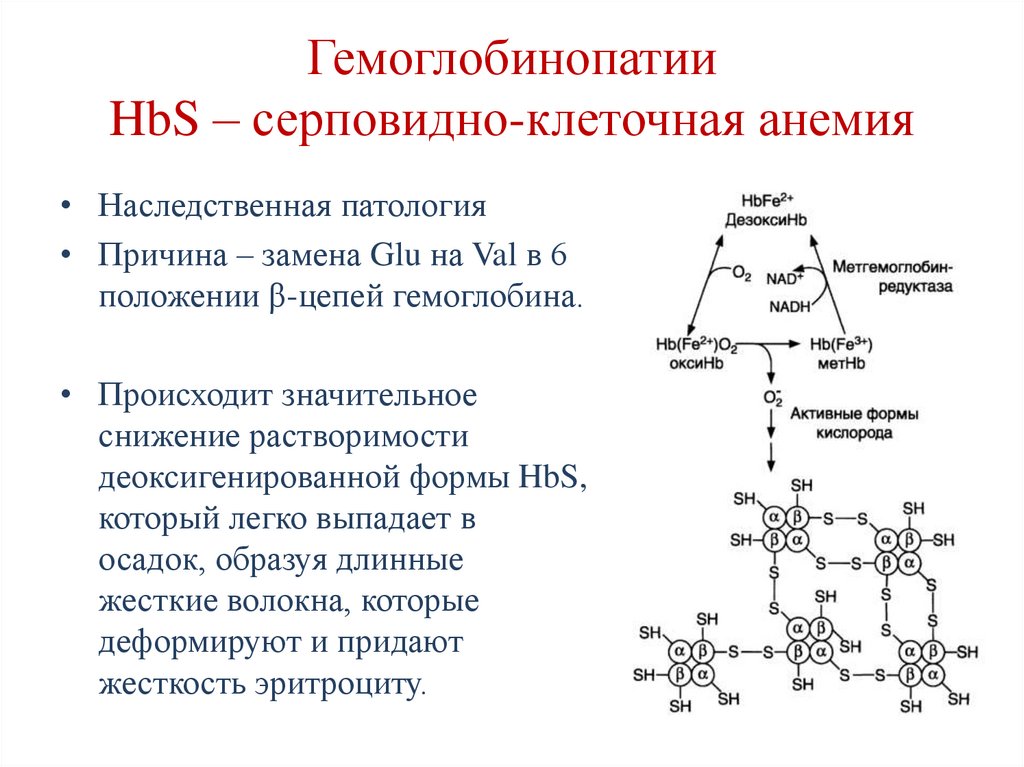
112. Гемоглобинопатии HbS – серповидно-клеточная анемия
• Наследственная патология• Причина – замена Glu на Val в 6
положении β-цепей гемоглобина.
• Происходит значительное
снижение растворимости
деоксигенированной формы HbS,
который легко выпадает в
осадок, образуя длинные
жесткие волокна, которые
деформируют и придают
жесткость эритроциту.
113. HbS – серповидно-клеточная анемия
• У гомозиготных лиц патология проявляетсявыраженной анемией, окклюзиями сосудов,
сопровождающимися острой болью,
уменьшением селезенки вследствие повторных
инфарктов селезенки. Клинические симптомы
вызваны неспособностью эритроцитов проходить
через просвет капилляров и их чрезмерной
деградацией в селезенке. Жизнь эритроцитов
составляет 10-12 дней (по сравнению со 120
днями для нормальных эритроцитов).
114. HbS – серповидно-клеточная анемия
• У гетерозиготных лиц клинические проявлениявозникают только при снижении парциального
давления кислорода.
• Гетерозиготные особи устойчивы к малярии, что
объясняется повышенной проницаемостью
мембраны серповидноклеточных эритроцитов, в
том числе для ионов калия; концентрация K+ в
эритроцитах уменьшается, что убивает
малярийного паразита (для нормального развития
Plasmodium falciparum необходима высокая
концентрация ионов калия).
115. Талассемии
• наследственные заболевания, обусловленныеснижением или отсутствием α- или β-цепей
гемоглобина.
• Образуются тетрамерные белки, состоящие из
одинаковых цепей.
• α-талассемии – не синтезируются α-цепи. У плода
образуются 4γ-тетрамеры. Внутриутробная смерть.
• β-талассемии – не синтезируются β-цепи.
Проявляется после рождения. Выраженная анемия.
116. Коллаген
• Фибриллярный белок, синтезируемыйклетками соединительной ткани
(фибробласты, эндотелиоциты).
• Содержится в межклеточном веществе.
• Составляет ¼ всех белков организма.
• Входит в состав соединительной ткани –
кость, зубы, сухожилии, хрящи, кожа,
кровеносные сосуды, кожа.
• Обеспечивает прочность соединительной
ткани.
117. Первичная структура коллагена – α-коллагеновая цепь
• Различают 20 типов коллагеновых цепей.• α-коллагеновая цепь состоит из ≈ 1000
аминокислотных остатков.
• ⅓ аминокислот – глицин.
• ¼ аминокислот – пролин и гидроксипролин.
• 10% аминокислот – аланин.
• Содержится гидроксилизин.
• Отсутствуют цистеин и триптофан.
• Полипептидная цепь коллагена – повторяющиеся
триплеты аминокислот – Gly-X-Y (Х – часто пролин,
а Y – гидроксипролин или гидроксилизин).
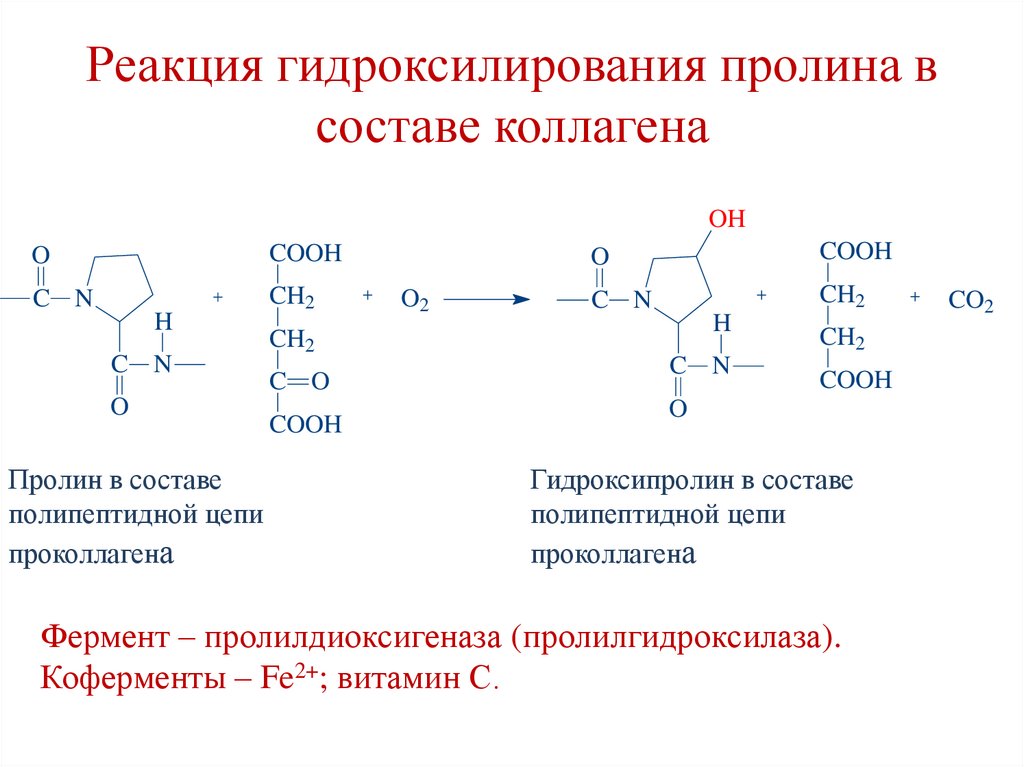
118. Реакция гидроксилирования пролина в составе коллагена
OHO
COOH
C N
CH2
H
C N
O
Пролин в составе
полипептидной цепи
проколлагена
O2
O
COOH
C N
CH2
H
CH2
C O
COOH
C N
CH2
COOH
O
Гидроксипролин в составе
полипептидной цепи
проколлагена
Фермент – пролилдиоксигеназа (пролилгидроксилаза).
Коферменты – Fe2+; витамин С.
CO2
119. Особенности вторичной структуры коллагена
Альфа-коллагеновая спираль:• левозакрученная спиральная конформация –
за счет пролина, который создает изгиб в
полипептидной цепи.
• Один виток – 3 аминокислоты.
• Спираль коллагена стабилизируется силами
стерического отталкивания колец пролина.
120. Тропоколлаген
• Трехцепочечная правозакрученнаясуперспиральная молекула.
• Является структурной единицей коллагена.
• Стабилизируется водородными связями между
атомами пептидной группы.
• Пролин и гидроксипролин («жесткие»
аминокислоты) ограничивают вращение
полипептидного стержня и увеличивают
стабильность тройной спирали.
• Глицин находится в месте пересечения цепей –
отсутствие радикала у глицина позволяет цепям
плотно прилегать друг к другу.
121.
122. Фибриллы коллагена
• Молекулы тропоколлагена объединяются вфибриллы за счет взаимодействия
комплементарных участков.
• Нити коллагена сдвинуты по отношению
друг к другу на ¼ длины.
• Связи между молекулами тропоколлагена –
водородные, ионные, гидрофобные, прочные
ковалентные связи (поперечные сшивки), в
образовании которых участвуют радикалы
лизина и гидроксилизина.
123. Укладка молекул тропоколлагена в фибриллы коллагена
124. Образование ковалентных связей (поперечные сшивки) между радикалами лизина
125. Образование ковалентных связей (поперечные сшивки) между радикалами лизина
126. Поперечные сшивки между радикалами лизина
127. Структура коллагена
128. Эластин
• Белок межклеточного веществасоединительной ткани.
• Входит в состав соединительной ткани –
кожа, легкие, стенки сосудов, эластичные
связки.
• Обладает резиноподобными свойствами.
• Обеспечивает эластичность
соединительной ткани.
129. Эластин
• Полипептидная цепь эластина содержитоколо 800 остатков аминокислот.
• Содержит много глицина, аланина, валина,
сравнительно много пролина, лизина, мало
гидроксипролина, не содержит
гидроксилизин.
130. Эластин
• Наличие большого количествагидрофобных радикалов препятствует
образованию стабильной глобулы. Цепи
эластина не формируют регулярные
вторичную и третичную структуры, а
принимают в межклеточном матриксе
разные конформации.
• Отсутствие упорядоченной структуры
объясняет высокую степень растяжимости.
131. Эластин
• В межклеточном матриксе молекулыэластина образуют волокна, в которых
пептидные цепи связаны между собой
поперечными связями (сшивками).
• Структуры называются:
• Десмозин (образуются между 4-мя
остатками лизина) и
• Лизиннорлейцин (образуются между 2-мя
остатками лизина.
132. Эластин
133. Ковалентные сшивки позволяют волокнам эластина растягиваться и сжиматься
134. Кальций-связывающие белки
• Кальмодулин;• Кальций-переносящий белок энтероцитов
(кальбиндин);
• Коллаген;
• Факторы свертывания крови (II, VII, IX, X);
• Са2+-АТФ-аза.
135. Структурные особенности кальций-связывающих белков
Структурные особенности кальцийсвязывающих белков• Содержат много дикарбоновых аминокислот
(Asp и Glu) и γ-карбоксиглутаминовую
кислоту (Gla).
• γ-карбоксиглутаминовая кислота образуется из
глутаминовой кислоты в ходе
посттрансляционного карбоксилирования с
участием витамина К.
• Gla содержат 2 диссоциированные
карбоксильные группы (2 заряда «-»),
необходимые для свазывания Са2+.
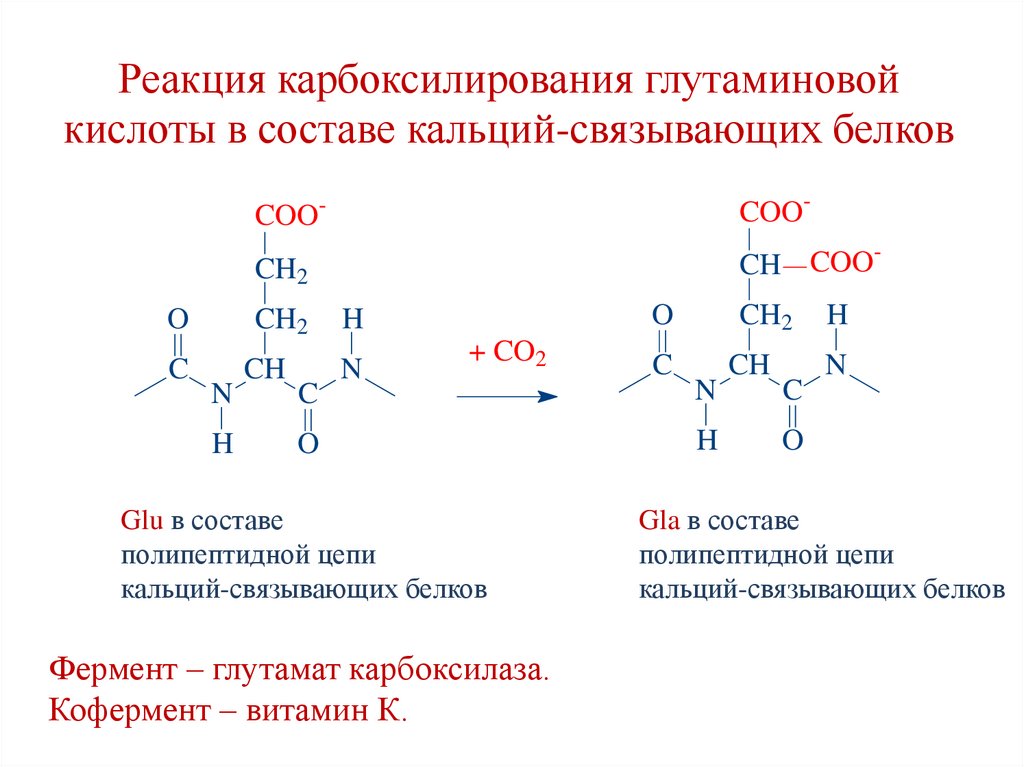
136. Реакция карбоксилирования глутаминовой кислоты в составе кальций-связывающих белков
COO-COO-
CH2
CH COO
O
CH2
H
C
CH
N
N
H
C
+ CO2
O
Glu в составе
полипептидной цепи
кальций-связывающих белков
Фермент – глутамат карбоксилаза.
Кофермент – витамин К.
O
CH2
H
C
CH
N
N
H
C
O
Gla в составе
полипептидной цепи
кальций-связывающих белков
137.
ФИЗИКО-ХИМИЧЕСКИЕСВОЙСТВА БЕЛКОВ.
МЕТОДЫ ОЧИСТКИ И
РАЗДЕЛЕНИЯ БЕЛКОВ
138. Молекулярная масса белков
• Белки – высокомолекулярные соединения(молекулярная масса – 6000-1000000 Д).
• Методы определения молекулярной массы
белков:
• Ультрацентрифугирование;
• Гель-хроматография;
• Электрофорез;
• Масс-спектрометрия.
139. Электро-химические свойства белков
• Обусловлены присутствием в составебелков кислых (Glu, Asp) и основных
аминокислот (Lys, Arg, His).
• Суммарный заряд белка зависит от
соотношения ионизированных
карбоксильных групп и ионизированных
основных групп.
140. Электро-химическая классификация белков
• Нейтральные.• Кислые (преобладают Glu, Asp).
• Основные (преобладают Lys, Arg, His).
141. Электро-химические свойства белков
• Степень ионизации функциональных группрадикалов кислых и основных аминокислот
зависит от рН среды.
• При физиологических значениях рН все
ионогенные группы белка находятся в
ионизированном состоянии.
142. Электро-химические свойства белков
• Значение рН, при котором белок приобретаетнулевой заряд, называется изоэлектрической
точкой и обозначается как рI.
• рI нейтральных белков – рН = 7
• рI кислых белков – кисляя среда (рН ˂ 7)
• рI основных белков – щелочная среда (рН ˃7)
143. Электро-химические свойства белков
• Лежат в основе электрофореза.• Электрофорез – движение заряженных частиц в
электрическом поле.
1. В изоэлектрической точке суммарный заряд
белка =0, белок не перемещается в
электрическом поле.
2. При значении рН, ниже его рI, белок приобретает
«+» заряд (катион) и движется к «–» электроду
(катоду).
3. При значении рН, выше его рI, белок
приобретает «-» заряд (анион) и движется к «+»
электроду (аноду).
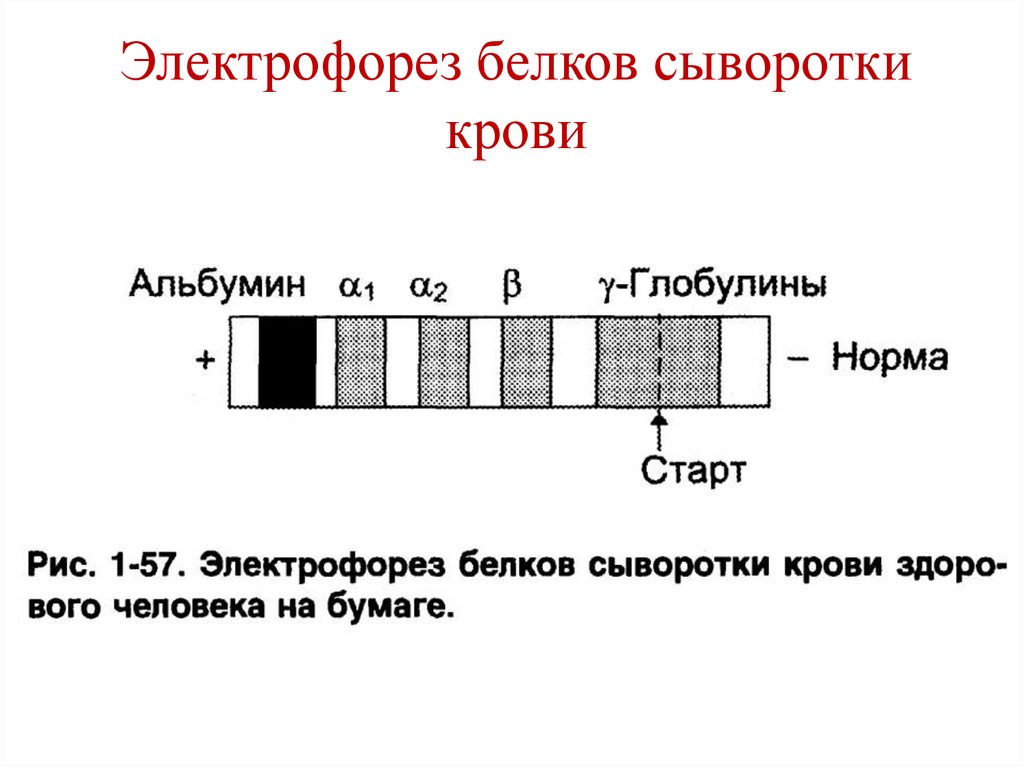
144. Электрофорез белков сыворотки крови
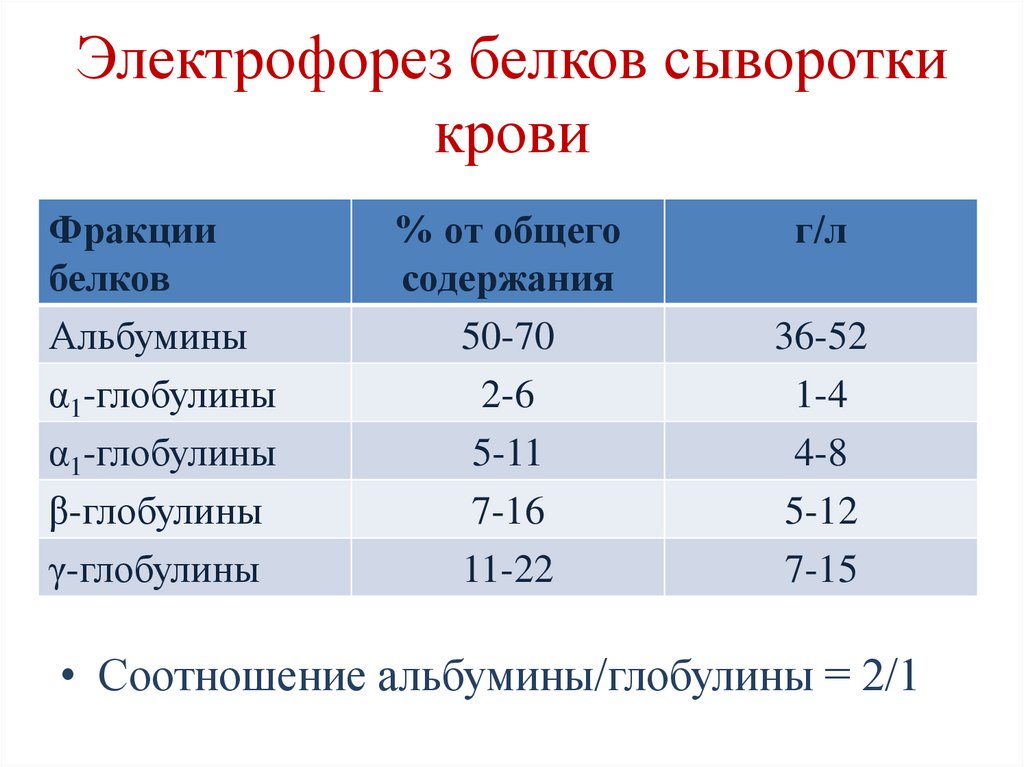
145. Электрофорез белков сыворотки крови
Фракциибелков
Альбумины
α1-глобулины
α1-глобулины
β-глобулины
γ-глобулины
% от общего
содержания
50-70
2-6
5-11
7-16
11-22
г/л
36-52
1-4
4-8
5-12
7-15
• Соотношение альбумины/глобулины = 2/1
146. Растворимость белков
Зависит от:• Содержания полярных и неполярных групп;
• Заряда белка;
• Массы белка;
• Формы белка.
147. Факторы, влияющие на растворимость белков
• Присутствие нейтральных солей – (NH4)2SO4,Na2 SO4, NaCl, MgCl2. В низких
концентрациях – повышают растворимость, в
высоких – уменьшают.
• Значение рН. В рI белки наименее устойчивы,
т.к. имеют суммарный нулевой заряд.
• Температура. Увеличение температуры
увеличивает растворимость белков.
148. Факторы, стабилизирующие белковые растворы
• Заряд белка – одноименно заряженныемолекулы белка отталкиваются друг от друга.
• Гидратная оболочка – препятствует
сближению и склеиванию молекул и их
выпадению в осадок.
149. Высаливание белков
• Метод очистки белков, основанный наразличиях в их растворимости при разной
концентрации соли в растворе.
Механизм высаливания:
1. Удаление гидратной оболочки;
2. Нейтрализация заряда.
При высаливании сохраняются нативные
свойства белков.
Пример: разделение альбуминов и глобулинов.
150. Свойства коллоидных белковых растворов
Оптические свойства.• При боковом освещении белкового раствора
образуется светящийся конус – эффект
Тиндаля (из-за дифракции лучей света
частицами белка).
• Оптические свойства белков используются
для их количественного определения
нефелометрическим методом.
151. Свойства коллоидных белковых растворов
Малая скорость диффузии.• Диффузия – самопроизвольное движение
молекул растворенных веществ.
• Белки обладают ограниченной скоростью
диффузии.
• Диффузия белков зависит от молекулярной
массы и формы белковой молекулы.
152. Свойства коллоидных белковых растворов
Осмотические свойства.• Белки являются высокомолекулярными
веществами, потому не проходят через
полупроницаемые мембраны.
• Неспособность белков проходить через
полупроницаемые мембраны используется
для очистки белков от низкомолекулярных
веществ и называется диализом.
153. Свойства коллоидных белковых растворов
• Неспособность белков диффундировать черезмембраны вызывает явление осмоса, т.е.
перемещение воды через мембрану в раствор
белка.
• Перемещение воды повышает
гидростатическое давление, которое
препятствует дальнейшему перемещению
воды.
154. Свойства коллоидных белковых растворов
• То давление, которое нужно приложить,чтобы остановить ток воды, называется
осмотическим давлением и зависит от
молярной концентрации белка и температуры.
Осмотическое давление, поддерживаемое
белками, называется онкотическим
давлением.
155. Свойства коллоидных белковых растворов
Высокая вязкость• Обусловлена силами сцепления между
молекулами белка и зависит от формы
белковых молекул.
• Вязкость зависит от:
• Формы белковых молекул;
• Температуры;
• Присутствия различных ионов (Са2+ ).
156. Свойства коллоидных белковых растворов
Способность к образованию гелей• Взаимодействие макромолекул белка
приводит к образованию структурных сеток,
внутри которых иммобилизуется вода –
образуется гель.
• Пример: полимеризация фибрина с
образованием сгустка.
157. Денатурация белков
• Нарушение нативной структуры белка.• При денатурации происходит разрыв связей,
стабилизирующих четвертичную, третичную
и вторичную структуры белка, сохраняется
только первичная структура.
Денатурированный белок:
• теряет биологическую активность;
• снижается его растворимость, белок выпадает
в осадок.
158. Факторы, вызывающие денатурацию белков
• Высокая температура;• Органические вещества (этанол, фенол,
мочевина);
• Кислоты и щелочи;
• Соли тяжелых металлов (медь, ртуть, свинец,
серебро);
• Детергенты.
159. Применение денатурирующих агентов в медицинской практике
• Стерилизация медицинских инструментов иматериала (высокая температура в
автоклавах).
• Антисептики (фенол, крезол, резорцин,
сулема – дихлорид ртути, ляпис – AgNO3,
колларгол).
160. Методы разделения белков
• Высаливание.• Гель-фильтрационная хроматография (метод
молекулярных сит).
• Ионообменная хроматография.
• Аффинная хроматография.
• Ультрацентрифугирование.
161. Гель-фильтрационная хроматография
162. Гель-фильтрационная хроматография
163. Гель-фильтрационная хроматография
164. Ионообменная хроматография
АнионообменникКатионообменник
165. Аффинная хроматография
166. Афинная хроматография
• Это специфичный методвыделения
индивидуальных
ферментов, основанный
на избирательном
взаимодействии с
лигандами (субстратом
или коферментом),
прикрепленными к
твердому носителю.
167. Афинная хроматография
• Через колонку, заполненнуюиммобилизованным лигандом, пропускают
раствор, содержащий смесь белков. К
лиганду присоединяется только фермент,
специфично взаимодействующий с ним.
Фермент, адсорбированный на колонке,
можно снять, промыв ее раствором с
измененным значением рН или
детергентом, разрывающие связи между
ферментом и лигандом.
168. Биомедицинское значение очистки и разделения белков
• Диализ – искусственная почка.• Получение чистых лекарственных белковых
препаратов (высокая биологическая
эффективность и низкая аллергенность).


















































































































 chemistry
chemistry








