Similar presentations:
Тема 14 Электролиз
1.
Важнейшие классыОсновы электрохимии.
неорганических соединений.
Электролиз
КИСЛОТЫ
Составители: к.х.н. Махмутова Г.Ф.,
к.х.н. Ефимова И.Г.
2.
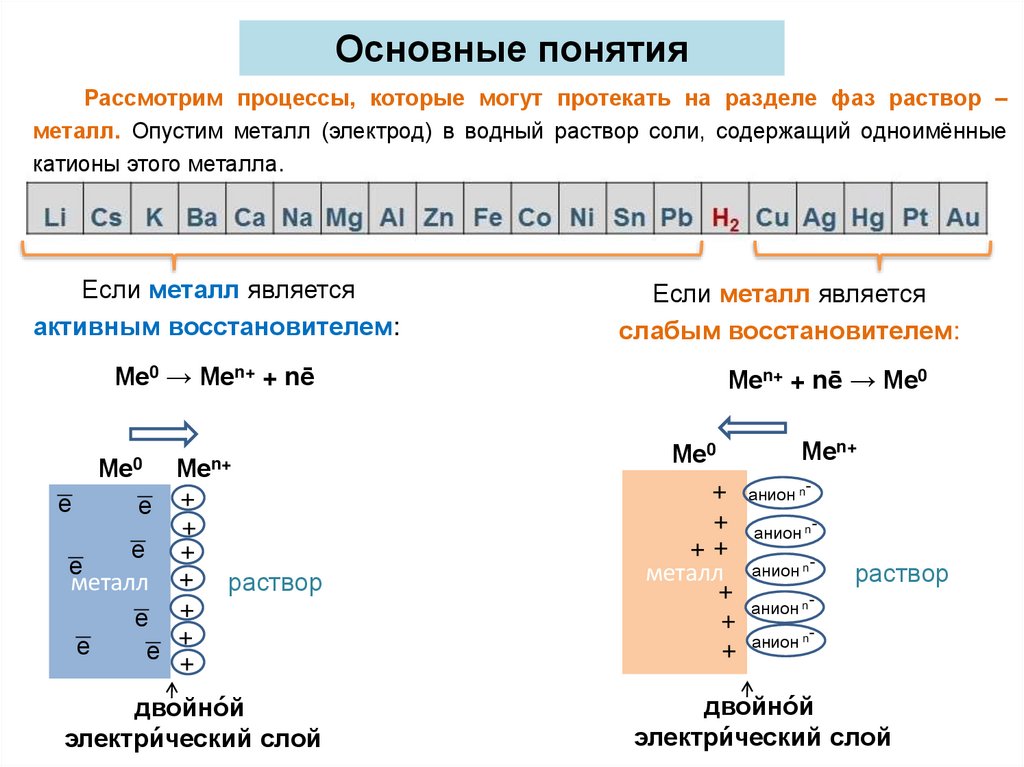
Основные понятияРассмотрим процессы, которые могут протекать на разделе фаз раствор –
металл. Опустим металл (электрод) в водный раствор соли, содержащий одноимённые
катионы этого металла.
Если металл является
активным восстановителем:
Ме0 → Меn+ + nē
_
е
Ме0
Меn+
_ +
е
_ +
_
е +
е
металл +
_ +
е_
_
+
е
е +
раствор
двойно́й
электри́ческий слой
Если металл является
слабым восстановителем:
Меn+ + nē → Ме0
Меn+
Ме0
+ анион n+ анион n++
металл анион nраствор
+
анион n+
n+ анион
двойно́й
электри́ческий слой
3.
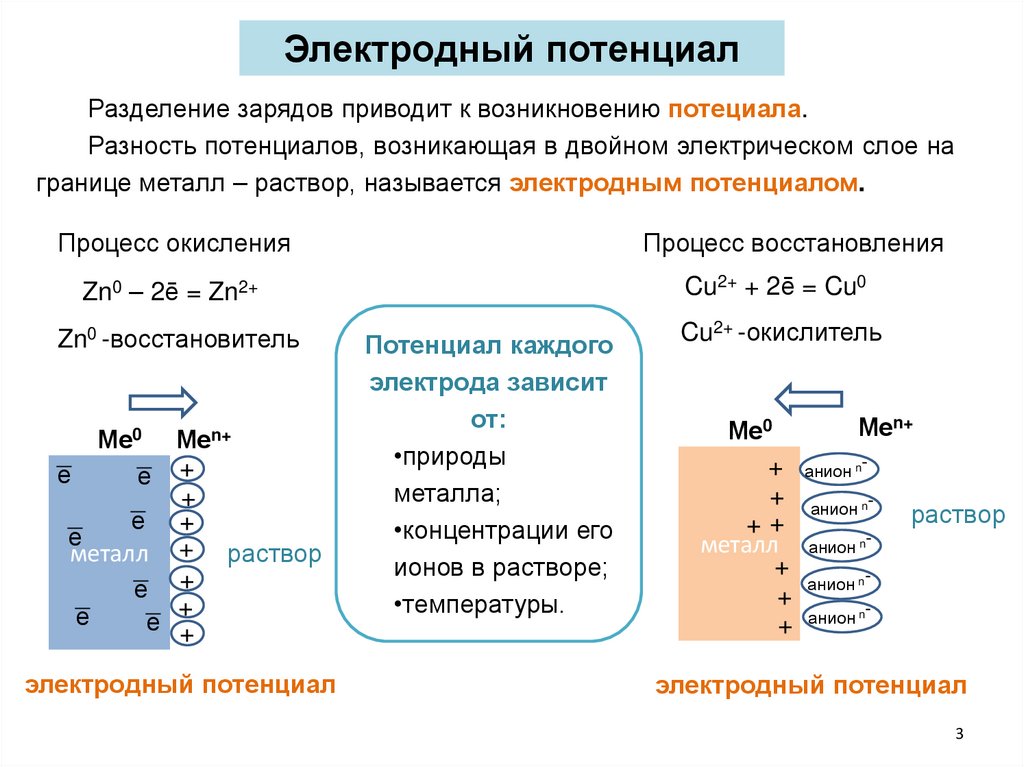
Электродный потенциалРазделение зарядов приводит к возникновению потециала.
Разность потенциалов, возникающая в двойном электрическом слое на
границе металл – раствор, называется электродным потенциалом.
Процесс окисления
Процесс восстановления
Zn0 – 2ē = Zn2+
Cu2+ + 2ē = Cu0
Zn0 -восстановитель
Cu2+ -окислитель
Ме0 Меn+
_
_ +
е
е
_ +
_
е +
е
металл + раствор
_ +
е_
_
+
е
е +
электродный потенциал
Потенциал каждого
электрода зависит
от:
•природы
металла;
•концентрации его
ионов в растворе;
•температуры.
Меn+
Ме0
+ анион n+ анион nраствор
++
металл анион n+
анион n+
n+ анион
электродный потенциал
3
4.
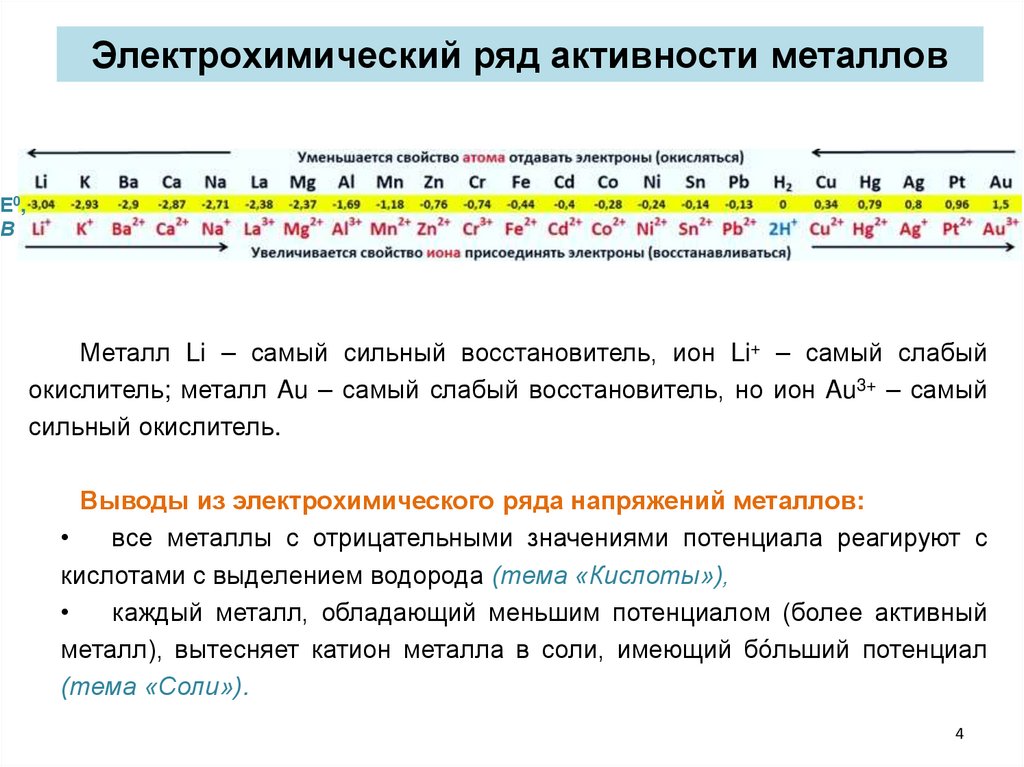
Электрохимический ряд активности металловЕ0,
В
Металл Li – самый сильный восстановитель, ион Li+ – самый слабый
окислитель; металл Au – самый слабый восстановитель, но ион Au3+ – самый
сильный окислитель.
Выводы из электрохимического ряда напряжений металлов:
все металлы с отрицательными значениями потенциала реагируют с
кислотами с выделением водорода (тема «Кислоты»),
каждый металл, обладающий меньшим потенциалом (более активный
металл), вытесняет катион металла в соли, имеющий бо́льший потенциал
(тема «Соли»).
4
5.
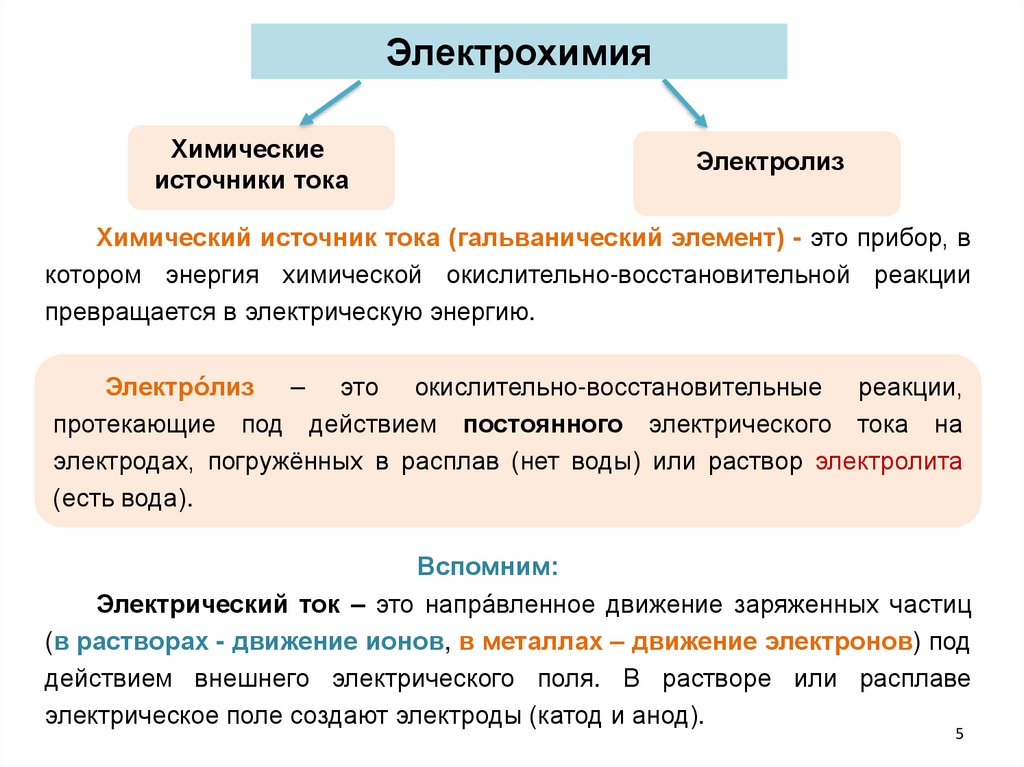
ЭлектрохимияХимические
источники тока
Электролиз
Химический источник тока (гальванический элемент) - это прибор, в
котором энергия химической окислительно-восстановительной реакции
превращается в электрическую энергию.
Электро́лиз – это окислительно-восстановительные реакции,
протекающие под действием постоянного электрического тока на
электродах, погружённых в расплав (нет воды) или раствор электролита
(есть вода).
Вспомним:
Электрический ток – это напра́вленное движение заряженных частиц
(в растворах - движение ионов, в металлах – движение электронов) под
действием внешнего электрического поля. В растворе или расплаве
электрическое поле создают электроды (катод и анод).
5
6.
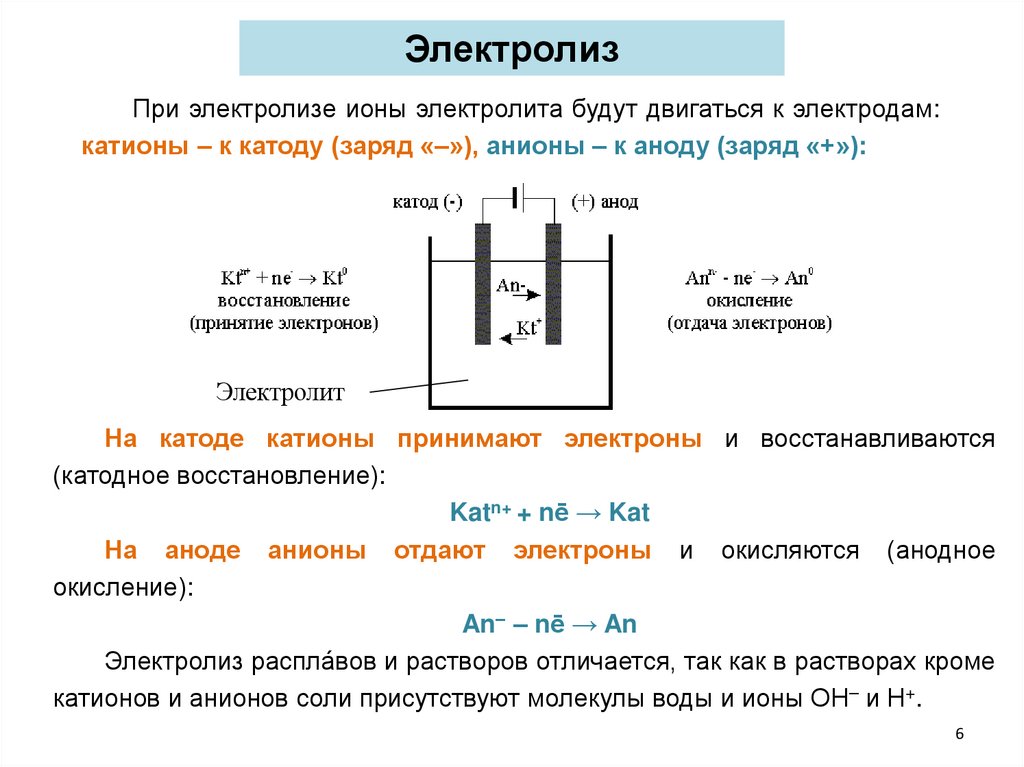
ЭлектролизПри электролизе ионы электролита будут двигаться к электродам:
катионы – к катоду (заряд «–»), анионы – к аноду (заряд «+»):
Электролит
На катоде катионы принимают электроны и восстанавливаются
(катодное восстановление):
Katn+ + nē → Kat
На аноде анионы отдают электроны и окисляются (анодное
окисление):
An– – nē → An
Электролиз распла́вов и растворов отличается, так как в растворах кроме
катионов и анионов соли присутствуют молекулы воды и ионы ОН– и Н+.
6
7.
Электролиз расплавовПроцессы, протекающие на электродах при электролизе
расплавов, не зависят от материала электродов и природы ионов.
При электролизе расплавов электролитов присутствуют
только ионы, образовавшиеся при его диссоциации.
Kat An → Katn+ + An–
На катоде происходит процесс восстановления
в результате образуются нейтральные атомы или молекулы:
Katn+ + nē → Kat
катиона,
На аноде происходит процесс окисления аниона (An–;
результате образуются нейтральные атомы или молекулы:
An– – nē → An
OH–), в
4OH– – 4ē → O2↑ + 2H2O
7
8.
Электролиз расплавовПримеры:
1. Написать уравнение электролиза расплава хлорида меди (II).
Запишем уравнение диссоциации электролита:
CuCl2 ⇄ Cu2+ +2Cl–
На катоде К (–):
На аноде А (+):
Cu2+ + 2ē·→ Cu0
2Cl– – 2ē·→ Cl20
1
1
Для подбора коэффициентов используем метод электронно-ионного баланса.
Суммарное ионное уравнение:
Cu2+ + 2Cl–
электролиз
Cu0↓ + Cl20↑
Суммарное молекулярное уравнение:
CuCl2
электролиз
Cu↓ + Cl2↑
8
9.
Электролиз расплавовПримеры:
2. Написать уравнение электролиза расплава сульфата натрия.
Уравнение диссоциации электролита:
Na2SО4 ⇄ 2Nа+ + SО42–
На катоде К (–): 2Nа+ + 2ē → 2Nа
На аноде А (+): SО42– – 2ē → SО3 + ½О2
1
1
Оксид серы в той же степени окисления +6,
что и до электролиза
Суммарное ионное уравнение:
2Nа+ + SО42–
электролиз
2Nа0↓ + SО3↑ + ½О2↑
Суммарное молекулярное уравнение:
Na2SО4
электролиз
2Nа↓ + SО3↑ + ½О2↑
9
10.
Электролиз расплавовПримеры:
3. Написать уравнение электролиза расплава гидроксида натрия.
Уравнение диссоциации электролита:
NaОН ⇄ Nа+ + ОН–
На катоде К (–): Nа+ + ē → Nа
На аноде А (+): 4OH– – 4ē → O2↑ + 2H2O
4
1
Коэффициент перед частицами Na
Суммарное ионное уравнение:
4Nа+ + 4ОН– электролиз 4Nа0↓ + О2↑ + 2Н2О
Суммарное молекулярное уравнение:
4NаОН
электролиз
4Nа0↓ + О2↑ + 2Н2О
Многие металлы получают в промышленности электролизом расплавов.
10
11.
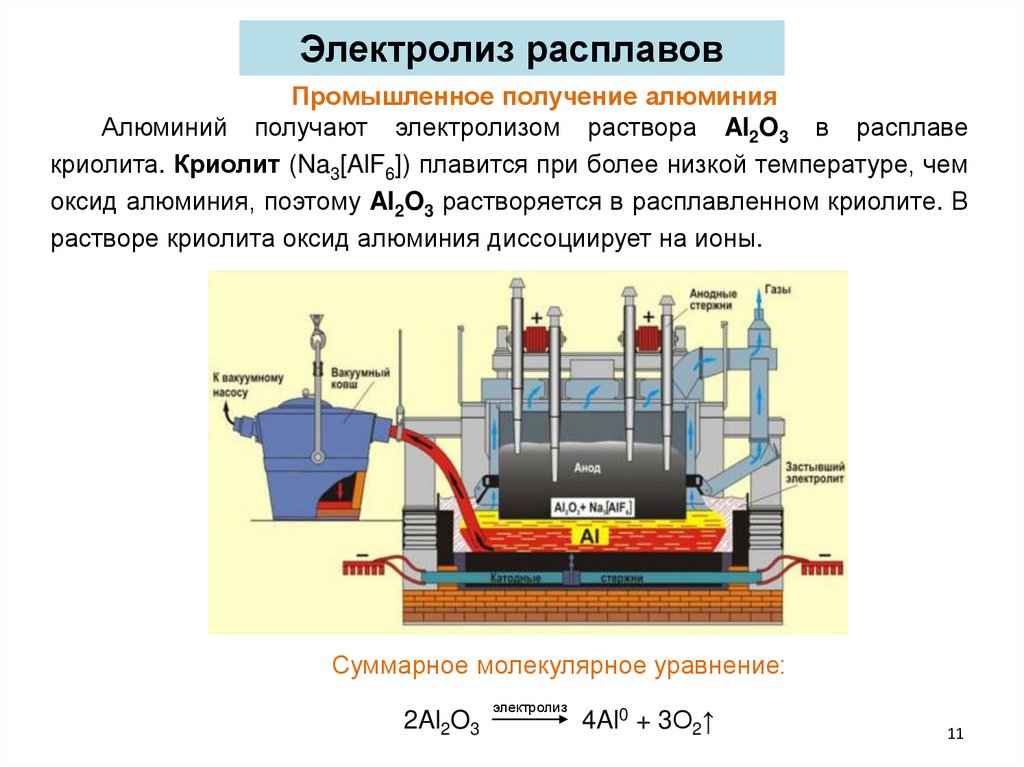
Электролиз расплавовПромышленное получение алюминия
Алюминий получают электролизом раствора Al2O3 в расплаве
криолита. Криолит (Na3[AlF6]) плавится при более низкой температуре, чем
оксид алюминия, поэтому Al2O3 растворяется в расплавленном криолите. В
растворе криолита оксид алюминия диссоциирует на ионы.
Суммарное молекулярное уравнение:
2Al2O3
электролиз
4Al0 + 3О2↑
11
12.
Электролиз растворовПри электролизе растворов электролитов присутствуют
ионы электорита и ионы растворителя (воды)
Kat An → Katn+ + An–
Н2О → Н+ + ОН–
Процессы, протекающие на электродах при электролизе
растворов, зависят от материала электродов и природы ионов.
1. Процессы, протекающие на КАТОДЕ при электролизе растворов не
зависят от материала катода; зависят от положения металла в ряду
напряжений.
2. Процессы, протекающие на АНОДЕ при электролизе растворов
зависят от материала анода и природы анионов.
12
13.
Электролиз растворовПроцессы, протекающие на КАТОДЕ при электролизе растворов.
Электрохимический ряд напряжений
Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb (H) Sb Bi Cu
Hg Ag Pt Au
Металлы до Al:
Li+, Cs+, K+, Ba2+, Ca2+,
Na+, Mg2+, Al3+
Металлы от Zn до
Pb: Zn2+, Fe2+, Co2+,
Ni2+, Sn2+, Pb2+
Катионы активных
металлов не
восстанавливаются,
а восстанавливаются
молекулы H2O:
2H2O+2ē→H2↑+2OH–
Катионы металлов
восстанавливаются
одновременно
с водой:
1) Men+ + nē →Me
2) 2H2O + 2é →
→ H2↑ + 2OH–-
Металлы после
водорода:
H2
Cu2+, Ag+, Hg2+,
Pt2+, Au3+
При электролизе Восстанавливаются
растворов кислот катионы металлов:
восстанавливаются
Men++nē → Me0
катионы H+:
2H+ + 2ē → H20↑
13
14.
Электролиз растворовПроцессы, протекающие на КАТОДЕ при электролизе растворов.
Электрохимический ряд напряжений
Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb (H) Sb Bi Cu Hg
Ag Pt Au
Если в растворе одновременно находятся катионы различных
металлов, то в первую очередь восстанавливается катион с бо́льшим
значением электродного потенциала.
Например, в растворе находятся следующие катионы:
Ni2+, Pb2+, Cu2+ (соли NiСl2, PbСl2, CuСl2).
Восстановление металлов происходит в следующем порядке:
1. Cu2+ + 2ē → Cu
2. Pb2+ + 2ē →Pb
3. Ni2+ + 2ē → Ni
14
15.
Электролиз растворовПроцессы, протекающие на АНОДЕ при электролизе растворов
зависят от материала анода и природы анионов.
Анод инертный (из угля, графита, Pt, Au)
Анионы
бескислородных
кислот окисляются до
простого вещества
(кроме F–):
An– – nē → An0
Анионы
кислородсодержащих
кислот (SO42–, CO32–) и F–
не окисляются, идёт
окисление молекул H2O:
2H2O – 4ē → O2↑ + 4H+
При электролизе
растворов щёлочей
окисляются ионы OH–:
4OH– – 4ē → O2↑ + 2H2O
Анионы органических кислот окисляются до углекислого газа и алкана:
2R-COO- – 2ē → R–R + 2CO2↑
2CH3COO- – 2ē → CH3–CH3 + 2CO2↑
Анод активный (из Cu, Ag, Zn, Ni, Fe и других металлов)
Анионы не окисляются.
Идёт окисление атомов металла анода:
Me0 – nē → Men+
15
Катионы Men+ переходят в раствор, при этом анод растворяется.
16.
Электролиз растворовПримеры:
1. Рассмотрим электролиз раствора соли, содержащей катион до Al и
анион кислородсодержащей кислоты (соль – K2SO4), если:
а) анод инертный;
б) анод активный (цинковый).
Уравнение диссоциации электролита:
K2SO4 ⇄ 2K+ + SO42−
а) На катоде К (–): 2H2O + 2ē → H2 + 2OHНа аноде А (+): 2H2O – 4ē → O2 + 4H+
Суммарное ионное уравнение:
6H2O
электролиз
Суммарное молекулярное уравнение: 2H2O
б)
2
1
2H2↑ + 4OH− + O2↑ + 4H+
электролиз
2H2↑ + O2↑
На катоде К (–): 2H2O + 2ē → H2 + 2OHНа аноде А (+): Zn0 – 2ē → Zn2+
Суммарное ионное уравнение:
2H2O + Zn0
электролиз
1
1
H2 ↑ + 2OH− + Zn2+
Суммарное молекулярное уравнение: 2H2O + Zn электролиз H2↑ + Zn(OH)2
16
17.
Электролиз растворовПримеры:
2. Рассмотрим электролиз раствора соли, содержащий катион от Zn до
Pb и анион бескислородной кислоты (ZnCl2) c угольными электродами
(инертные).
Уравнение диссоциации электролита:
ZnCl2 ⇄ Zn2+ + 2Cl–
На катоде К (–): Zn2+ + 2ē → Zn0
2H2O + 2ē → H2 + 2OH-
1
На аноде А (+):
2
2Cl– – 2ē → Cl2
Суммарное ионное уравнение:
электролиз
Zn2+ + 2H2O + 4Cl–
Zn0↓ + H2↑ + 2OH− + 2Cl2↑
основание
Суммарное молекулярное уравнение:
электролиз
2ZnCl2 + 2H2O
Zn↓ + H2↑ + Zn(OH)2 + 2Cl2↑
17
18.
Электролиз растворовПримеры:
3. Рассмотрим электролиз раствора соли, содержащей катион металла
после Н2 и анион кислородсодержащей кислоты (Cu(NO3)2) с инертными
электродами.
Уравнение диссоциации электролита:
Cu(NO3)2 ⇄ Cu2+ + 2NO3На катоде К (–): Cu2+ +2ē → Cu0
На аноде А (+): 2H2O – 4ē → O2 + 4H+
2
1
Суммарное ионное уравнение:
электролиз
2Cu2+ + 2H2O
2Cu0↓ + O2 ↑+ 4H+
Суммарное молекулярное уравнение:
электролиз
2Cu(NO3)2 + 2H2O
2Cu↓ + O2↑+ 4HNO3
кислота
18
19.
Домашнее задание1. Установите соответствие между формулой вещества и продуктами электролиза
водного раствора этого вещества, образовавшимися на инертных электродах:
ФОРМУЛА ВЕЩЕСТВА
А) HBr
Б) Al2(SO4)3
В) Cu(NO3)2
Г) KBr
ПРОДУКТЫ ЭЛЕКТРОЛИЗА
1) H2, O2
2) H2, Br2
3) Cu, O2
4) K, O2
5) Al, SO2
2. Установите соответствие между формулой соли и продуктом, образующимся на
инертном аноде при электролизе её водного раствора:
ФОРМУЛА СОЛИ
А) K2CO3
Б) Na2S
В) MgSO4
Г) CuBr2
ПРОДУКТ НА АНОДЕ
1) HBr
2) Cu
3) O2
4) Br2
5) S
6) SO2
19
20.
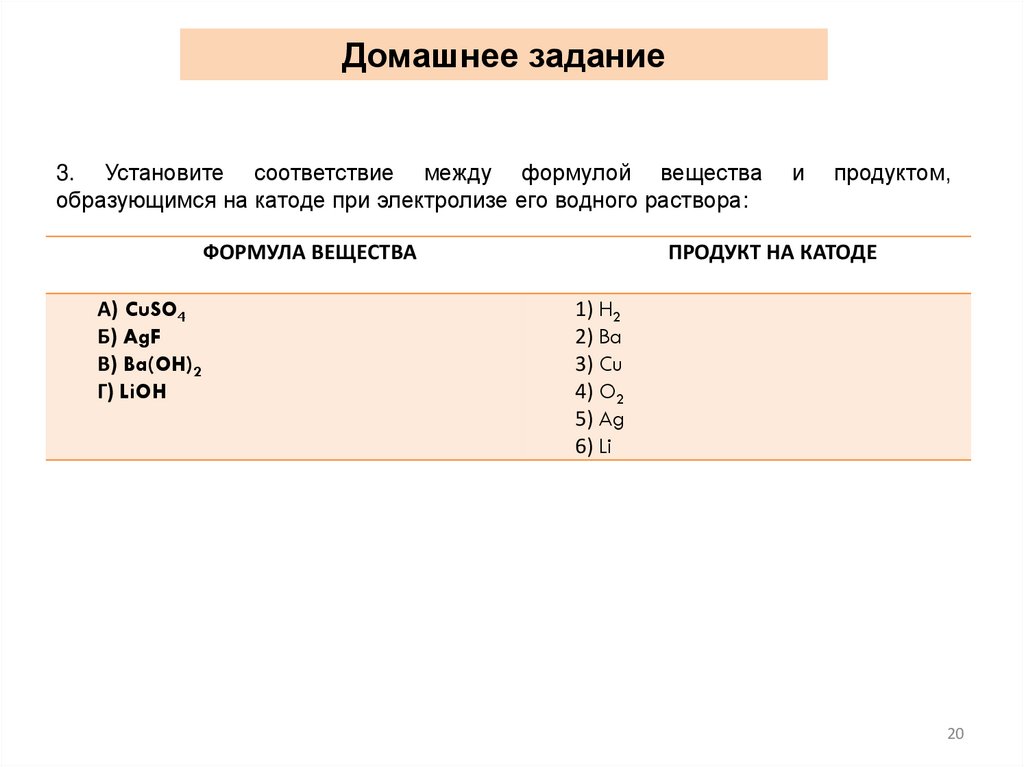
Домашнее задание3. Установите соответствие между формулой вещества
образующимся на катоде при электролизе его водного раствора:
ФОРМУЛА ВЕЩЕСТВА
А) CuSO4
Б) AgF
В) Ba(OH)2
Г) LiOH
и
продуктом,
ПРОДУКТ НА КАТОДЕ
1) H2
2) Ba
3) Cu
4) O2
5) Ag
6) Li
20














 chemistry
chemistry