Similar presentations:
f0ba61e075054c53b7f38995a3624454
1.
КИСЛОТЫ.СОЛИ
2.
Лимоннаякислота
Яблочная
кислота
Щавелевая
кислота
Муравьиная
кислота
Уксусная
кислота
Молочная
кислота
3.
Растворы всех кислот навкус кислые.
Но ни один химик не будет
распознавать кислоты на
вкус.
Как же химики судят о том, является ли данное
вещество кислотой?
4.
1) Что такоеиндикаторы?
2)Какие индикаторы вы
знаете?
3) Как индикаторы меняют
цвет в кислой среде?
5.
Окраска индикаторов в кислотахПомни! Нерастворимые кислоты не меняют окраску
индикаторов.
6.
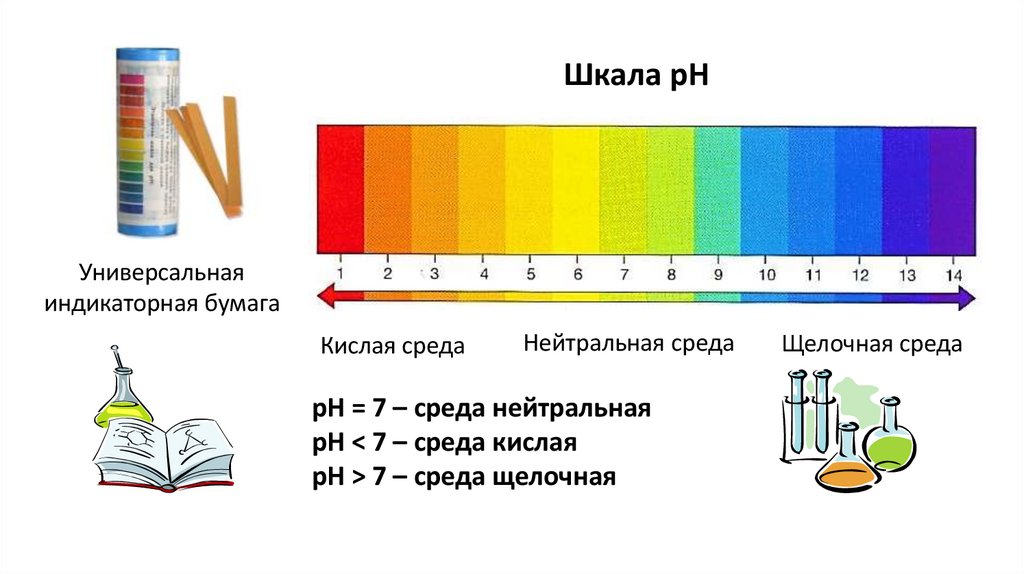
Шкала рНУниверсальная
индикаторная бумага
Кислая среда
Нейтральная среда
рН = 7 – среда нейтральная
рН < 7 – среда кислая
рН > 7 – среда щелочная
Щелочная среда
7.
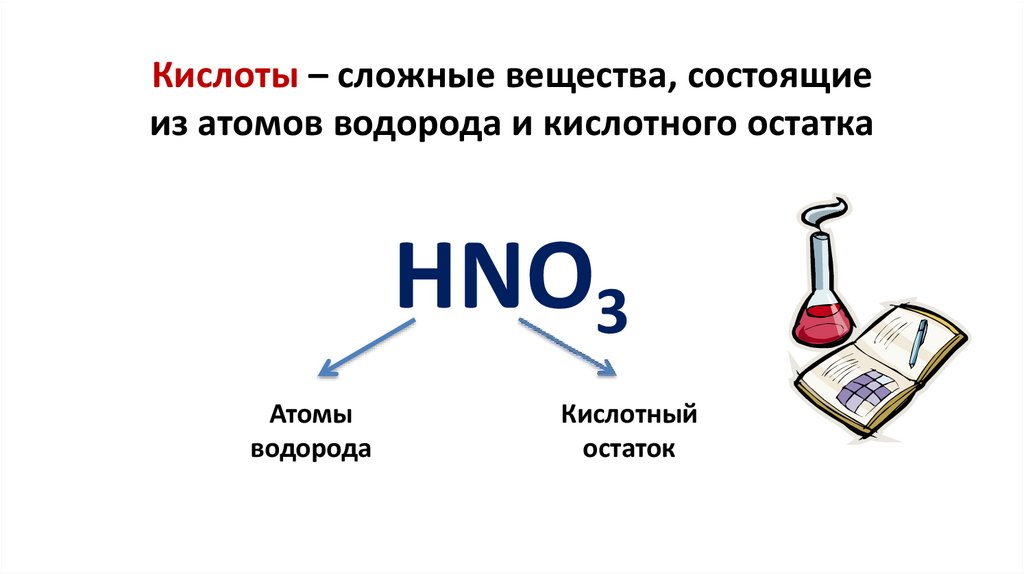
Кислоты – сложные вещества, состоящиеиз атомов водорода и кислотного остатка
HNO3
Атомы
водорода
Кислотный
остаток
8.
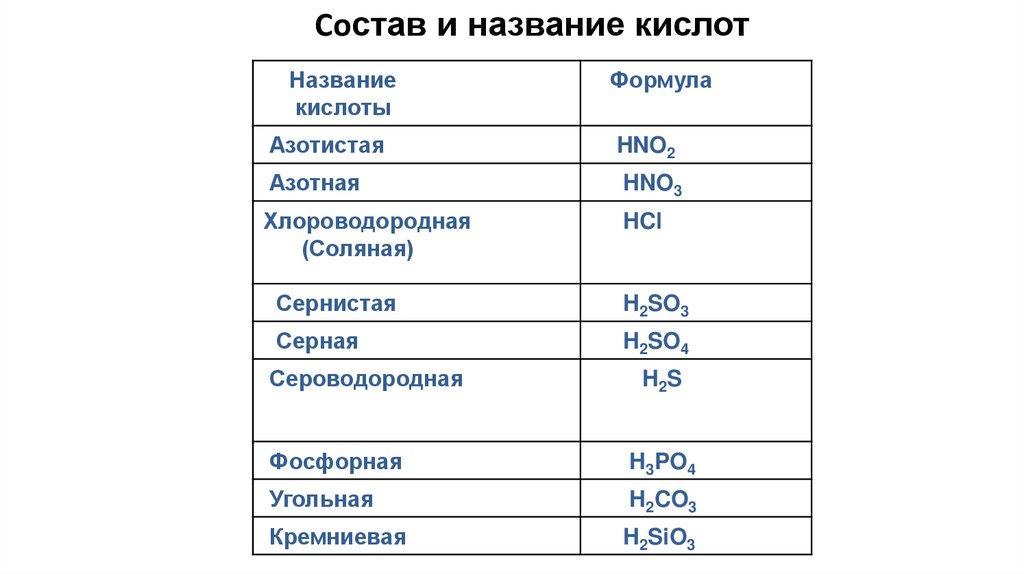
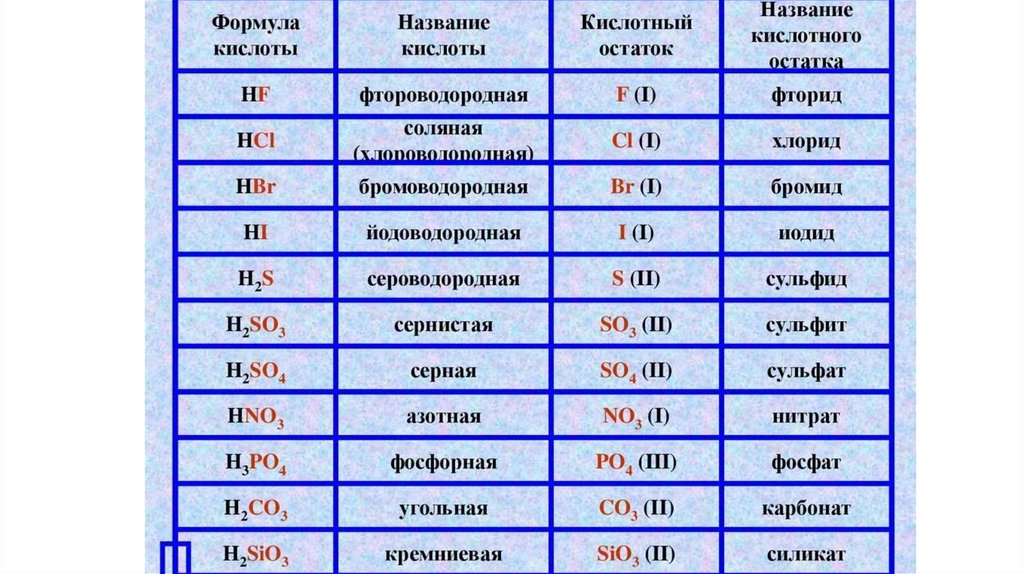
Состав и название кислотНазвание
кислоты
Формула
Азотистая
HNO2
Азотная
HNO3
Хлороводородная
(Соляная)
HCl
Сернистая
H2SO3
Серная
H2SO4
Сероводородная
H2S
Фосфорная
H3PO4
Угольная
H2CO3
Кремниевая
H2SiO3
9.
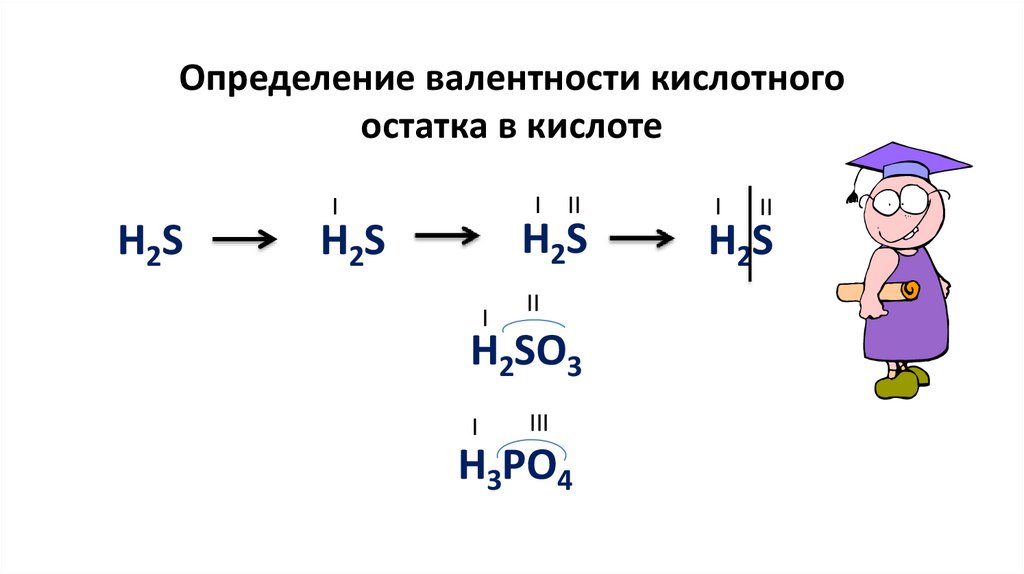
Определение валентности кислотногоостатка в кислоте
II
H2S
H2S
I
II
H2SO3
I
III
H2S
I
I
H3РO4
I
II
H2S
10.
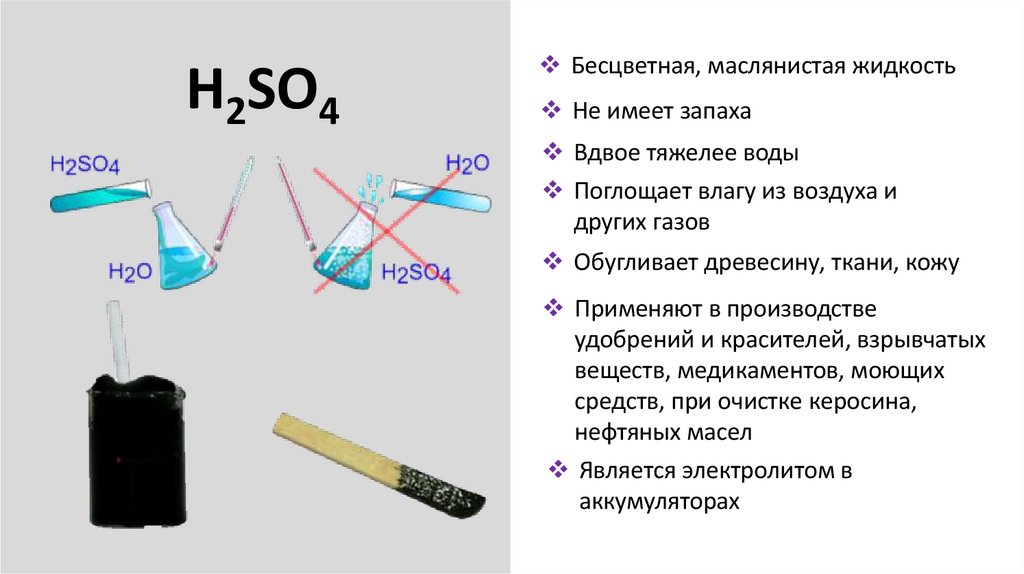
H2SO4Бесцветная, маслянистая жидкость
Не имеет запаха
Вдвое тяжелее воды
Поглощает влагу из воздуха и
других газов
Обугливает древесину, ткани, кожу
Применяют в производстве
удобрений и красителей, взрывчатых
веществ, медикаментов, моющих
средств, при очистке керосина,
нефтяных масел
Является электролитом в
аккумуляторах
11.
Обугливание сахара серной кислотой12.
13.
Соляная кислотаСоляная кислота (хлороводородная)
одноосновная
кислота, «дымящая» на воздухе, бесцветная едкая
жидкость с острым запахом хлористого водорода.
Соляная кислота содержится желудочном соке (около
0,3%)
способствует
пищеварению
и
убивает
болезнетворные бактерии.
Соляная кислота — едкое вещество, при попадании на
кожу вызывает сильные ожоги. Особенно опасно
попадание в глаза. При открывании сосудов с соляной
кислотой в обычных условиях образуется туман и пары
хлороводорода,
которые
раздражают
слизистые
оболочки и дыхательные пути.
14.
Правило разбавлениякислот
Запомните правило:
сначала вода, потом
кислота, иначе случится
большая беда!!!
При растворении кислоты
нужно вливать ее тонкой
струей в воду и
перемешивать.
15.
16.
ЕСЛИ КИСЛОТА ПОПАЛА НА КОЖУ.Пораженный участок кожи промывают
сильно скользящей струей холодной
воды в течение 10 – 15 мин. После
промывки
на
обожженное
место
накладывают пропитанную водным 2%м раствором питьевой соды марлевую
повязку или ватный тампон. Через 10
мин. повязку снимают, кожу обмывают,
осторожно
удаляют
влагу
фильтровальной бумагой или мягкой
тканью и смазывают глицерином для
уменьшения болевых ощущений
17. Классификация кислот
18. Физические свойства
Агрегатное состояние. При нормальных условиях (при температуре 0 °C)кислоты могут быть как твёрдыми веществами, так и жидкостями.
Цвет. Водные растворы кислот, как правило, являются бесцветными.
Запах. Некоторые кислоты являются летучими и в концентрированном виде
имеют резкий запах.
Растворимость в воде. В подавляющем большинстве кислоты хорошо
растворяются в воде. Практически нерастворимой является кремниевая
кислота, плохо растворяется в воде борная кислота.
Способность проводить ток. Кислоты могут быть хорошими
проводниками электричества, потому что содержат заряженные частицы —
ионы.
19. Химические свойства
1. Кислота + основание = соль + водаHCl+NaOH=NaCl+H2O
2HNO3 + Fe(OH)2 = Fe(NO3)2 + 2H2O
2. Кислота + основный оксид = соль + вода
H2SO4 + CuO = CuSO4 + H2O
20.
3. Кислота + металл = соль + водород2HCl + Zn = ZnCl2 + H2
Для осуществления реакции необходимо:
1) Металл должен находиться в ряду
напряжений до водорода.
2) Должна получиться растворимая соль
Pb + H2SO4 = PbSO4 + H2
21.
4. Кислота + соль = новая кислота + новая сольРеакция идёт в том случае, если образуется:
1) Осадок
H2SO4 + BaCl2 = BaSO4 + 2HCl
2) Газ
2HNO3 + CaCO3 = Ca(NO3)2 + H2O + CO2
22.
12
3
4
5
6
7
8
9
10
11
23.
24.
СОЛИ25.
1. Какие классы веществ вы знаете?2. Что такое простые вещества?
3. Что такое сложные вещества?
4. Что такое оксиды?
5. Что такое кислоты?
26.
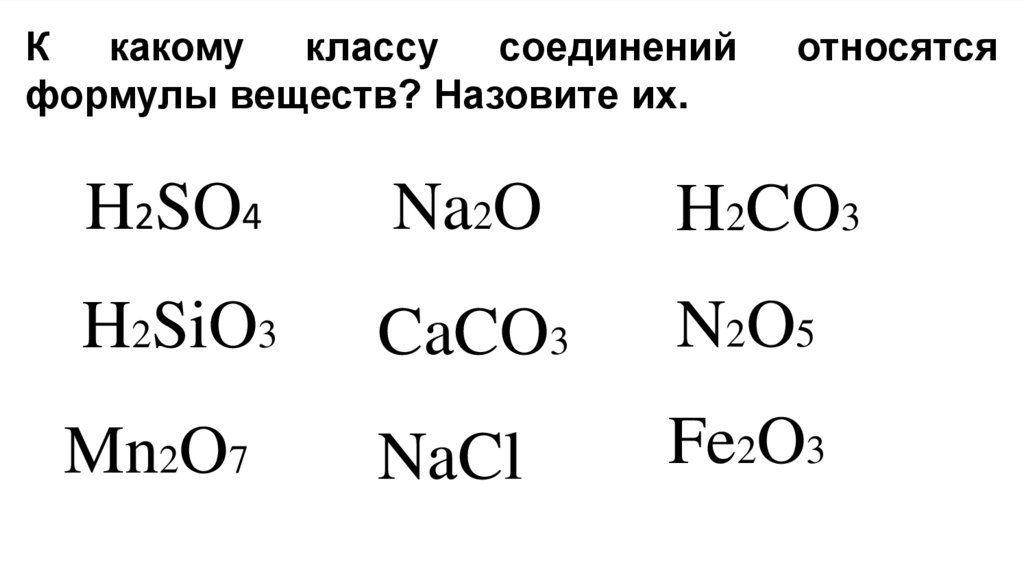
К какому классу соединенийформулы веществ? Назовите их.
относятся
H2SO4
Na2O
H2CO3
H2SiO3
CaCO3
N2 O 5
Mn2O7
NaCl
Fe2O3
27.
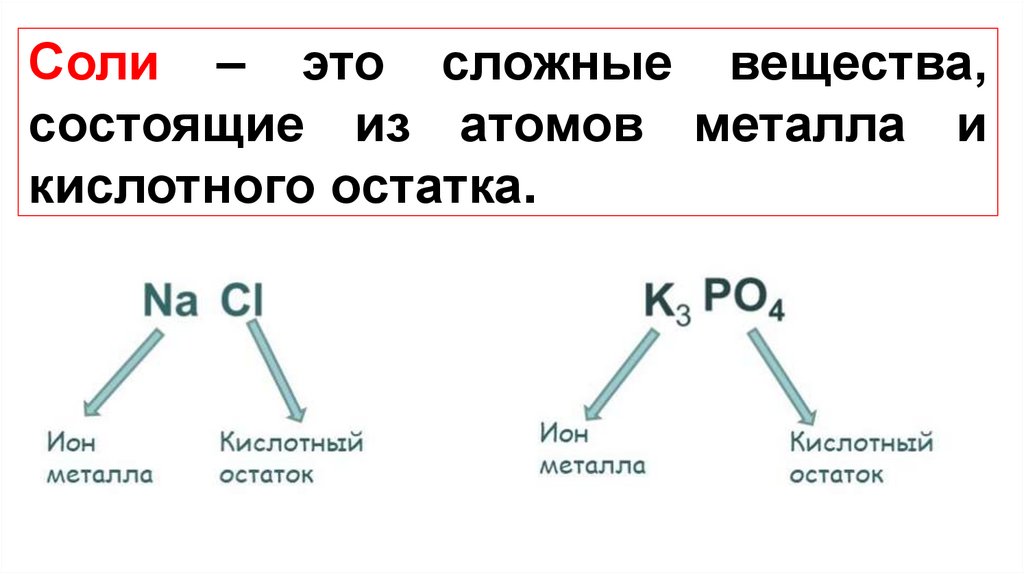
Соли – это сложные вещества,состоящие из атомов металла и
кислотного остатка.
28.
Чтобы вывести формулу соли, необходимо знатьвалентность как металла, так и кислотного остатка.
Например, составим формулу кальциевой соли
фосфорной кислоты.
1. Запишем рядом символ металла и формулу кислотного
остатка:
CaPO4
29.
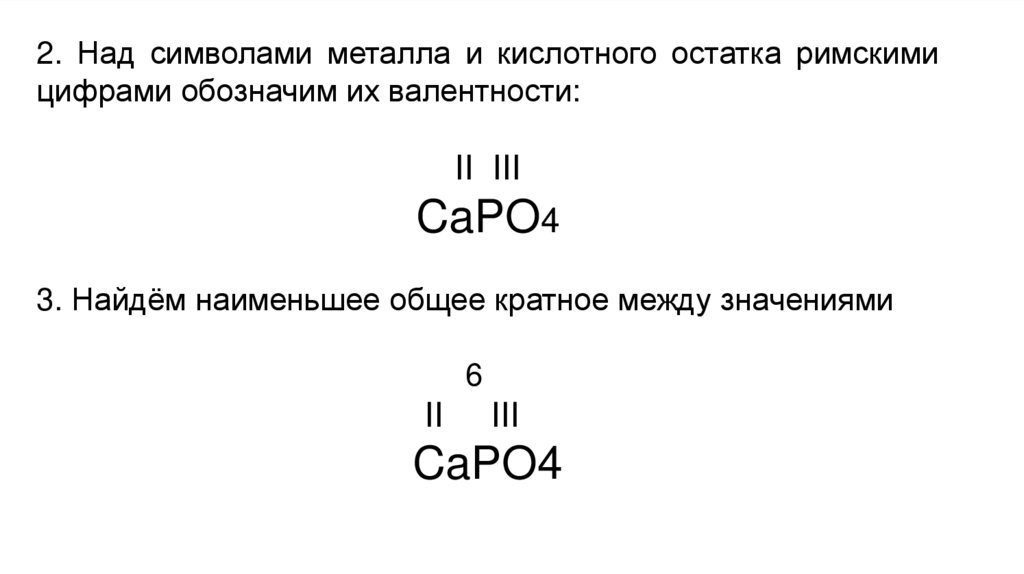
2. Над символами металла и кислотного остатка римскимицифрами обозначим их валентности:
II III
CaPO4
3. Найдём наименьшее общее кратное между значениями
6
II
III
CaPO4
30.
4. Разделим НОК на валентность каждой составной частисоли (таким образом определим их индексы).
Ca3(PO4)2
Если в состав соли входит несколько кислотных остатков, их
записывают
в скобках. Число кислотных остатков
обозначается
соответствующим
индексом,
который
записывается за скобками. Название соли составляют из
названий кислотного остатка и металла, входящего в состав
соли.
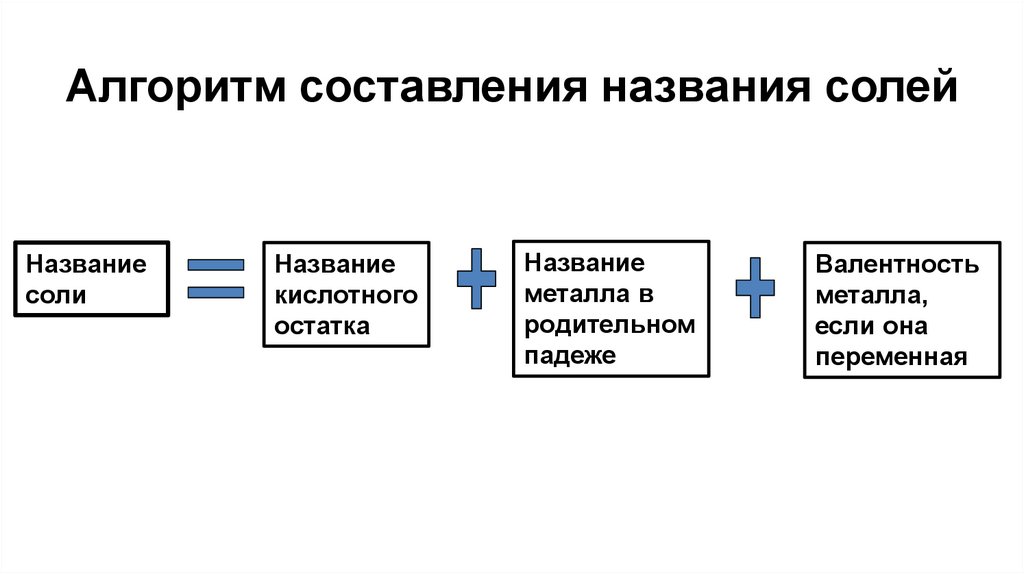
31. Алгоритм составления названия солей
Названиесоли
Название
кислотного
остатка
Название
металла в
родительном
падеже
Валентность
металла,
если она
переменная
32.
33.
34.
35.
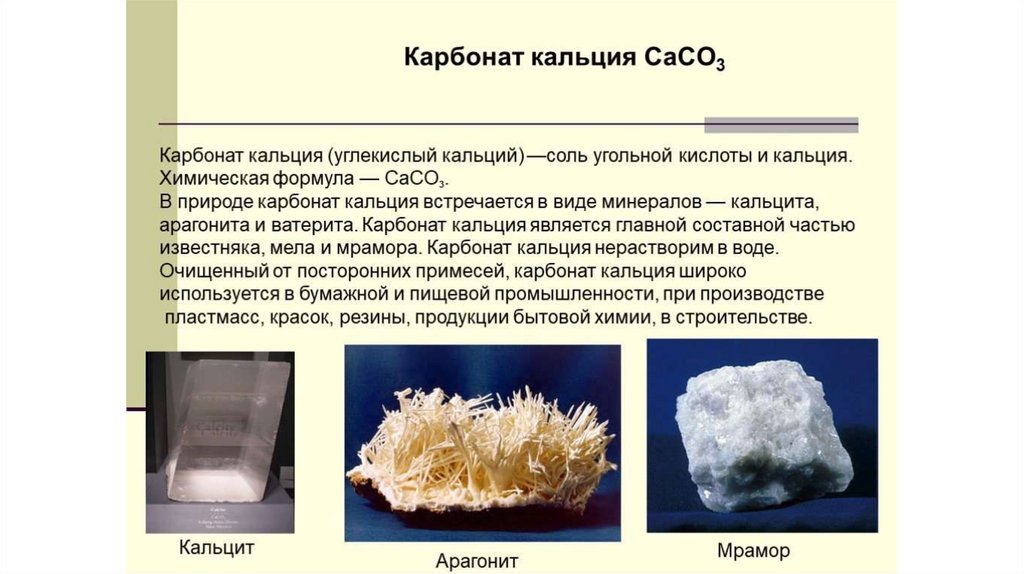
Ca3(PO4)2Фосфат кальция представляет
собой бесцветное или белое
кристаллическое
вещество
(абразив), чрезвычайно плохо
растворимое в воде.
Ортофосфат кальция широко распространён в природе, входит в состав
минералов фосфорита, апатита, гидроксиапатита.
Применение: применяется как источник кальция для подкормки скота и
птиц, в составе фосфоритной муки используется как удобрение для
кислых почв, в производстве керамики и стекла, абразивов, в пищевой
промышленности в качестве разрыхлителя, также входит в состав
некоторых лекарств.
36.
37.
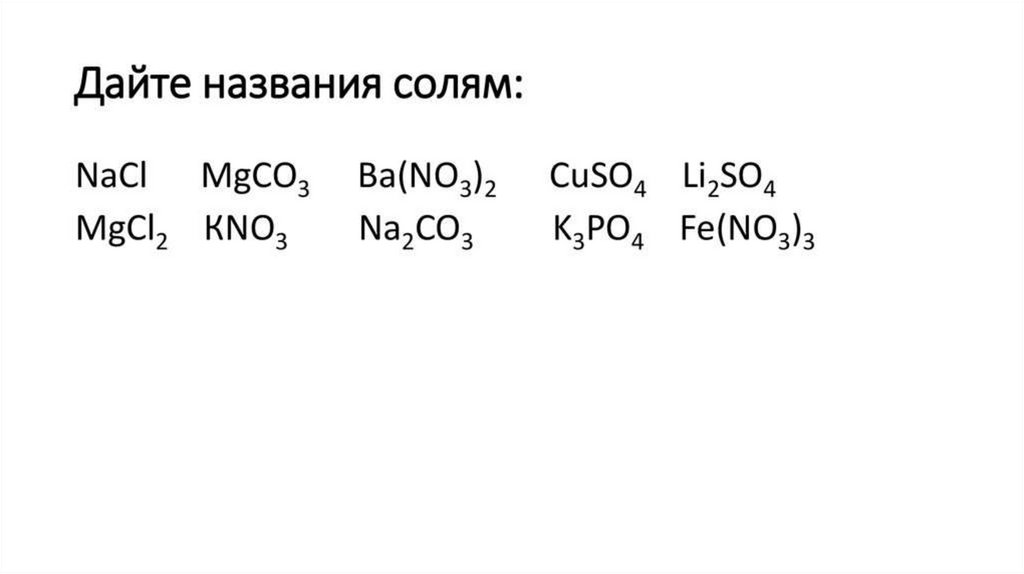
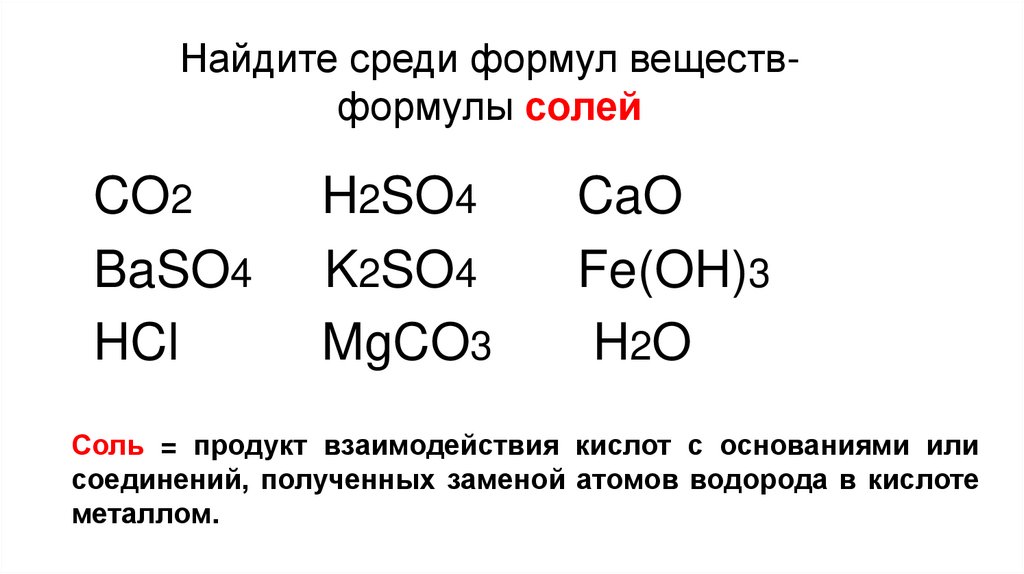
Найдите среди формул веществформулы солейCO2
BaSO4
HCl
H2SO4
K2SO4
MgCO3
CaO
Fe(OH)3
H2O
Соль = продукт взаимодействия кислот с основаниями или
соединений, полученных заменой атомов водорода в кислоте
металлом.
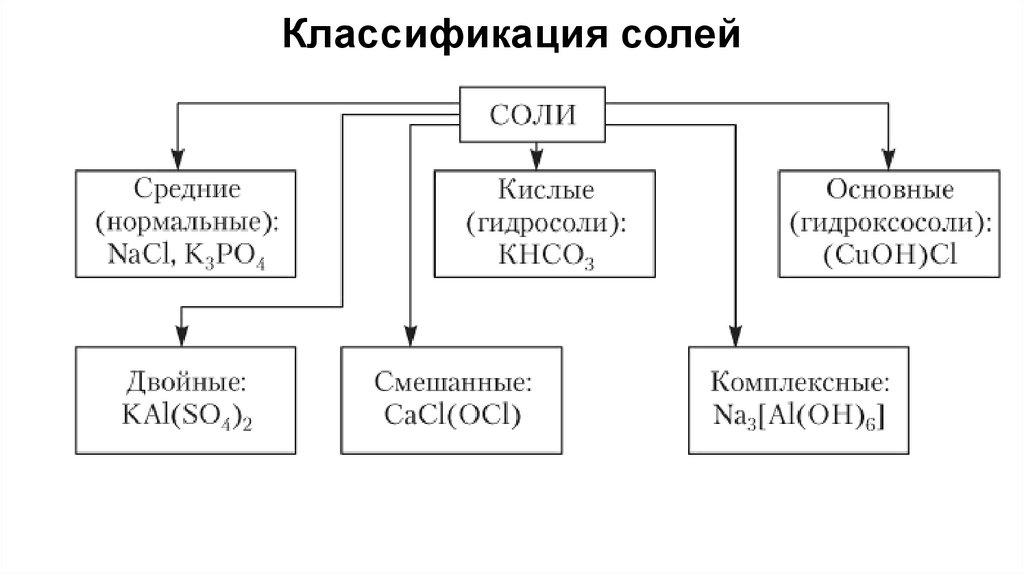
38. Классификация солей
39.
Средние (нормальные) соли — это продукты полногозамещения атомов водорода в кислоте на металл.
Например:
Na2CO3 – карбонат натрия
Al(NO3)3 – нитрат алюминия
CuSO4 – сульфат меди (ΙΙ)
40.
Кислые соли — это продукты неполного замещения атомовводорода в кислоте на металл.
Номенклатура:
Приставка «гидро» + кислотный остаток + металл в Род. пад
NaHSO4
Гидросульфат натрия
41.
Осно́вные соли — это продукты неполногогидроксогрупп в основании на кислотный остаток
замещения
Номенклатура:
Приставка «гидроксо» + кислотный остаток + металл в Род. пад
(CuOH)2CO3 – гидроксокарбонат меди (II)
AlOHCl2 –
42.
Двойные соли — соли, содержащие два атома металла икислотный остаток.
Номенклатура:
Кислотный остаток + металлы в Род. Пад через дефис
CaMg(CO3)2 – карбонат магния – кальция
KAl(SO4)2 –
43.
Смешанные соли — соли, содержащие атом металла и двакислотных остатка.
Номенклатура:
Кислотные остатки через дефис + металл в Род. Пад
CaCl(OCl) — хлорид-гипохлорит кальция
PbFCl — фторид-хлорид свинца (II).
44.
Комплексныесоли
—
соли,
комплексный катион или анион.
содержащие
K4[Fe(CN)6] — гексацианоферрат (II) калия (жёлтая
кровяная соль);
45. Физические свойства
Твёрдость. При нормальных условиях соли — твёрдые кристаллическиевещества.
Высокая температура плавления. У солей типичных металлов — ионная
кристаллическая решётка, поэтому они имеют сравнительно высокую
температуру плавления и нелетучи.
Разнообразие окраски. Отдельные кристаллы некоторых солей бесцветны,
однако в массе множество таких мелких кристалликов приобретает белый цвет.
Растворимость в воде. По растворимости в воде соли можно разделить на
хорошо растворимые, малорастворимые и практически нерастворимые.
Проводимость электрического тока. Растворы солей хорошо проводят
электрический ток.
46. Химические свойства
1. Соль + кислота = новая соль + новая кислотаСмотри раннее
2. Соль + основание = новая соль + новое основание
Смотри раннее
47.
3. Соль 1 + соль 2 = соль 3 + соль 4Ca(NO3)2 + Na2CO3 = CaCO3 + 2NaNO3
В ходе реакции должен образовываться осадок
48.
4. Соль + металл = новая соль + новый металлCuSO4 + Fe = FeSO4 + Cu
Для осуществления реакции необходимо:
1) Металл должен находиться в ряду напряжений
левее металла соли.
2) Должна получиться растворимая соль



































 chemistry
chemistry








