Similar presentations:
ХИМИЯ-8-2
1. Строение атома и химическая связь
СТРОЕНИЕ АТОМА ИХИМИЧЕСКАЯ СВЯЗЬ
2. СТРУКТУРНЫЕ ЕДИНИЦЫ – от атомов к ионам
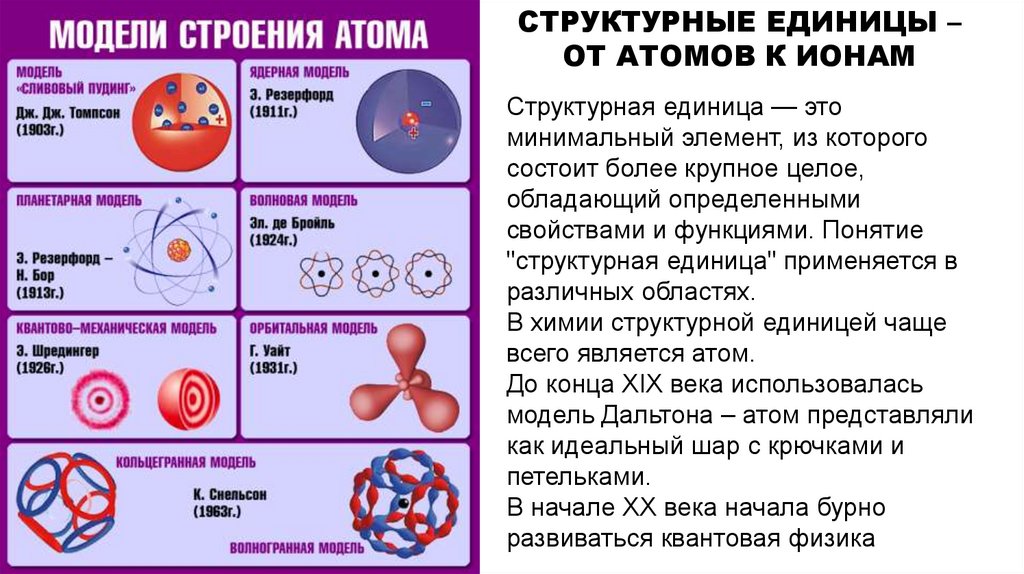
СТРУКТУРНЫЕ ЕДИНИЦЫ –ОТ АТОМОВ К ИОНАМ
Структурная единица — это
минимальный элемент, из которого
состоит более крупное целое,
обладающий определенными
свойствами и функциями. Понятие
"структурная единица" применяется в
различных областях.
В химии структурной единицей чаще
всего является атом.
До конца ΧΙΧ века использовалась
модель Дальтона – атом представляли
как идеальный шар с крючками и
петельками.
В начале ХХ века начала бурно
развиваться квантовая физика
3. КОРПУСКУЛЯРНО-ВОЛНОВОЙ ДУАЛИЗМ
Корпускулярно-волновой дуализм — это физический принцип,утверждающий, что любой объект природы может вести себя и как
частица, и как волна.
Гипотеза де Бройля:
Движению каждой частицы соответствует распространение некоторой
волны. Частота и длина этой волны определяются энергией и
импульсом частицы:
ν = Ε / h, λ = h / p
h – постоянная Планка (6,626*10-34 Дж*с)
Точно так же, любой волне с частотой ν и длиной волны λ отвечают
частицы с энергией E = hν и импульсом p = h/λ.
4. Принцип неопределенностей Гейзенберга
ПРИНЦИП НЕОПРЕДЕЛЕННОСТЕЙГЕЙЗЕНБЕРГА
будучи частицей, электрон локализован в пространстве; но, будучи
волной, локализован не в точке, а «размазан» по некоторой
области.
Координаты и скорость электрона не могут быть измерены
одновременно сколь угодно точно.
Неопределённость координаты ∆x и неопределённость
соответствующей проекции импульса ∆px оказываются связанными
соотношением неопределённостей Гейзенберга:
∆x · ∆px ≥ h / 2π
5.
СТРОЕНИЕ АТОМААТОМ – мельчайшая химически неделимая частица вещества
Химические свойства атома определяются состояниями
электронов, входящих в его состав.
Состояния электронов выражает набор квантовых чисел:
• главное квантовое число (n);
• орбитальное квантовое число (l);
• магнитное квантовое число (ml);
• спиновое квантовое число (ms).
6.
ГЛАВНОЕ КВАНТОВОЕ ЧИСЛОГлавное квантовое число (n) характеризует номер энергетического уровня
атома.
Главное квантовое число численно равно номеру периода в системе
элементов Менделеева.
Принимает значения: 1, 2, 3,….∞.
Однако на сегодняшний день максимальным главным квантовым числом
является 7, так как в таблице Менделеева всего 7 периодов. Например,
главное квантовое число атома фосфора (P) равно трем, так как этот элемент
находится в третьем периоде.
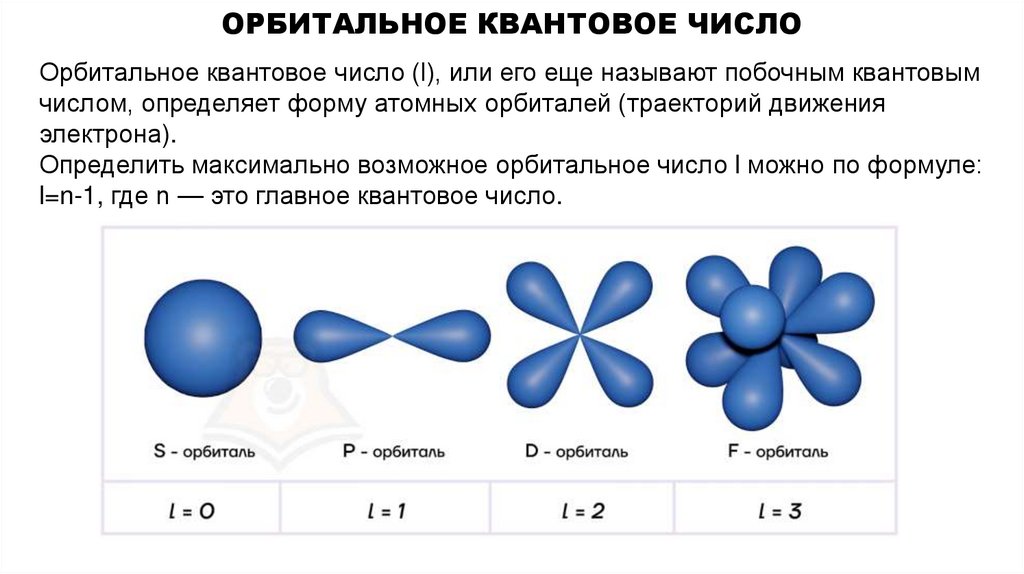
7. Орбитальное квантовое число
ОРБИТАЛЬНОЕ КВАНТОВОЕ ЧИСЛООрбитальное квантовое число (l), или его еще называют побочным квантовым
числом, определяет форму атомных орбиталей (траекторий движения
электрона).
Определить максимально возможное орбитальное число l можно по формуле:
l=n-1, где n — это главное квантовое число.
8.
важно помнить, что количество атомных орбиталей на каждом уровнеравно номеру этого уровня.
Например, фосфор, находящийся в третьем периоде, имеет
на первом энергетическом уровне одну атомную орбиталь (s),
на втором — две (s и p),
на третьем — три (s, p и d).
То есть атом фосфора имеет три разных по энергии, но одинаковые по
форме s-орбитали – на первом, втором и третьем энергетических
уровнях.
9. Магнитное квантовое число
МАГНИТНОЕ КВАНТОВОЕ ЧИСЛОМагнитное квантовое число (ml) определяет количество атомных орбиталей
(ячеек).
Оно рассчитывается по формуле:
ml =2l+1, где
l – это орбитальное квантовое число.
Например, у атома фосфора главное квантовое число n=3;
орбитальное квантовое число l=3-1=2 (d-орбиталь);
магнитное квантовое число ml =2 · 2+1=5.
Таким образом делаем вывод, что на третьем (n) энергетическом уровне у
фосфора находится пять (ml) различных по энергии d-орбиталей (l).
10. Спиновое квантовое число
СПИНОВОЕ КВАНТОВОЕ ЧИСЛОСпиновое квантовое число (ms) характеризует собственное
движение электрона — спин.
Электроны на атомной орбитали мы схематично изображаем
стрелками вверх (↑) и вниз (↓), обозначая, что они имеют
различный спин: для ↑ ms = +½; для ↓ ms = -½. Например, для
каждого неспаренного электрона атома фосфора на 3p орбитали
ms = +½.
11. Расчеты главного, орбитального и магнитного квантовых чисел
РАСЧЕТЫ ГЛАВНОГО, ОРБИТАЛЬНОГО ИМАГНИТНОГО КВАНТОВЫХ ЧИСЕЛ
12.
ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ — это формула,отражающая распределение электронов по
электронным оболочкам атома (энергетическим
уровням).
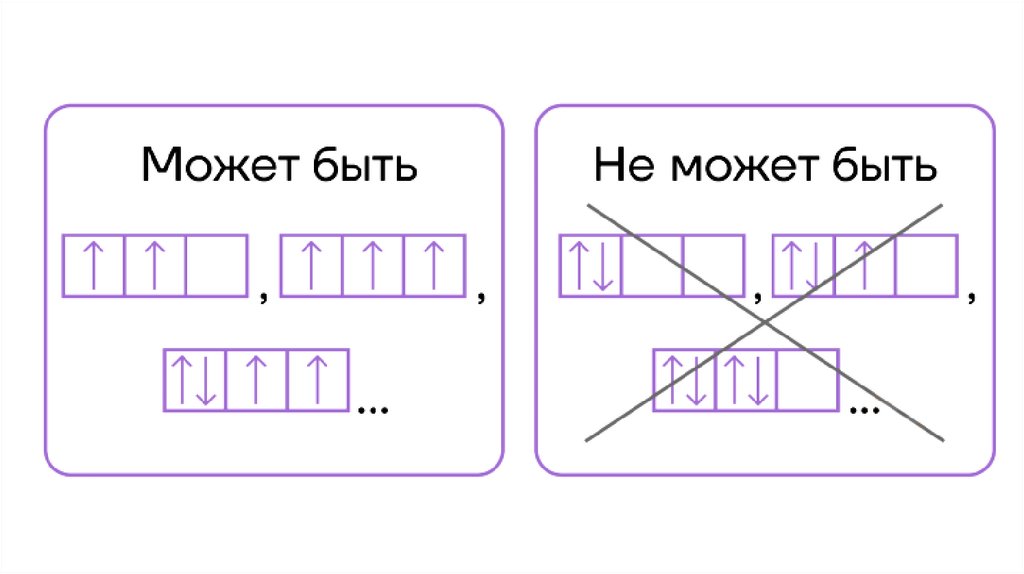
13. Принцип Паули
ПРИНЦИП ПАУЛИПринцип Паули гласит: в любой квантовой системе не может быть
двух совершенно одинаковых элементарных частиц
Для конкретного случая единичного атома принцип Паули
выглядит так:
«На любой орбитали может быть не более двух
электронов, при этом их спины
противоположны».
14. правило Хунда
ПРАВИЛО ХУНДАЗаполнение подуровней тоже регулируется определенным образом,
согласно правилу Гунда (Хунда):
«Суммарное значение спинового квантового числа
электронов на подуровне должно быть
максимальным».
Это означает, что в каждой из орбиталей подслоя заполняется сначала
один электрон, а второй электрон добавляется только после заполнения
всех орбиталей хотя бы одним электроном.
15.
16. правила Клечковского.
ПРАВИЛА КЛЕЧКОВСКОГО.Атомные подуровни заполняются электронами в порядке
увеличения их энергии. Этот порядок выглядит следующим
образом:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s →
…
1. Заполнение электронами атомных орбиталей идет от
орбиталей, обладающих меньшим значением суммы главного
и орбитального квантового числа (n+l), к орбитали с большим
значением суммы.
2. Если сумма n+l одинакова, то электрон располагается на
орбитали с меньшим значением n, то есть ближе к ядру.
17. АТОМЫ И ИОНЫ
Атом может отдать или принять электроны таким образом, чтобы внешнийэнергетический уровень был максимально заполнен, так как это
энергетически выгодно.
Рассмотрим пример с образованием сульфид-аниона S2-.
Третий энергетический уровень является внешним для атома серы, на
нем располагается 6 электронов, 2 из которых являются неспаренными.
К этим электронам могут добавиться два «соседа», благодаря которым pподуровень заполняется полностью и обретает стабильную
конфигурацию.
Так как каждый из электронов имеет отрицательный заряд, равный
единице, то суммарно после их присоединения к сере образуется
сульфид-анион S2-.
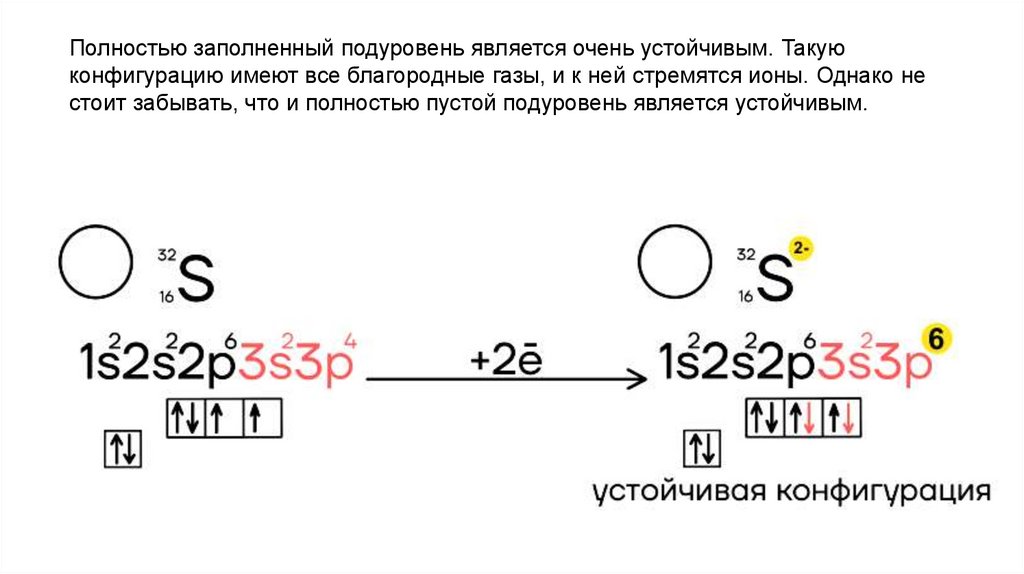
18.
Полностью заполненный подуровень является очень устойчивым. Такуюконфигурацию имеют все благородные газы, и к ней стремятся ионы. Однако не
стоит забывать, что и полностью пустой подуровень является устойчивым.
19.
Задание.Из указанных в ряду химических элементов выберите
два элемента, которые образуют устойчивый
положительный ион, содержащий 10 электронов:
1) 11Na
2) 19K
3) 7N
4) 8O
5) 17Cl
20. Периодический закон
ПЕРИОДИЧЕСКИЙ ЗАКОНСовременная формулировка периодического закона:
Свойства химических элементов, а также формы и свойства образуемых
ими простых веществ и соединений, находятся в периодической
зависимости от величины зарядов ядер их атомов
Свойства элементов можно распределить по нескольким группам:
металлические/неметаллические свойства,
окислительно-восстановительные свойства,
радиус атома,
электроотрицательность,
валентность и степени окисления,
энергия ионизации,
энергия сродства к электрону.
21. Химическая связь.
ХИМИЧЕСКАЯ СВЯЗЬ.атомы имеют на внешнем уровне от 1 до 8 электронов. Если на
внешнем уровне содержится максимальное число электронов - 8,
то уровень считается завершенным и отличается большой
прочностью (благородные газы).
У других атомов уровни незавершенные и они в процессе
химической реакции стремятся их завершить, что достигается
присоединением или отдачей электронов, либо образованием
общих электронных пар.
Химическая связь осуществляется валентными электронами: у
s- и p- элементов это электроны внешнего уровня с s- и pподуровня,
у d- элементов это электроны d- подуровня предвнешнего уровня и
электроны s-подуровня внешнего уровня
22. ПАРАМЕТРЫ Химической связи
ПАРАМЕТРЫ ХИМИЧЕСКОЙ СВЯЗИЭнергия связи. Химическая связь возникает лишь в том случае, если полная
энергия взаимодействующих атомов уменьшается, т.е. при образовании связи
должна всегда выделяться энергия.
Количество энергии, выделяющейся при образовании химической связи,
называется энергией связи EСВ (кДж/моль).
Длина связи: Расстояние между химически связанными атомами называют
длиной связи.
Она зависит от размеров электронных оболочек и степени их перекрывания. С
уменьшением длины связи обычно растет энергия связи и устойчивость молекул.
Например, в ряду от HF до HI длина связи растет, а ее энергия уменьшается.
Валентный угол – угол, образуемый линиями, проходящими через ядра атомов.
23. Ионная химическая связь
ИОННАЯ ХИМИЧЕСКАЯ СВЯЗЬИонная химическая связь возникает при электростатическом
взаимодействии отрицательно и положительно заряженных
ионов в химическом соединении.
Эта связь возникает лишь в случае большой разности
электроотрицательности атомов, например, между катионами sметаллов первой и второй групп периодической системы и
анионами неметаллов шестой и седьмой групп (LiF, СsСl, NaCl и
др.)
24.
При образовании катионов и анионов могут возникать устойчивыевосьмиэлектронные (октетные) конфигурации. Атомы и ионы с одинаковыми
электронными конфигурациями образуют изоэлектронные ряды, например
ряды неона, аргона, криптона:
Ne, O2‾, F‾, Na+, Mg2+, Al3+ - 1s22s22p6 или [Ne]
Ar, S2‾, Cl‾, K+, Ca2+, Sc3+ - [Ne] 3s23p6 или [Ar]
Kr, Se2‾, Br‾, Rb+, Sr2+, Y3- - [Ar] 3d104s23p6 или [Kr]
Так как электрическое поле иона имеет сферический характер, то для
ионной связи не характерна направленность и насыщаемость. Поэтому ион
способен взаимодействовать с соседними ионами противоположного знака
в любом количестве и в любом направлении. Вещества с ионной связью
представляют собой кристаллические вещества, существующие в виде
гигантских молекул типа NanCln
25. Метод валентных связей
МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙприближенный квантово-механический метод расчета двух- или
многоатомных систем, основанный на сохранении атомами своей
индивидуальности.
Основные положения метода валентных связей
1.
Ковалентная химическая связь образуется двумя электронами с
противоположно направленными спинами, принадлежащими двум атомам.
2.
Ковалентная связь тем прочнее, чем в большей степени перекрываются
взаимодействующие электронные облака.
3.
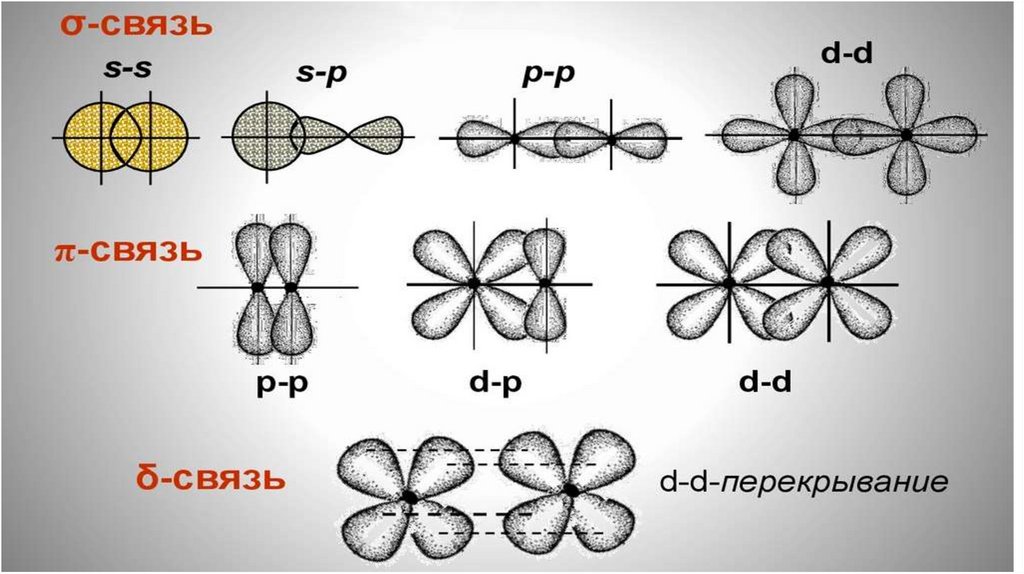
Характеристики химической связи определяются типом перекрывания АО.
4.
Ковалентная связь направлена в сторону максимального перекрывания АО
реагирующих атомов
26. Ковалентная связь
КОВАЛЕНТНАЯ СВЯЗЬРассмотрим образование ковалентной связи в молекуле водорода.
При сближении атомов водорода происходит проникновение их
электронных облаков друг в друга и их частичное перекрывание.
Электронная плотность между ядрами возрастает. Ядра
притягиваются друг к другу, вследствие этого снижается энергия
системы. При очень сильном сближении атомов возрастает
отталкивание ядер. Поэтому имеется оптимальное расстояние
(длина связи r0) между ядрами, при котором система имеет
минимальную энергию. При таком состоянии выделяется энергия
EСВ, называемая энергией связи
27.
28. Свойства Ковалентной связи
СВОЙСТВА КОВАЛЕНТНОЙ СВЯЗИНасыщаемость - способность атомов образовывать ограниченное число
ковалентных связей. Например, нельзя присоединить еще один атом
водорода к молекуле H2 или HCl
Направленность ковалентной связи определяет пространственную
структуру молекул.
Полярность ковалентной связи. Если один из атомов сильнее притягивает
электроны, то электронная пара смещается в сторону этого атома и в этом
случае возникает полярная ковалентная связь.
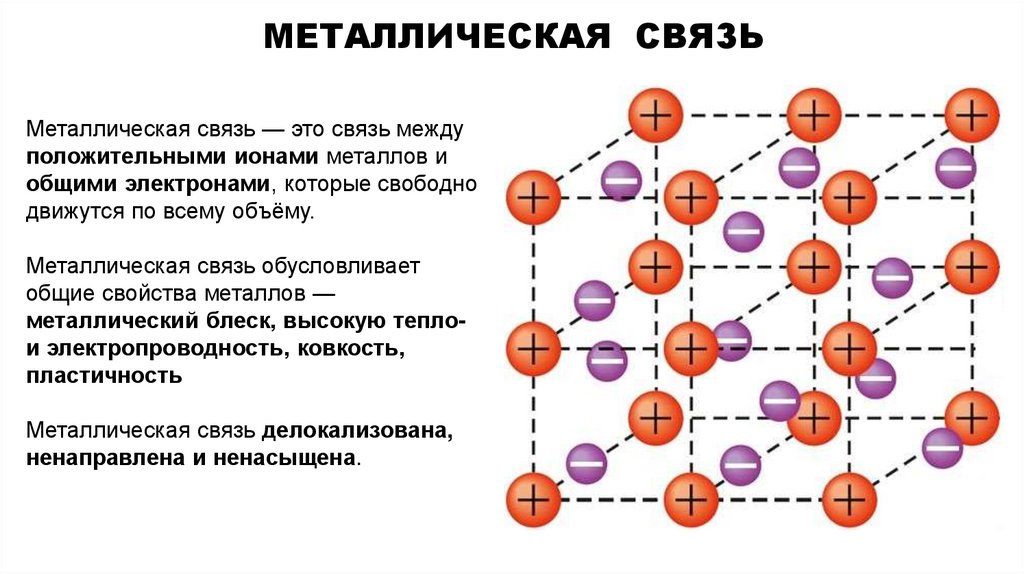
29. металлическая связь
МЕТАЛЛИЧЕСКАЯ СВЯЗЬМеталлическая связь — это связь между
положительными ионами металлов и
общими электронами, которые свободно
движутся по всему объёму.
Металлическая связь обусловливает
общие свойства металлов —
металлический блеск, высокую теплои электропроводность, ковкость,
пластичность
Металлическая связь делокализована,
ненаправлена и ненасыщена.
30. Водородная связь
ВОДОРОДНАЯ СВЯЗЬОбразование водородной связи обусловлено тем, что в полярных молекулах
А – Н или полярных группах –А – Н поляризованный атом водорода обладает
уникальными свойствами: отсутствием внутренних электронных оболочек,
значительным сдвигом электронной пары к атому с малым размером.
Поэтому водород способен глубоко внедряться в электронную оболочку
соседнего отрицательно поляризованного атома.
Атомы могут быть одинаковыми, как при взаимодействии НF
Fδ‾–Нδ+ + Fδ‾–Нδ+ = F–Н···F–Н,
но могут быть и разными, как при взаимодействии воды и фтороводорода:
31.
При возникновении водородных связей образуются димеры, тримеры илиполимерные структуры, например зигзагообразные структуры (НF)n,
кольцевые структуры некоторых органических кислот, например уксусной
кислоты, или более сложные конфигурации, например у льда, у которого
молекулы воды образуют по четыре водородные связи. Соответственно в
жидком состоянии молекулы, вступающие в водородные связи,
ассоциированы, а в твердом состоянии образуют сложные кристаллические
структуры.
Образование межмолекулярных водородных связей приводит к
существенному изменению свойств веществ: повышению вязкости,
диэлектрической постоянной, температур плавления и кипения, теплот
парообразования и плавления. Например, вода, фтороводород и аммиак
имеют аномально высокие температуры кипения и плавления. Под
влиянием водородных связей изменяются и химические свойства.
32. Межмолекулярное взаимодействие.
МЕЖМОЛЕКУЛЯРНОЕ ВЗАИМОДЕЙСТВИЕ.Межмолекулярное взаимодействие - взаимодействие молекул между собой,
не приводящее к разрыву или образованию новых химических связей.


























 chemistry
chemistry








