Similar presentations:
Основные понятия и законы химии. Периодический закон и периодическая система элементов Д. И. Менделеева. Теория строения веществ
1. Раздел 1.Теоретические основы химии
Тема: «Основные понятия и законыхимии.
Периодический закон и периодическая
система элементов
Д. И. Менделеева. Теория строения
веществ.»
2. План:
1.2.
3.
4.
5.
Введение.
Основные понятия и законы химии.
Периодический закон и
периодическая система химических
элементов Д.И. Менделеева.
Теория строения атомов.
Виды химической связи.
3. 1. Введение
Окружающий человека мир материален и,несмотря на все богатство его проявлений, в
настоящее время выделяют всего лишь две
формы существования материи: вещество и поле,
которые проникают друг в друга и при
определенных условиях могут превращаться друг
в друга.
Вот что писал в 1870 г. Д.И. Менделеев в своей
книге “Основы химии” о предмете химии:
“Ближайший предмет химии составляет изучение
однородных веществ, из сложения которых
составлены все тела мира, превращений их друг в
друга и явлений, сопровождающих такие
превращения.
4. Введение
Химия, как и всякая наука, есть в одно время и средство, и цель.Она есть средство для достижения тех или других
практических, в общем смысле этого слова, стремлений. Так,
при содействии ее облегчается обладание веществом в
разных его видах, она дает новую возможность пользоваться
силами природы, указывает способы получения и свойства
множества веществ и т.д. В этом смысле химия близка к
делам заводчика и мастера, роль ее служебная, она
составляет средство для достижения блага. К этому, уже
почтенному, свойству присоединяется, однако, другое: в
химии, как и в каждой выработанной науке, есть ряд
стремлений высших, не ограничиваемых временными и
частными целями (хотя и приводящих к ним и нисколько им
не противоречащих).
Стараясь познать бесконечное, наука сама конца не имеет и,
будучи всемирной, в действительности неизбежно
приобретает народный характер....»
5. 2. Основные понятия и законы химии.
1. Все вещества (химические соединения) Вселеннойсостоят из молекул, а молекулы из атомов
химических элементов таблицы Д.И. Менделеева.
Атомы в свою очередь состоят из более мелких
частиц: протонов, нейтронов и электронов. В
настоящее время известно 105 химических
элементов, которые отличаются друг от друга
химическими свойствами и количеством входящих в
них указанных частиц.
2. При определенных условиях молекулы веществ
способны превращаться друг в друга, однако атомы
элементов при этом не превращаются друг в друга.
Элементы способны превращаться друг в друга
только в ядерных реакциях.
3. При любых химических превращениях всегда
соблюдаются законы сохранения массы, энергии и
заряда.
6. Основные понятия и законы химии.
4. При протекании любой химической реакции массыреагирующих веществ и продуктов реакции всегда
находятся в пропорциональных количествах,
соответствующих их стехиометрическим
коэффициентам.
5. В природе не существует веществ, обладающих
одинаковым набором свойств. Каждое вещество
уникально.
6. Свойства веществ зависят от качественного и
количественного состава их молекул и от их
строения.
7. 3. Периодический закон Д.И. Менделеева.
«свойства простых веществ, а такжесвойства и формы соединений
элементов находятся в периодической
зависимости от величины атомных
весов элементов»
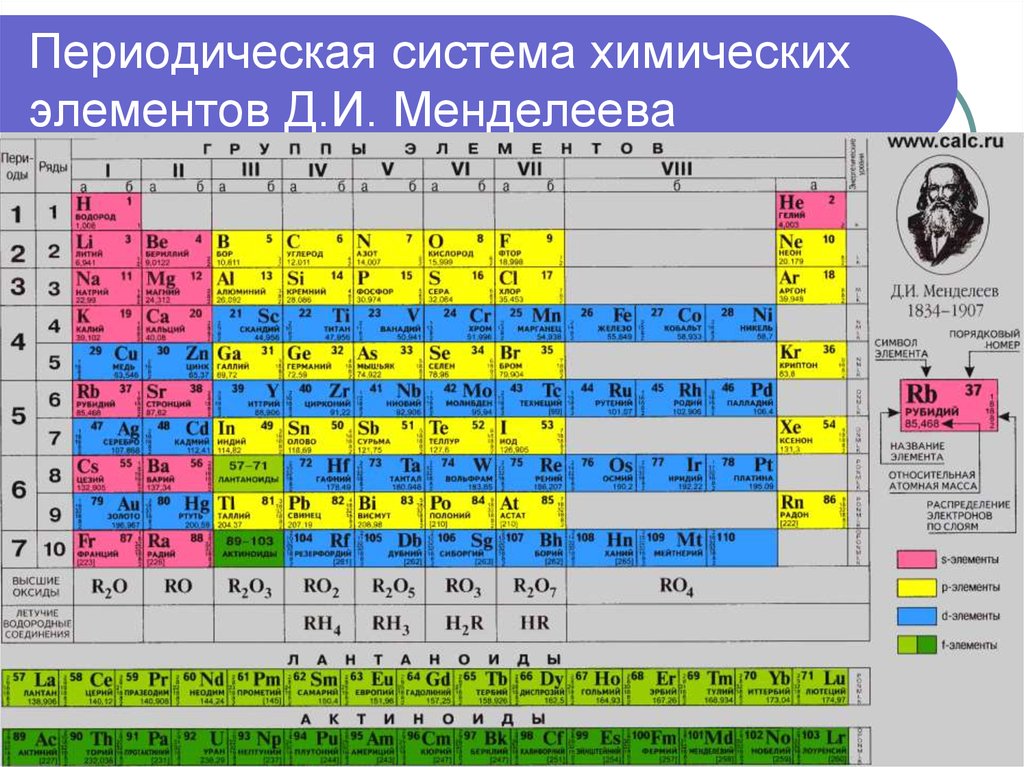
8. Периодическая система химических элементов Д.И. Менделеева
это наглядное графическоеизображение периодического закона.
Химический элемент – это вид
атомов, характеризующихся
определённым зарядом ядра равным
порядковому номеру в периодической
системе.
9. В структуре таблицы (системы) выделяют периоды, группы и подгруппы.
Периодом называют горизонтальнуюсовокупность элементов, расположенных в
порядке возрастания заряда ядра.
Группой называют совокупность элементов,
расположенных в таблице вертикально в
порядке возрастания заряда ядра. В
периодической системе находится 8 групп.
Каждая группа состоит из главной и
побочной подгрупп.
10. Периодическая система химических элементов Д.И. Менделеева
11. Характер изменения некоторых свойств элементов
Энергия ионизации –это энергия, затраченная наотрыводного электрона от нейтрального атома, в периоде
возрастает с ростом заряда ядра, в главных и третьей
побочной подгруппах – убывает сверху вниз в связи с
появлением нового энергетического уровня. В остальных
побочных подгруппах энергия ионизации возрастает с
ростом заряда ядра.
Сродством к электрону (Е) – называют энергию, которая
выделяется при присоединении дополнительного электрона
к атому, иону или молекуле. Максимальным сродством к
электрону обладают атомы галогенов.
Электроотрицательность (ЭО) - относительная
характеристика способности атома, притягивать
электронную пару. Относительная электроотрицательность в
периоде возрастает и уменьшается в подгруппе с ростом
заряда ядра.
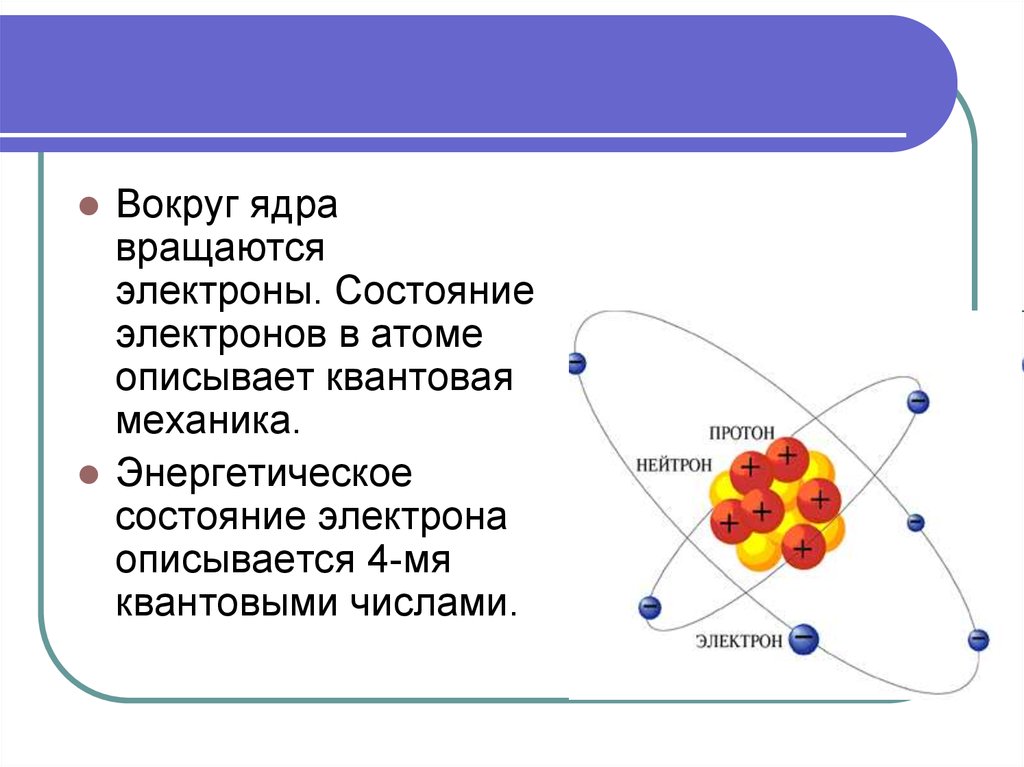
12. 3. Теория строения атомов.
Атом любого элемента состоит из положительнозаряженного ядра и отрицательно заряженных
электронов, в целом же атом – система
электронейтральная.
Атомное ядро состоит из: протонов (заряд +1,
массовое число 1) и нейтронов (заряд 0, массовое
число 1). Заряд ядра, равный порядковому номеру
элемента в таблице Д.И. Менделеева, совпадает с
числом протонов: массовое число ядра равно
суммарному количеству протонов и нейтронов. У
одного элемента возможно существование атомов
с различным массовым числом ядер – изотопов,
т.е. атомов с различным числом нейтронов и
одинаковым числом протонов.
13.
Вокруг ядравращаются
электроны. Состояние
электронов в атоме
описывает квантовая
механика.
Энергетическое
состояние электрона
описывается 4-мя
квантовыми числами.
14. n- главное квантовое число
определяет энергию АО и номер энергетическогоуровня, на котором находится электрон и может
принимать значения от единицы до бесконечности.
Указывает отдалённость энергетического уровня от
ядра, оно принимает целое положительное
значение.
Число энергетических уровней равно № периода.
Количество электронов на последнем
энергетическом уровне считают по формуле:
N=2n2
15. Орбитальное квантовое число – l
Орбитальное квантовое число – l определяетформу АО и энергетический подуровень и
может принимать значения от нуля до (n-1).
Например:
n=2, l = 0, 1; n=3 , l = 0, 1, 2.
l = 0, то электрон находится на s-подуровне;
l = 1, p-подуровень;
l = 2, d-подуровень;
l = 3, f- подуровень.
16. Магнитное квантовое число – ml
ориентацию данной АО относительнонаправления магнитного поля и может
принимать значения от – l …0…+ l
Соответственно:
Для s-подуровня имеется одна АО
Для p-подуровня – три АО
Для d-подуровня – пять АО
Для f-подуровня – семь АО
17. Спиновое квантовое число- ms.
характеризует вращение электронавокруг своей оси. Спиновое
квантовое число может принимать
всего два значения: ms= 1/2, -1/2, в
зависимости от того параллельно или
нет магнитному полю ориентирован
спин электрона.
18. Построение электронных формул атомов хим. Элементов базируется на 3 основных положениях
принцип Паули согласно которому в атомене может быть двух электронов, у которых
все четыре квантовых числа одинаковые.
Основным следствием этого принципа
является то, что на одной АО не может
находиться более двух электронов.
Состояние электронов в атоме должно
отличаться значением хотя бы одного
квантового числа. При переходах
электронов с одной орбиты на другую атом
поглощает или излучает энергию.
19. правило Хунда
устойчивому состоянию атомасоответствует такое распределение
электронов в пределах
энергетического подуровня, при
котором абсолютное значение
суммарного спина атома
максимально.
S=1/2+1/2+1/2=3/2
S=1/2+1/2-1/2=1/2 – не верно
20. Принцип наименьшей энергии
Первыми заполняются орбитали снаименьшей энергией
Шкала энергии
1 s ® 2 s ® 2 p ® 3 s ®3 p ® 4 s ® 3 d ® 4 p ®
5 s ® 4 d ® 5 p ® 6 s ®…
21. Электронная конфигурация элементов
Принадлежность элемента к электронномусемейству определяется характером заполнения
энергетических подуровней: s- элементы –
заполнение внешнего s - подуровня при наличии
на предвнешнем уровне двух или восьми
электронов, например:
Li 1s2 2s1
р- элементы – заполнение внешнего p- подуровня,
например:
F 1s2 2s2 2p5
d- элементы – заполнение предвнешнего dподуровня, например:
V 1s22s22p63s23p64s23d3
22. 4. Виды химической связи
Атомы металлов способны отдаватьэлектроны, атомы неметалловпринимать.
Образование химической связи
объясняется стремлением атомов
отдать, получить или разделить с
другими атомами электроны, чтобы
приобрести устойчивую конфигурацию
благородных газов(nS2nP6)
23. Выделяют следующие типы хим. связи:
ИоннаяКовалентная(полярная и не полярная)
Водородная
Металлическая
24. Ионная связь
Образуется между атомамиэлементов металла с неметаллом.
..
Na. + .Cl: = Na+Cl..
25. Ковалентная связь
Образуется между атомами элементовнеметаллов.
CI2 –каждый из атомов хлора делится одним
из своих внешних электронов. Происходит
перекрывание атомных орбиталей, общая
пара электронов образует ковалентную
связь.
Если электроотрицательность
атомов(способность атомов притягивать к
себе электроны) одинаковая, образуется
ковалентная неполярная связь.(H2, O2, N2 и
т.д.)
26. Ковалентная полярная связь
Возникает между атомами элементовнеметаллов с разной
электроотрицательностью.
Самый электроотрицательный
элемент – F.
Примеры: H2O, NO2 , HCl и т.д.
F2O – фторид кислорода
27. Донорно-акцепторый механизм ковалентной связи
Химическая связь возникает за счётдвухэлектронного облака одного атома и
свободной орбитали другого атома.
Н
H
..
..
H:N: + Hон = H:N:H
..
H
..
H
он
28. Водородная связь(межмолекулярная)
Возникает между молекулами всостав которых входит водород и
сильно электроотрицательный
элемент (F, O, N, реже Cl, S).
29. Металлическая связь
В твердом состоянии металлы отличаютсяот всех остальных веществ своими
характерными свойствами - очень
высокими теплопроводностью и
электропроводностью, почти полной
непрозрачностью и высокой отражательной
способностью по отношению к видимому
свету благодаря так называемому
металлическому блеску.
30. Металлическая связь
Эти свойства обусловленыметаллической связью. У металлов
имеется избыток орбиталей и
недостаток электронов. Валентные
электроны слабо удерживаются ядром
и электроны могут свободно
перемещаться по свободным
орбиталям(по всему кристаллу).
31. Задание:
Написать электронную конфигурацию:Са, Мn, CI.
Определить типы химических связей:
СaCI2; Br2; Al ; H2O.





























 chemistry
chemistry








