Similar presentations:
2025-12-13-09-59-26-лекция 10-2
1. Основы термодинамики
• Основные понятия и определениятермодинамики.
• Внутренняя энергия системы.
• Внутренняя энергия идеального газа.
• Работа и теплота как формы передачи энергии.
• Теплоемкость.
• Удельная теплоемкость.
• Уравнение теплового баланса.
2. Основные понятия и определения термодинамики
• Термодинамика – раздел физики, в котором изучаютсяусловия превращения различных видов энергии в тепловую
и обратно.
• Термодинамическая система – физическая система,
состоящая из большого числа частиц – атомов и молекул,
которые совершают тепловое движение и, взаимодействуя
между собой, обмениваются энергиями.
• Макроскопические параметры – давление, объем,
температура.
• Равновесные состояния – состояния, в которых параметры
термодинамической системы не меняются со временем.
3.
• Термодинамический процесс – переход системыиз начального состояния в конечное через
последовательность промежуточных состояний.
• Обратимый процесс – процесс, при котором
возможен обратный переход системы из конечного
состояния в начальное через те же промежуточные
состояния, чтобы в окружающих телах не
произошло никаких изменений.
• Необратимый процесс – процесс,
сопровождаемый трением или теплопередачей от
нагретого тела к холодному.
4. Необратимый процесс
5. Теплопроводность
6. Трение
7. Все реальные процессы являются необратимыми
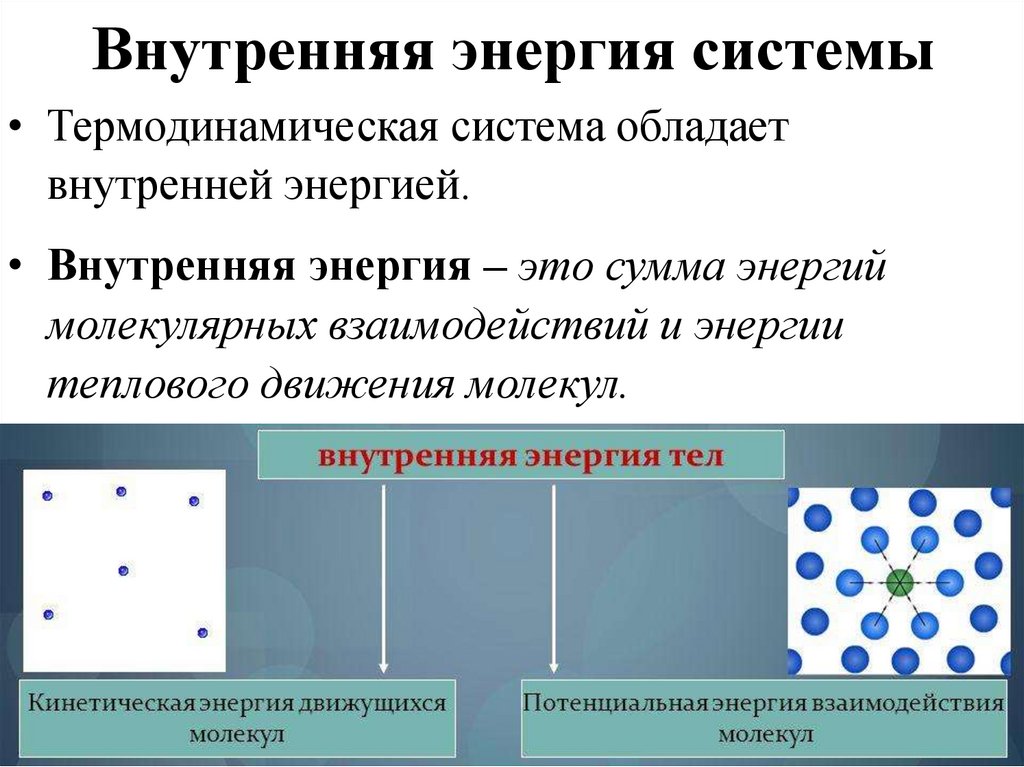
8. Внутренняя энергия системы
• Термодинамическая система обладаетвнутренней энергией.
• Внутренняя энергия – это сумма энергий
молекулярных взаимодействий и энергии
теплового движения молекул.
9.
10.
• Внутренняя энергия системы зависит только отее состояния и является однозначной функцией
состояния.
• Изменение состояния системы характеризуется
параметрами состояния p, V, T. Одному и тому
же состоянию системы соответствует
определенное значение внутренней энергии U.
• При нагревании газа увеличивается скорость,
при изменении давления или объема меняются
межмолекулярные расстояния.
11. Внутренняя энергия системы равна нулю при Т=0 К (-273,15 С).
Внутренняя энергия системы равнанулю при Т=0 К (-273,15 С).
12. Внутренняя энергия идеального газа
• Одноатомный газ – газ, состоящий изотдельных атомов, а не молекул.
• Инертные газы - Гелий, неон, аргон.
• В идеальном газе пренебрегают силами
взаимодействиями молекул, поэтому
внутренняя энергия идеального газа
представляет собой кинетическую энергию
теплового движения молекул.
13. Внутренняя энергия идеального газа пропорциональна массе газа и его термодинамической температуре.
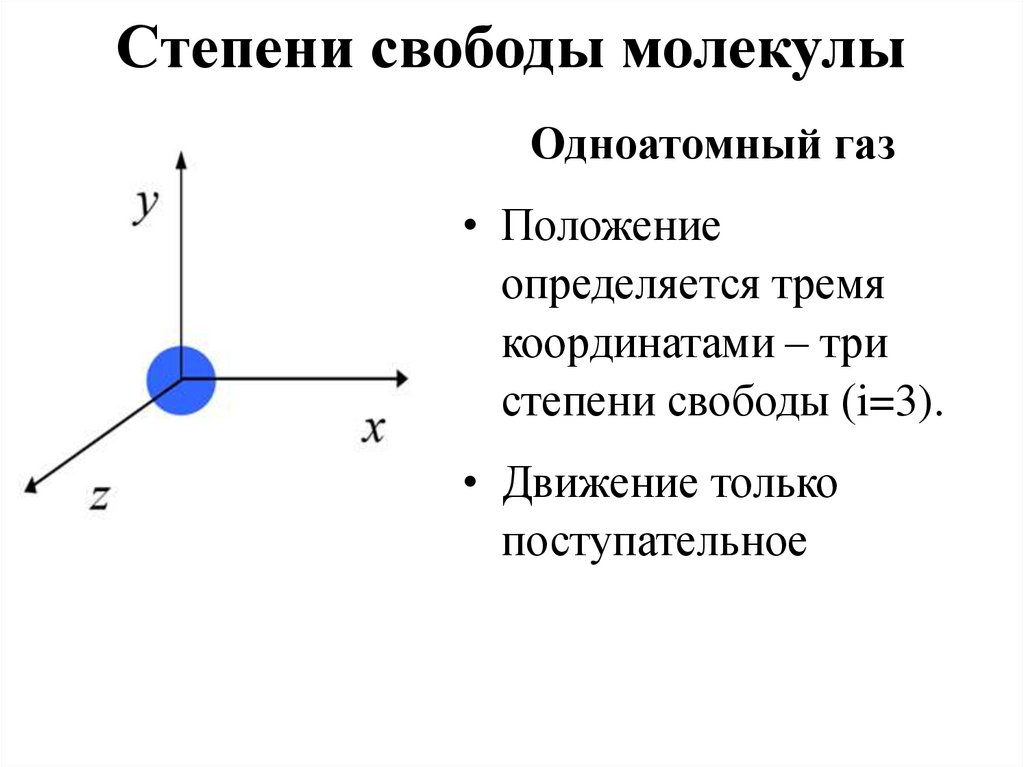
14. Степени свободы молекулы
Одноатомный газ• Положение
определяется тремя
координатами – три
степени свободы (i=3).
• Движение только
поступательное
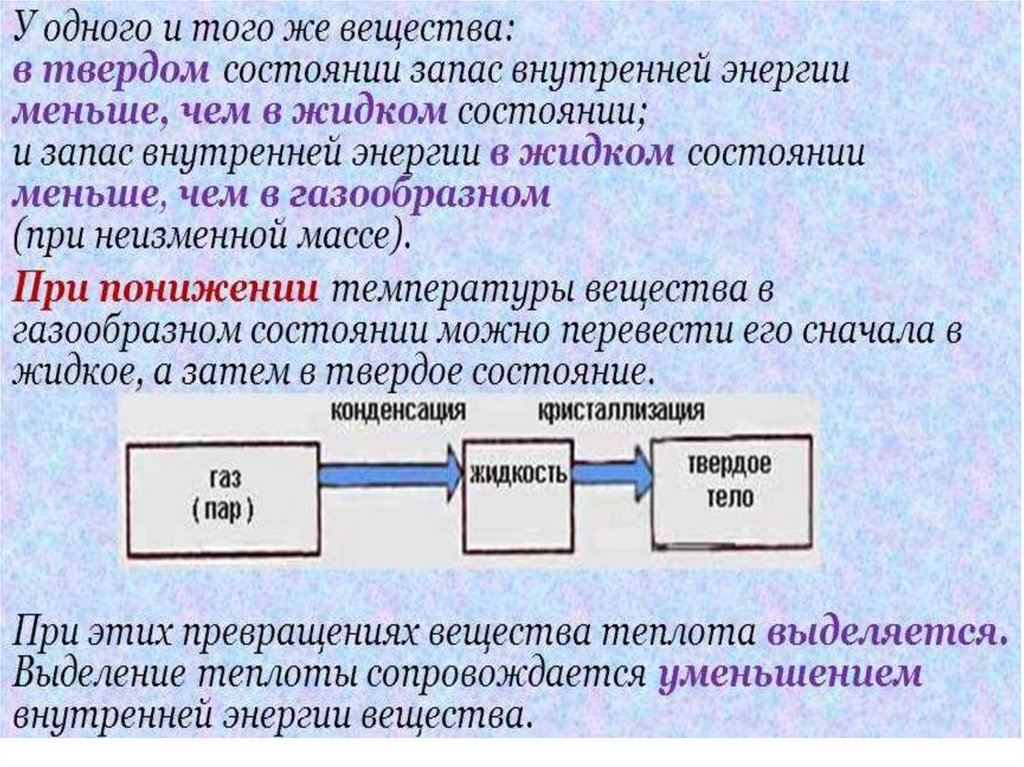
15. Двухатомный газ
• Атомы жестко связаны между собой, гантельнаямодель.
• Для молекулы двухатомного газа i=5.
• i=3 – три координаты, i=2 – вращение.
• Материальные точки не могут вращаться вокруг
оси, проходящей через эти точки.
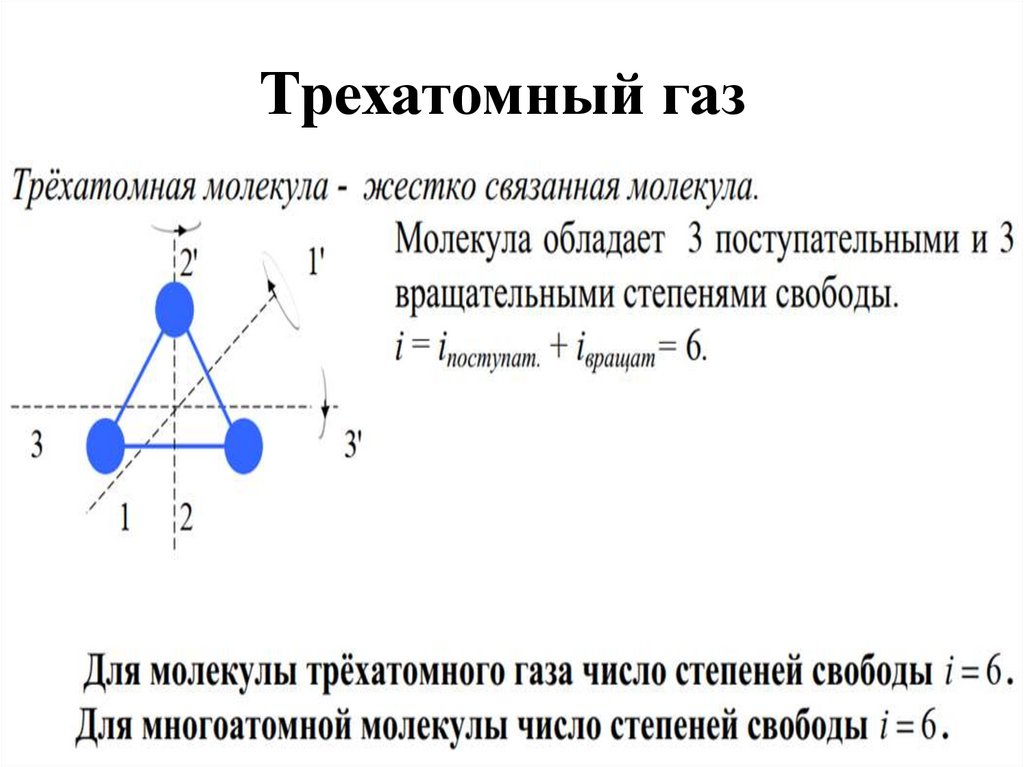
16. Трехатомный газ
17. Внутренняя энергия многоатомного идеального газа массы m равна
18. Задача 1
Аэростат объёмом 400 м3 наполнен гелием,обладающем внутренней энергий U. Давление
газа 150 кПа. Определите значение
внутренней энергии.
19. Задача 1
Аэростат объёмом 400 м3 наполнен гелием,обладающем внутренней энергий U. Давление
газа 150 кПа. Определите значение
внутренней энергии.
20. Задача 2
Газ, действующий силой 5кН на подвижныйпоршень площадью S, изобарно расширяется,
совершая работу 120 Дж. Изменение объема
газа составляет 180 см3. Определите площадь
поршня.
21. Задача 2
Газ, действующий силой 5кН на подвижныйпоршень площадью S, изобарно расширяется,
совершая работу 120 Дж. Изменение объема
газа составляет 180 см3. Определите площадь
поршня.
22. Задача 2
Газ, действующий силой 5кН на подвижныйпоршень площадью S, изобарно расширяется,
совершая работу 120 Дж. Изменение объема
газа составляет 180 см3. Определите площадь
поршня.
23. Задача 3
Газ массой m находится в цилиндрическом сосуде сподвижным поршнем. При повышении температуры от
400 К до 500 К газ, изобарно расширяясь, совершает
работу 1660 Дж. Молярная масса газа 28 г/моль.
24. Задача 3
Газ массой m находится в цилиндрическом сосуде сподвижным поршнем. При повышении температуры от
400 К до 500 К газ, изобарно расширяясь, совершает
работу 1660 Дж. Молярная масса газа 28 г/моль.
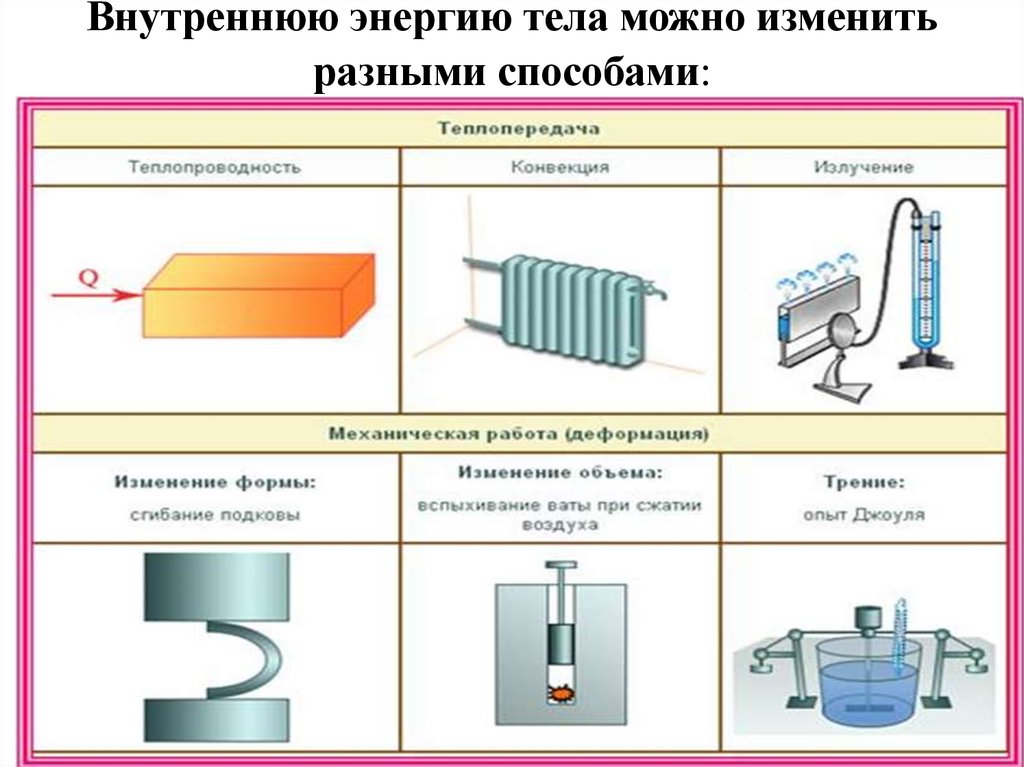
25. Внутреннюю энергию тела можно изменить разными способами:
26. Работа и теплота как формы передачи энергии
Способы изменения внутренней энергии:• механический способ,
• теплообмен
27. Механический способ
При сжатии газа его внутренняяэнергия увеличивается за счет
совершения поршнем
механической работы. При
расширении газа его внутренняя
энергия уменьшается,
превращаясь в механическую
энергию движущегося поршня.
28. Теплообмен
• Теплообмен – процесс передачи внутреннейэнергии без совершения механической работы.
• Кинетическая энергия хаотического движения
молекул первого тела переходит в кинетическую
энергию второго тела.
• Количество теплоты – мера энергии,
получаемой или отдаваемой в процессе
теплообмена.
29.
• Теплота и работа являются не видом энергии,а формой ее передачи, они существуют лишь в
процессе передачи энергии.
• В реальных условиях оба способа передачи
энергии системе в форме работы и форме
теплоты сопутствуют друг другу.
30. Теплоемкость
Теплоемкость тела называют отношениеколичества теплоты Q, необходимого для
повышения его температуры от Т1 до Т2, к
разности этих температур Т=Т2 – Т1:
Единица измерения Дж/К
31. Теплоемкость тела зависит от его природы.
Теплоемкость характеризует то количествотеплоты, которое нужно сообщить телу, чтобы
нагреть его на 1 К (при охлаждении тело выделяет
то же количество теплоты).
Для разных веществ одной массы требуется
различное количество теплоты.
32. Удельная теплоемкость
• Теплоемкость тела пропорциональна егомассе.
• Удельная теплоемкость с – величина, равная
отношению теплоемкости тела к его массе:
33.
Количество теплоты, необходимое для нагреваниятела массой m от температуры Т1 до Т2:
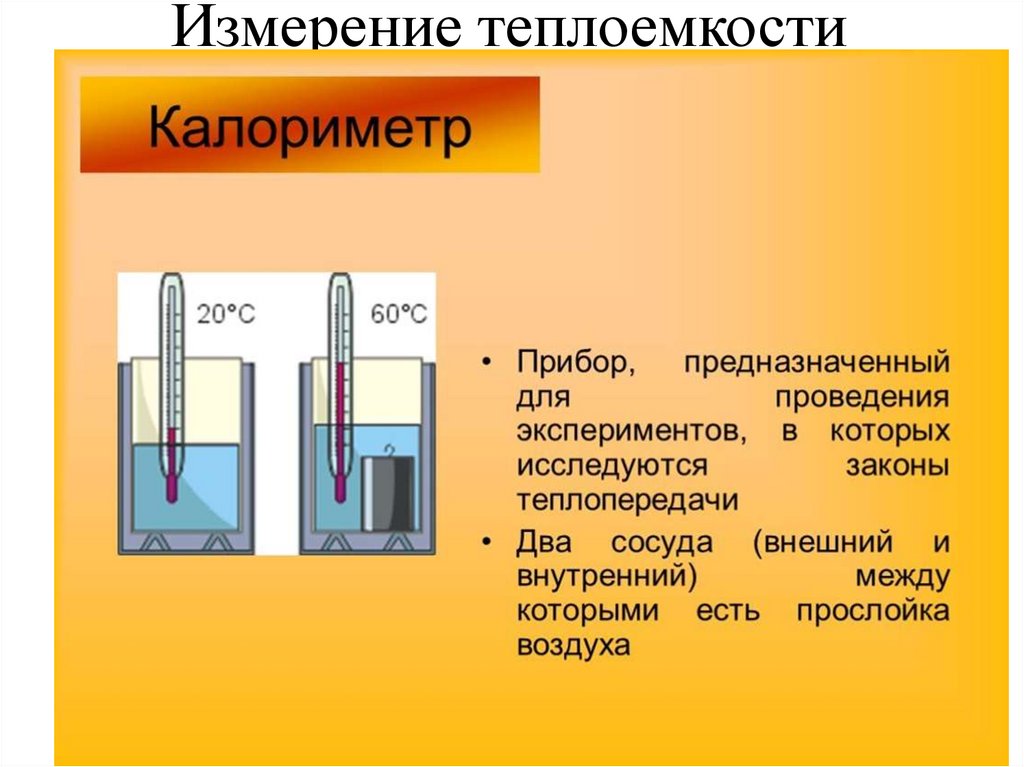
34. Измерение теплоемкости
35. Уравнение теплового баланса
Количество теплоты Q1, отданное телом, равноколичеству теплоты, полученному калориметром
(Q2 – сосудом, Q3 – жидкостью):
Q1= Q2+ Q3
36.
37. Задача 7
При охлаждении металлической детали массой m оттемпературы 600 С до температуры 450 С выделяется
количество теплоты 110 кДж. Удельная теплоемкость
металла 460 Дж/(кг* С). Определите массу детали. Во
сколько раз изменится количество теплоты,
выделяющейся при охлаждении детали, если массу
детали увеличить в 2 раза?
38. Задача 7
При охлаждении металлической детали массой m оттемпературы 600 С до температуры 450 С выделяется
количество теплоты 110 кДж. Удельная теплоемкость
металла 460 Дж/(кг* С). Определите массу детали. Во
сколько раз изменится количество теплоты,
выделяющейся при охлаждении детали, если массу
детали увеличить в 2 раза?
39. Задача 8
При сгорании топлива объёмом V выделяетсяколичество теплоты 60 МДж. Плотность
топлива 0,68г/см3 удельная теплота его
сгорания 44 MДж/кг. Определите объем
топлива.
40. Задача 8
При сгорании топлива объёмом V выделяется количество теплоты 60 МДж.Плотность топлива 0,68г/см3 удельная теплота его сгорания 44 MДж/кг.
Определите объем топлива.


































 physics
physics