Similar presentations:
белки
1. Белки
Белки (протеины, полипептиды) — это высокомолекулярныеорганические соединения, состоящие из остатков аминокислот,
соединённых пептидными (амидными) связями. Также белки могут
содержать другие компоненты: ионы металлов, неорганические и
органические группы (сложные белки).
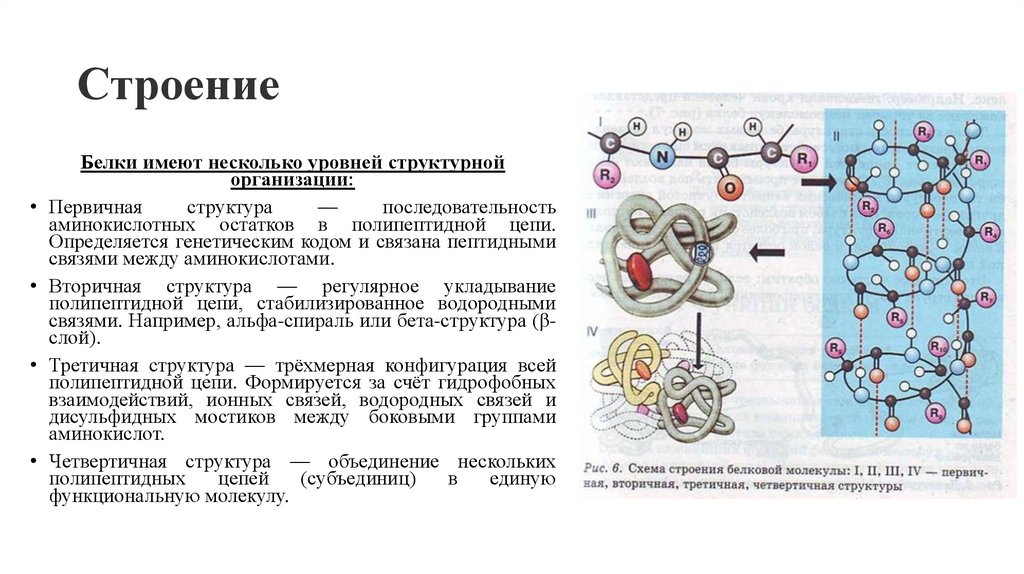
2. Строение
Белки имеют несколько уровней структурнойорганизации:
• Первичная
структура
—
последовательность
аминокислотных остатков в полипептидной цепи.
Определяется генетическим кодом и связана пептидными
связями между аминокислотами.
• Вторичная структура — регулярное укладывание
полипептидной цепи, стабилизированное водородными
связями. Например, альфа-спираль или бета-структура (βслой).
• Третичная структура — трёхмерная конфигурация всей
полипептидной цепи. Формируется за счёт гидрофобных
взаимодействий, ионных связей, водородных связей и
дисульфидных мостиков между боковыми группами
аминокислот.
• Четвертичная структура — объединение нескольких
полипептидных
цепей
(субъединиц)
в
единую
функциональную молекулу.
3.
Пептидная (амидная) связь — вид химической связи,возникающий при образовании белков и пептидов. Это связь между
α-аминогруппой одной аминокислоты и α-карбоксильной группой
другой аминокислоты.
Аминокислоты, соединённые пептидной связью, образуют
полипептидную цепь. Если количество аминокислот не превышает
10, соединение называется пептидом, если от 10 до 40 аминокислот
— полипептидом, если более 40 аминокислот — белком.
Пептидная связь играет важную роль в формировании структуры
белков.
4. КЛАССИФИКАЦИЯ БЕЛКОВ
По химическому составу:• Простые – содержат в составе только аминокислоты
• Сложные – кроме аминокислот имеются небелковые компоненты
5. Функции
• Структурная — обеспечивают форму и прочность клеток итканей: коллаген — основной белок соединительной ткани,
кератин — входит в состав волос, ногтей, перьев.
• Транспортная — переносят различные вещества в организме:
гемоглобин — переносит кислород от лёгких к тканям и
углекислый газ обратно к лёгким.
• Защитная — участвуют в защите организма от чужеродных
агентов: антитела (иммуноглобулины) — распознают и
нейтрализуют антигены, фибриноген и тромбин — участвуют в
свёртывании крови.
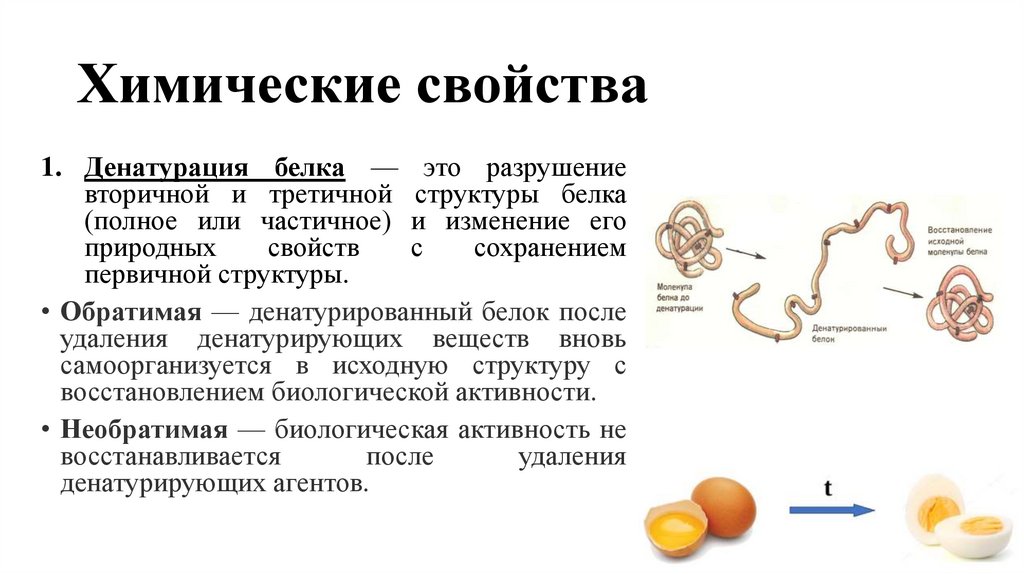
6. Химические свойства
1. Денатурация белка — это разрушениевторичной и третичной структуры белка
(полное или частичное) и изменение его
природных
свойств
с
сохранением
первичной структуры.
• Обратимая — денатурированный белок после
удаления денатурирующих веществ вновь
самоорганизуется в исходную структуру с
восстановлением биологической активности.
• Необратимая — биологическая активность не
восстанавливается
после
удаления
денатурирующих агентов.
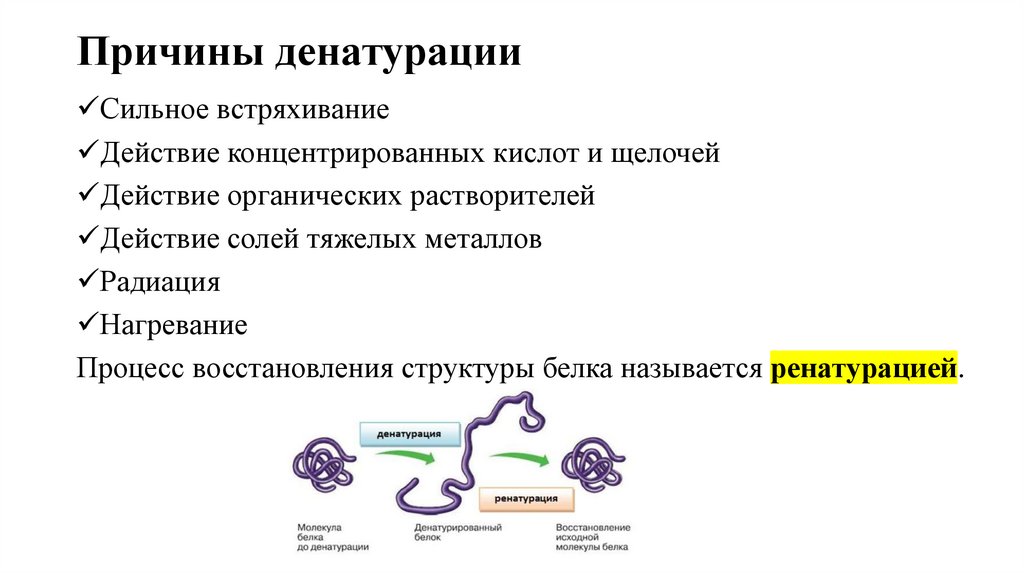
7. Причины денатурации
Сильное встряхиваниеДействие концентрированных кислот и щелочей
Действие органических растворителей
Действие солей тяжелых металлов
Радиация
Нагревание
Процесс восстановления структуры белка называется ренатурацией.
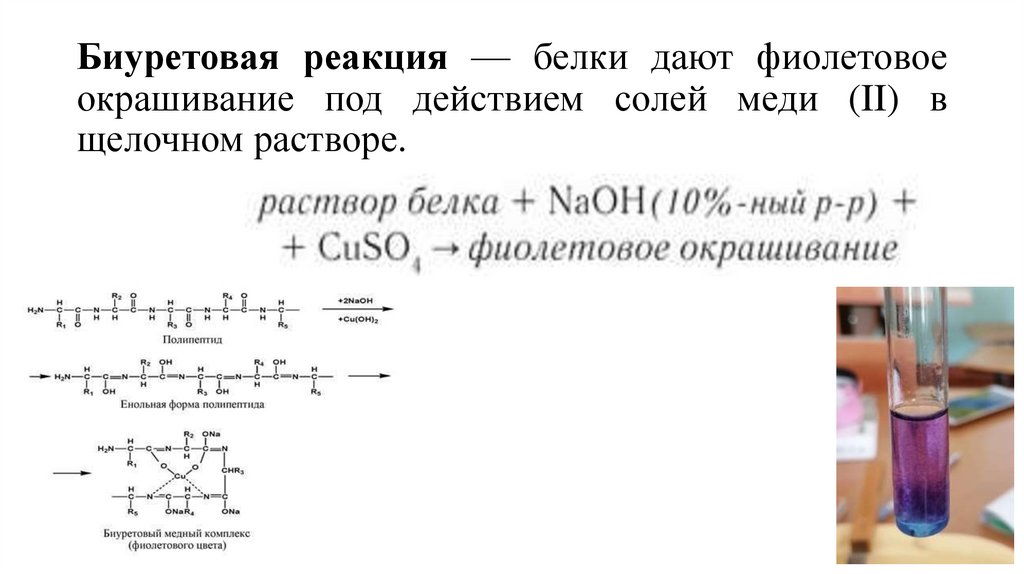
8. Биуретовая реакция — белки дают фиолетовое окрашивание под действием солей меди (II) в щелочном растворе.
Биуретовая реакция — белки дают фиолетовоеокрашивание под действием солей меди (II) в
щелочном растворе.
9.
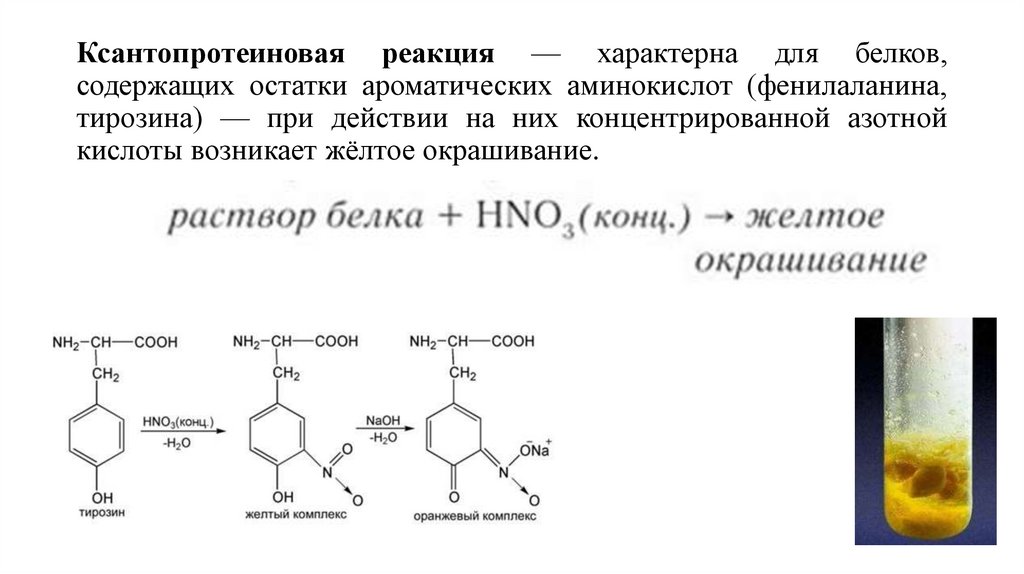
10. Ксантопротеиновая реакция — характерна для белков, содержащих остатки ароматических аминокислот (фенилаланина, тирозина) — при
Ксантопротеиновая реакция — характерна для белков,содержащих остатки ароматических аминокислот (фенилаланина,
тирозина) — при действии на них концентрированной азотной
кислоты возникает жёлтое окрашивание.






 biology
biology