Similar presentations:
https___school.mos.ru_ej_attachments_files_219_731_649_original_%D0%A5%D0%B0%D0%BB%D1%8C%D0%BA%D0%BE%D0%B3%D0%B5%D0%BD%D1%8B.%20%D0%A1%D0%B5%D1%80%D0%B0_.%20(9%20%D0%BA%D0%BB%D0%B0%D1%81%D1%81) (1)
1. Общая характеристика элементов VIA-группы (халькогены). Кислород. Сера.
ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВVIA-ГРУППЫ (ХАЛЬКОГЕНЫ).
КИСЛОРОД. СЕРА.
2. Элементы VI группы главной подгруппы. Халькогены, т.е « рождающие руды».
ЭЛЕМЕНТЫ VI ГРУППЫ ГЛАВНОЙПОДГРУППЫ.
ХАЛЬКОГЕНЫ, т.е
« РОЖДАЮЩИЕ РУДЫ».
O
•S
• Se
• Te
• Po
3. Se и Te -минералов не образуют Ро - очень редкий радиоактивный элемент
Se И Te -МИНЕРАЛОВ НЕ ОБРАЗУЮТРо - ОЧЕНЬ РЕДКИЙ
РАДИОАКТИВНЫЙ ЭЛЕМЕНТ
4. Кислород
КИСЛОРОД• КИСЛОРОД – САМЫЙ
РАСПРОСТРАНЕННЫЙ
ЭЛЕМЕНТ НА ЗЕМЛЕ (49,5%
МАСС.).
• КИСЛОРОД СУЩЕСТВУЕТ В
САМОРОДНОМ ВИДЕ (ВОЗДУХ)
И ВХОДИТ В СОСТАВ ВОДЫ,
ГОРНЫХ ПОРОД И ЖИВЫХ
ОРГАНИЗМОВ.
• В АТМОСФЕРЕ СОДЕРЖАНИЕ
КИСЛОРОДА – 23,13% МАСС..
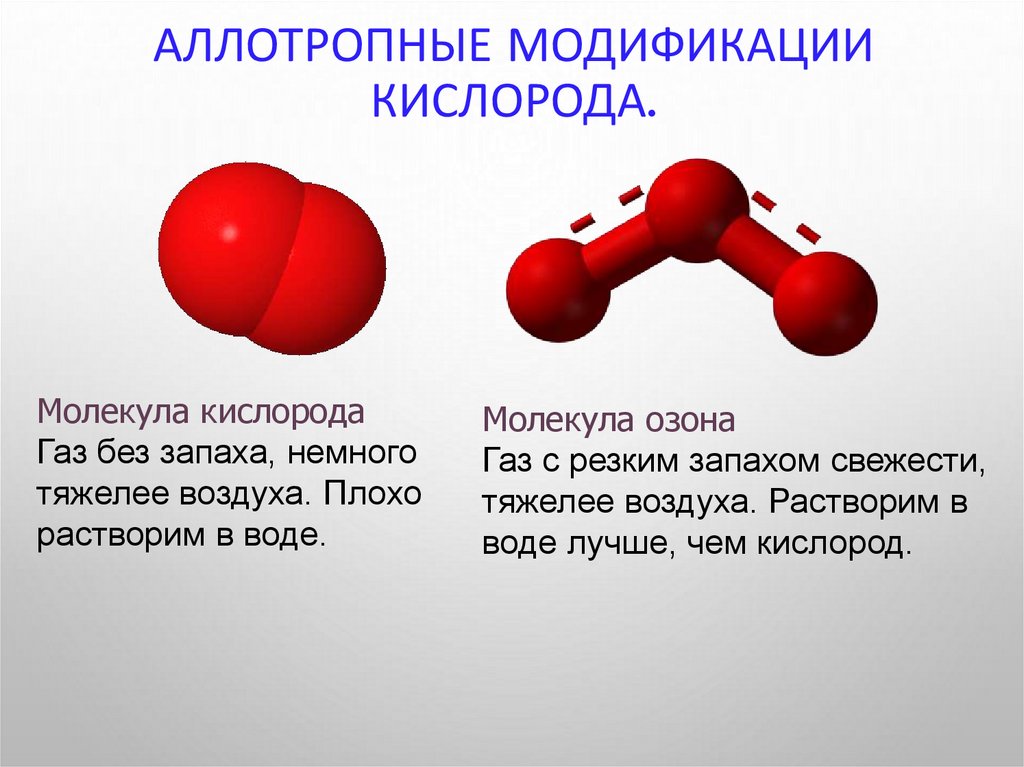
5. Аллотропные модификации кислорода.
АЛЛОТРОПНЫЕ МОДИФИКАЦИИКИСЛОРОДА.
Молекула кислорода
Газ без запаха, немного
тяжелее воздуха. Плохо
растворим в воде.
Молекула озона
Газ с резким запахом свежести,
тяжелее воздуха. Растворим в
воде лучше, чем кислород.
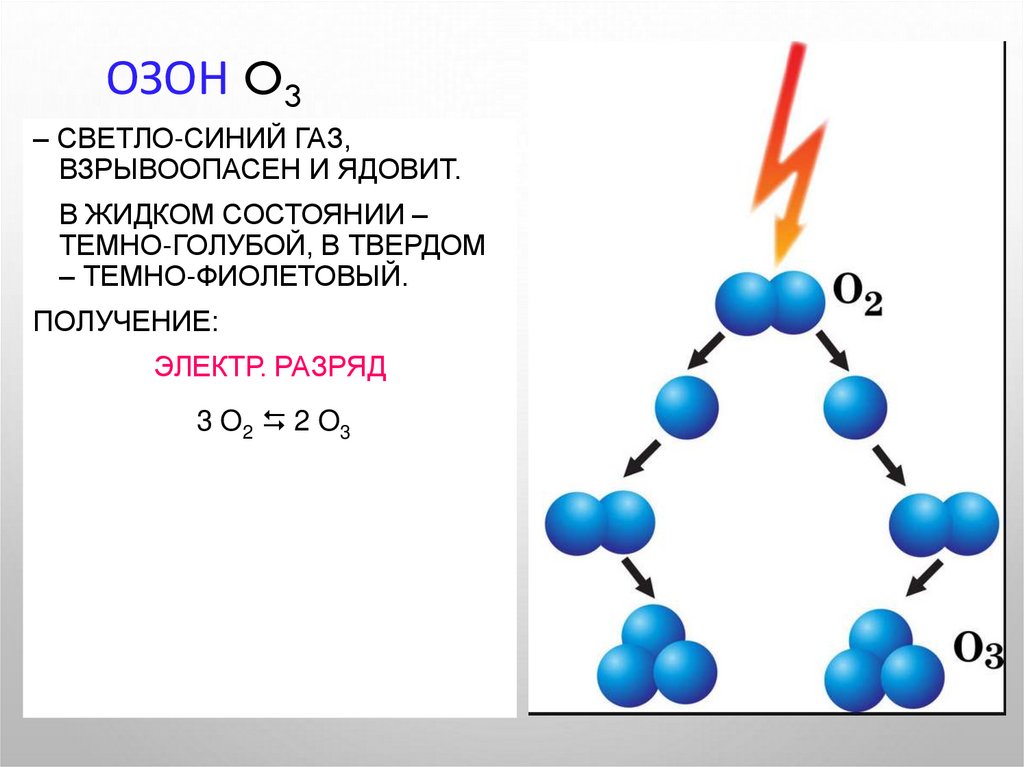
6. Озон O3
ОЗОН O3– СВЕТЛО-СИНИЙ ГАЗ,
ВЗРЫВООПАСЕН И ЯДОВИТ.
В ЖИДКОМ СОСТОЯНИИ –
ТЕМНО-ГОЛУБОЙ, В ТВЕРДОМ
– ТЕМНО-ФИОЛЕТОВЫЙ.
ПОЛУЧЕНИЕ:
ЭЛЕКТР. РАЗРЯД
3 O2 2 O3
7.
Химические свойства кислорода:не взаимодействует с галогенами,
благородными газами, золотом и
платиновыми металлами.
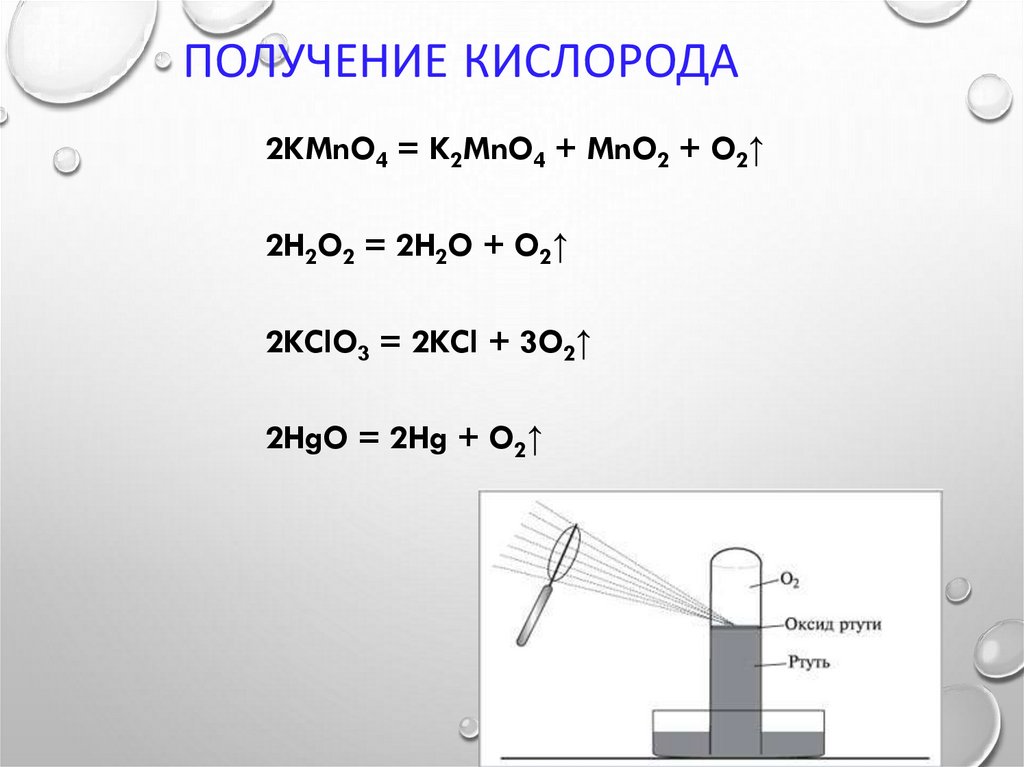
8. Получение кислорода
ПОЛУЧЕНИЕ КИСЛОРОДА2KMnO4 = K2MnO4 + MnO2 + O2↑
2H2O2 = 2H2O + O2↑
2KClO3 = 2KCl + 3O2↑
2HgO = 2Hg + O2↑
ДЖ. ПРИСТЛИ
9.
• КИСЛОРОД АКТИВНО ВЗАИМОДЕЙСТВУЕТ СО ЩЕЛОЧНЫМИМЕТАЛЛАМИ ДАЖЕ БЕЗ НАГРЕВАНИЯ. МЕТАЛЛЫ СРЕДНЕЙ И НИЗКОЙ
АКТИВНОСТИ РЕАГИРУЮТ С КИСЛОРОДОМ ПРИ НАГРЕВАНИИ.
4LI + O2 = 2LI2O
3Fe + 2O2 = Fe3O4
2Mg + O2 = 2MgO
10. Реакция горения
РЕАКЦИЯ ГОРЕНИЯ• ПРИ ВЗАИМОДЕЙСТВИИ МЕТАЛЛОВ И НЕМЕТАЛЛОВ С КИСЛОРОДОМ
ЗАЧАСТУЮ ПРОИСХОДИТ ВЫДЕЛЕНИЕ БОЛЬШОГО КОЛИЧЕСТВА ТЕПЛА И ДАЖЕ
ВОСПЛАМЕНЕНИЕ.
S + O2 = SO2
4P + 5O2 = 2P2O5
11.
Взаимодействие кислорода с азотом происходит толькопри нагревании свыше 2000 °C или же при электрическом
разряде.
N2 + O2 = 2NO - Q
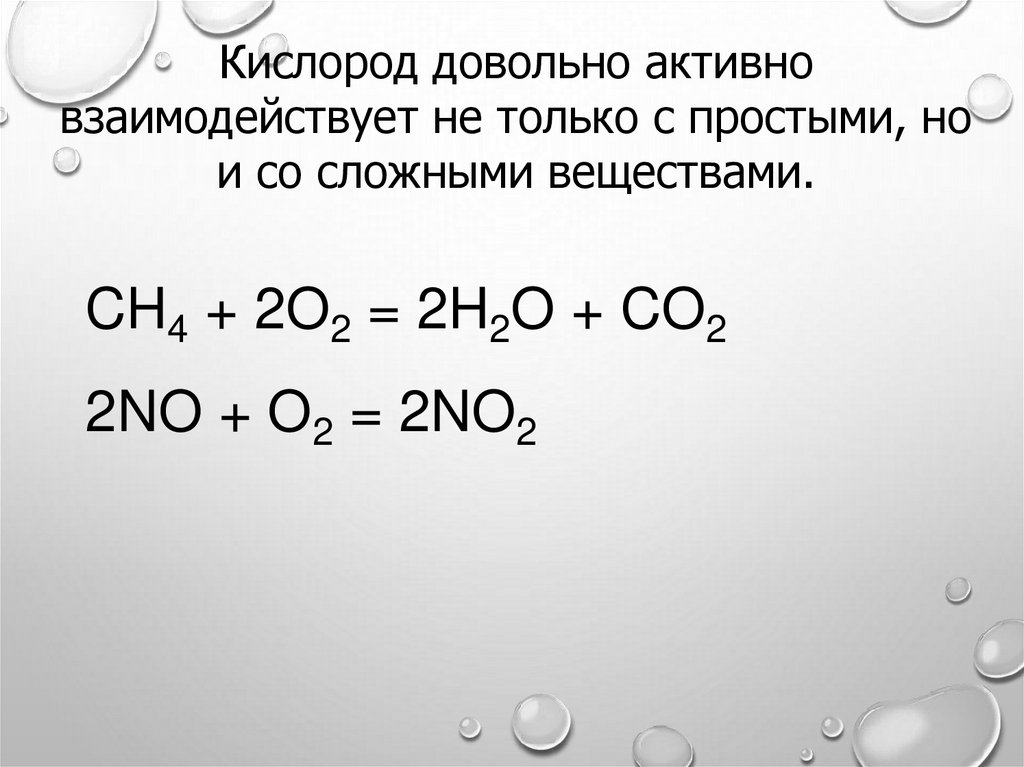
12.
Кислород довольно активновзаимодействует не только с простыми, но
и со сложными веществами.
CH4 + 2O2 = 2H2O + CO2
2NO + O2 = 2NO2
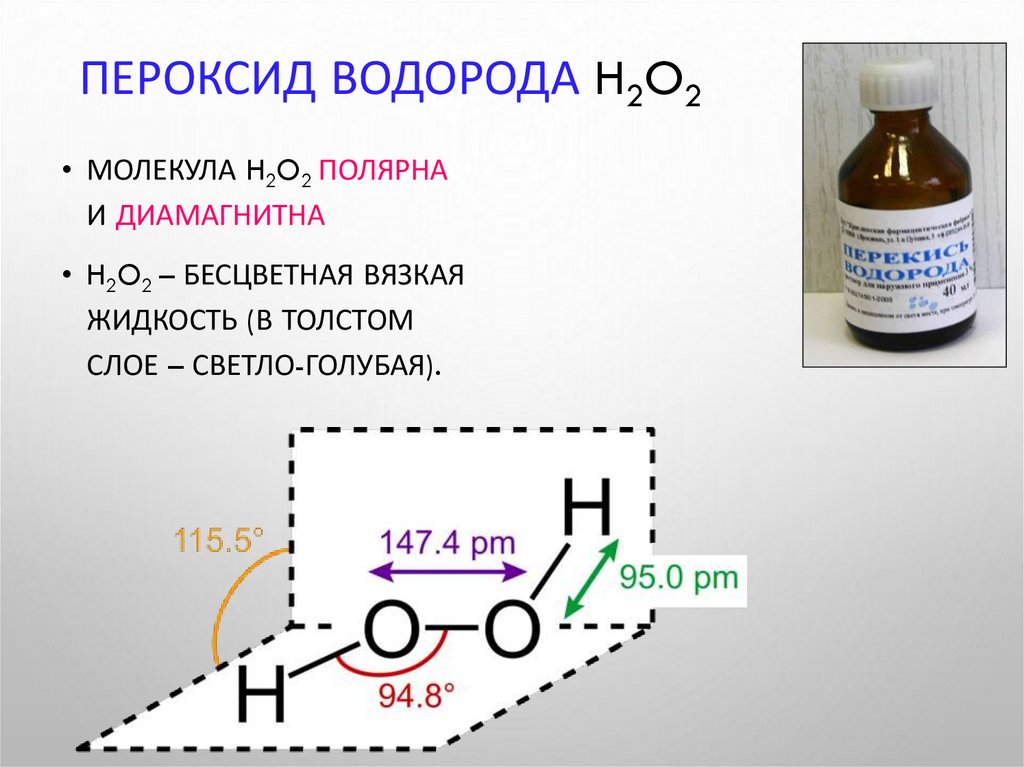
13. Пероксид водорода H2O2
ПЕРОКСИД ВОДОРОДА H2O2• МОЛЕКУЛА H2O2 ПОЛЯРНА
И ДИАМАГНИТНА
• H2O2 – БЕСЦВЕТНАЯ ВЯЗКАЯ
ЖИДКОСТЬ (В ТОЛСТОМ
СЛОЕ – СВЕТЛО-ГОЛУБАЯ).
14. Пероксид водорода H2O2
ПЕРОКСИД ВОДОРОДА H2O2• В РАЗБАВЛЕННЫХ РАСТВОРАХ ПЕРОКСИД
ВОДОРОДА НЕУСТОЙЧИВ И САМОПРОИЗВОЛЬНО
ДИСПРОПОРЦИОНИРУЕТ:
2H2O2–I = 2H2O–II + O20
15. Сера - химический элемент
СЕРА - ХИМИЧЕСКИЙ ЭЛЕМЕНТКАКОВ ХИМИЧЕСКИЙ ЗНАК?
В КАКОЙ ГРУППЕ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ НАХОДИТСЯ?
В КАКОМ ПЕРИОДЕ НАХОДИТСЯ?
КАКОЙ АТОМНЫЙ НОМЕР?
КАКАЯ ОТНОСИТЕЛЬНАЯ АТОМНАЯ МАССА?
СКОЛЬКО ЭЛЕКТРОНОВ В АТОМЕ? КАК РАСПОЛАГАЮТСЯ
ЭЛЕКТРОНЫ НА АО?
КАКАЯ ЭЛЕКТРОННАЯ ФОРМУЛА СЕРЫ?
КАКИЕ НИЗШАЯ (В СОЕДИНЕНИЯХ С ВОДОРОДОМ И
МЕТАЛЛАМИ) И ВЫСШАЯ (В СОЕДИНЕНИИ С КИСЛОРОДОМ)
ВАЛЕНТНОСТИ СЕРЫ?
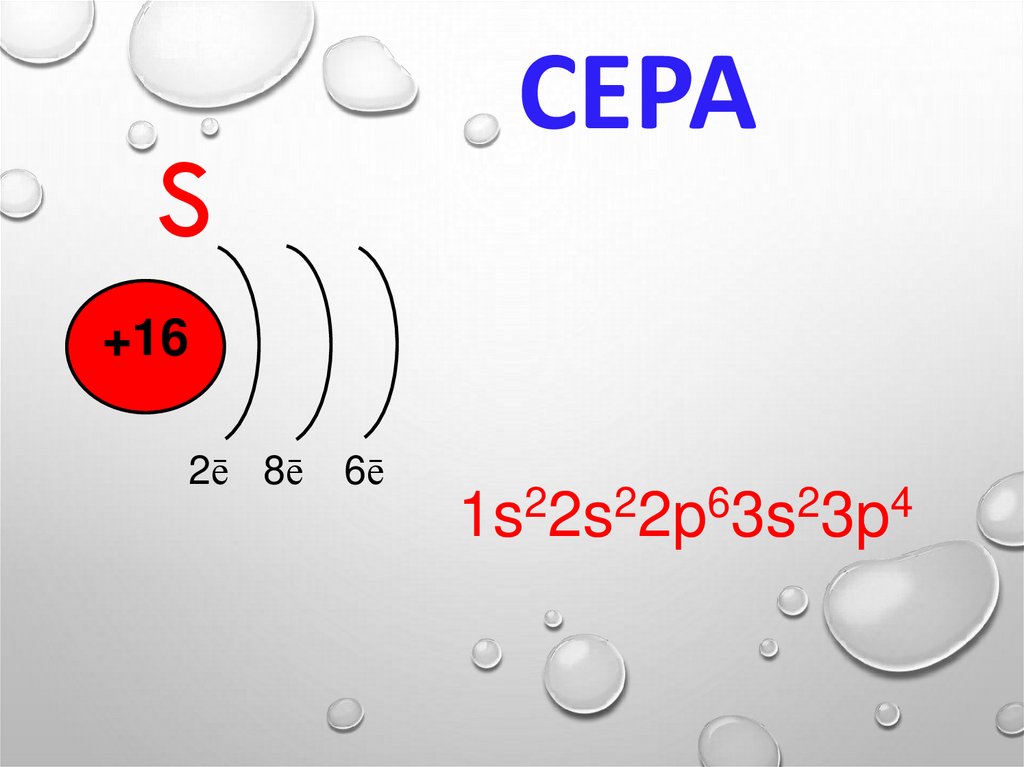
16. СЕРА
S+16
2ē 8ē
6ē
2
2
6
2
4
1s 2s 2p 3s 3p
17. Строение атома серы
СТРОЕНИЕ АТОМА СЕРЫ1s22 s22p63s23p43d0
Размещение электронов по
орбиталям (последний слой)
Степень
окисления
+2, -2
+4
+6
18.
Сера вприроде
Сера является на 16-м месте по
распространённости в земной
коре. Встречается в свободном
(самородном) состоянии и
связанном виде.
19. Сера также встречается в виде сульфатов солей серной кислоты - мирабилит
СЕРА ТАКЖЕ ВСТРЕЧАЕТСЯ В ВИДЕСУЛЬФАТОВ СОЛЕЙ СЕРНОЙ КИСЛОТЫ МИРАБИЛИТ
20. Пирит - огненный камень (соединение серы в природе)
ПИРИТ - ОГНЕННЫЙ КАМЕНЬ(СОЕДИНЕНИЕ СЕРЫ В ПРИРОДЕ)
21. Сера - жизненно важный химический элемент
СЕРА - ЖИЗНЕННОВАЖНЫЙ
ХИМИЧЕСКИЙ
ЭЛЕМЕНТ
СЕРА ВХОДИТ В СОСТАВ
БЕЛКОВ. ОСОБЕННО
МНОГО СЕРЫ В БЕЛКАХ
ВОЛОС, РОГОВ, ШЕРСТИ.
КРОМЕ ЭТОГО СЕРА
ЯВЛЯЕТСЯ СОСТАВНОЙ
ЧАСТЬЮ БИОЛОГИЧЕСКИ
АКТИВНЫХ ВЕЩЕСТВ:
ВИТАМИНОВ И
ГОРМОНОВ. ПРИ
НЕДОСТАТКЕ СЕРЫ В
ОРГАНИЗМЕ
НАБЛЮДАЕТСЯ
ХРУПКОСТЬ И ЛОМКОСТЬ
КОСТЕЙ, ВЫПАДЕНИЕ
ВОЛОС.
22. Физические свойства
ФИЗИЧЕСКИЕ СВОЙСТВАТВЁРДОЕ КРИСТАЛЛИЧЕСКОЕ
ВЕЩЕСТВО ЖЕЛТОГО ЦВЕТА, БЕЗ
ЗАПАХА.
КАК И ВСЕ НЕМЕТАЛЛЫ ПЛОХО
ПРОВОДИТ ТЕПЛОТУ И НЕ
ПРОВОДИТ ЭЛЕКТРИЧЕСКИЙ ТОК.
СЕРА В ПРИРОДЕ ПРАКТИЧЕСКИ НЕ
РАСТВОРЯЕТСЯ.
ТЕМПЕРАТУРА ПЛАВЛЕНИЯ 1200С.
23.
АЛЛОТРОПИЯ- РОМБИЧЕСКАЯ (Α - СЕРА) - S8
T ПЛ. = 113 C; = 2,07 Г/СМ3
НАИБОЛЕЕ УСТОЙЧИВАЯ МОДИФИКАЦИЯ.
- МОНОКЛИННАЯ (Β - СЕРА) - ТЕМНО-ЖЕЛТЫЕ ИГЛЫ
T ПЛ. = 119 C; = 1,96 Г/СМ3
УСТОЙЧИВАЯ ПРИ ТЕМПЕРАТУРЕ БОЛЕЕ 96 С; ПРИ ОБЫЧНЫХ
УСЛОВИЯХ ПРЕВРАЩАЕТСЯ В РОМБИЧЕСКУЮ.
- ПЛАСТИЧЕСКАЯ - КОРИЧНЕВАЯ РЕЗИНОПОДОБНАЯ
(АМОРФНАЯ) МАССА
НЕУСТОЙЧИВА, ПРИ ЗАТВЕРДЕВАНИИ ПРЕВРАЩАЕТСЯ В
РОМБИЧЕСКУЮ.
24. Химические свойства Окислительные свойства серы (S0 + 2ē S-2)
ХИМИЧЕСКИЕ СВОЙСТВАОКИСЛИТЕЛЬНЫЕ СВОЙСТВА СЕРЫ
(S0 + 2ē S-2)
СЕРА РЕАГИРУЕТ СО ЩЕЛОЧНЫМИ МЕТАЛЛАМИ БЕЗ
НАГРЕВАНИЯ:
2Na + S Na2S
C ОСТАЛЬНЫМИ МЕТАЛЛАМИ (КРОМЕ AU, PT) - ПРИ
ПОВЫШЕННОЙ T :
2Al + 3S –T Al2S3
Zn + S –T ZnS
С НЕКОТОРЫМИ НЕМЕТАЛЛАМИ СЕРА ОБРАЗУЕТ БИНАРНЫЕ
СОЕДИНЕНИЯ:
H2 + S H2S
2P + 3S P2S3
C + 2S CS2
25. Химические свойства
ХИМИЧЕСКИЕ СВОЙСТВАВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА СЕРА ПРОЯВЛЯЕТ В
РЕАКЦИЯХ С СИЛЬНЫМИ ОКИСЛИТЕЛЯМИ:
S - 2ē S+2; S - 4ē S+4; S - 6ē S+6
КИСЛОРОДОМ:
S + O2 –T S+4O2
2S + 3O2 –T ;РT 2S+6O3
C ГАЛОГЕНАМИ (КРОМЕ ЙОДА):
S + Cl2 S+2Cl2
C КИСЛОТАМИ - ОКИСЛИТЕЛЯМИ:
S + 2H2SO4(КОНЦ) 3S+4O2 + 2H2O
S + 6HNO3(КОНЦ) H2S+6O4 + 6NO2 + 2H2O
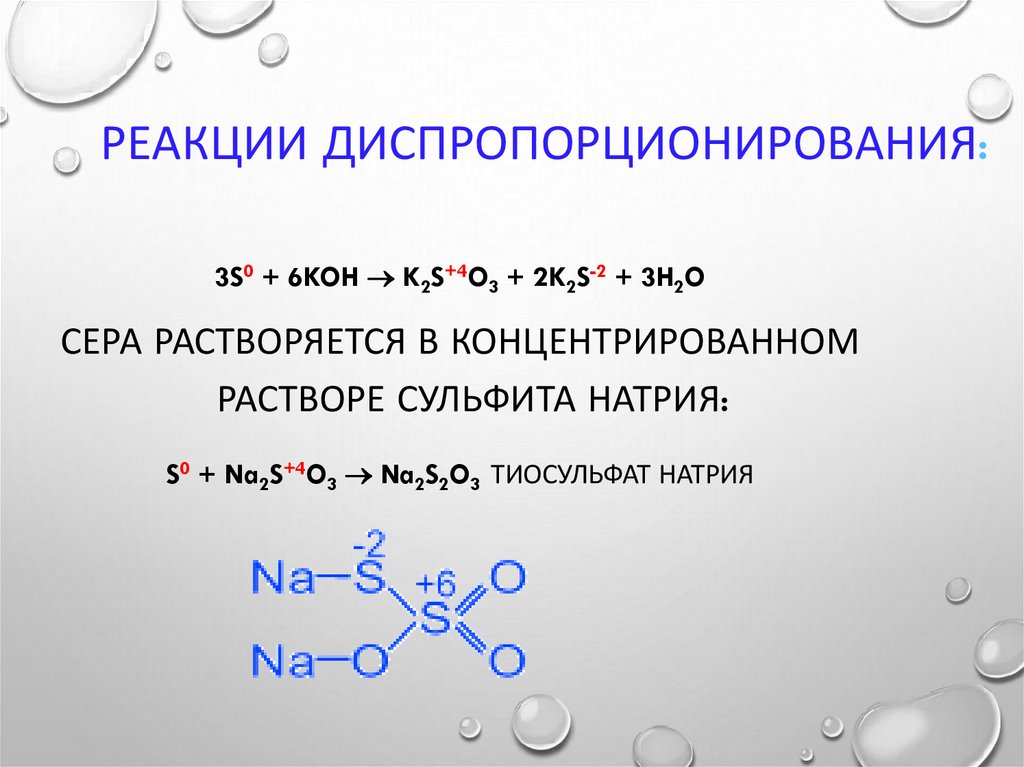
26. Реакции диспропорционирования:
РЕАКЦИИ ДИСПРОПОРЦИОНИРОВАНИЯ:3S0 + 6KOH K2S+4O3 + 2K2S-2 + 3H2O
СЕРА РАСТВОРЯЕТСЯ В КОНЦЕНТРИРОВАННОМ
РАСТВОРЕ СУЛЬФИТА НАТРИЯ:
S0 + Na2S+4O3 Na2S2O3 ТИОСУЛЬФАТ НАТРИЯ
27.
В ЗЕРНОХРАНИЛИЩАХ ДЛЯ ИСТРЕБЛЕНИЯ НАСЕКОМЫХ СЖИГАЮТ СЕРУ,ИСХОДЯ ИЗ НОРМЫ 24 Г НА 1 М3 ПОМЕЩЕНИЯ. РАССЧИТАЙТЕ, СКОЛЬКО
КИЛОГРАММ ОКСИДА СЕРЫ (IV) ДОЛЖНО ПОЛУЧИТЬСЯ ПРИ ГАЗАЦИИ
ПОМЕЩЕНИЯ 100 М3
НАПИШИТЕ УРАВНЕНИЯ РЕАКЦИЙ
S → SO2 → SO3 → H2SO4 → CaSO4
28. Домашнее задание:
ДОМАШНЕЕ ЗАДАНИЕ:• П.13, УПР.5 В, СТР. 77.





















 chemistry
chemistry








