Similar presentations:
зат құрылысы 2018 (2)
1. Заттың құрылысы
Кафедра Х және ХТ«Химия»
пәнінен барлық мамандықтар үшін
2. Жоспар
Атом құрылысы туралы түсінік;Атом ядросының құрылысы және
сипаттамалары;
Негізгі заңдар;
Химиялық байланыс.
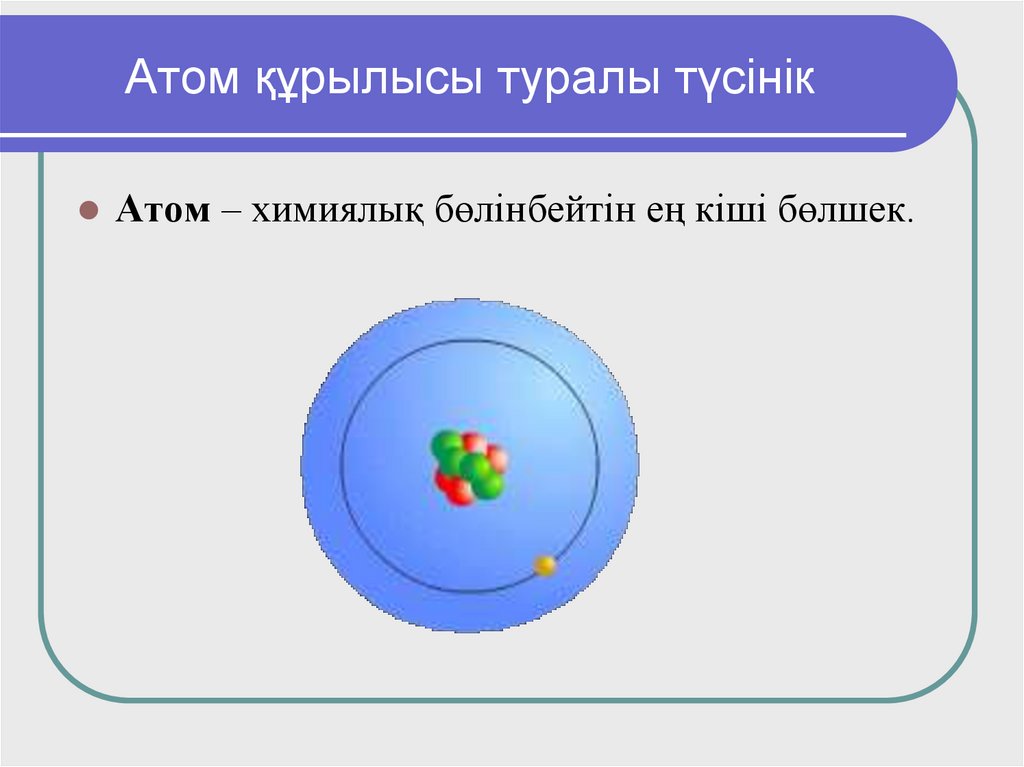
3. Атом құрылысы туралы түсінік
Атом – химиялық бөлінбейтін ең кіші бөлшек.4. Атом – күрделі микрожүйе
Атом ядродан және оның кеңістігіндеайналып жүретін электрондардан тұрады.
5. Атом ядросының құрылысы және сипаттамалары
1911 жылы Э.Резерфорд атомқұрылысының планетарлық
моделін ұсынды, бұл модель
бойынша атом мөлшері өте кіші оң
зарядталған массивті ядродан
тұрады. Ядроға атомның барлық
массасы шоғырланған. Ядро
протон және нейтроннан тұрады.
Ядродан біраз қашықтықта
атомның электрондар қауызын
құрайтын электрондар айналып
жүреді.
6. 1. Атом ядросының құрылысы және сипаттамалары
1913 жылы Нильс Бор, Планк енгізген сәулешашырауының кванттық теориясын қолданып,
Резерфорд теориясын әрі қарай дамытты.
Планктің кванттық теориясының мағынасы:
сәулелі энергия квант энергиясы түрінде аздап
бөлшектеніп шығады және сіңіріледі.
Кванттық түсінікті, ядроны айналып жүрген
электрондарға қолданып, Бор үш негізгі
постулатты құрастырды.
7. Бордың үш негізгі постулаттары:
1) электрон белгілі орбита бойынша энергияжұмсамай айналады;
2) ядроға тақау орналасқан орбита
неғұрлым қалыпты атом күйде болады;
3) егер электрон бір орбитадан екінші
орбитаға ауысса, атом энергияны сіңіреді
немесе бөледі.
8. Мозли заңы
Реттік сан= +ядро заряды = - электрон саны= +протон саны;Реттік сан = +Z = -e = +p;
Нейтрон саны=салыстырмалы атомдық масса – протон саны;
n=Ar-p.
9. Сипаттамалар
11
1
0
p;
mp 1,67 10
27
кг м.а.б 1,00728
n; mn 1,6749 10 27 кг
1
0
е; mе 9,11·10
-31
кг
м.а.б 1,00867
м.а.б 0,000549
10. Сипаттамалар:
147
A
Z
X Y e
A
Z
X Z A1Y 10e
A
Z 1
0
1
N He H O
4
2
1
1
17
8
11. Сипаттамалар:
73
Li p He
4
2
10
5
14
7
B n Li He
7
3
4
2
N n C p
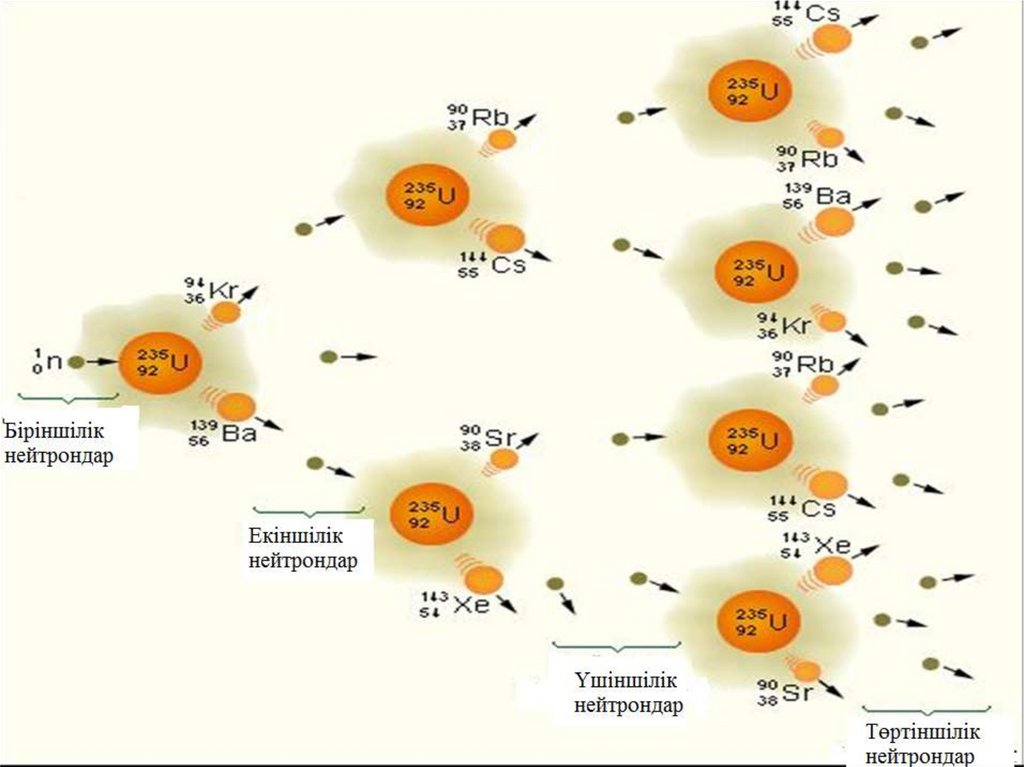
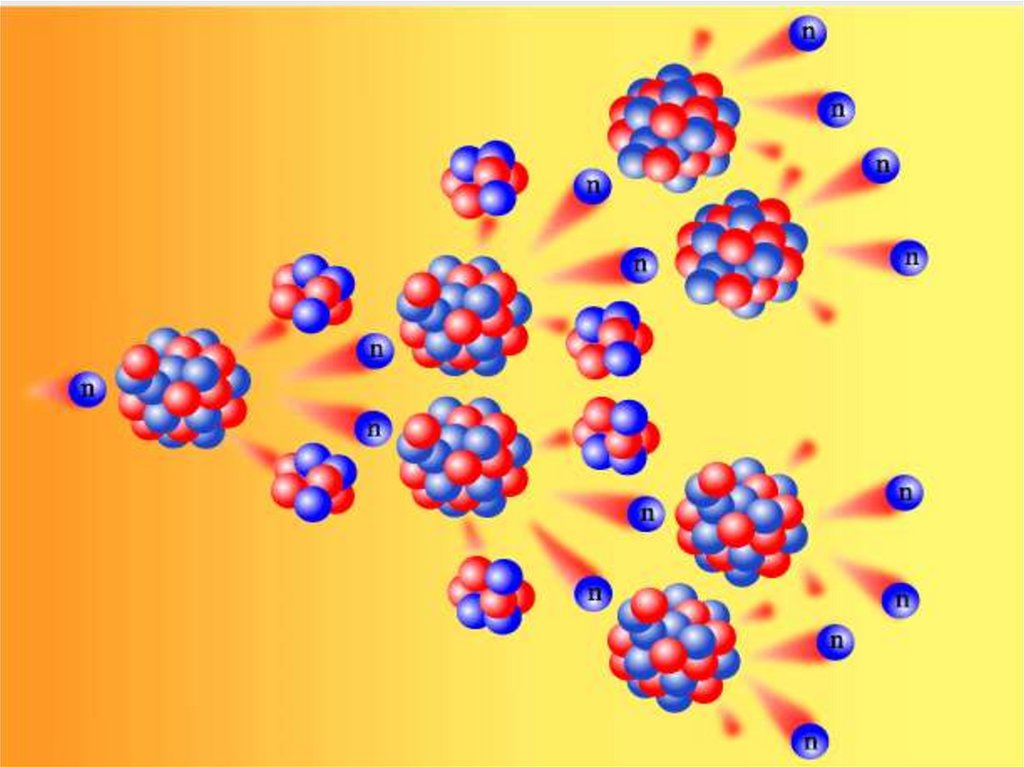
14
6
U n Cs Rb 2n
235
92
140
55
2
1
94
37
Н Н Н р
2
1
3
1
1
1
12.
13.
14. Бас квант саны (n)
Бас квант саны (n) ядроның электрмагниттік өрісіндеайналатын
электрондардың
энергетикалық
деңгейін
анықтайды.
Бас квант саны (n)
мәні
Менделеев
таблицасындағы
период
санымен
сәйкес
келеді,
электронның орналасу радиусын көрсетеді;
n мәне 1-ден 7,0 дейінгі бүтін сандармен көрсетіледі.
Энергетикалық деңгейдегі электрондардың ең көп саны
деңгей нөмірінің екі еселенген квадратына тең шама, яғни
N = 2n2 ,
мұндағы,
N- электрондар саны; n- деңгейдегі нөмірі
немесе бас квант саны.
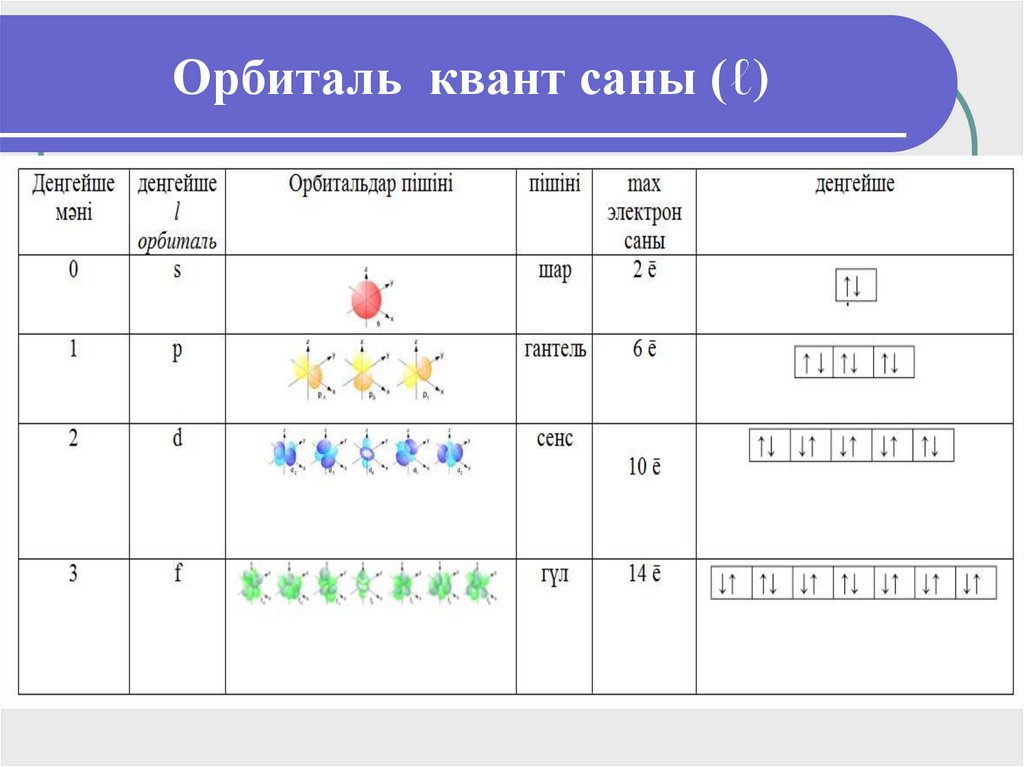
15. Орбиталь квант саны (ℓ)
Электрон бұлттарының пішінінанықтайды, бас квант санына тәуелді
болады,
электронның
орналасу
деңгейшесін
көрсетеді.
ℓ-әрпімен
белгіленеді. ℓ мәні 0-ден басталады.
n-1 формуласы
16. Орбиталь квант саны (ℓ)
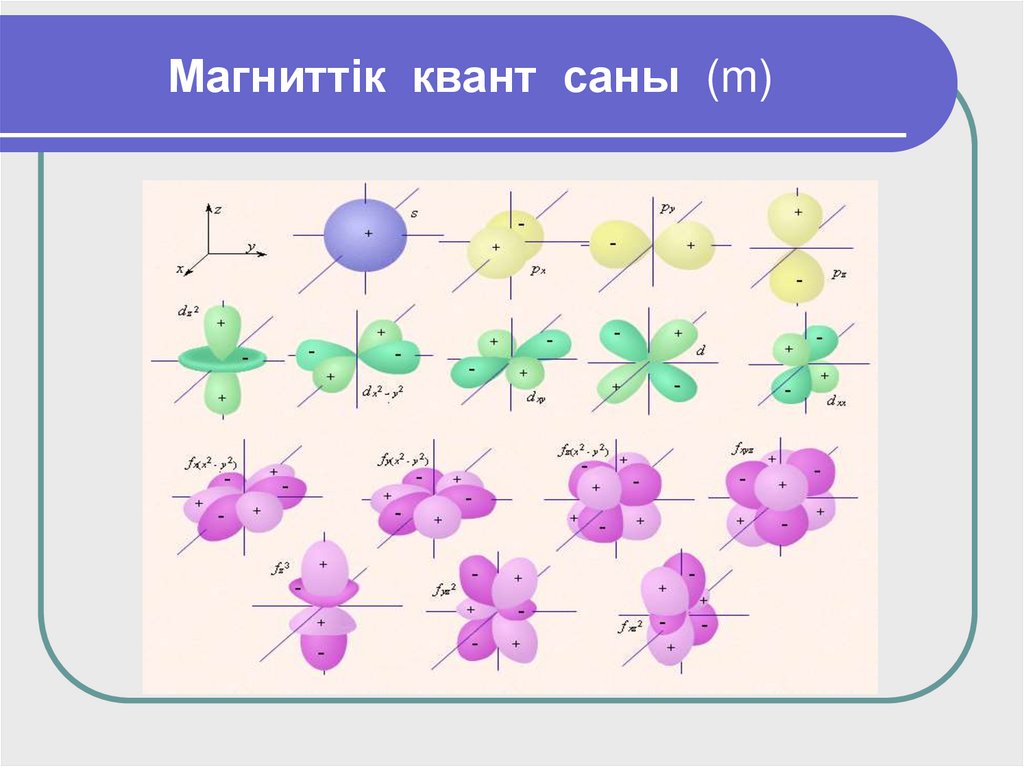
17. Магниттік квант саны (m)
Магнит квант (quantum лат. сөзі – затмөлшері, масса) саны (m) электрон
бұлттарының кеңістікте орналасу бағытын
анықтайды, - l дан + l дейінгі барлық
мәндерге ие. Деңгейшелер ұяшықтарға
бөлінеді.
m=2l+1
формуласымен анықталады.
18. Магниттік квант саны (m)
19. Cпин квант саны (ms)
20. Негізгі заңдылықтар Хунд ережесі
НЕГІЗГІ ЗАҢДЫЛЫҚТАРХунд ережесі
Барлық атомдық орбитальдар (АО)
алдымен мүмкіндігінше бір электронмен,
сосын екіншісі жүйенің спині максимальды
болуы үшін толтырылады. Демек, берілген
орбитальдағы электрондардың спин
сандарының қосындысы максималь болуы
шарт.
21. Клечковский І ережесі
Атомдық орбиталдар (АО) электрон толтырылуыбас және қосымша квант сандары қосындысының өсу
ретімен толтырылады. (n+ l).
Мысалы: Электрон 4p деңгейшеден кейін қай деңгейшеде
толтырылады: 4d немесе 5s?
4 p толтырылған
4 p толтырылған
4d
5s
n+l=4+2=6
n+l=5+0=5
4p кейін 5s толтырылады, 4d толтырылмайды
22. Клечковский ІІ ережесі
Егер n+ l қосындысы тең болса, электрон nмәні аз орбитальға толтырылады. Мысалы: 4s
кейін электрон қай деңгейшеге толтырылады: 3d
немесе 4p?
3d
4p
n+ l = 3 + 2 = 5
n+ l = 4 + 1 = 5
n+ l қосындысы тең, электрон толтырылуы 4p
емес 3d, себебі 3d-де n мәні аз.
23. Ең аз энергия ережесі
Орбиталь электронмен толтырылған кезде,алдымен энергиясы аз орбиталь толтырылады.
Энергетикалық деңгейшелердің қатары:
1s < 2 s < 2p < 3 s < 3 p < 4 s ≈ 3d < 4p < 5s ≈ 4d <
5p < 6s ≈ 5d < 4f < 6p <7s ≈ 6d ≈ 5f < 7p...
Берілген қатар бойынша алдымен 1s, одан
соң 2s деңгей т.с.с.
24. Паули принципі
Атомда төрт квант сандарының мәні бірдейекі электрон болуы мүмкін емес. Егер екі
электронның n, l, ml мәндері бірдей болса, онда
бұл 2 электрон қарама-қарсы спинді болады.
25. БАРИДІҢ АТОМ ҚҰРЫЛЫСЫ СИПАТТАМАСЫ
Алтыншы периодта, екінші негізгі топшада орналасқан.Реттік саны (56); Ядро заряды (+56); Электрон саны (е= –56);
Протон саны (р = +56); Нейтрон саны (n=137-56 =81)
Энергетикалық деңгей cаны 6;
Салыстырмалы атомдық массасы = 137.
Атомдық құрылысы:
1
2
3
4
5
6
Вa +56 ) )
)
)
)
)
-2 -8 -18 -18 -8 -2
электрондық конфигурациясын жазсақ,
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 6s2;
26. Иондық байланыс
Иондықбайланыс электротерістілік (ЭТ) мәні
айырмашылығы
жоғары
атомдар
арасында
туындайды: бір атом оң зарядталады (+), келесі атом
теріс зарядталады (-), электрондық жұп бір атомнан
екіншісіне көбірек ығысады.
Иондық
байланыс
түзілу
механизміне
мысал:
2Na0 + Cl20 = 2 Na+Cl─
2Na0 ─ 2e- = 2 Na+
Cl20 + 2e = 2Cl─
27. Коваленттік байланыс
Коваленттік байланыс бір немесе бірнеше электронжұптары арқылы түзілетін химиялық байланыс.
Егер коваленттік байланыс біртекті екі атомды
молекула арасында болса,(H2, J2 ), онда мұндай
байланыс- полюссіз ковалентті байланыс деп аталады.
Мысалы:
H . + . H= H : H
Әртүрлі атомдар арасындағы коваленттік байланысты
полюсті ковалентті байланыс деп атайды. Бұл жағдайда
электрон жұбы электр терістігі жоғары атомға қарай
ығысады. Мысалы:
28. Донорлық- акцепторлық байланыс
Бір атомның қос электронды орбиталі (донор) екіншіатомның бос орбиталімен (акцептор) бүркескенде
түзілетін коваленттік байланыс донорлы-акцепторлы
байланыс деп аталады. Мысалы: NH3+HOH=NH4OH
29. Сутектік байланыс
атомы және электротерістілігі жоғарыэлемент атомдары арасындағы байланыс.
Na0
Cутегі
Н-F…H-F …
30. Бақылау сұрақтары:
1.2.
3.
4.
Атом құрылысы;
Квант сандары;
28, 38, 48, 58, 68, 78, 88, 98, 108 элементтердің атом
құрылыстарын, электрондық конфигурацияларын
жазыңдар.
Заңдар;
31. Ұсынылатын әдебиеттер:
1.Бірімжанов Б. Нұрахметов Жалпы химия.- Алматы, 2012.
2.
Глинка Н.Л. Общая химия. -Л., 2005.
3.
Ахметов Н.С. Неорганическая химия. – М., 2006.
4.
Некрасов Б.В. Учебник общей химии. – М. 2012.
5.
Глинка Н.Л. Задачи и упражнения по общей химии. – Л., 2007.
6.
Коровин Н.В. Лабораторные работы по химии. – М., 2011. – 256 с.
7.
Жакупова А.С. Жалпы химия бойынша практикум, К: ҚарМТУ-2015 ж.
8.
Угай Я.А. Общая и неорганическая химия. – М., 2006. – 528 с.
9.
Паничев С.А. Химия. Основные понятия и термины. – М., 2008. – 544 с.
10. Химия. Справочное издание. – М., 2010. – 648 с.