Similar presentations:
Атомдағы электрондар. Электрондардың атомда орналасуы (бірінші 20 элемент үшін)
1.
Атомдағы электрондар.Электрондардың атомда
орналасуы
(бірінші 20 элемент үшін)
2.
Оқу мақсаттары:- бірінші 20 элементтің электрондар санын
атай білу
- атомдағы электрондардың ядродан
арақашықтықтары алыстай түсетін
орбитальдар бойында орналасатындығын
түсіну
- әрбір электрондық қабат белгілі электрон
сиымдылығына ие екендігін түсіну
- меңгерілген білімдерді электрондардың
электрондық қабаттарда орналасуының
модельдерін салу үшін қолдану
3.
Қайталау сұрақтары• Атом деген не?
• Атом құрылысын сипаттаңыздар.
• Протон деген не?
• Нейтрон жайлы не білесіздер?
• Электронның массасы, заряды,
атомдағы орналасуы жайлы баяндап
беріңіздер.
• Атомдағы электрондар санын қалай
анықтауға болады?
4.
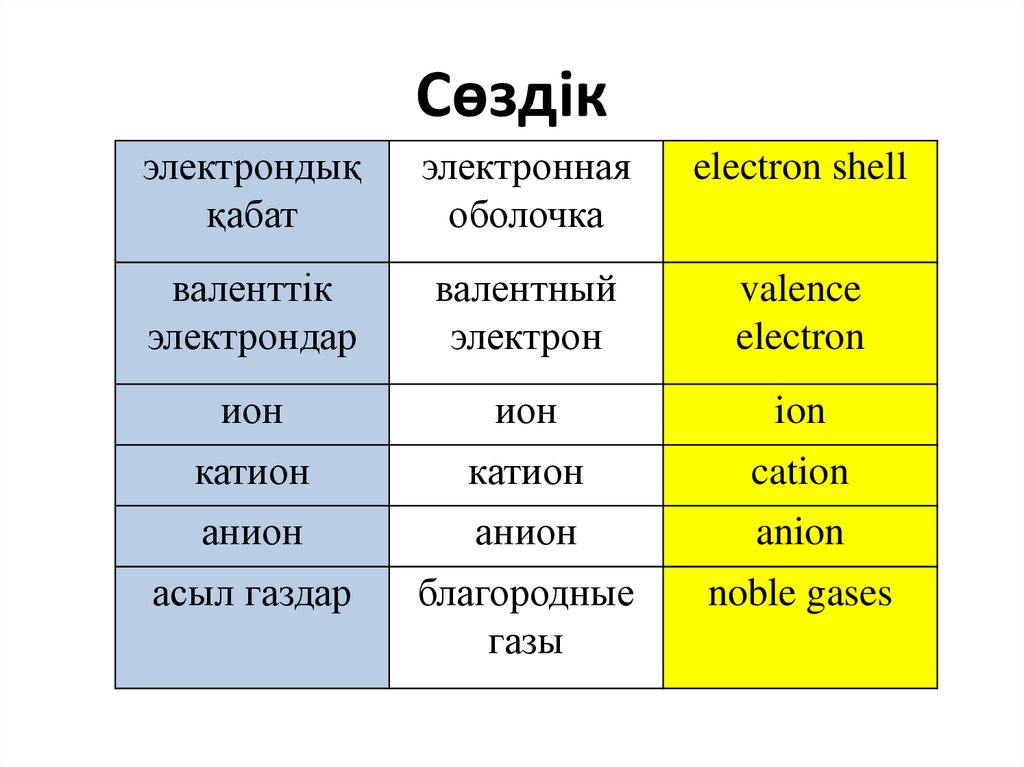
Сөздікэлектрондық
қабат
электронная
оболочка
electron shell
валенттік
электрондар
валентный
электрон
valence
electron
ион
ион
ion
катион
катион
cation
анион
анион
anion
асыл газдар
благородные
газы
noble gases
5.
Атом деген не?https://twig-bilim.kz/kz/film/what-is-an-atom
6.
• Атом – күрделі бөлшек.• Оның ортасында оң зарядты ядро
орналасқан, ал оны теріс зарядты
электрондар айналып қозғалып жүреді.
• Электрон ең кіші теріс зарядқа ие, оның
шартты шамасы -1-ге тең. Электрондар
саны элементтің ядро зарядына тең, ал ядро
заряды элементтің реттік нөміріне сәйкес
келеді.
• Химиялық элементті сипаттайтын және
қасиеттерін айқындайтын атомның ядро
зарядының мөлшері болып табылады.
7.
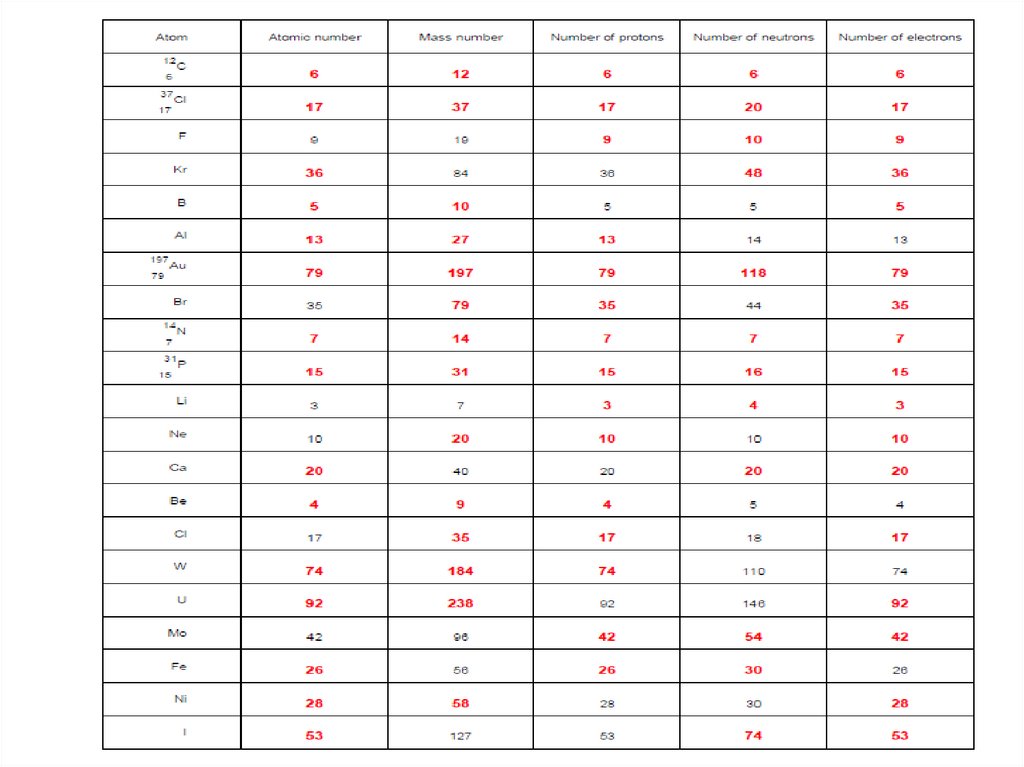
«Атом құрылысы» тапсырма8.
9.
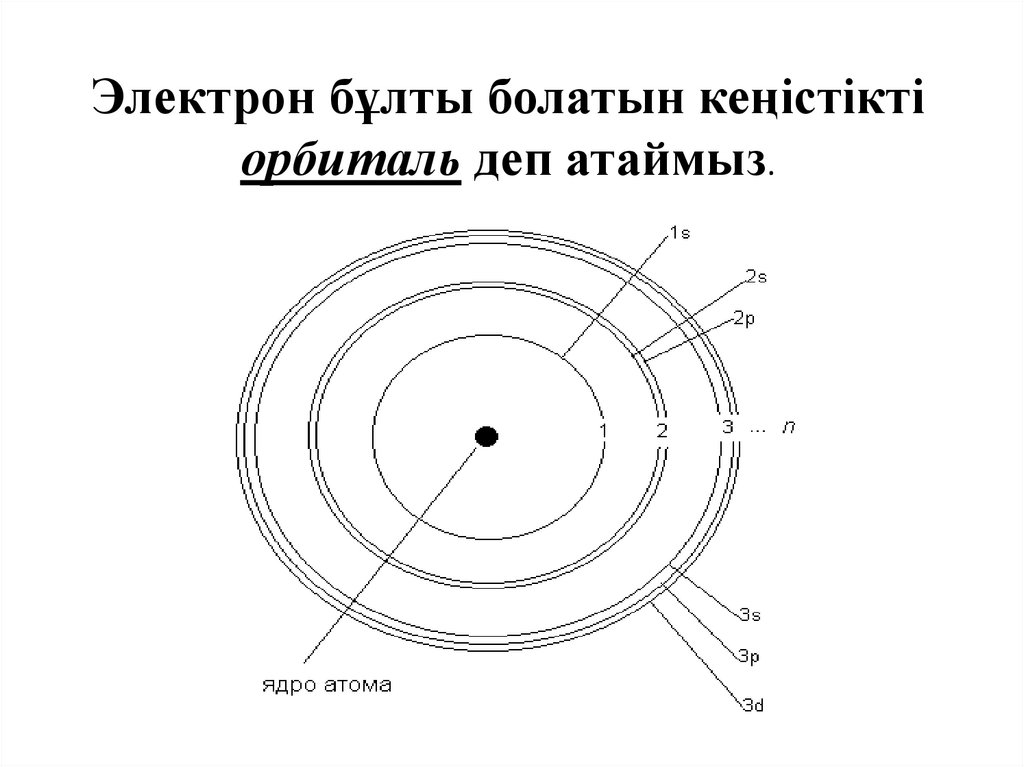
Электрондық бұлтАтомдағы электрондар
қозғалысының траекториясы
белгісіз, электрондар болу
ықтималдығын – электрондық
бұлт , ядро маңындағы
электронның болу
ықтималдығы 90 % жоғары
кеңістікті орбиталь деп атайды.
10.
Электрондық қабатдеп бір энергетикалық
деңгейдегі
электрондардың
жиынтығын айтады.
11.
«Электрондық қабат»• https://twig-bilim.kz/kz/film/atom-structureelectron-shells
12.
Электрондарядроның
айналасында,
электрондық қабат деп те аталатын,
белгілі бір энергетикалық деңгейлерде
жоғары жылдамдықпен қозғалады. Жеке
деңгейшелер электрондардың шектелген
және нақты анықталған санына ие бола
алады.
Атомның
энергетикалық
деңгейлерінде
энергиясы
жуық
электрондар
орналасады.
Атомдағы
электрон қабатының саны период нөміріне
сәйкес келеді.
13.
ТапсырмаМына элементтерді электрон қабат саны
қанша?
He,Be, Si, Ca
14.
He – 1 себебі периодтық кестедебірінші периодта орналасқан
Be – 2 себебі периодтық кестеде
екінші периодта орналасқан
Si – 3 себебі периодтық кестеде
үшінші периодта орналасқан
Ca – 4 себебі периодтық кестеде
төртінші периодта орналасқан
15.
Электрон бұлты болатын кеңістіктіорбиталь деп атаймыз.
16.
Электрондық қауыз• Атомның барлық электрондары жиналып
электрондық қауызын құрайды.
• Өзара энергиясы жуық электрондар атомның
электрондық қабатын түзеді.
• Электрондық қабаттар рет нөміріне қарай
1,2,3,4… деп белгіленеді.
• Әр қабаттағы орбитальдардың өзіндік энергиясы
мен пішіндері болады.
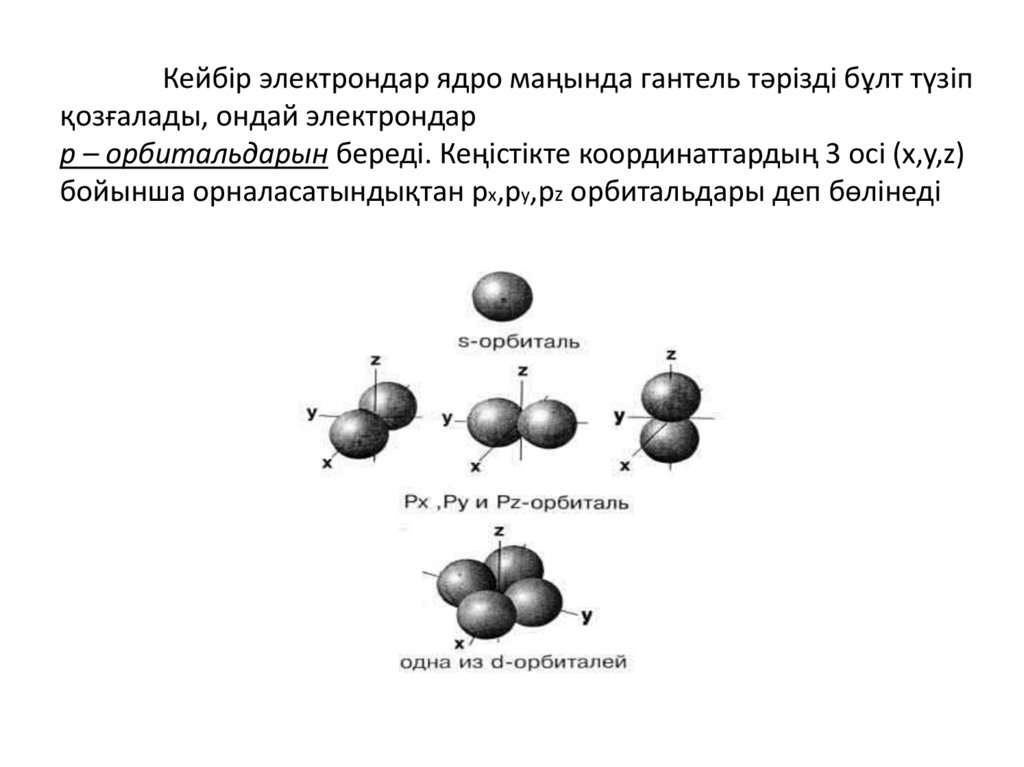
• Шар тәрізді электрон бұлтын s-электрондар деп,
ал орбитальдарды s-орбиталь д.а.
17.
Кейбір электрондар ядро маңында гантель тәрізді бұлт түзіпқозғалады, ондай электрондар
p – орбитальдарын береді. Кеңістікте координаттардың 3 осі (x,y,z)
бойынша орналасатындықтан рx,рy,рz орбитальдары деп бөлінеді
18.
Электрондар өздерінің энергияларына сай ядроныбелгілі бір ара қашықтықта айналып жүреді, мұны
энергетикалық деңгей деп атайды
Ағылшын және
орыс тілді
оқулықтарда
энергетикалық
деңгейді латын
әріптерімен
белгілейтін
нұсқасы
кездеседі
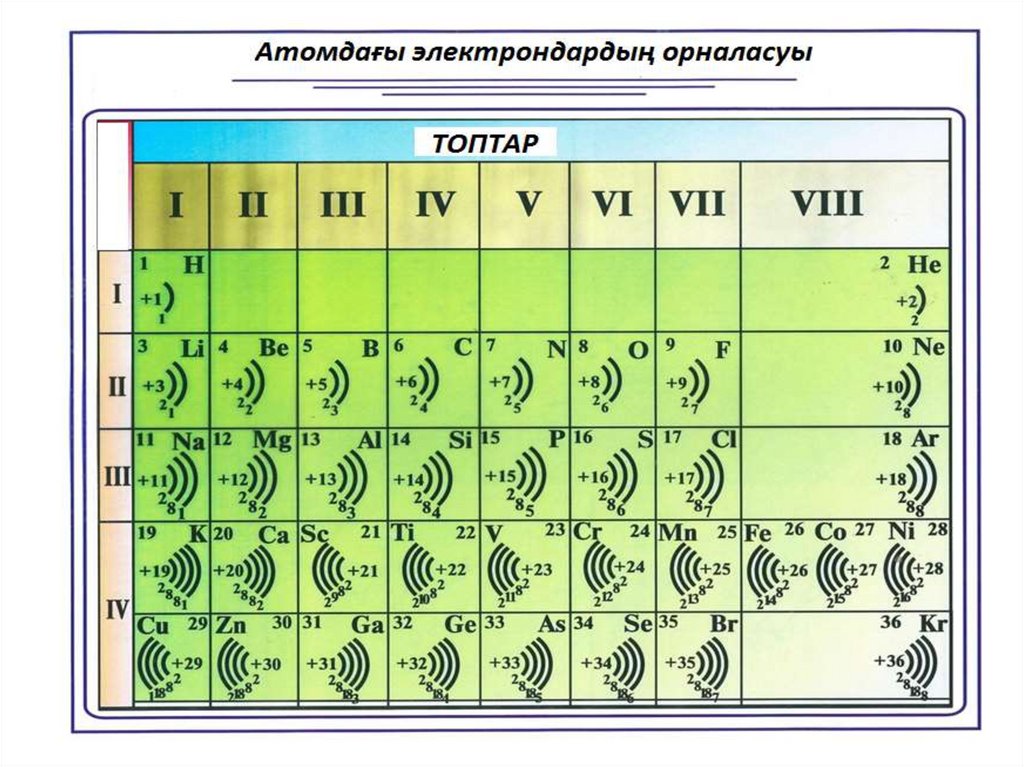
Энергетикалық деңгей саны период нөмірімен анықталады, яғни период
санына тең болады
19.
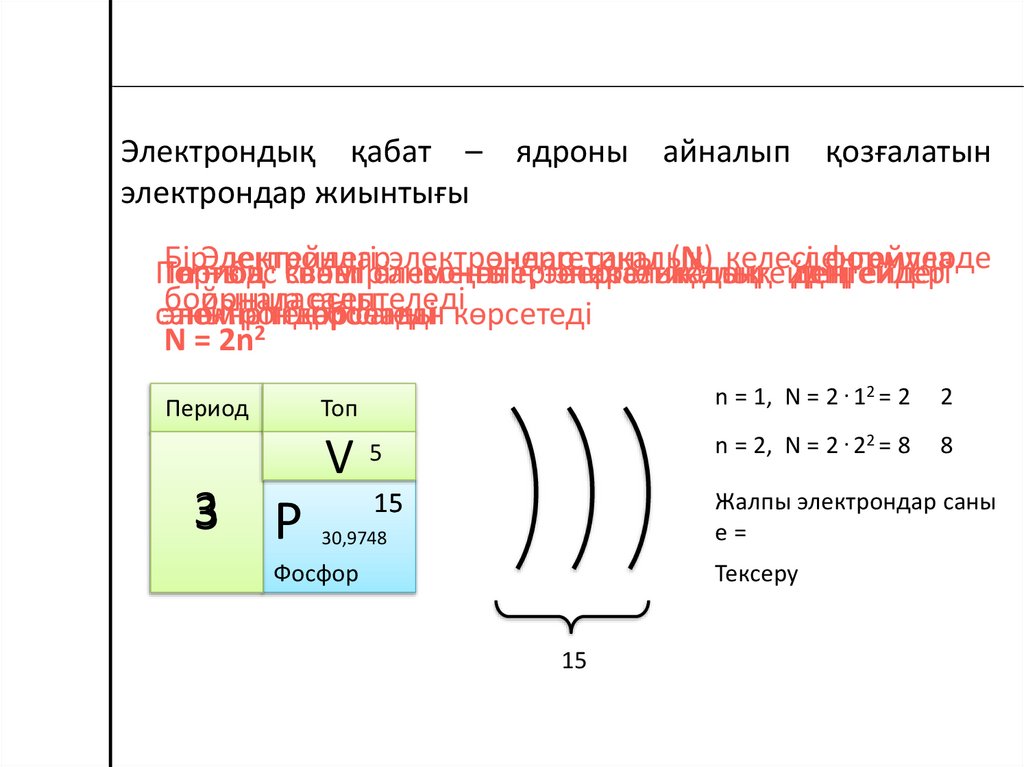
Электрондық қабат – ядроны айналып қозғалатынэлектрондар жиынтығы
Бір
электрондар
энергетикалық
саны (N)деңгейдің
келесі
деңгейлерде
формула
Период
Топтың
n Электрондар
–деңгейдегі
бас саны
квант
нөмірі
саны
элементтің
соңғы
– энергетикалық
энергетикалық
энергетикалық
деңгейлер
деңгейдегі
бойынша
орналасады
есептеледі
санына
электрондар
нөмірін
тең
көрсетеді
болады
санын көрсетеді
2
N = 2n
Период
2
5
n = 2, N = 2 . 22 = 8
8
15
Жалпы электрондар саны
е=
Топ
V
3
n = 1, N = 2 . 12 = 2
Р
30,9748
Тексеру
Фосфор
15
20.
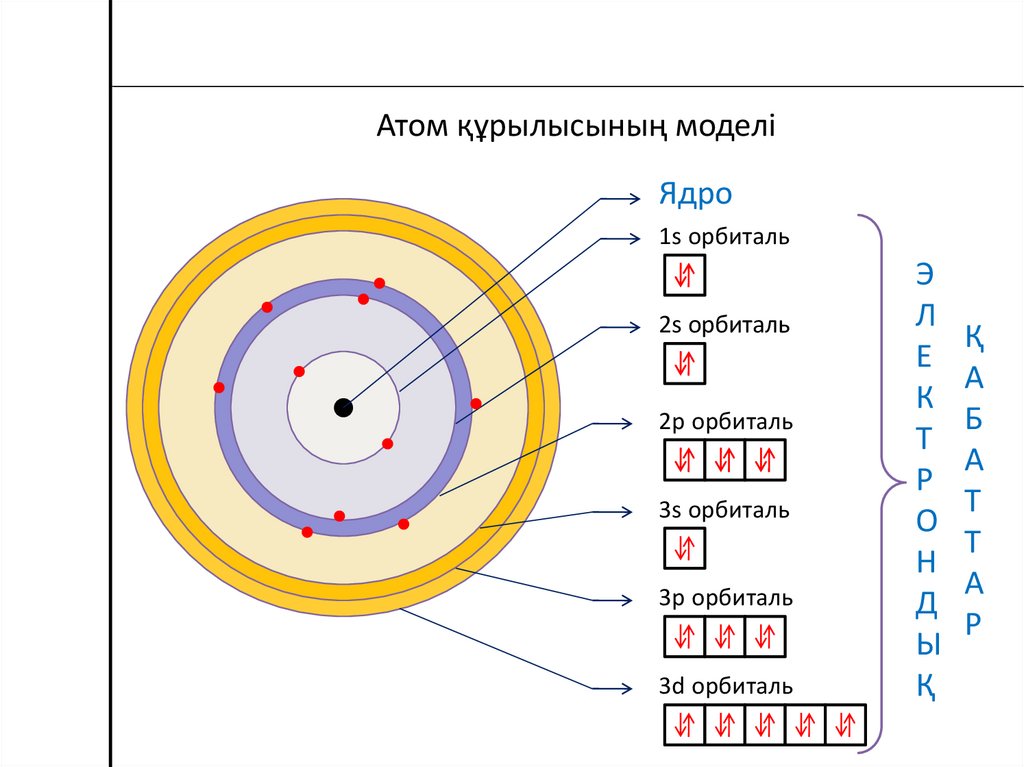
Атом құрылысының моделіЯдро
1s орбиталь
2s орбиталь
2p орбиталь
3s орбиталь
3p орбиталь
3d орбиталь
Э
Л
Қ
Е
А
К
Б
Т
А
Р
Т
О
Т
Н
А
Д
Р
Ы
Қ
21.
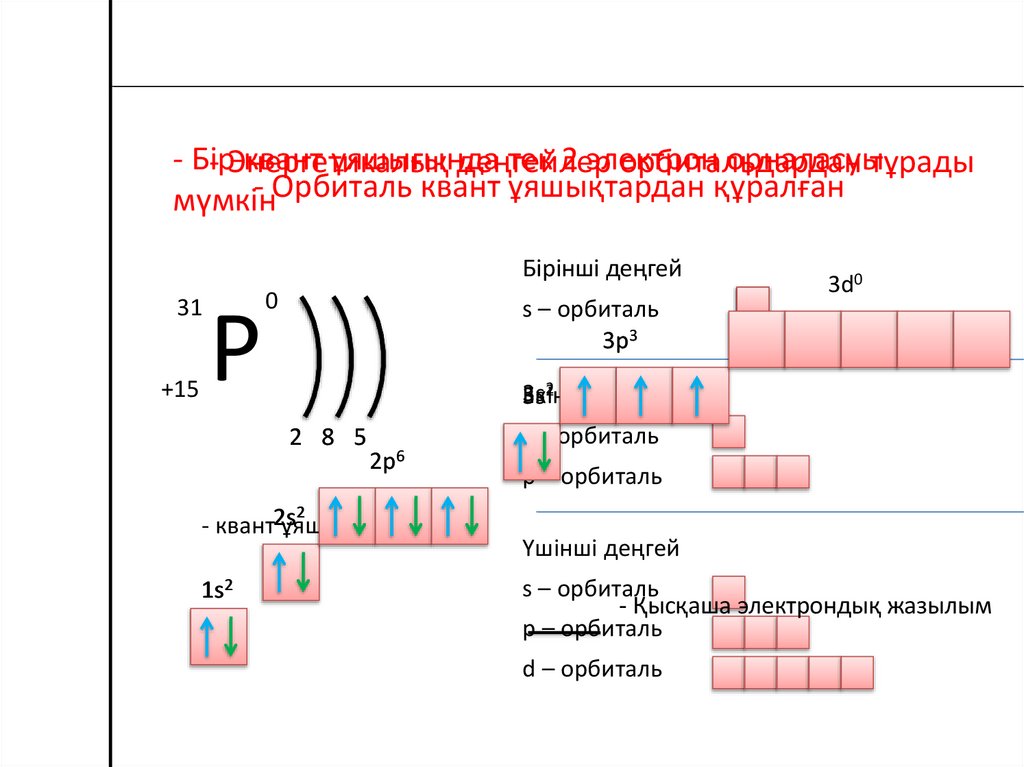
- Бірквант ұяшығында
тек 2 электрон
орналасуытұрады
- Энергетикалық
деңгейлер
орбитальдардан
- Орбиталь квант ұяшықтардан құралған
мүмкін
Бірінші деңгей
31
+15
Р
0
s – орбиталь
3p3
2
3s
Екінші
еңгей
2 8 5
2
- квант2s
ұяшығы
1s2
3d0
2p6
s – орбиталь
p – орбиталь
Үшінші деңгей
s – орбиталь
- Қысқаша электрондық жазылым
p – орбиталь
d – орбиталь
22.
• Периодтың нөмірі - энергетикалықдеңгейлер (электрондық қабат)
санына тең
• Бір
энергетикалық
деңгейдегі
максималды электрондар саны
N = 2n2
• Топтың нөмірі – сыртқы
энергетикалық деңгейдегі
электрондар саны
23.
ТапсырмаТаңдап алған элементтеріңіздің
электрондық қабатты көрсете отырып,
атом үлгілерінің сызбаларын
салуыңыздар
Li,Na,K,Ca,Be,B,F,O,N,C,Si,P,Mg,S,
Al, He,Ne,CI,Ar,H
24.
25.
Металдық және бейметалдыққасиеттер
• Периодтар мен топтарда металдық және
бейметалдық қасиеттердің периодты түрде
өзгереді.
• Жоғарыдан төменге қарай – металдық
қасиет артады; бейметалдық қасиет кемиді.
• Солдан оңға қарай – металдық қасиет
кеміп, бейметалдық қасиет артады.
26.
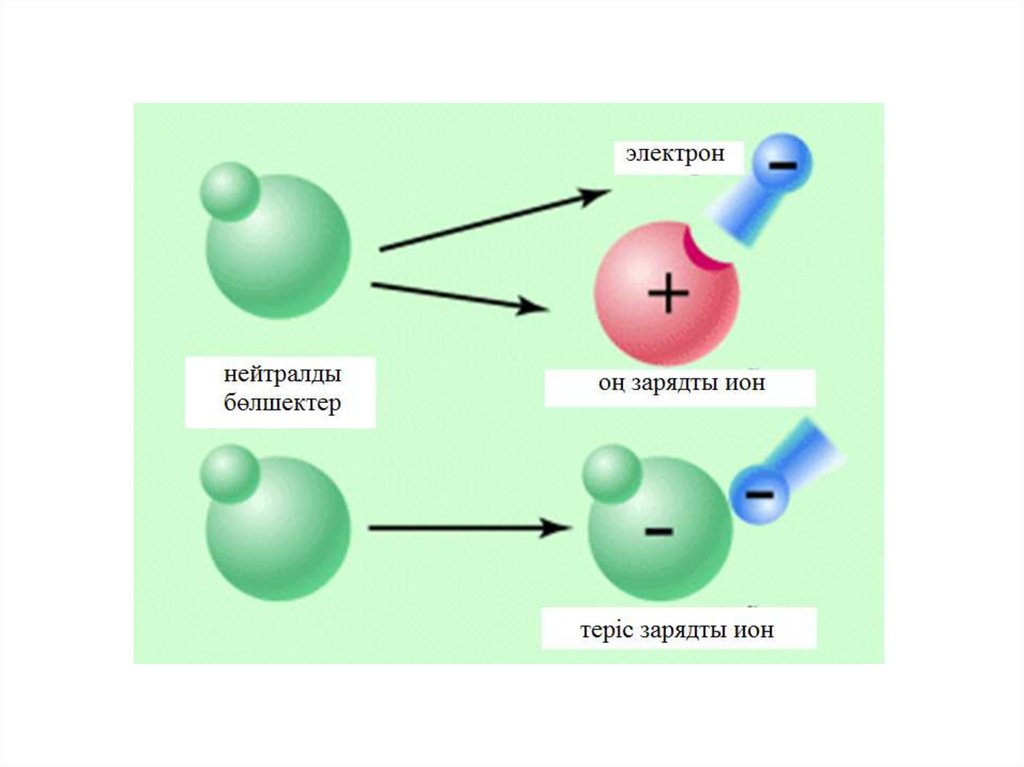
Атомдар инертті газдардың конфигурациясына ие болыптұрақтану үшін сыртқы қабаттағы электрондардарын беріп
жіберіп немес соның үстіне қосып алып иондар түзеді.
Иондар дегеніміз электронды қосып алу немесе беріп
жіберу нәтижесінде пайда болған зарядталған бөлшектер.
Сыртқы қабаттағы электрон саны аз болып , атом радиусы
үлкен болатын болса , онда элемент сыртқы қабаттағы
электронын беріп оң зарядты ионға айналады.
Сыртқы қабаттағы электрон саны көп болып , атом
радиусы кішкентай болатын болса , онда элемент сыртқы
қабатына электронды қосып алып теріс зарядты ионға
айналады.
Ортада 4-ші топта тұрған элементтер беріп жіберуге
немесе қосып алуға да бейім
27.
28.
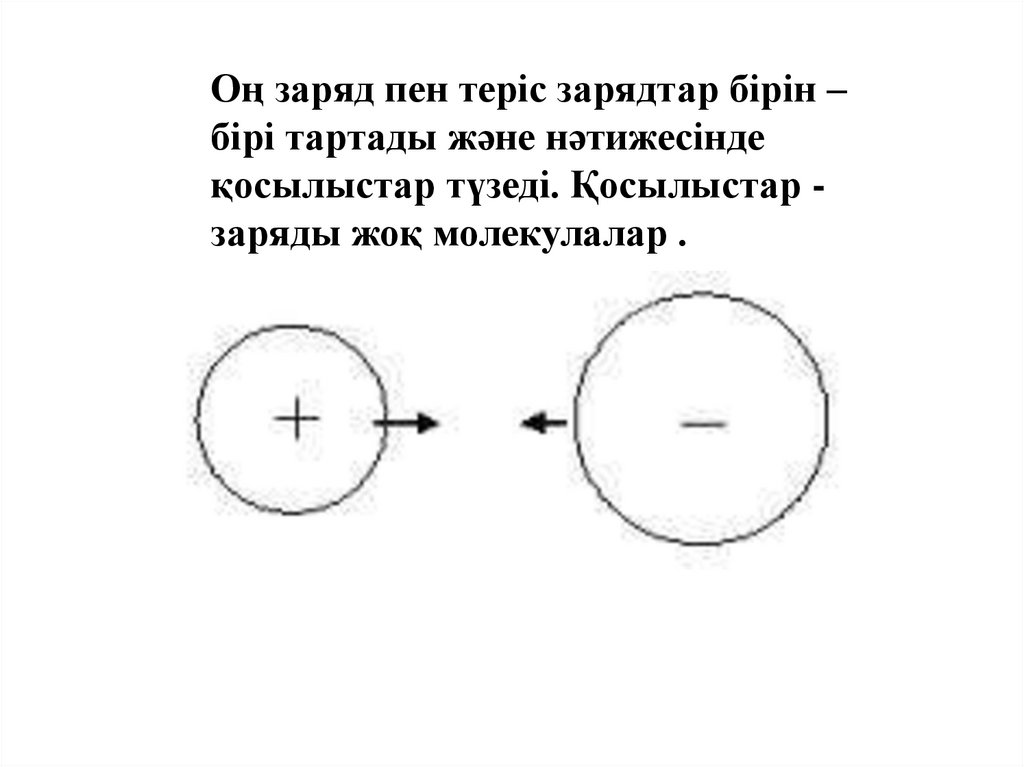
Оң заряд пен теріс зарядтар бірін –бірі тартады және нәтижесінде
қосылыстар түзеді. Қосылыстар заряды жоқ молекулалар .
29.
ВидеоИондар түзілуі
• https://www.youtube.com/watch?v=7BF4prQ
Uymk
30.
Төрт электронмен алмасу –максималды болып табылады
31.
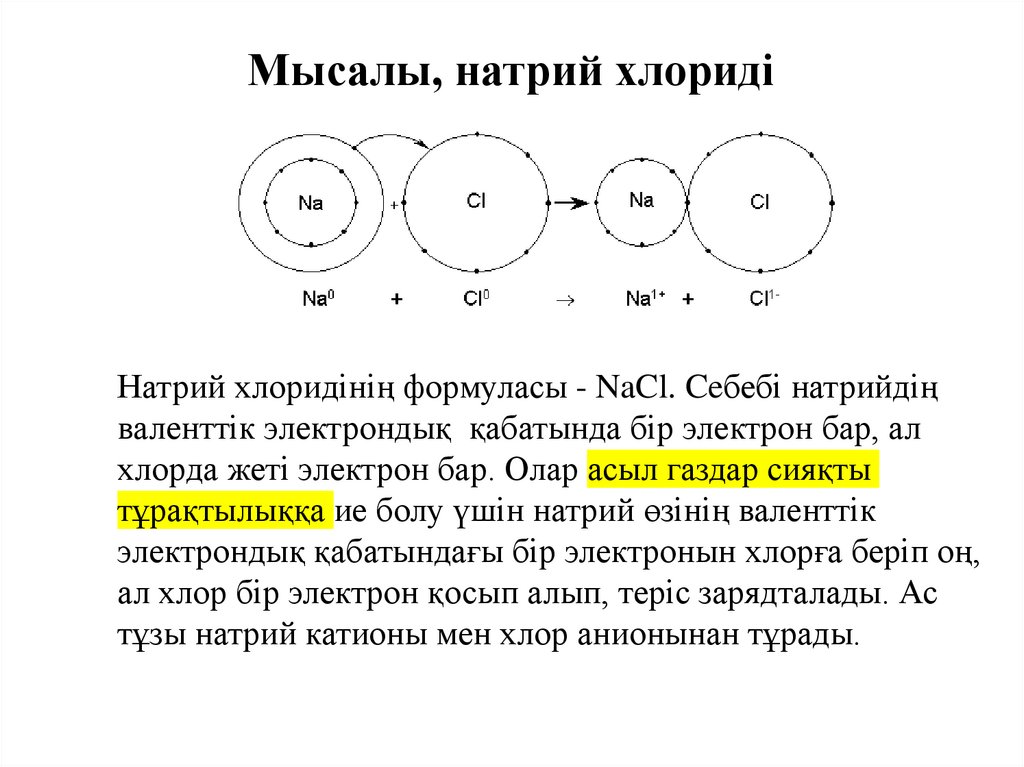
Мысалы, натрий хлоридіНатрий хлоридінің формуласы - NaCl. Ceбебі натрийдің
валенттік электрондық қабатында бір электрон бар, ал
хлорда жеті электрон бар. Олар асыл газдар сияқты
тұрақтылыққа ие болу үшін натрий өзінің валенттік
электрондық қабатындағы бір электронын хлорға беріп оң,
ал хлор бір электрон қосып алып, теріс зарядталады. Ас
тұзы натрий катионы мен хлор анионынан тұрады.
32.
Асыл газдар• https://bilimland.kz/ru/courses/chemistryru/neorganicheskaya-ximiya/ehlementy-i-ixsoedineniya/lesson/inertnye-gazy
33.
Заттардың формуласын құрастыру алгоритміБинарлы заттардың формулаларын құрастыру:
1.Затты құрайтын элементтердің таңбаларын бір қатарға жазамыз: мысалы,
NaO
+
2-
2.Химиялық элементтердің жоғары жағына ион зарядын қоямыз : NaO
3. Ион зарядының кіші ортақ еселігін табамыз: 2
4. Ең кіші ортақ еселігін элементтердің ион зарядтарына бөліп, индекстерін
табамыз:
+
2-
NaO
2: 1 =2 (Na)
2: 2 =1 (О)
формула – Na2O.
34.
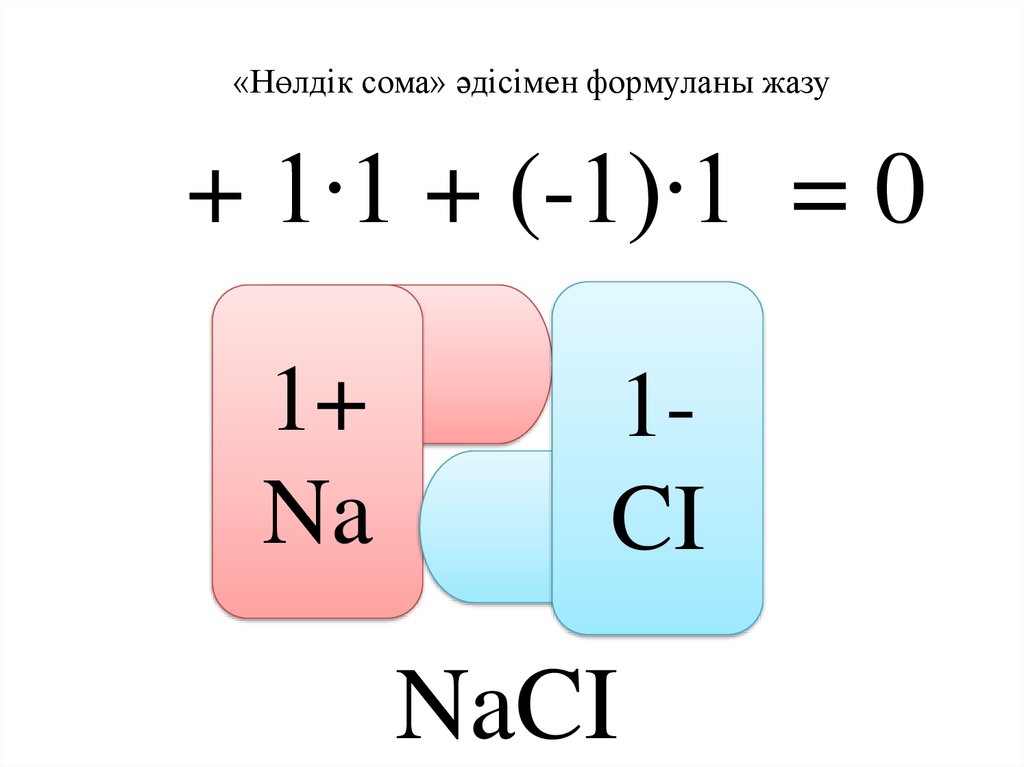
«Нөлдік сома» әдісімен формуланы жазу+ 1∙1 + (-1)∙1 = 0
1+
Na
1CI
NaCI
35.
Тұрмыста кездесетін заттардыңформулалары
36.
NaClас тұзы
37.
су38.
С12Н22О1139.
Көмірқышқыл газы40.
ҚұмSiO2
41.
(C6H10O5)n42.
Негізгі терминдерХимиялық формула – химиялық жеке заттар
молекуласының құрамын химиялық таңба және сан
арқылы белгілеу. Химиялық формула молекуланың
сапалық және сандық құрамын көрсетеді.
Индекс – зат формуласындағы химиялық элемент
атомдарының саны
Коэффициент – теңдеудегі заттың алдына қойылатын
және молекулалар санын көрсететін сан
Мысалы:
коэффициент
химиялық таңба
2О2
индекс
43.
ТексеруКелесі заттардың химиялық формулаларын
құрастырып, нөлдік сома әдісімен тексеру
өткізіңіздер
CxOy
SixOy
CaxNy
44.
Біріншіқосынды Al O
45.
Екіншіқосынды –
NaH
46.
Үшіншіқосынды –
CaN
47.
Төртіншіқосынды –
HS
48.
Бесіншіқосынды –
LiN
49.
Алтыншықосынды –
SiO
50.
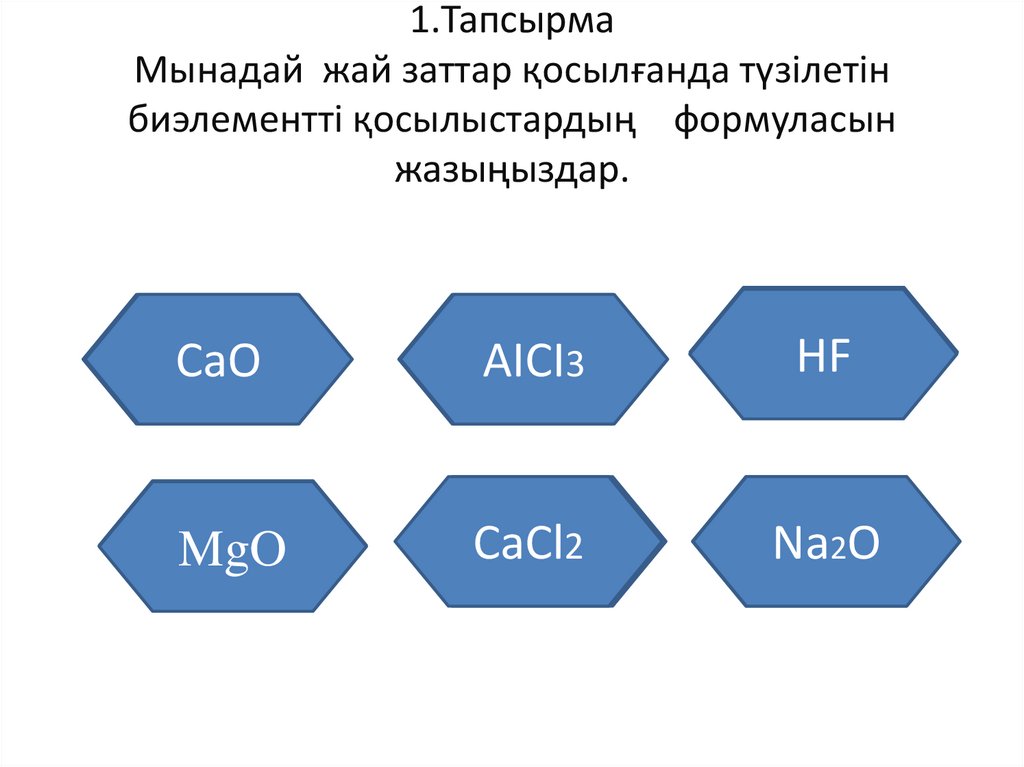
1.ТапсырмаМынадай жай заттар қосылғанда түзілетін
биэлементті қосылыстардың формуласын
жазыңыздар.
Кальций
мен оттек
СаО
Алюминий
3
мен хлор
АІСІ
Сутек пен
фтор
Магний мен
оттек
Кальций
2
мен хлор
Натрий мен
2
оттек
MgO
СаCl
НF
Nа О
51.
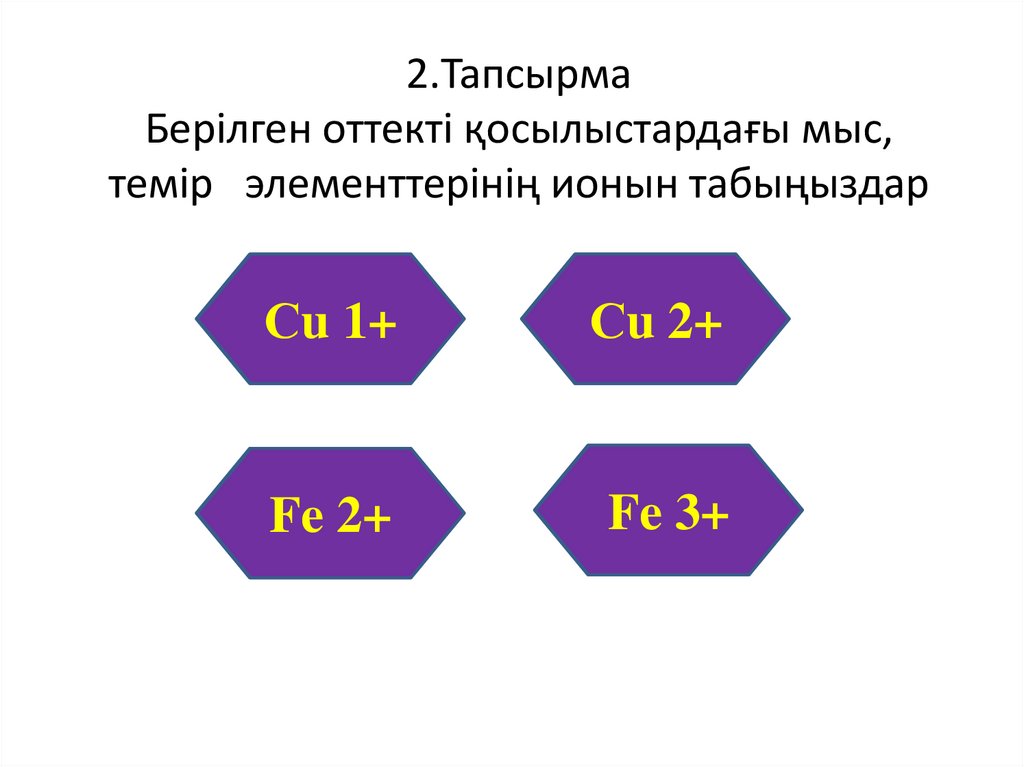
2.ТапсырмаБерілген оттекті қосылыстардағы мыс,
темір элементтерінің ионын табыңыздар
Сu
Сu21+
O
Сu
СuO
2+
Fe
FeO
2+
Fe23+
O3
52.
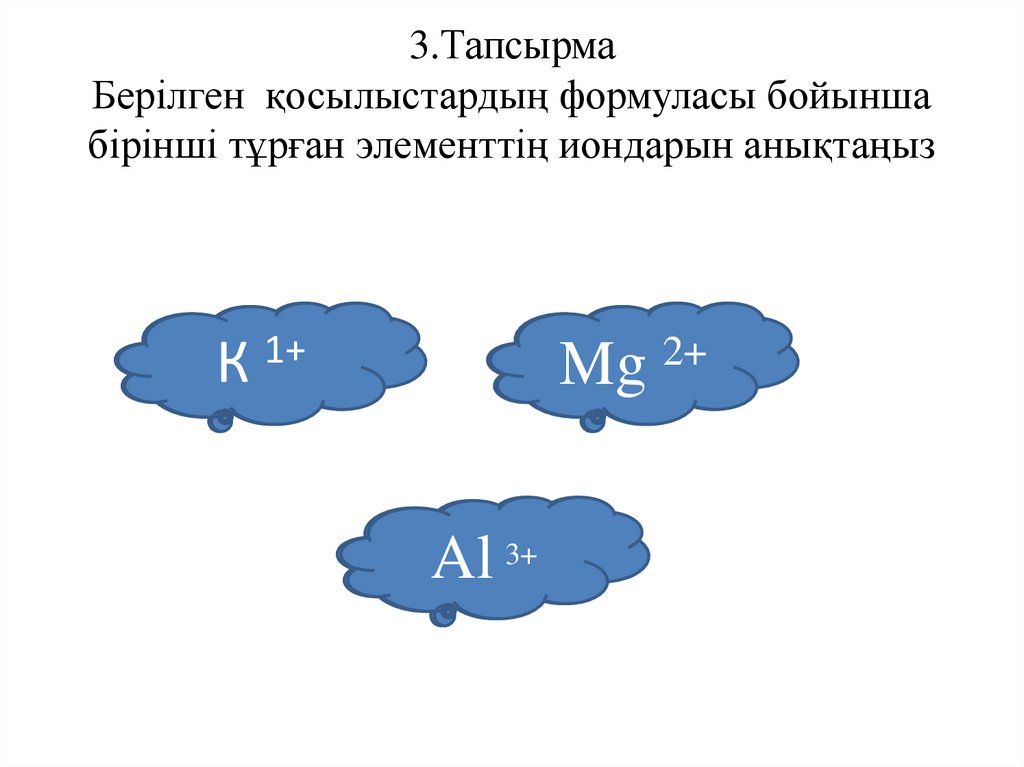
3.ТапсырмаБерілген қосылыстардың формуласы бойынша
бірінші тұрған элементтің иондарын анықтаңыз
1+
К
КСІ
MgСІ
Mg 2+2
Al
Al2S3+3
53.
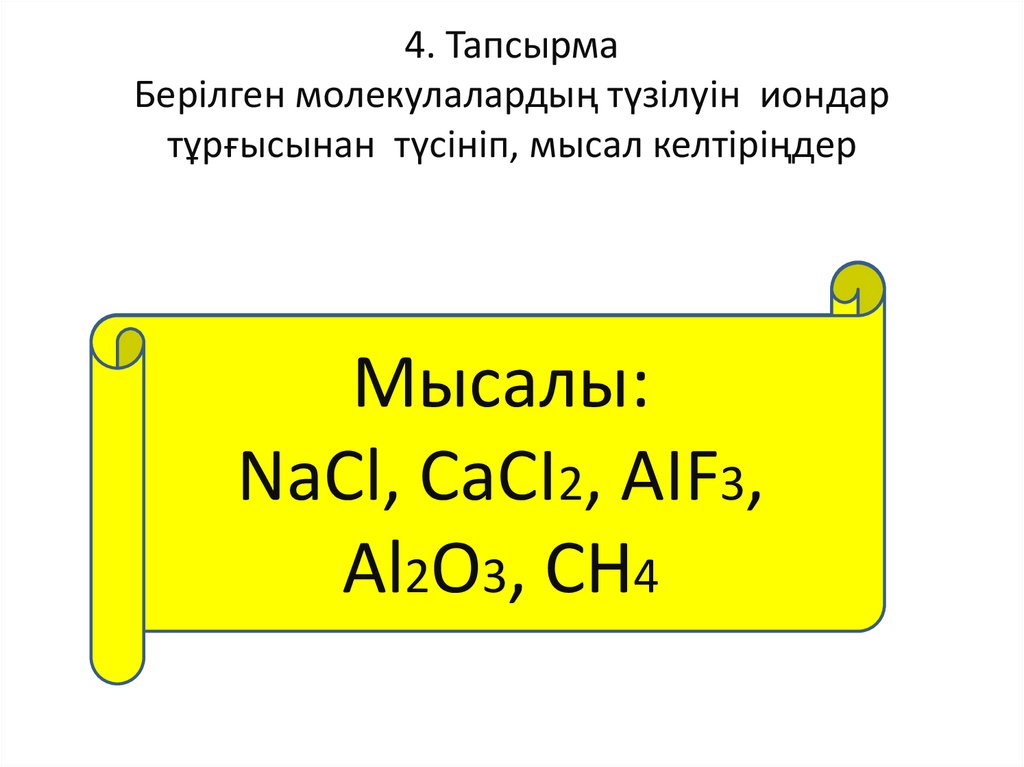
4. ТапсырмаБерілген молекулалардың түзілуін иондар
тұрғысынан түсініп, мысал келтіріңдер
Мысалы:
АВ, АВ2, АВ3, А2В3,
NaCl, СаСІ2, АІF3,
АВ4
Аl2O3, CH4
54.
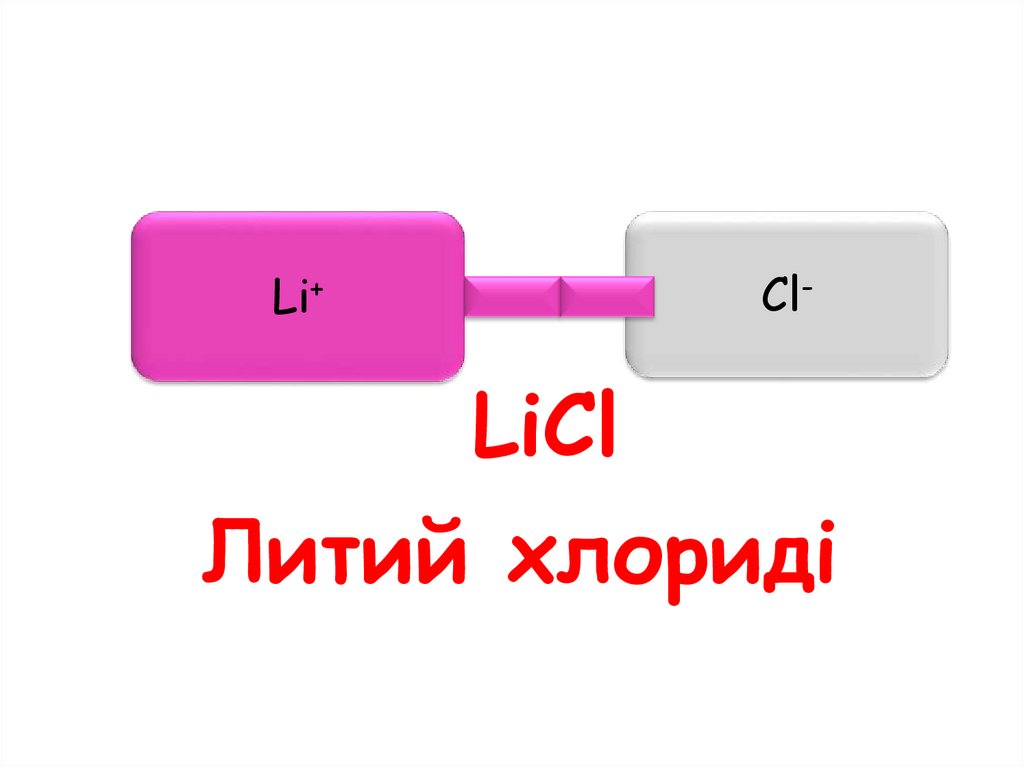
Li+Cl-
LiCl
Литий хлориді
55.
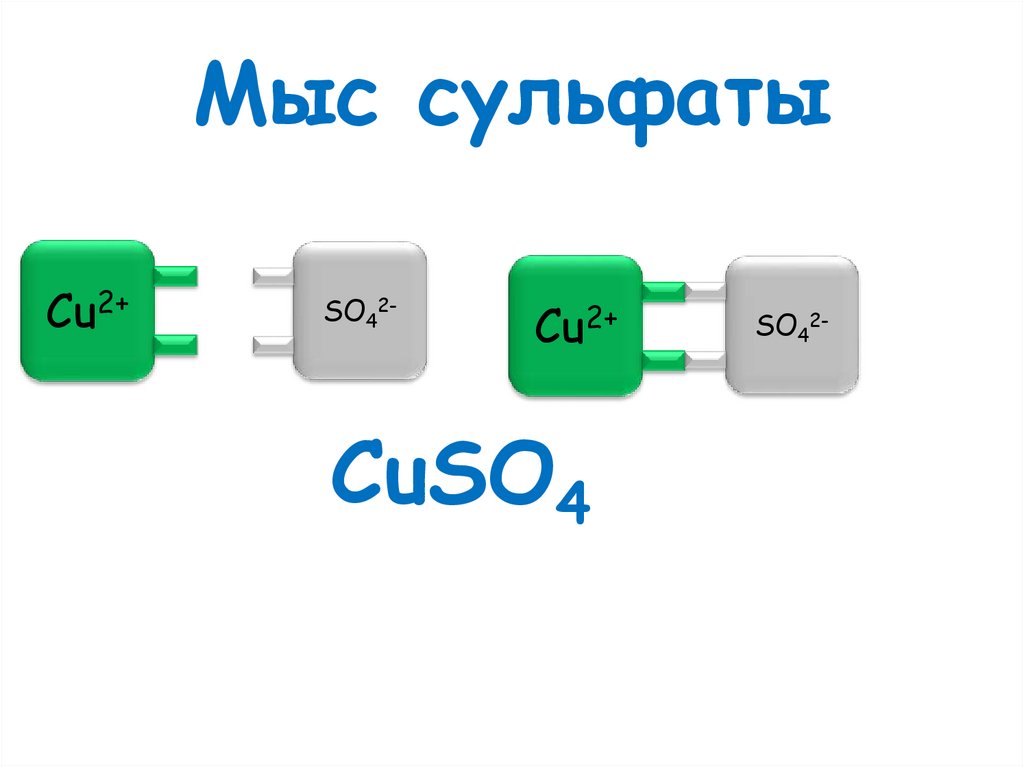
Мыс сульфатыCu2+
SO42-
Cu2+
CuSO4
SO42-
56.
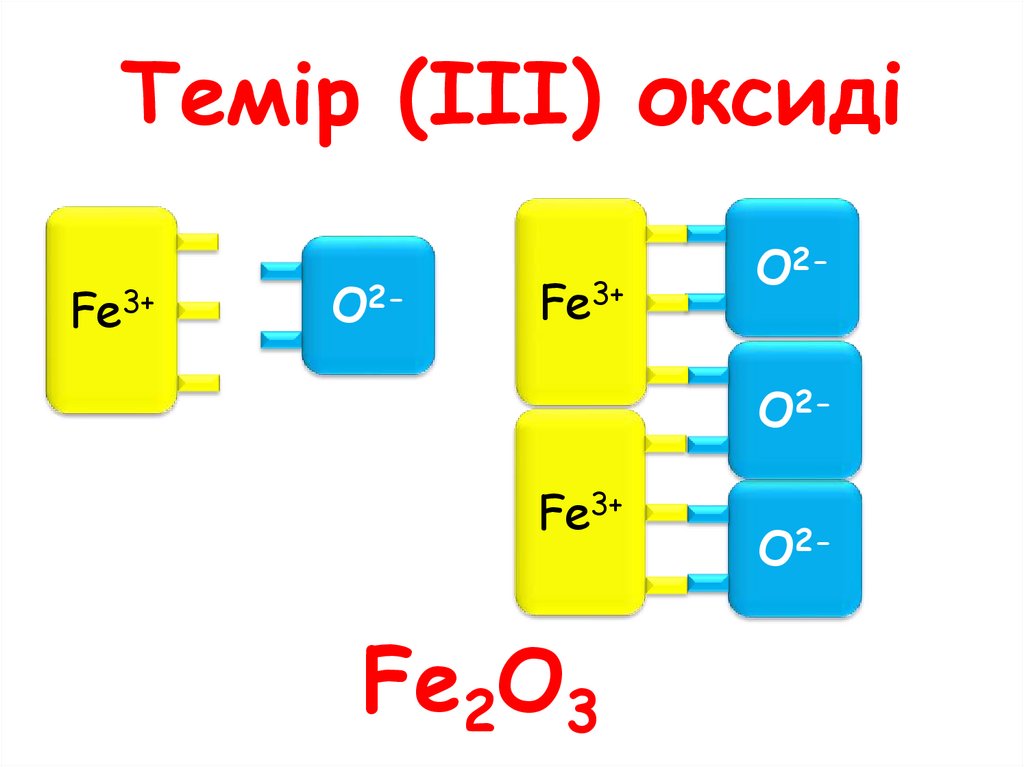
Темір (ІІІ) оксидіFe3+
O2-
Fe3+
O2O2-
Fe3+
Fe2O3
O2-
57.
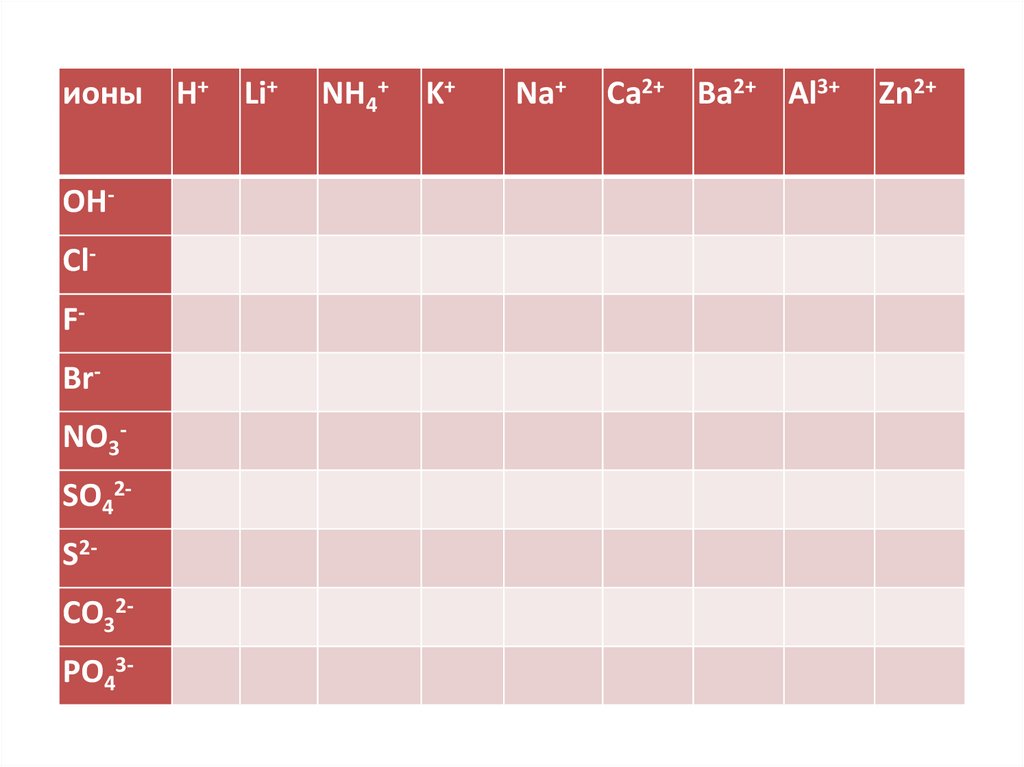
ионы Н+OHClFBrNO3SO42S2CO32PO43-
Li+
NH4+
K+
Na+
Ca2+ Ba2+ Al3+
Zn2+
58.
Үй тапсырмасыӨтілген тақырыпты
қайталау
59.
Массалық үлес60.
Ойланыңыз• өзіңіздің бөлмеңіз үйдің барлық
ауданының қанша үлесін алып
жатқандығын есептеңіз.
• Бұл алгоритмді күрделі қосылыстардың
құрамына кіретін элементтердің массалық
үлесін табуға айналдырыңыз.
61.
Массалық үлес формуласы• k – осы элементтің молекуладағы атомдар
саны.
62.
Су құрамындағы атомдар63.
Химиялық формулалар бойыншаесептеулер
• MgO, CO2, Al2O3, KMnO4 барлық
элементтердің массалық үлесін есептеп
шығарыңыз.









































 chemistry
chemistry