Similar presentations:
1_СОСТАВЛЕНИЕ УРАВНЕНИЙ_9КЛ_ВАЖНО
1.
Составление РИО2.
Цель урока. Формирование понятия о реакциях ионного обмена,выяснение их сущности. Выявление условий практически
необратимого протекания реакций иного обмена.
Проблемный вопрос урока.
В чем сущность реакций ионного обмена, протекающих в
растворах? В каких случаях реакции обмена
протекают практически необратимо?
3.
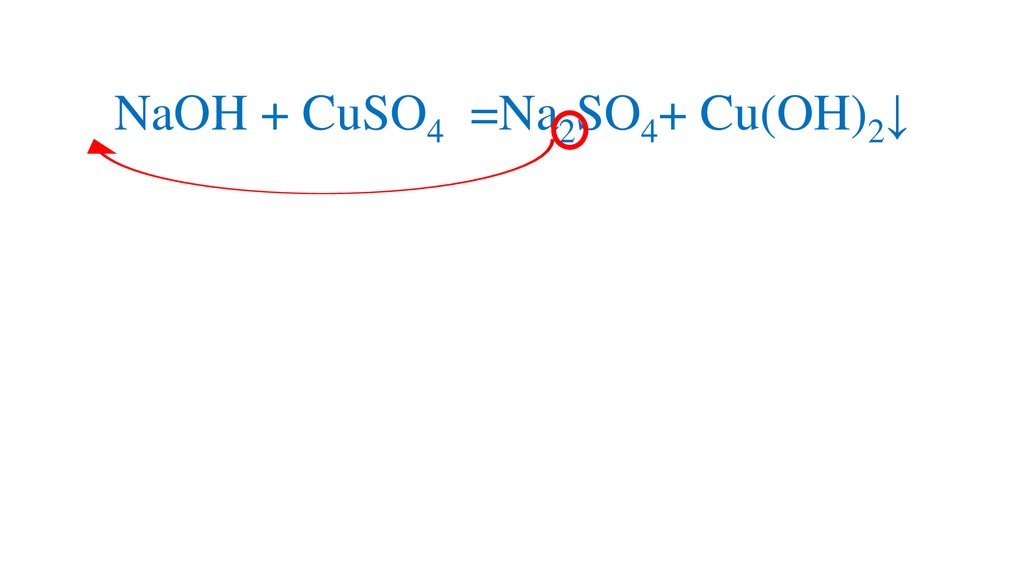
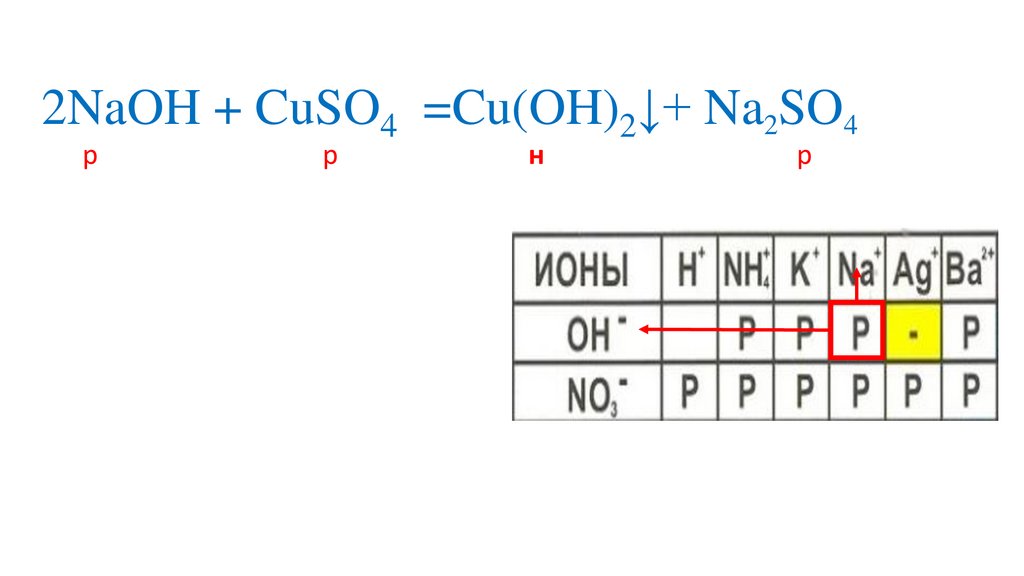
2NaOH + CuSO4 =Cu(OH)2↓+ Na2SO44.
2NaOH + CuSO4 =Cu(OH)2↓+ Na2SO45.
2NaOH + CuSO4 =Na SO4Cu(OH)2↓+Na2SO4
6.
2NaOH + CuSO4 =Na2SO4+Na2SO47.
2NaOH + CuSO4 =Na2SO4+Na2SO48.
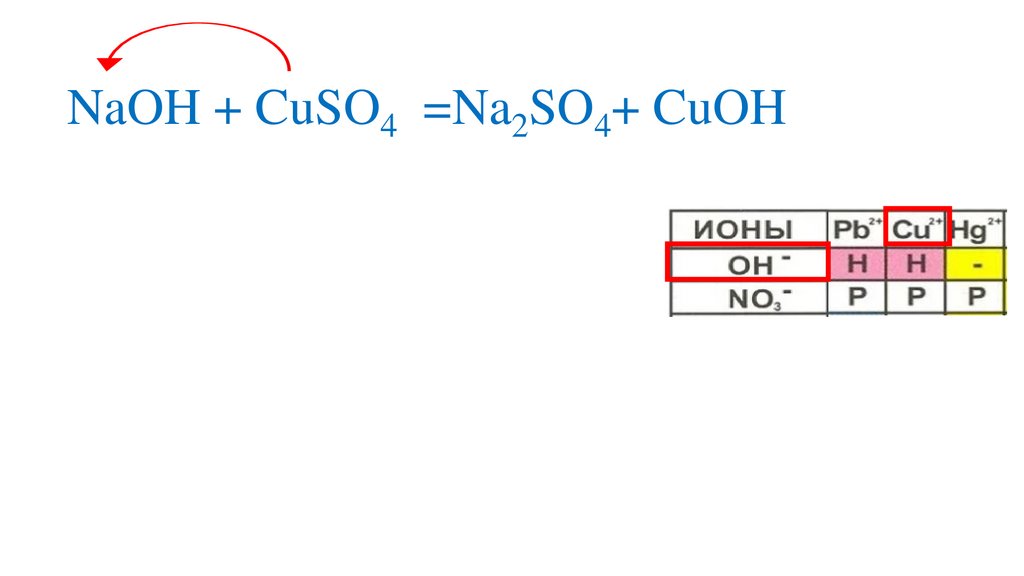
2NaOH + CuSO4 =Na2SO4+ CuOH9.
2NaOH + CuSO4 =Na2SO4+ Cu(OH)2↓10.
2NaOH + CuSO4 =Na2SO4+ Cu(OH)2↓11.
2NaOH + CuSO4 =Na2SO4+ Cu(OH)2↓12.
2NaOH + CuSO4 =Na2SO4+ Cu(OH)2↓13.
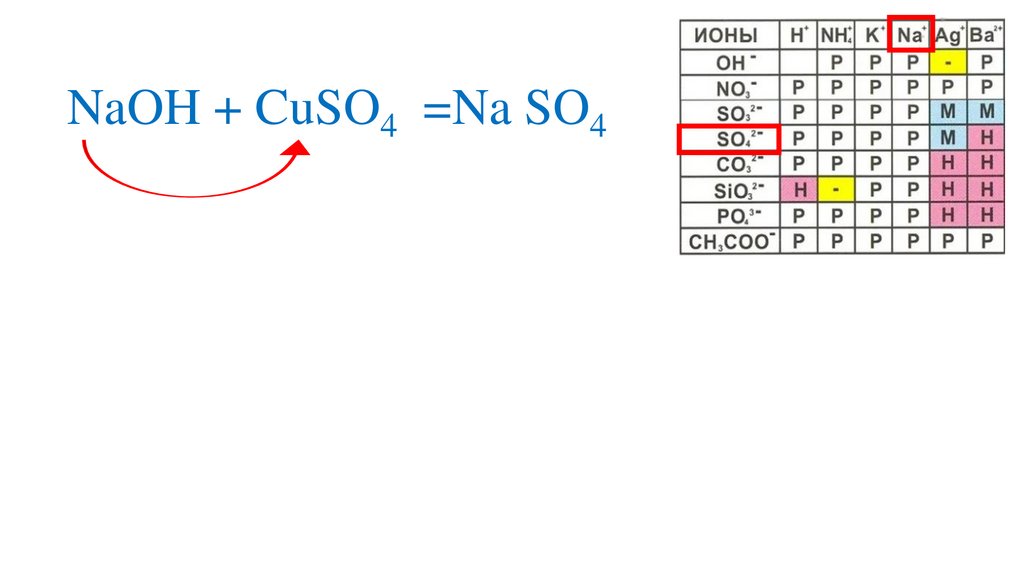
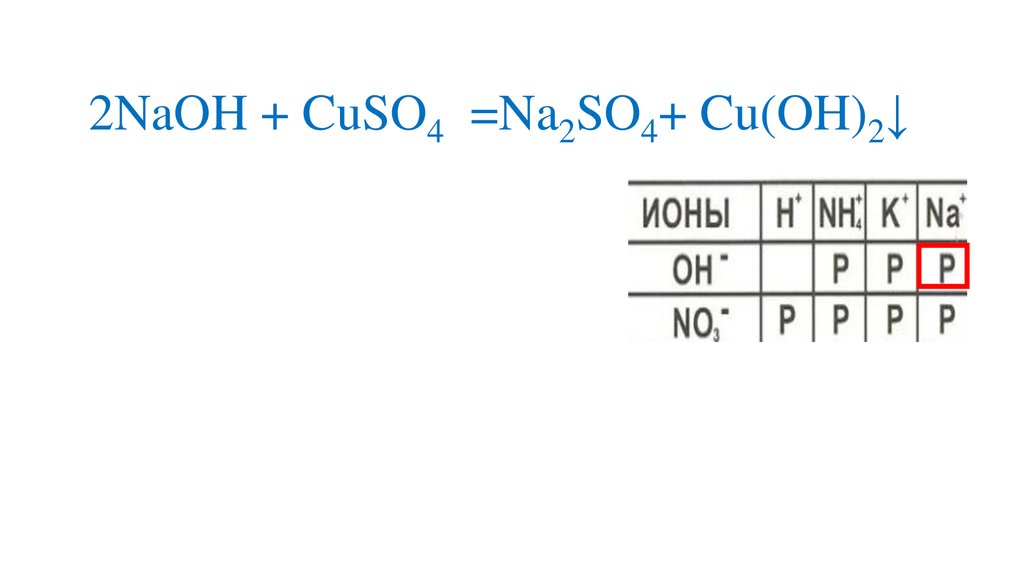
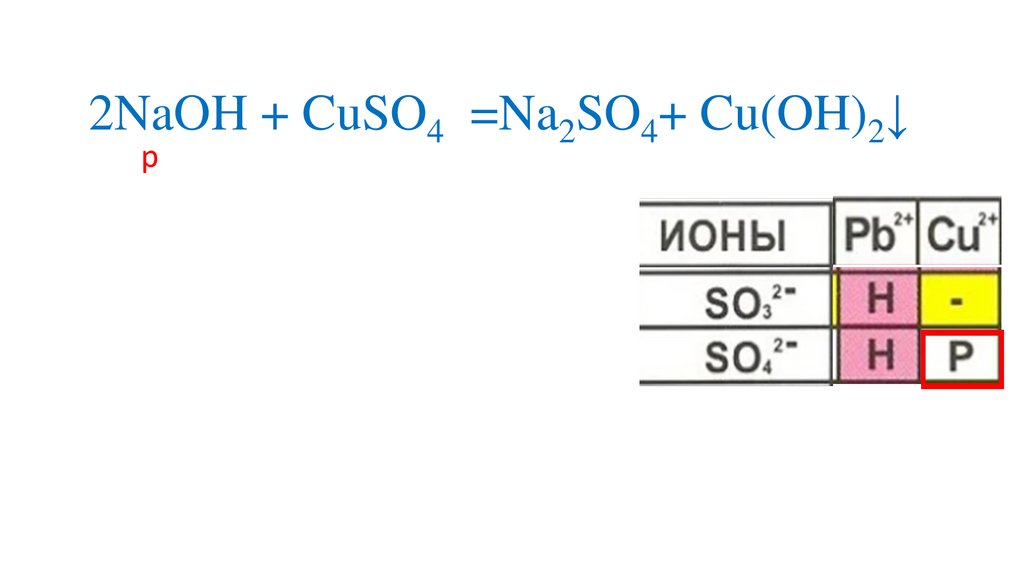
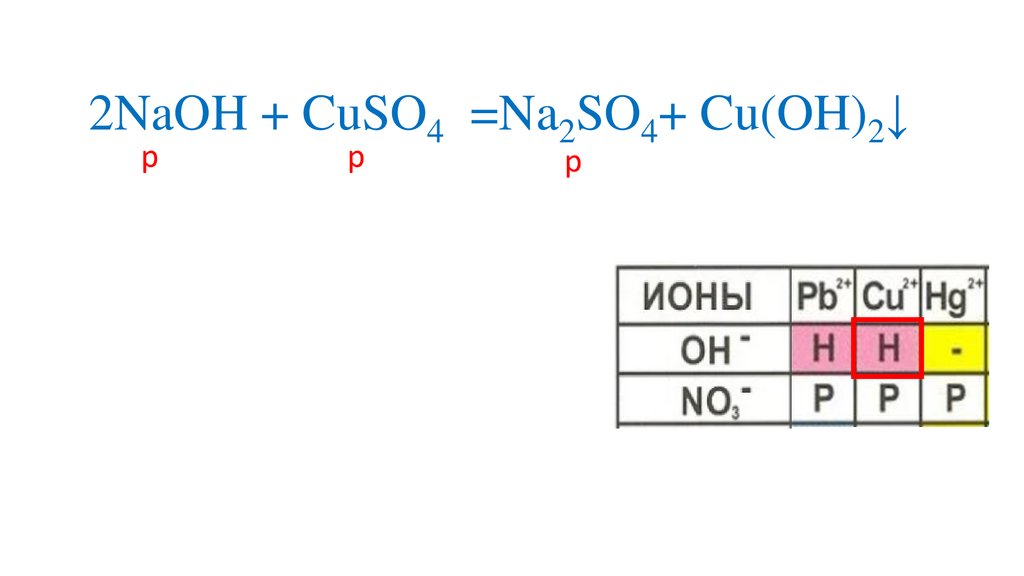
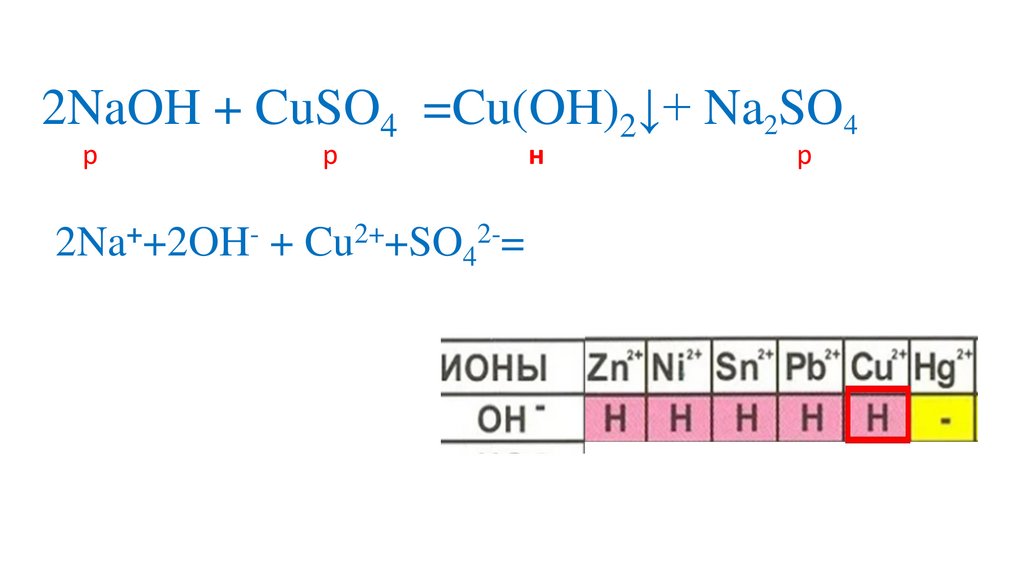
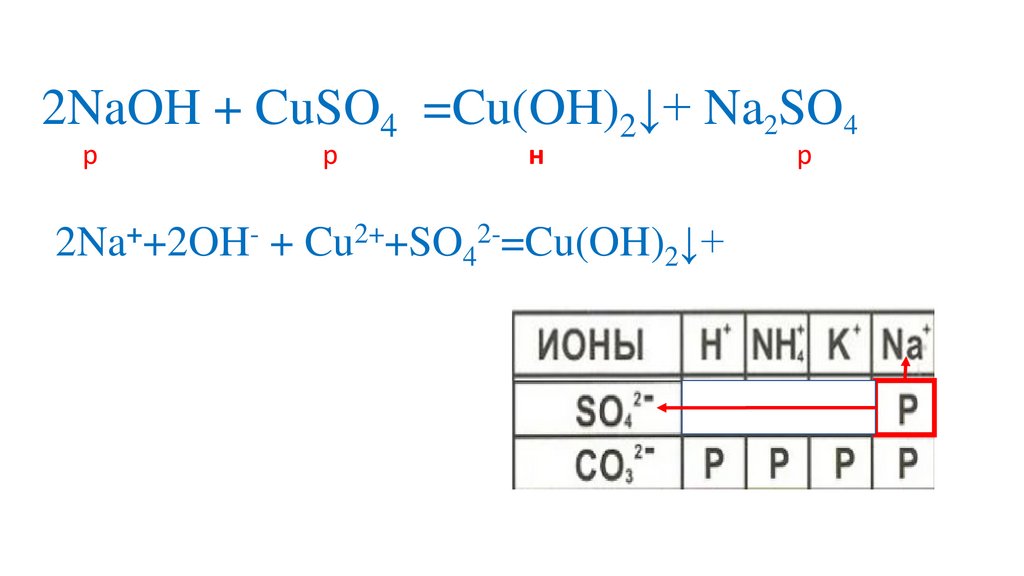
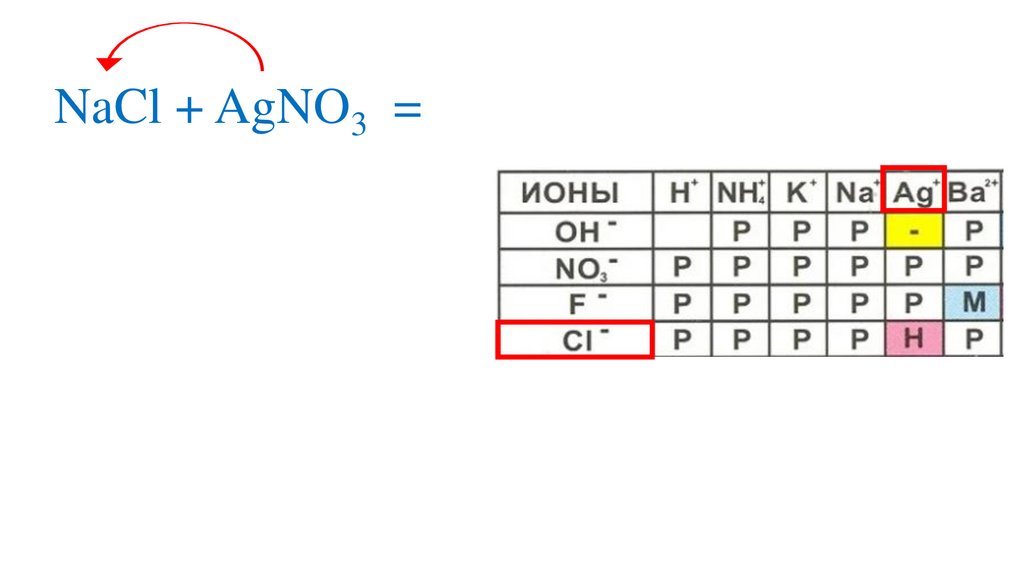
Определяемрастворимость веществ
14.
2NaOH + CuSO4 =Na2SO4+ Cu(OH)2↓15.
2NaOH + CuSO4 =Na2SO4+ Cu(OH)2↓16.
2NaOH + CuSO4 =Na2SO4+ Cu(OH)2↓р
17.
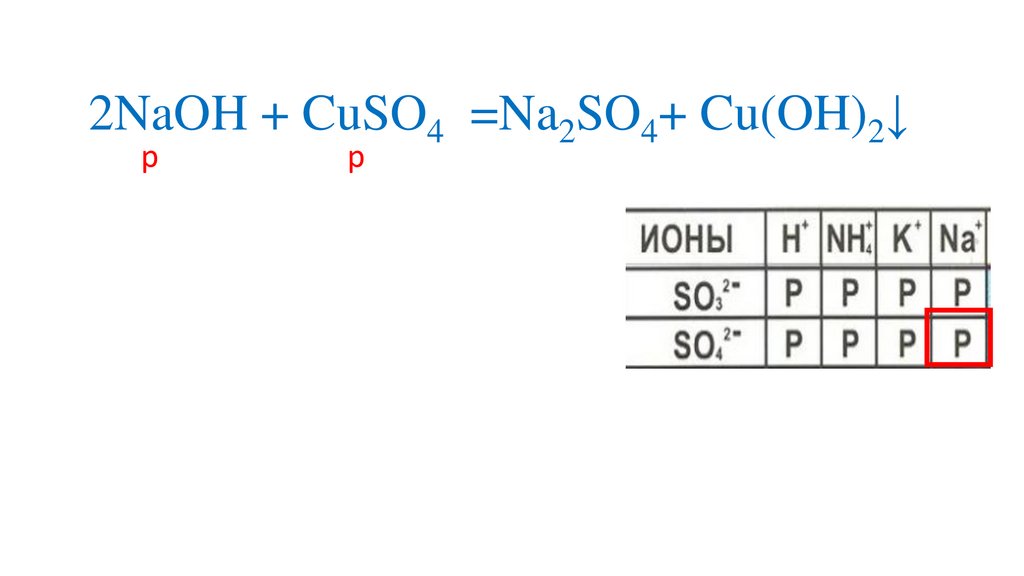
2NaOH + CuSO4 =Na2SO4+ Cu(OH)2↓р
18.
2NaOH + CuSO4 =Na2SO4+ Cu(OH)2↓р
р
19.
2NaOH + CuSO4 =Na2SO4+ Cu(OH)2↓р
р
20.
2NaOH + CuSO4 =Na2SO4+ Cu(OH)2↓р
р
р
21.
2NaOH + CuSO4 =Na2SO4+ Cu(OH)2↓р
р
р
22.
2NaOH + CuSO4 =Na2SO4+ Cu(OH)2↓р
р
р
н
23.
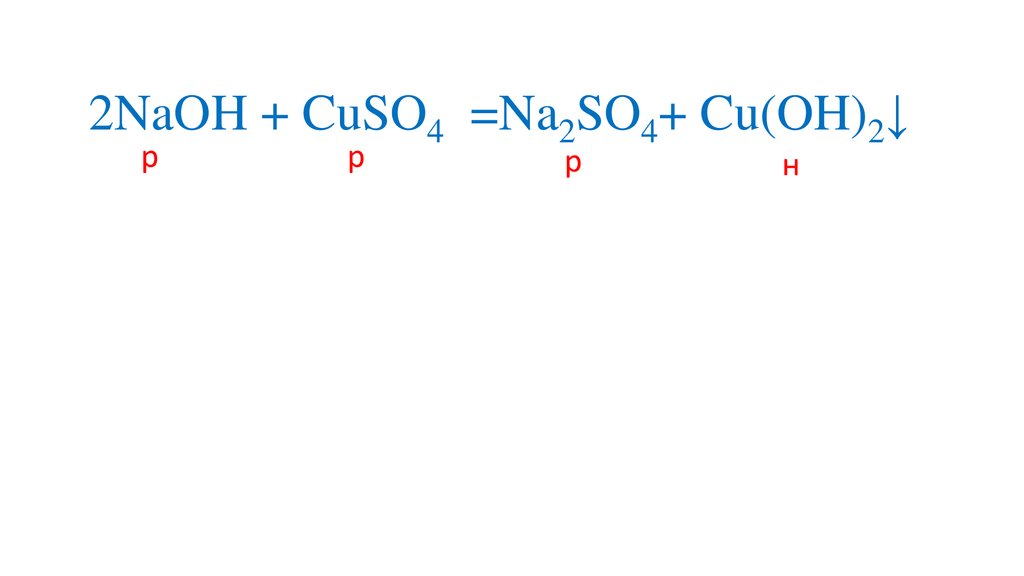
Определяем на какиеионы распадаются
вещества
24.
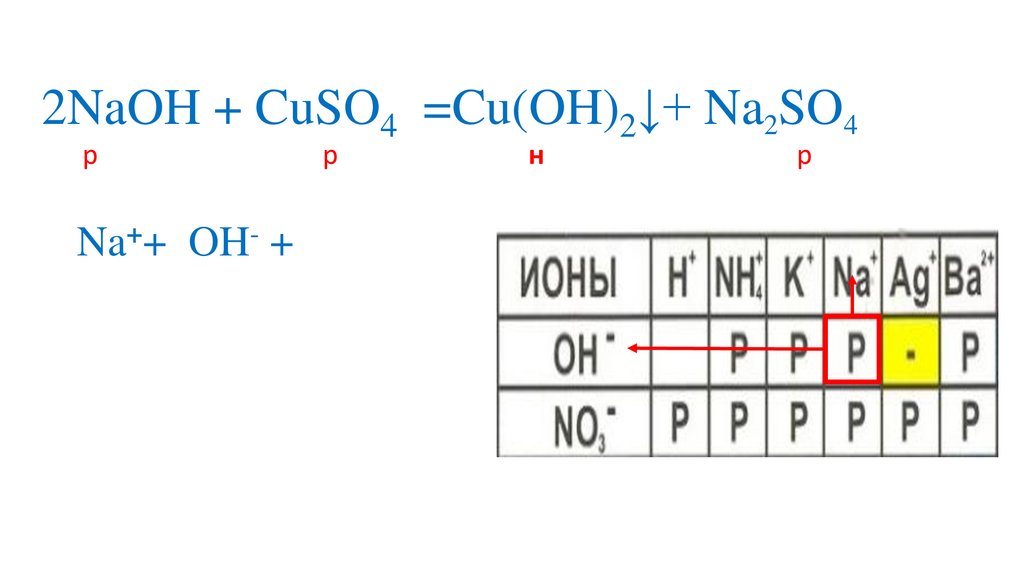
2NaOH + CuSO4 =Cu(OH)2↓+ Na2SO4р
р
н
р
25.
2NaOH + CuSO4 =Cu(OH)2↓+ Na2SO4р
р
н
Cu2++SO42-=Cu(OH)2↓+2Na++ SO42-
р
26.
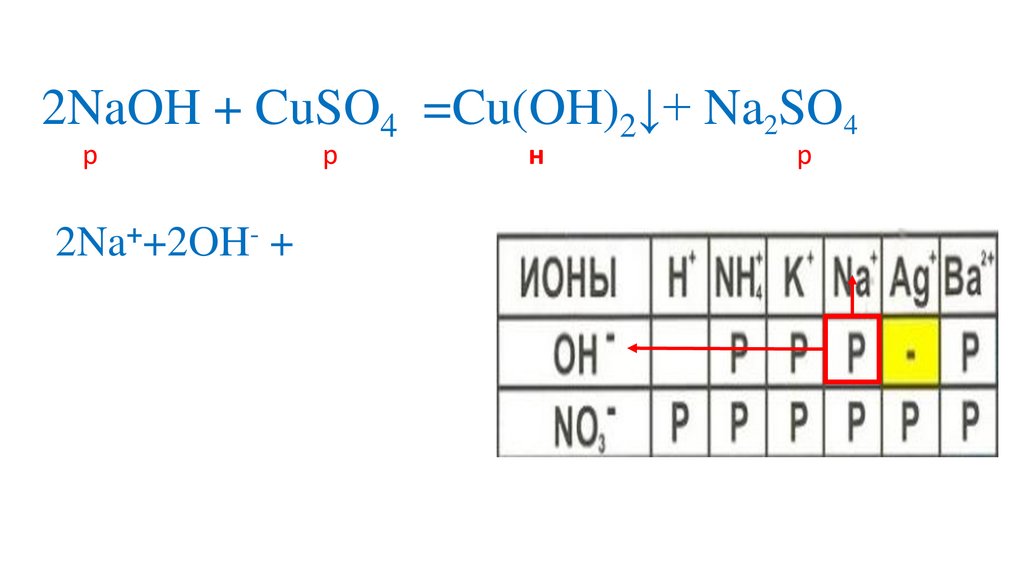
2NaOH + CuSO4 =Cu(OH)2↓+ Na2SO4р
р
н
р
2Na++2OH- + Cu2++SO42-=Cu(OH)2↓+2Na++ SO42-
27.
2NaOH + CuSO4 =Cu(OH)2↓+ Na2SO4р
р
н
р
2Na++2OH- + Cu2++SO42-=Cu(OH)2↓+2Na++ SO42-
28.
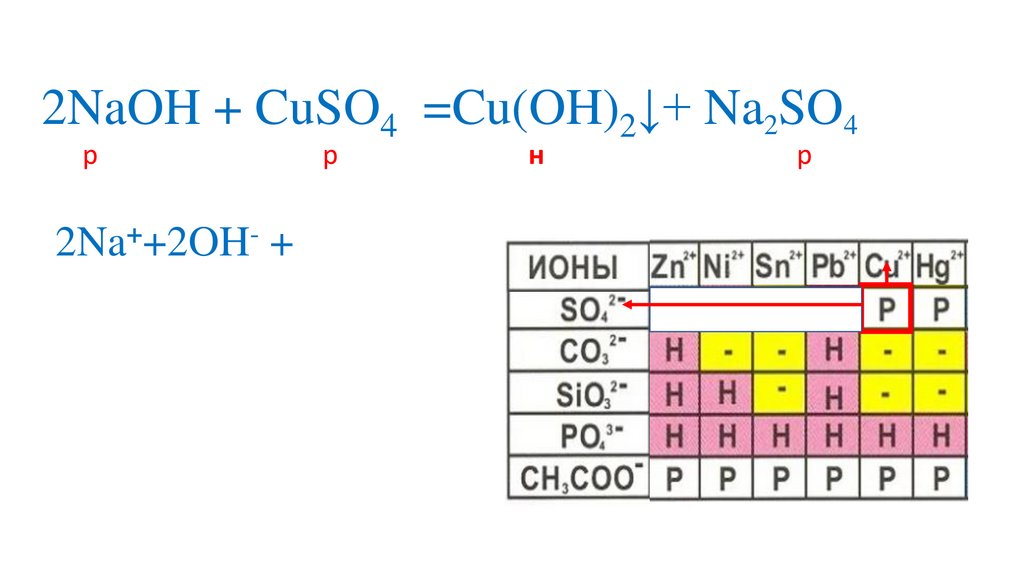
2NaOH + CuSO4 =Cu(OH)2↓+ Na2SO4р
р
н
2Na++2OH- + (OH)2↓+2Na++ SO42-
р
29.
2NaOH + CuSO4 =Cu(OH)2↓+ Na2SO4р
р
н
р
2Na++2OH- + Cu2++SO42-=Cu(OH)2↓+2Na++ SO42-
30.
2NaOH + CuSO4 =Cu(OH)2↓+ Na2SO4р
р
н
2Na++2OH- + Cu2++SO42-= ++ SO42-
р
31.
2NaOH + CuSO4 =Cu(OH)2↓+ Na2SO4р
р
н
р
2Na++2OH- + Cu2++SO42-=Cu(OH)2↓+2Na++ SO42-
32.
2NaOH + CuSO4 =Cu(OH)2↓+ Na2SO4р
р
н
2Na++2OH- + Cu2++SO42-=Cu(OH)2↓+
р
33.
2NaOH + CuSO4 =Cu(OH)2↓+ Na2SO4р
р
н
р
2Na++2OH- + Cu2++SO42-=Cu(OH)2↓+2Na++ SO42-
34.
2NaOH + CuSO4 =Cu(OH)2↓+ Na2SO4р
р
н
р
2Na++2OH- + Cu2++SO42-=Cu(OH)2↓+2Na++ SO42-
35.
2NaOH + CuSO4 =Cu(OH)2↓+ Na2SO4р
р
н
р
2Na++2OH- + Cu2++SO42-=Cu(OH)2↓+2Na++ SO42-
36.
Сокращаем одинаковыеионы
37.
2NaOH + CuSO4 =Cu(OH)2↓+ Na2SO4р
р
н
р
2Na++2OH- + Cu2++SO42-=Cu(OH)2↓+2Na++ SO42Cu2++ 2OH- =Cu(OH)2↓
38.
2NaOH + CuSO4 =Cu(OH)2↓+ Na2SO4р
р
н
р
2Na++2OH- + Cu2++SO42-=Cu(OH)2↓+2Na++ SO42Cu2++ 2OH- =Cu(OH)2↓
39.
2NaOH + CuSO4 =Cu(OH)2↓+ Na2SO4р
р
н
р
2Na++2OH- + Cu2++SO42-=Cu(OH)2↓+2Na++ SO42Cu2++ 2OH- =Cu(OH)2↓
40.
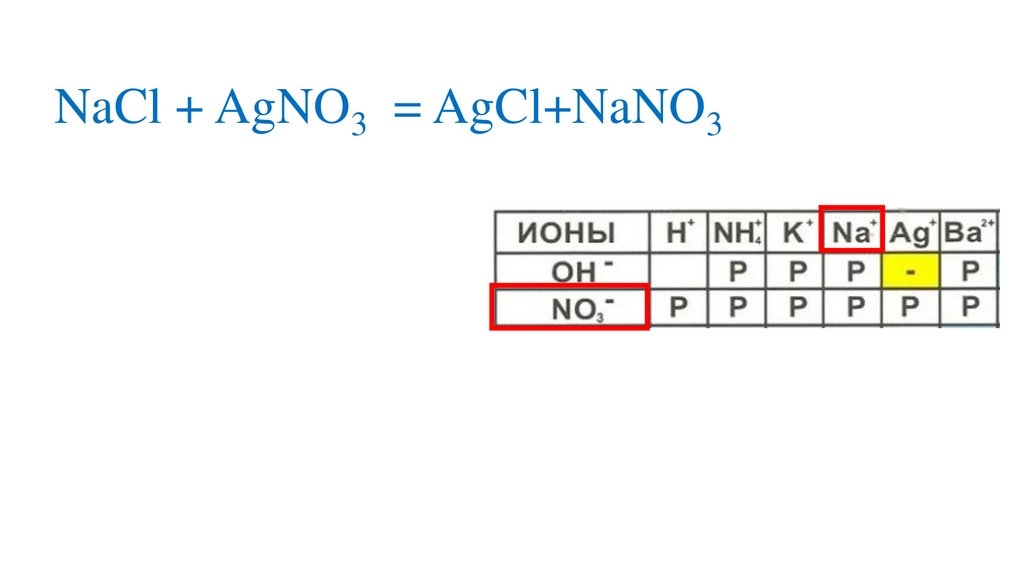
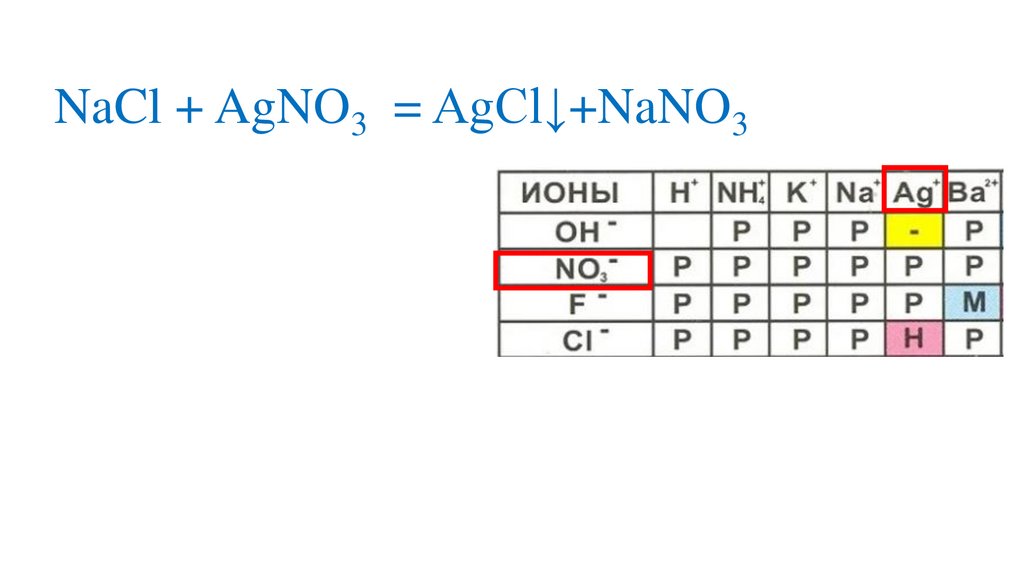
Взаимодействие нитрата серебра схлоридом натрия
41.
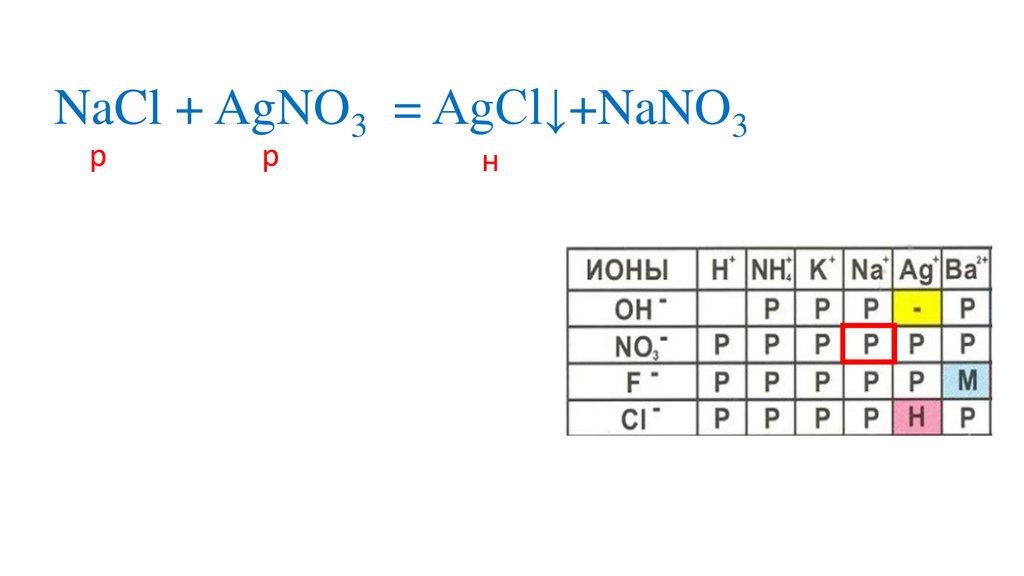
NaCl + AgNO3 = NaNO3+AgCl↓р
р
р
н
42.
NaCl + AgNO3 = NaNO3+AgCl↓р
р
р
н
43.
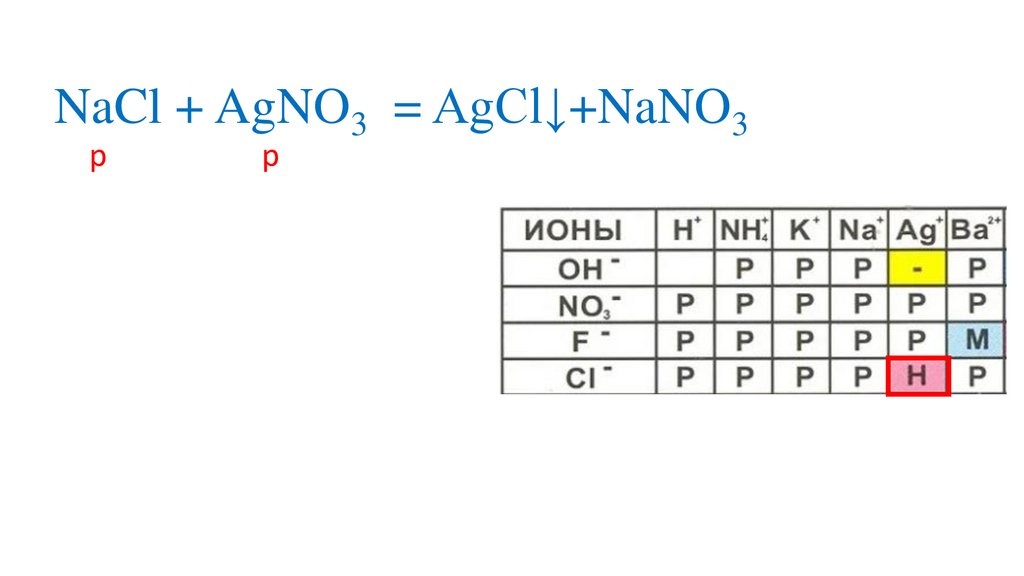
NaCl + AgNO3 = aNO3+AgCl↓р
р
р
н
44.
NaCl + AgNO3 = AgCl↓ +NaNO3+AgCl↓р
р
р
н
45.
NaCl + AgNO3 = AgCl↓ +NaNO3+AgCl↓р
р
р
н
46.
NaCl + AgNO3 = AgCl+ +AgCl↓р
р
р
н
47.
NaCl + AgNO3 = AgCl+NaNO3+AgCl↓р
р
р
н
48.
NaCl + AgNO3 = AgCl↓+NaNO3+AgCl↓р
р
р
н
49.
NaCl + AgNO3 = AgCl↓+NaNO3+AgCl↓р
р
р
н
50.
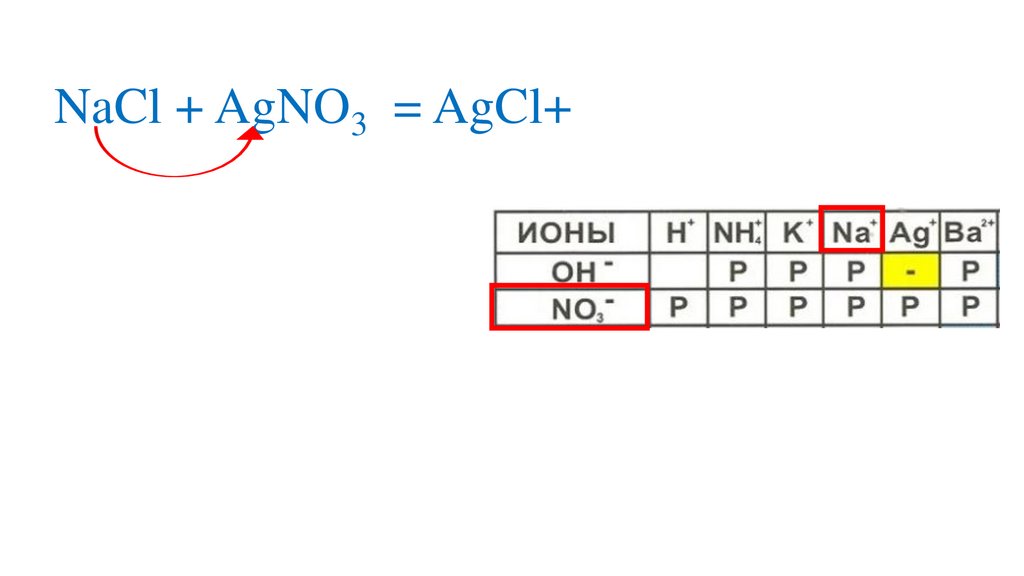
NaCl + AgNO3 = AgCl↓+NaNO3р
51.
NaCl + AgNO3 = AgCl↓+NaNO352.
NaCl + AgNO3 = AgCl↓+NaNO3р
р
53.
NaCl + AgNO3 = AgCl↓+NaNO3р
р
54.
NaCl + AgNO3 = AgCl↓+NaNO3р
р
н
55.
NaCl + AgNO3 = AgCl↓+NaNO3р
р
н
н
56.
NaCl + AgNO3 = AgCl↓+NaNO3р
р
н
р
н
57.
NaCl + AgNO3 = AgCl↓+NaNO3р
р
н
р
н
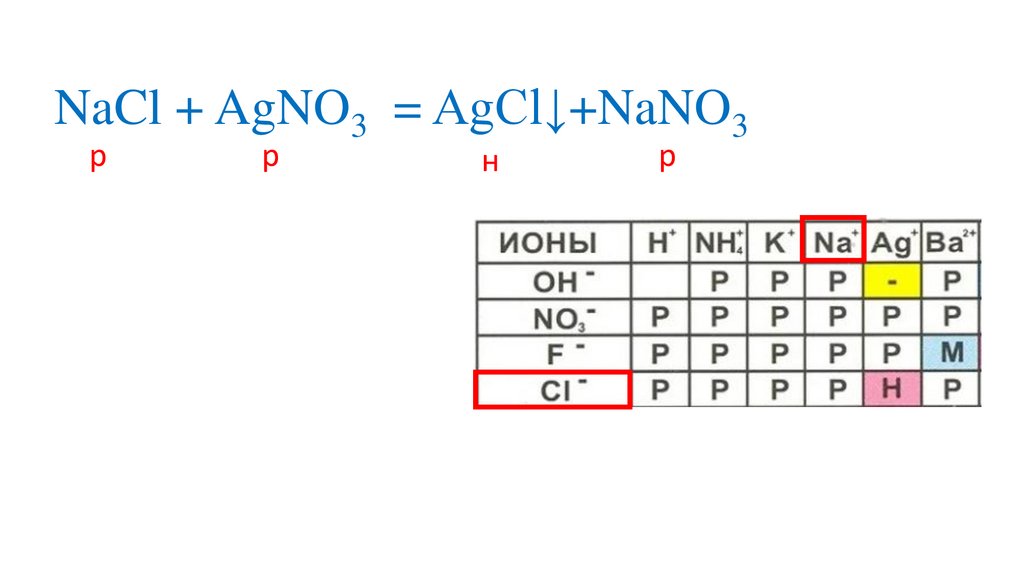
58.
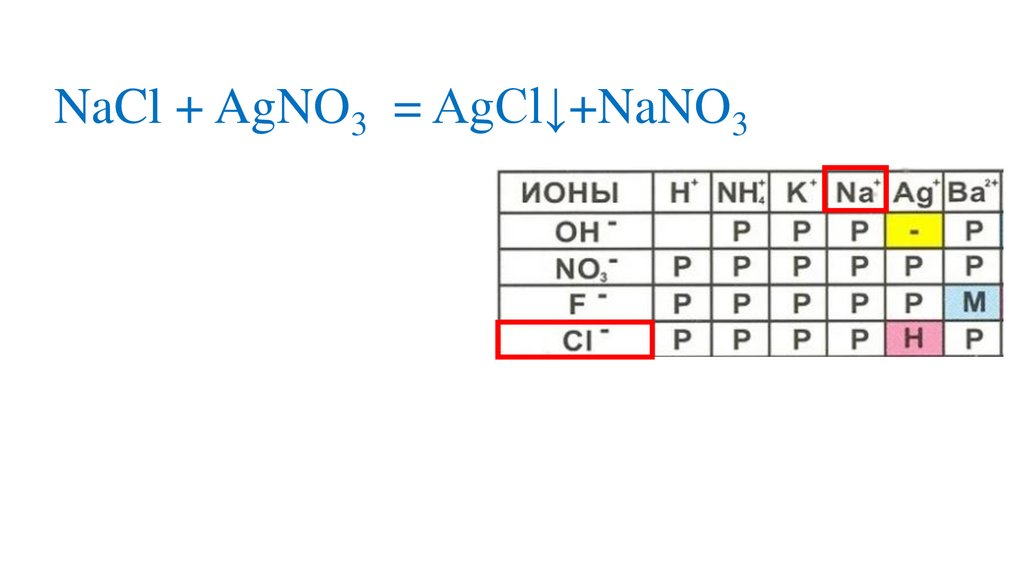
NaCl + AgNO3 = AgCl↓+NaNO3р
р
+
+
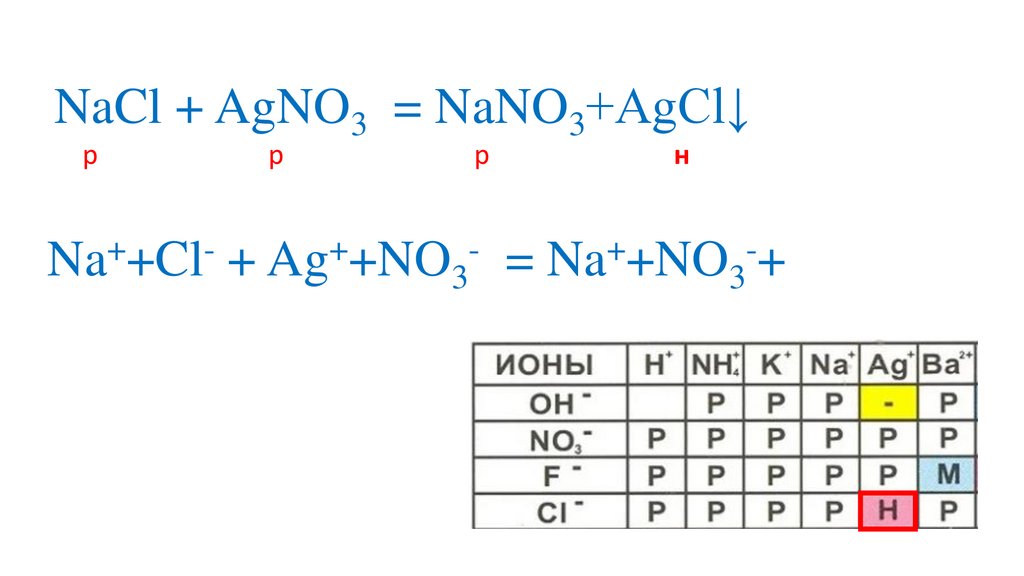
Na +Cl + Ag +NO3
н
р
+
= Na +NO3 +AgCl↓
н
59.
NaCl + AgNO3 = AgCl↓+NaNO3р
р
+
+
Na +Cl + Ag +NO3
н
р
+
= Na +NO3 +AgCl↓
н
60.
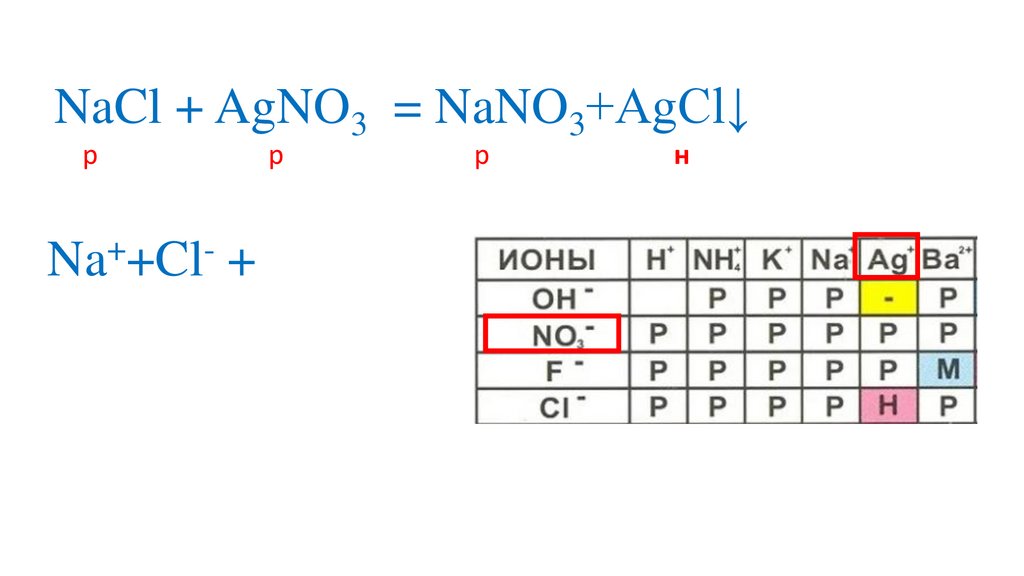
NaCl + AgNO3 = NaNO3+AgCl↓р
р
р
+
+
Na +Cl + Ag +NO3
н
+
= Na +NO3 +AgCl↓
61.
NaCl + AgNO3 = NaNO3+AgCl↓р
р
р
+
+
Na +Cl + Ag +NO3
н
+
= Na +NO3 +AgCl↓
62.
NaCl + AgNO3 = NaNO3+AgCl↓р
р
р
+
+
Na +Cl + Ag +NO3
н
+
= Na +NO3 +AgCl↓
63.
NaCl + AgNO3 = NaNO3+AgCl↓р
р
р
+
+
Na +Cl + Ag +NO3
н
+
= Na +NO3 +AgCl↓
64.
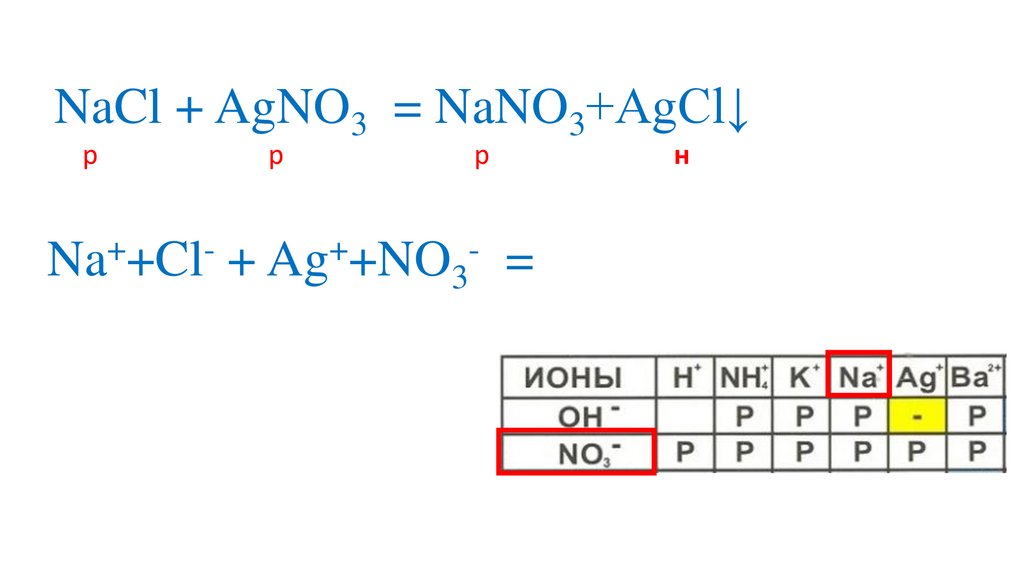
NaCl + AgNO3 = NaNO3+AgCl↓р
р
р
+
+
Na +Cl + Ag +NO3
н
+
= Na +NO3 +AgCl↓
65.
NaCl + AgNO3 = NaNO3+AgCl↓р
р
р
+
+
Na +Cl + Ag +NO3
н
+
= Na +NO3 +AgCl↓
66.
NaCl + AgNO3 = NaNO3+AgCl↓р
р
р
+
+
Na +Cl + Ag +NO3
н
+
= Na +NO3 +AgCl↓
67.
NaCl + AgNO3 = NaNO3+AgCl↓р
р
р
+
+
Na +Cl + Ag +NO3
н
+
= Na +NO3 +AgCl↓
68.
NaCl + AgNO3 = NaNO3+AgCl↓р
р
р
+
+
Na +Cl + Ag +NO3
н
+
= Na +NO3 +AgCl↓
+
Ag + Cl = AgCl↓
69.
Закрепление изученной темы1. Запишите диссоциацию веществ:
KOH, AgI, HNO3, Zn(OH)2, FeF2, H2S,
MnCO3, Mg2(PO4)3, Ca(OH)2, Al(NO3)3
2. Запишите реакцию обмена в
молекулярном и ионных видах:
NaOH + H2SO4 =
KOH + CuCl2 =
NaNO3 + K2SO4 =
Na2CO3 + HCl =
70.
2. Составьте по два молекулярных уравнения дляпредложенных ионных:
Ca2+ + CO32- = CaCO3
OH- + Fe3+ = Fe(OH)3
71.
3. Закончите уравнения реакций,определите окислитель и
восстановитель:
Zn + HBr =
K + O2 =
72.
4. Закончите уравнения реакций,определите окислитель и
восстановитель:
Zn + HBr =
K + O2 =
73.
5. Определить реакцию среды врастворах следующих солей:
NaI, CaSO3, MgCl2
74.
Домашнее задание:подготовка в контрольной
работе


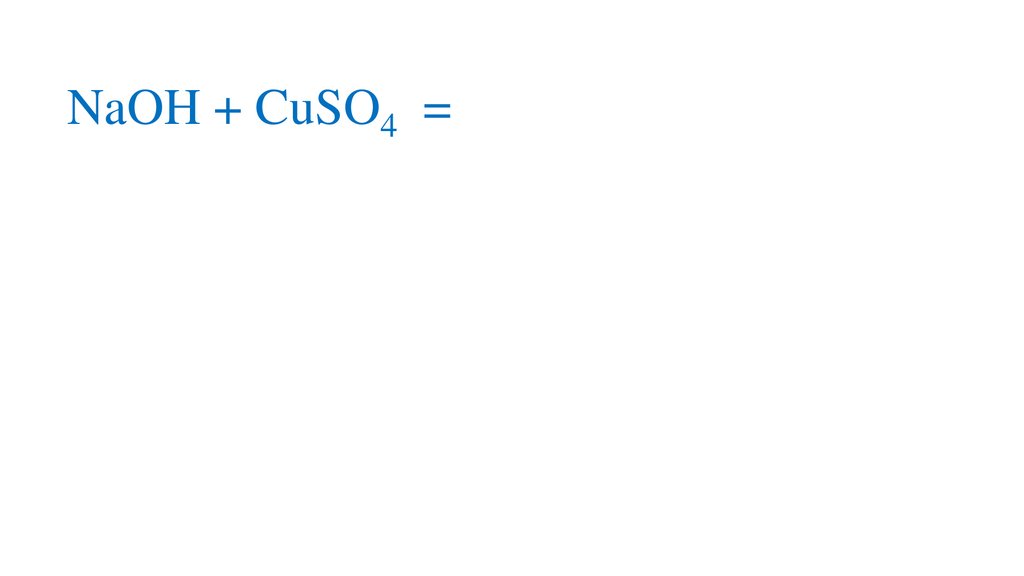
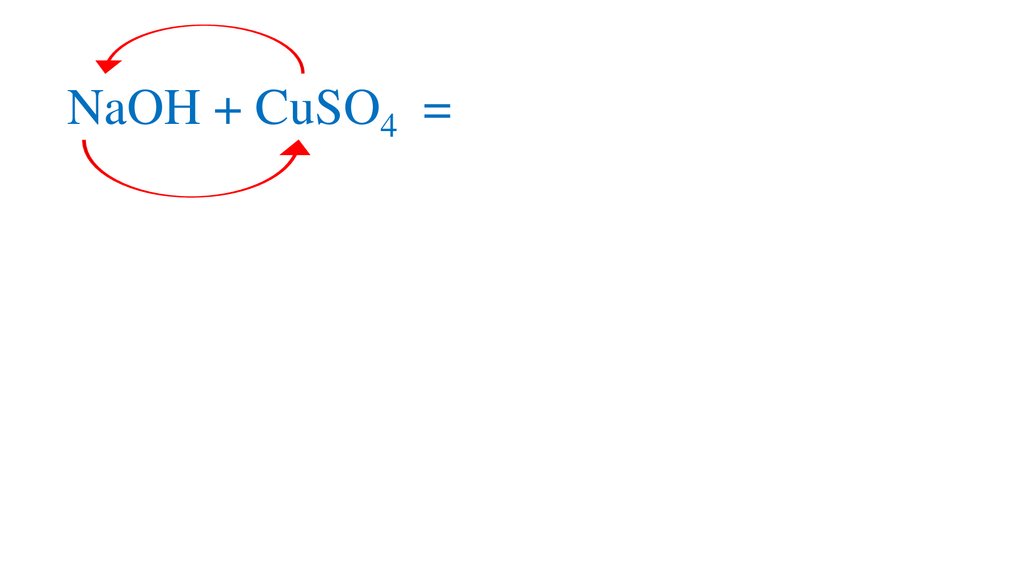
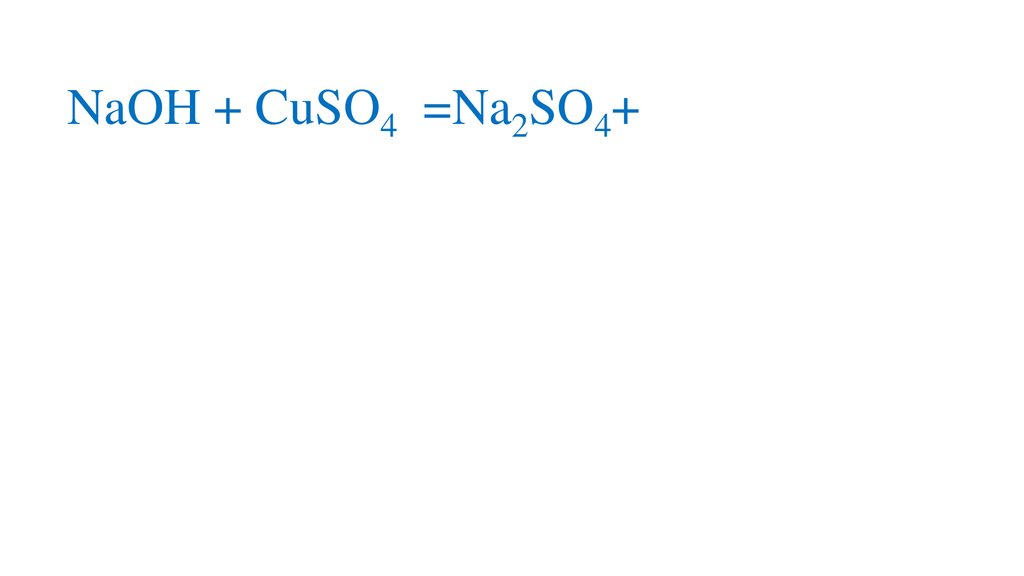
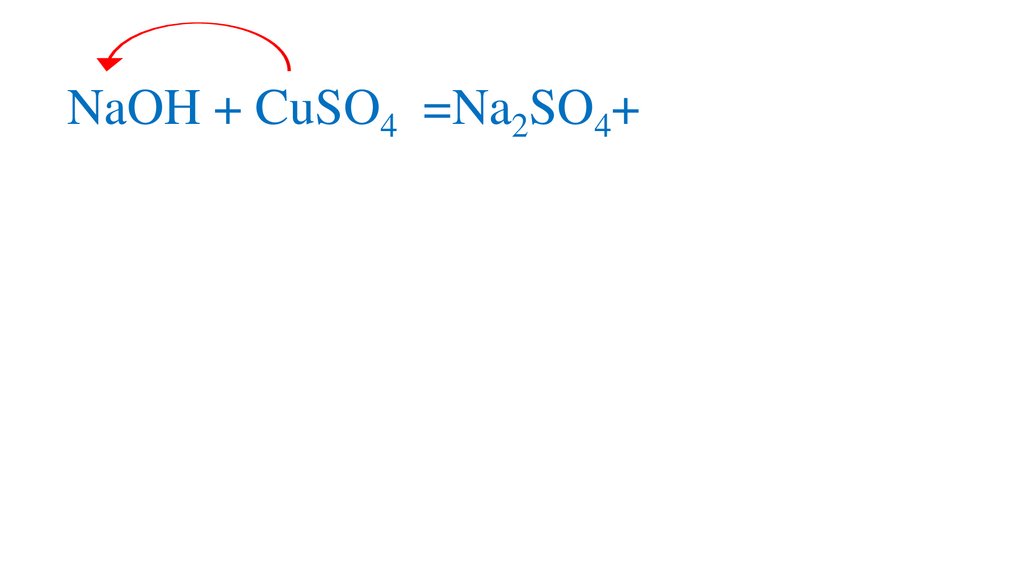
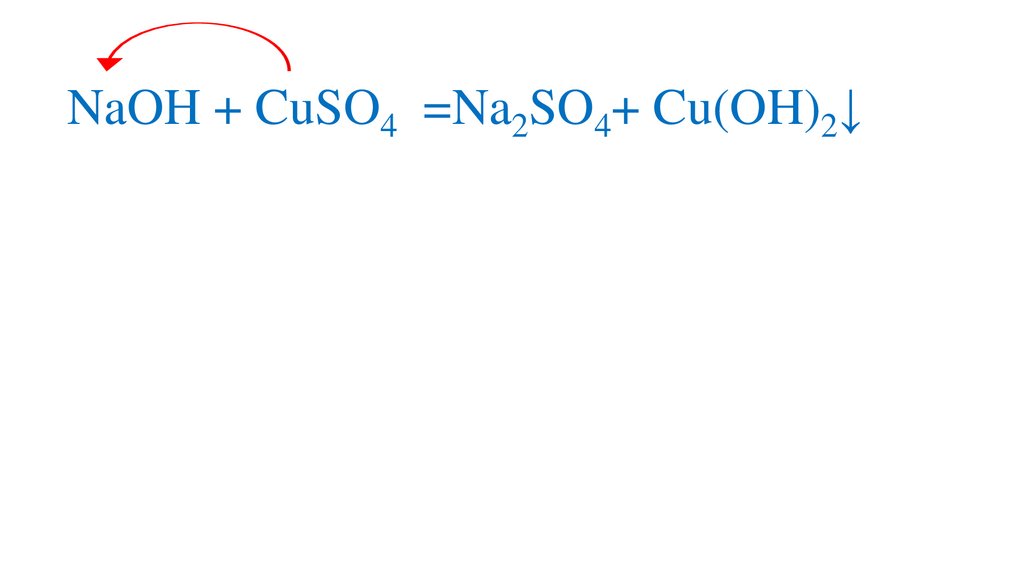
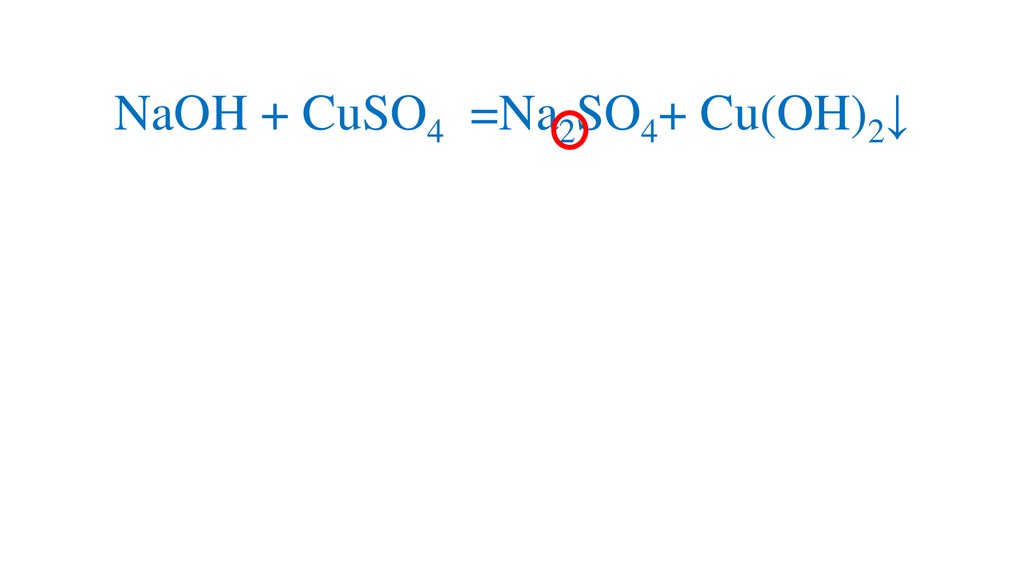
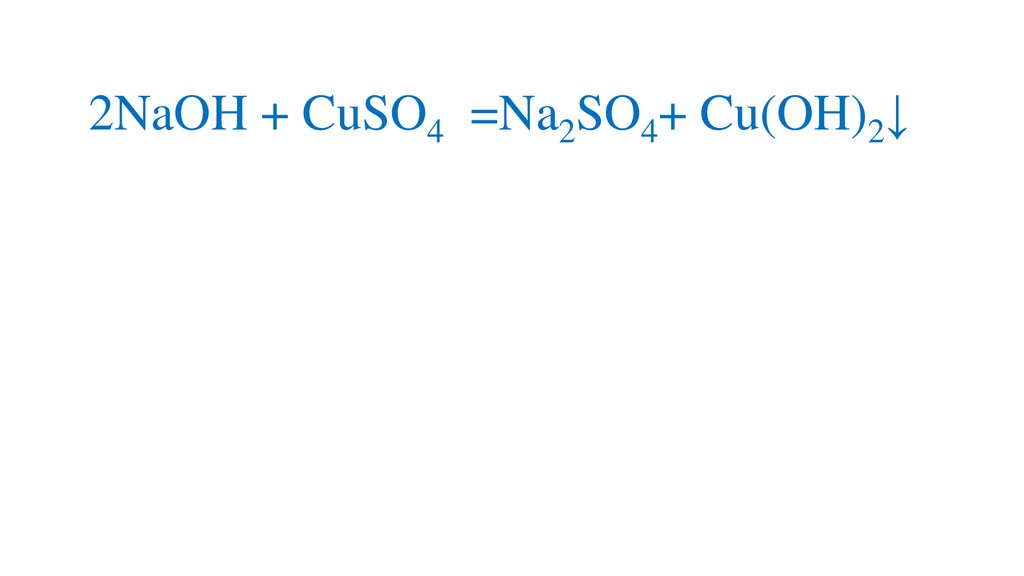

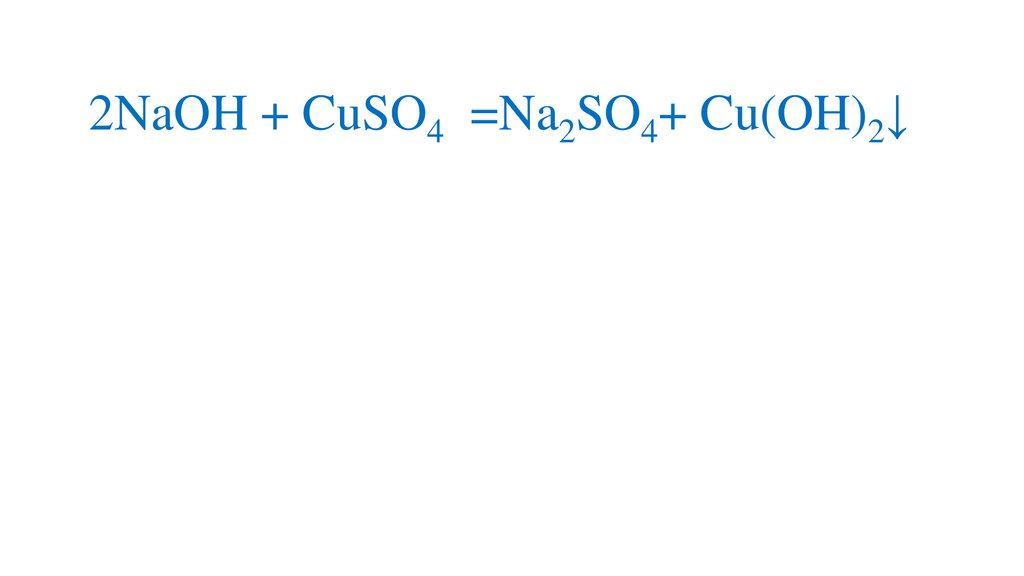
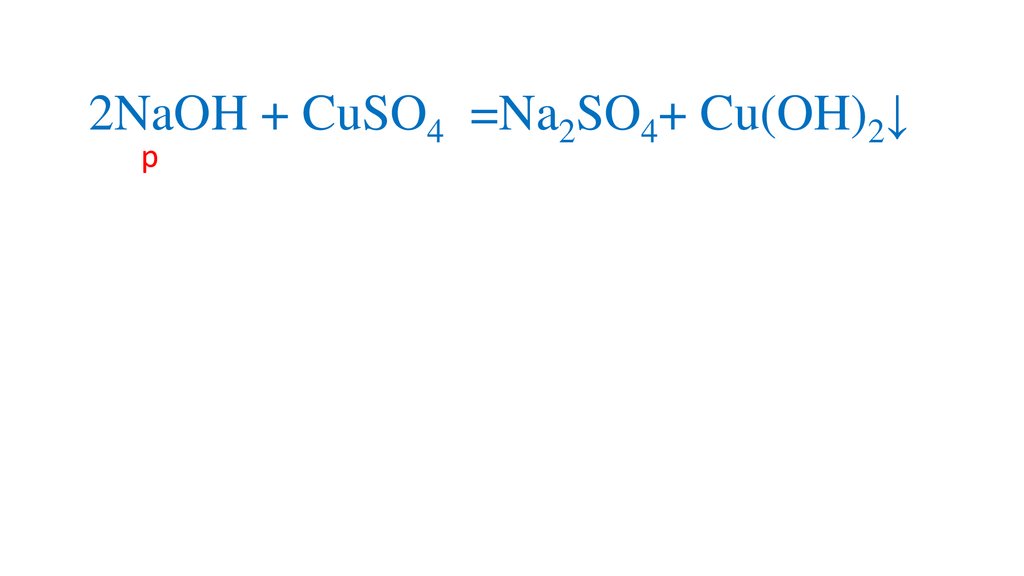
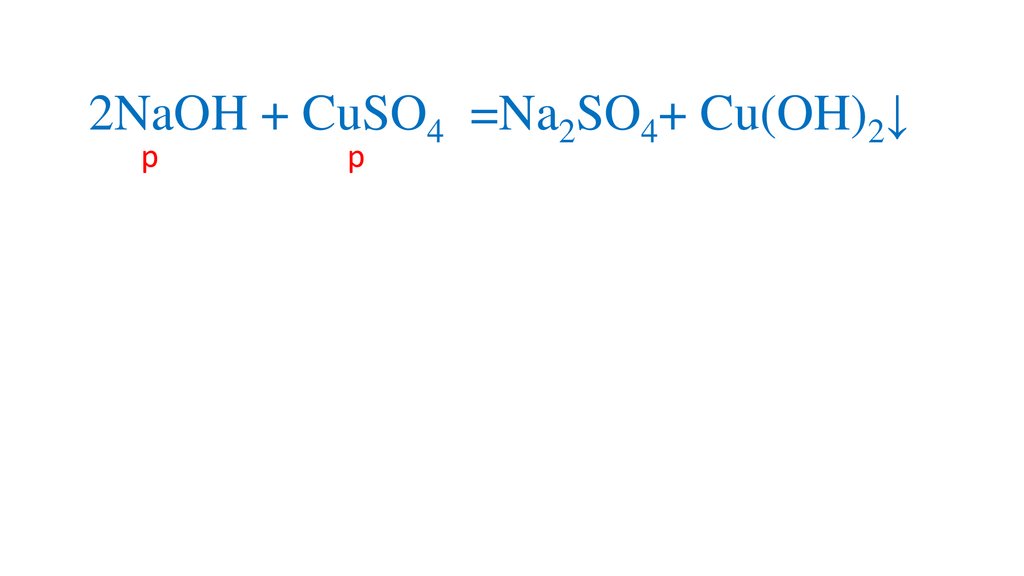
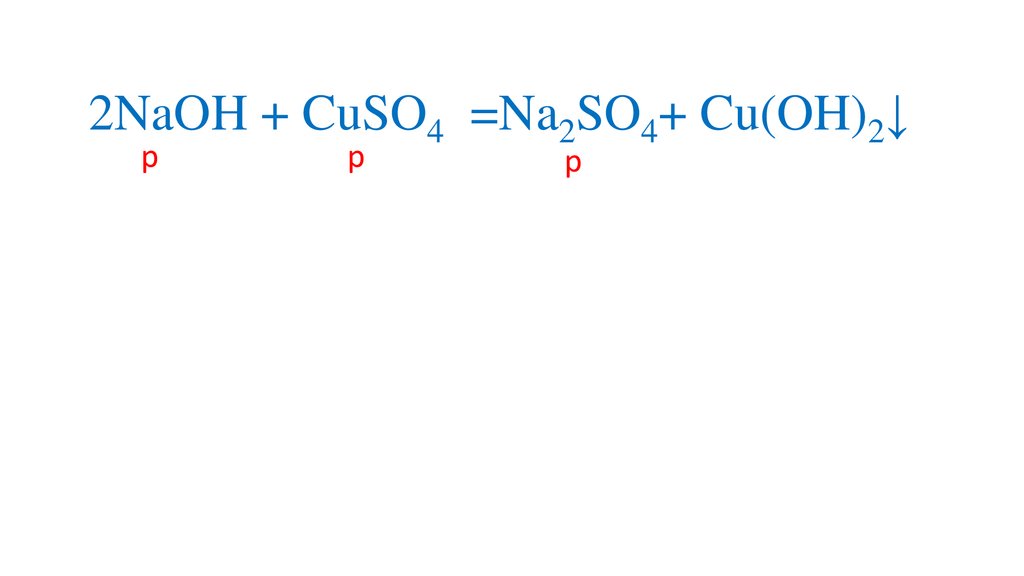

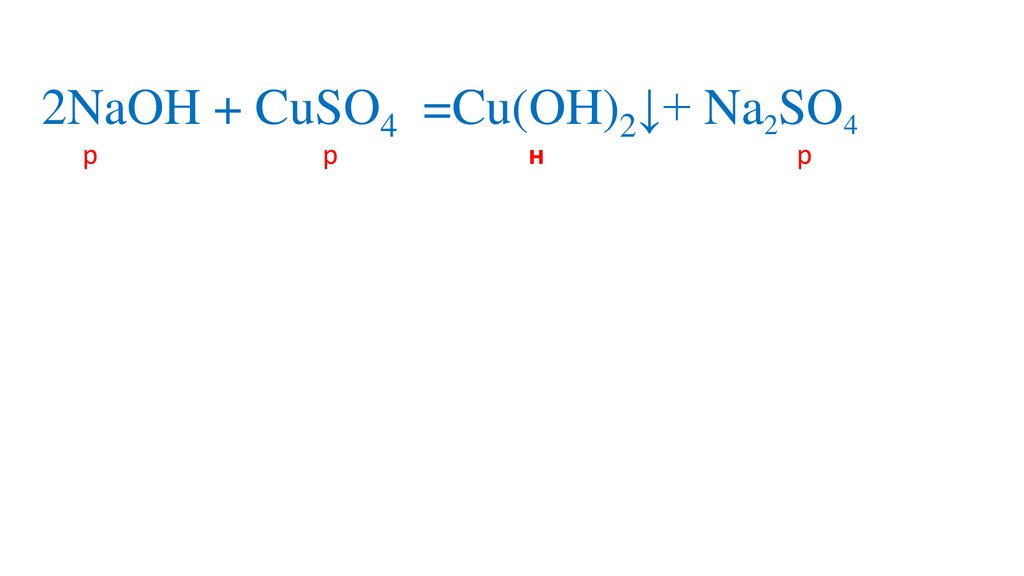
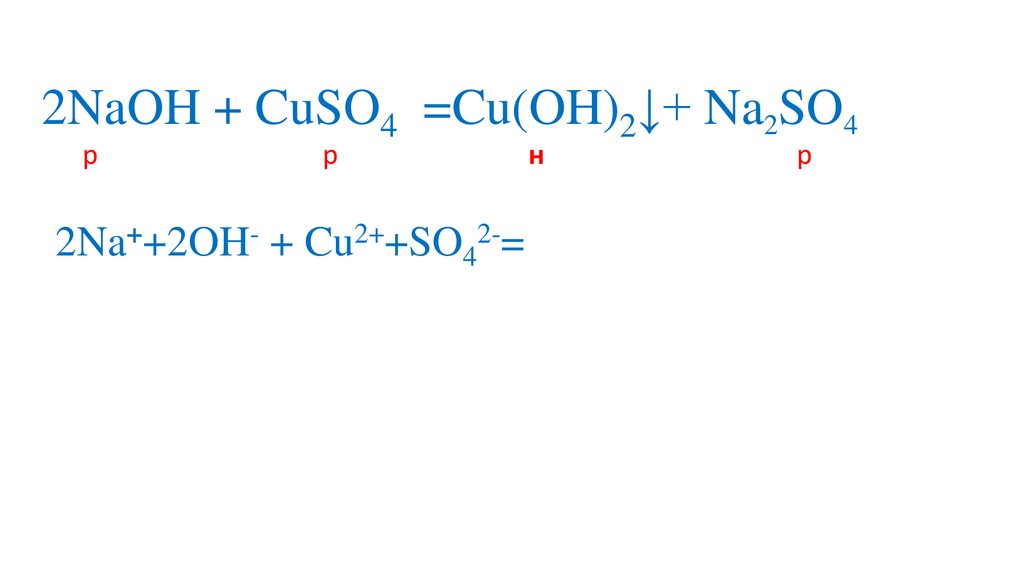
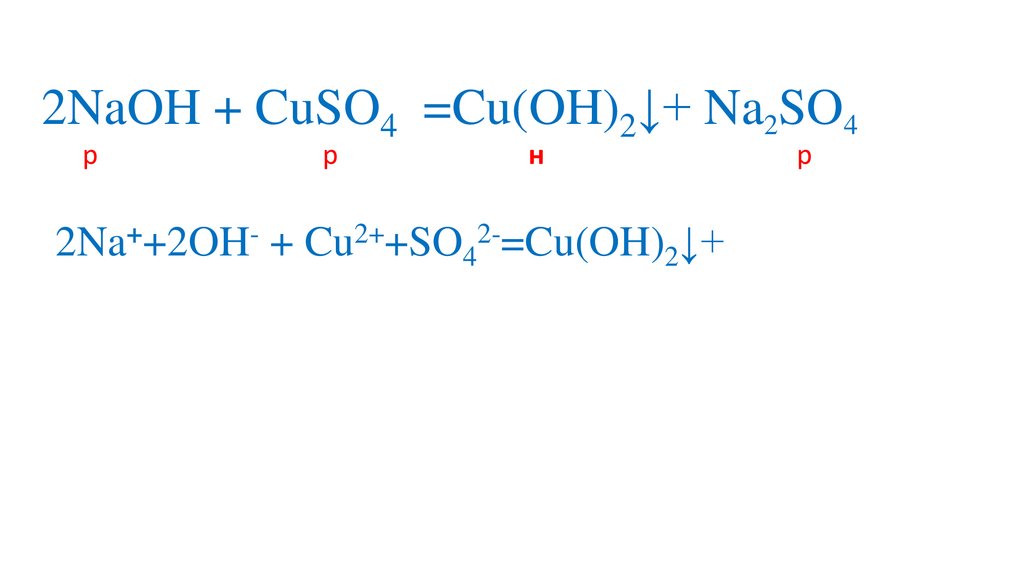
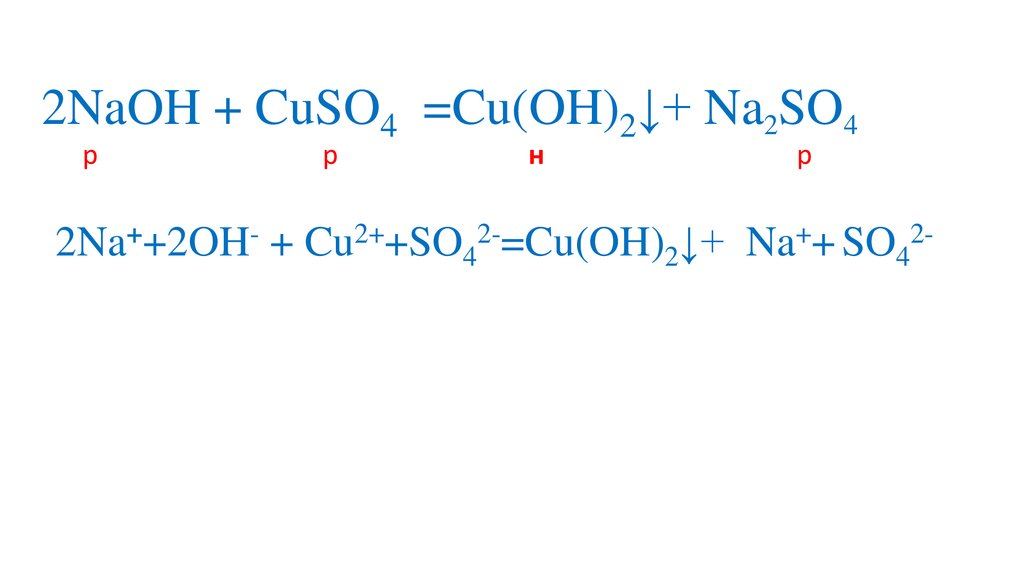
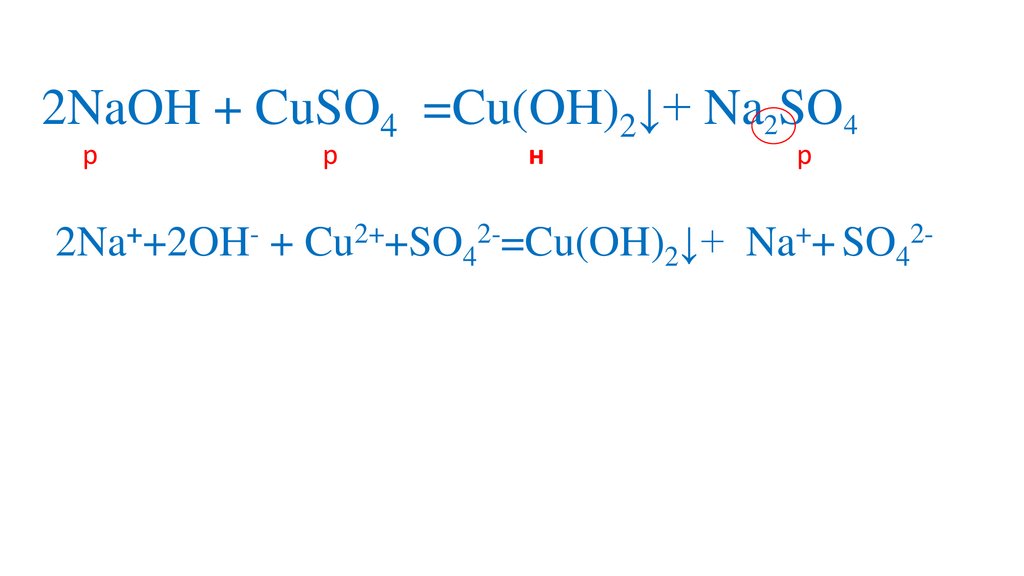
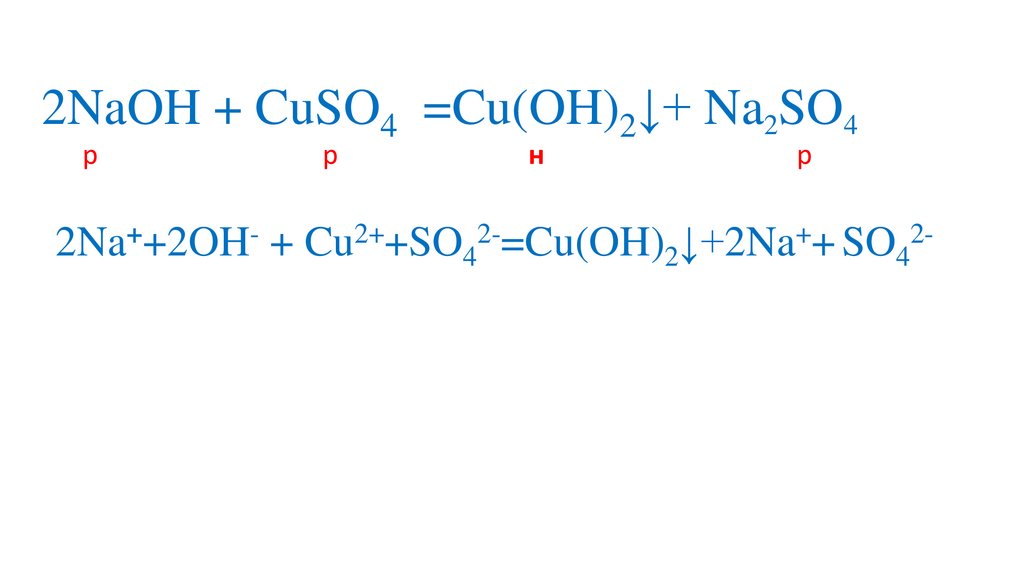

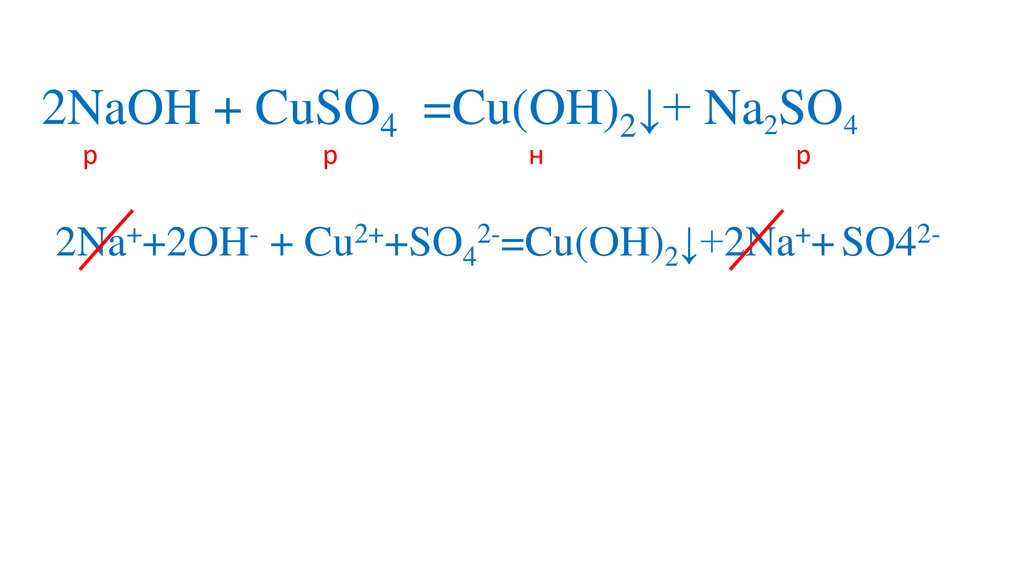
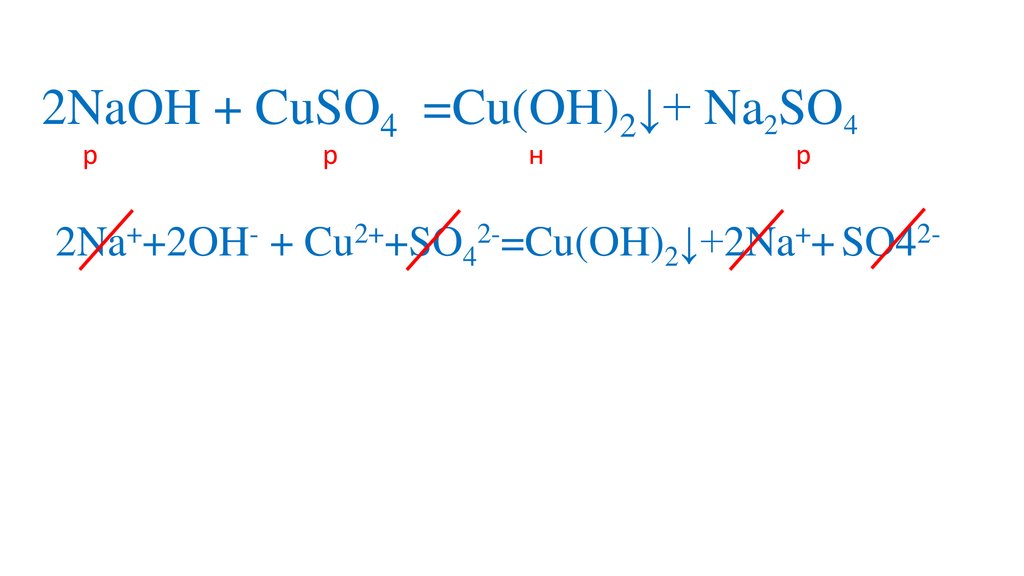
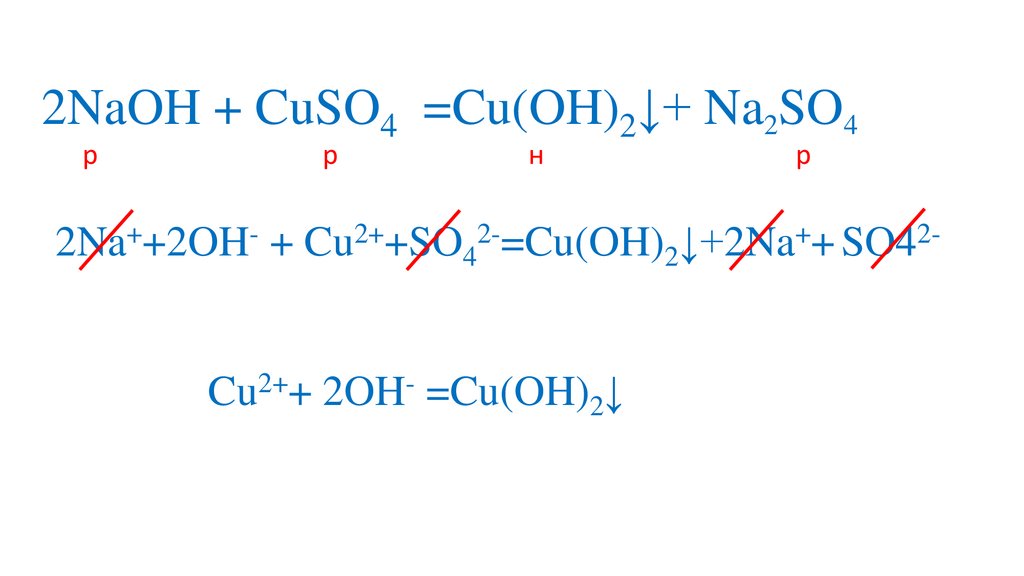

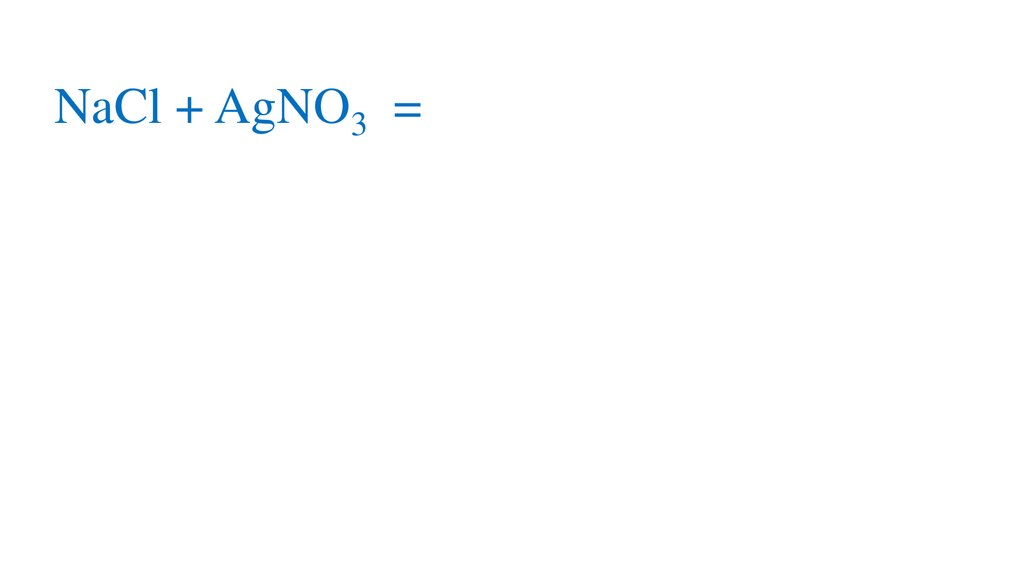
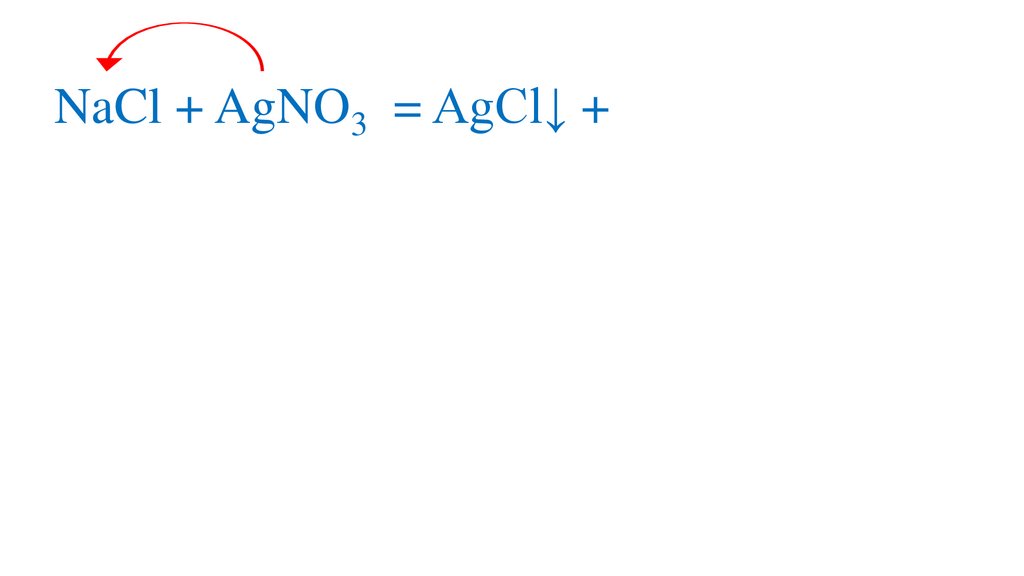
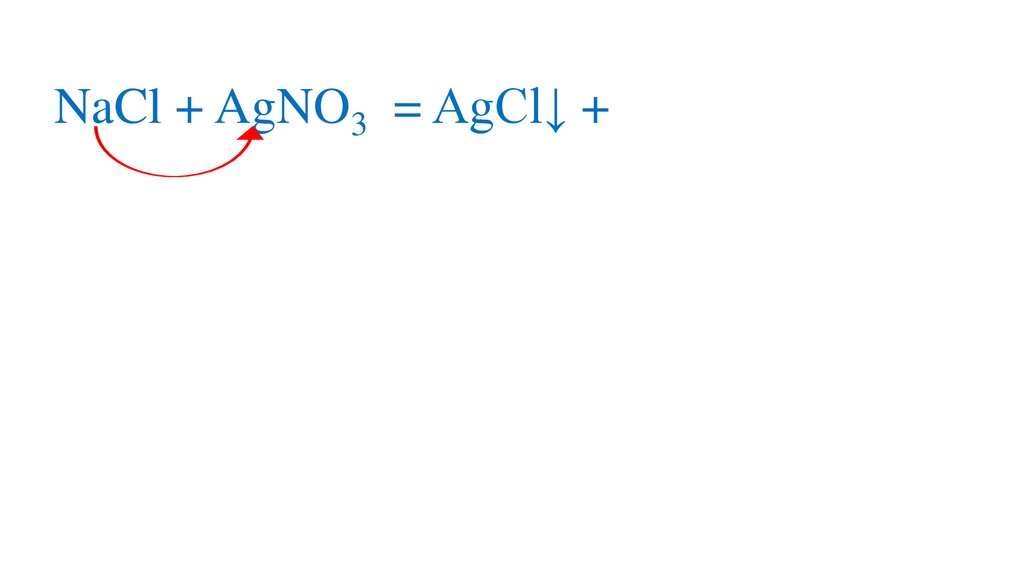
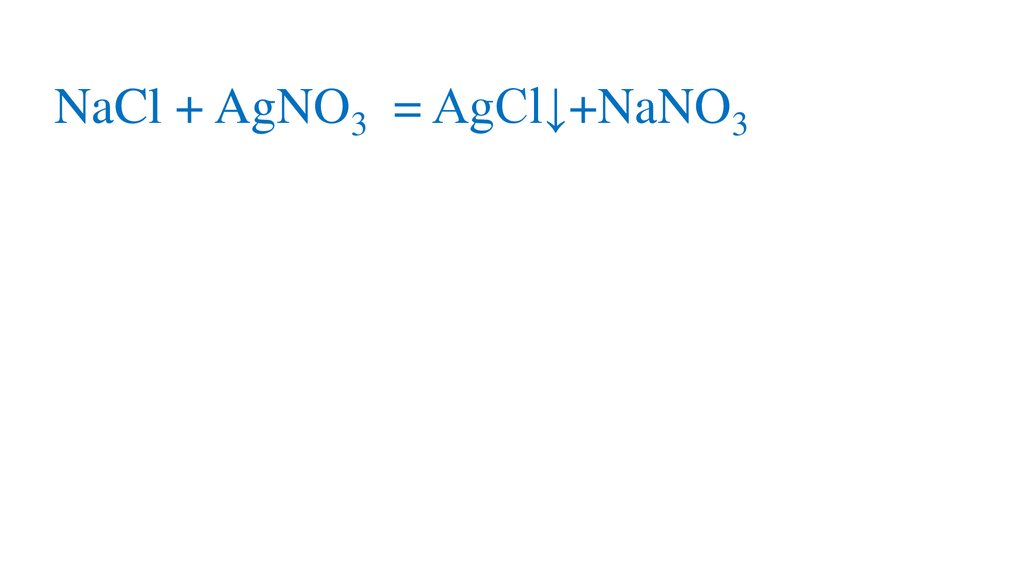
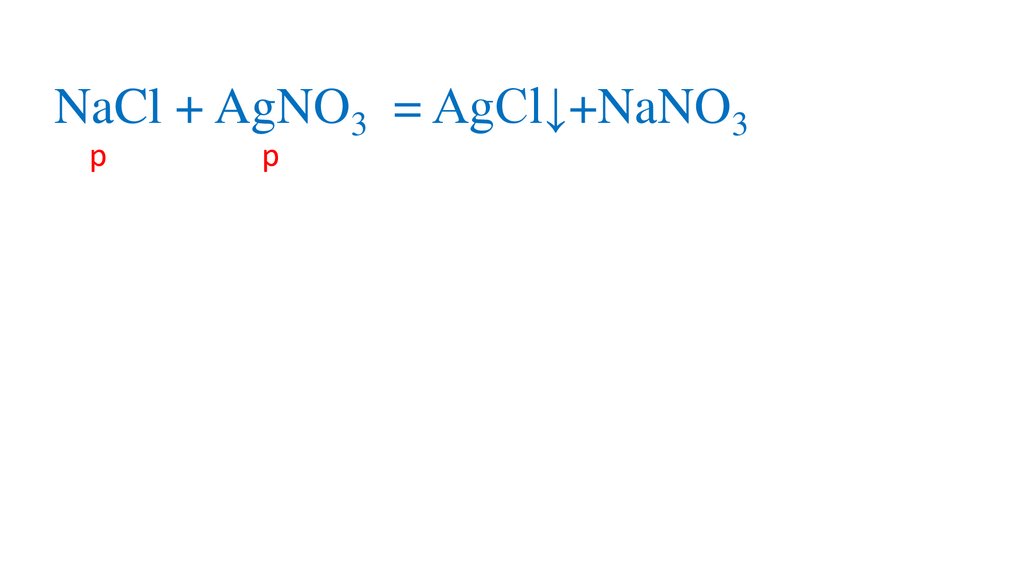
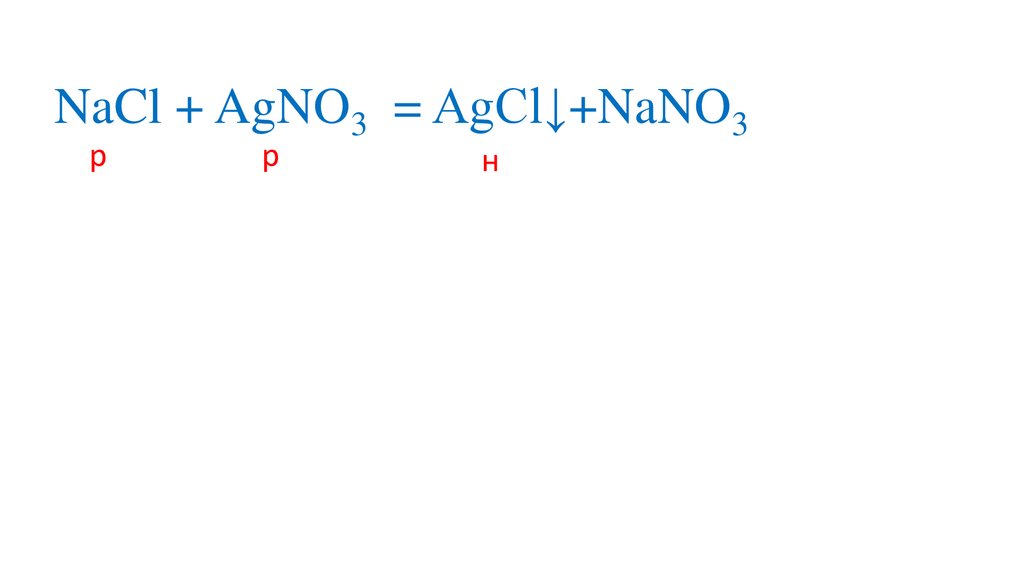
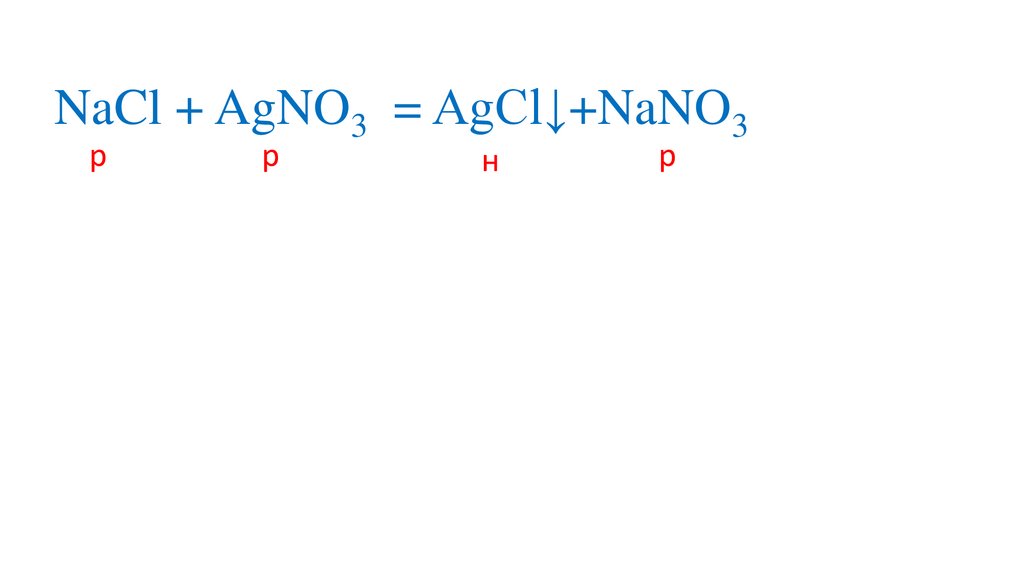
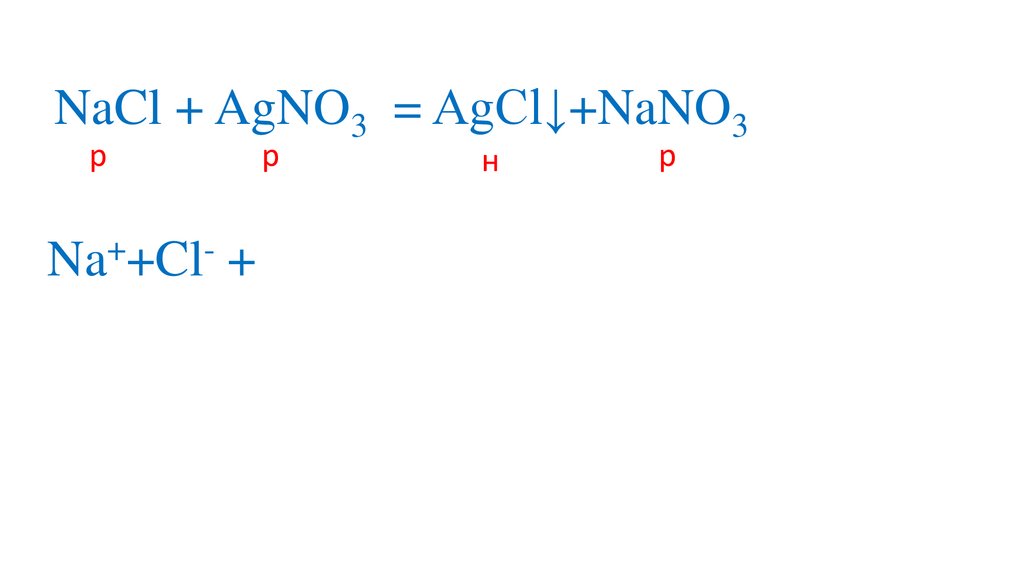
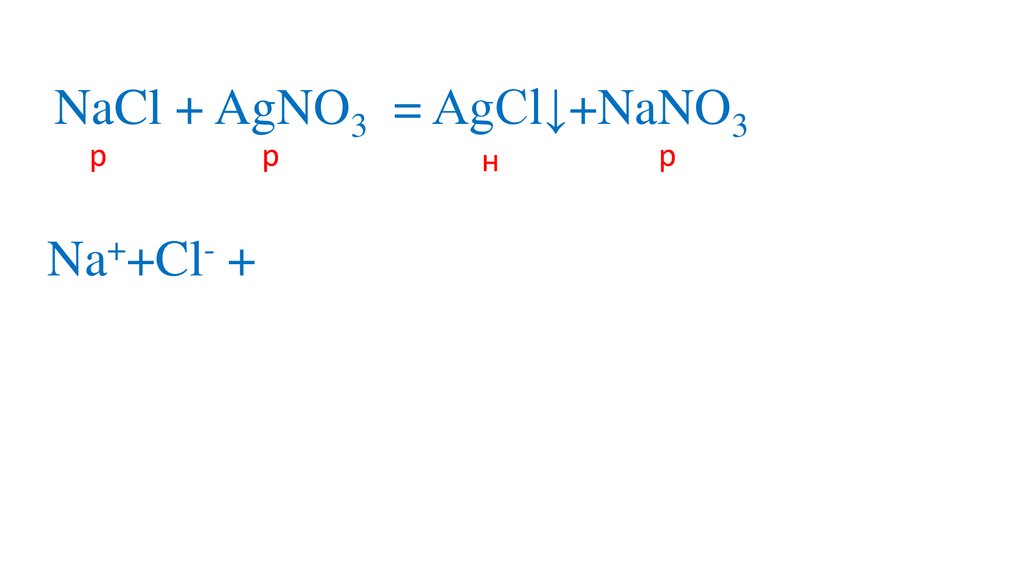
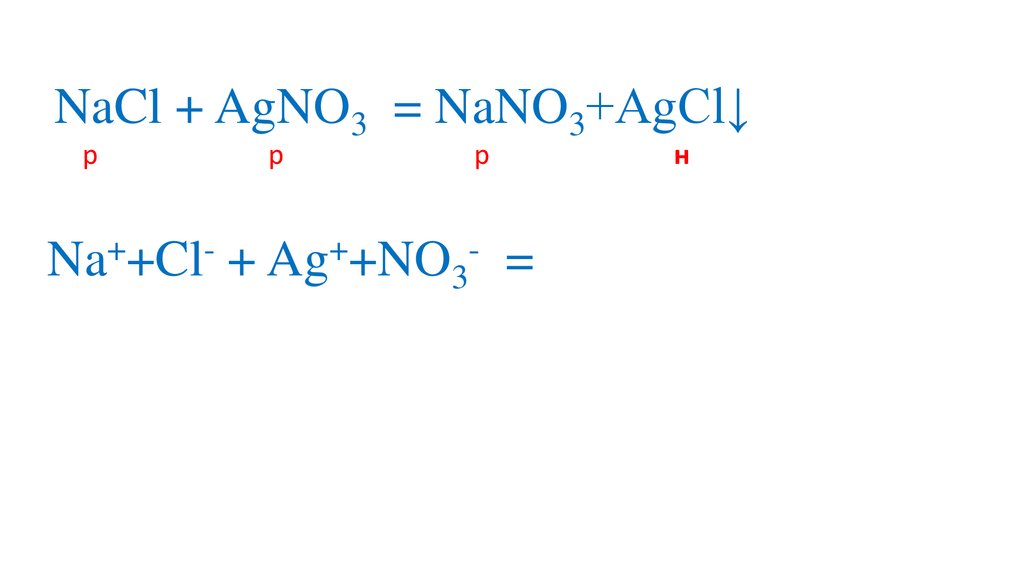
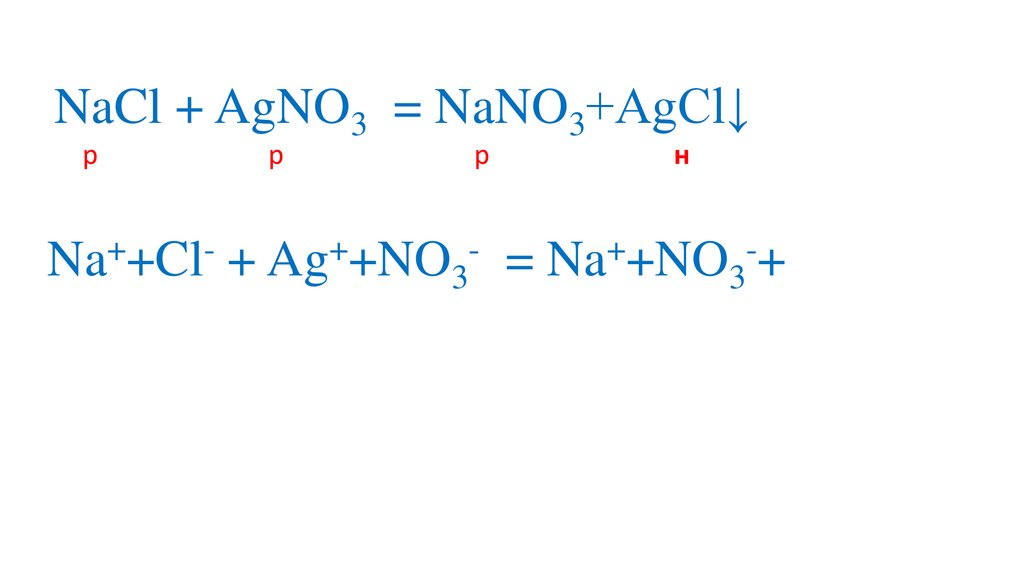
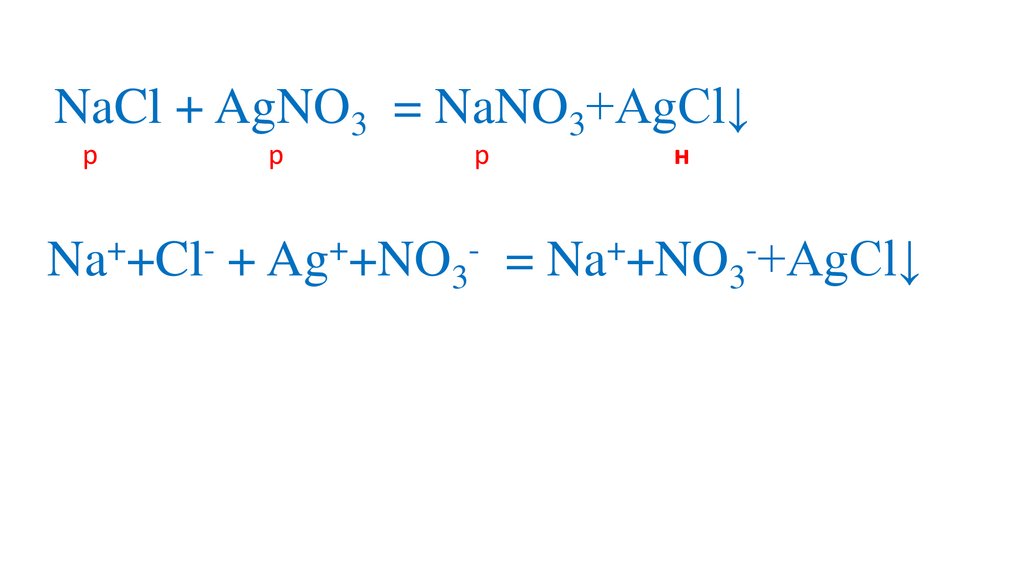
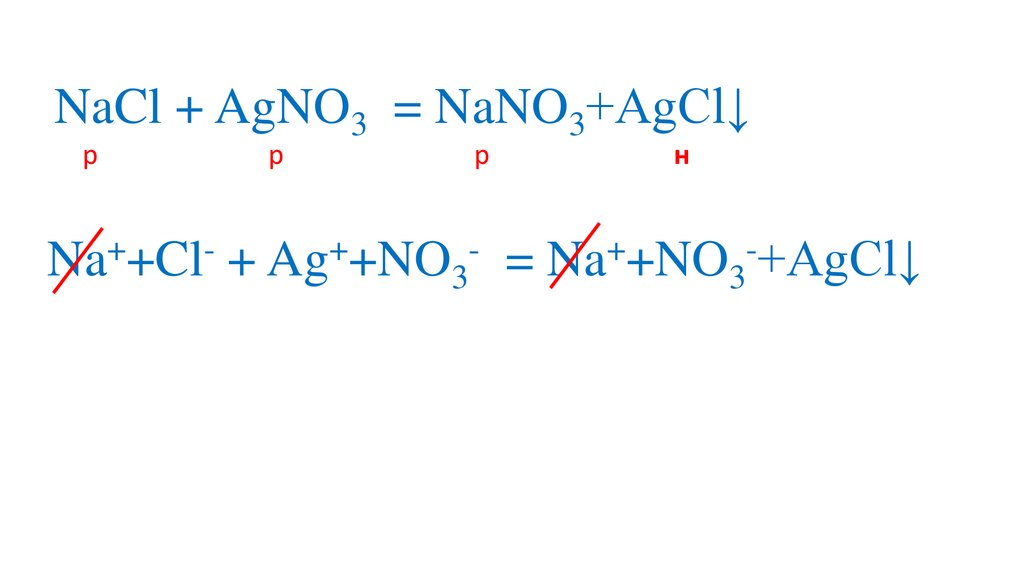
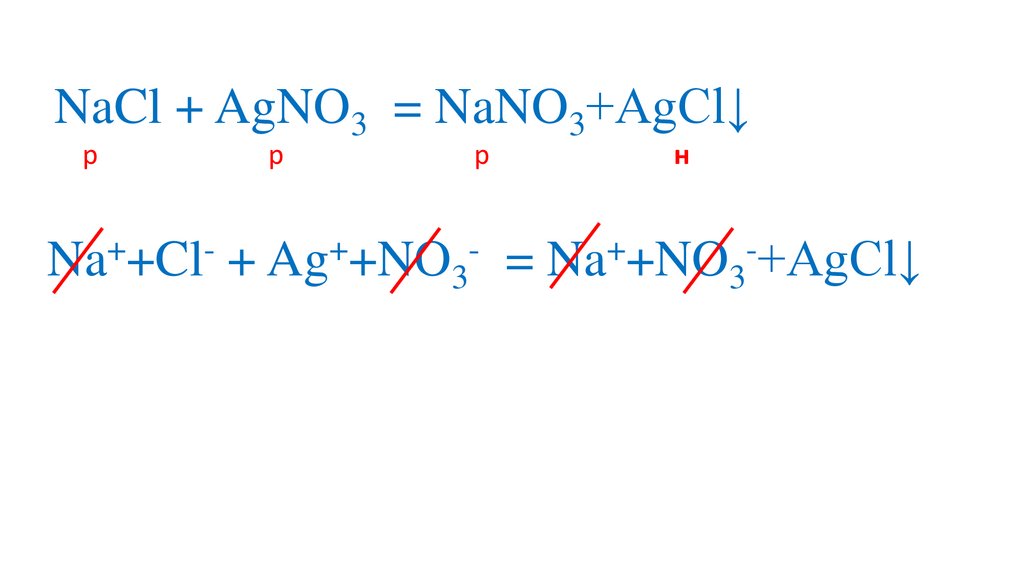
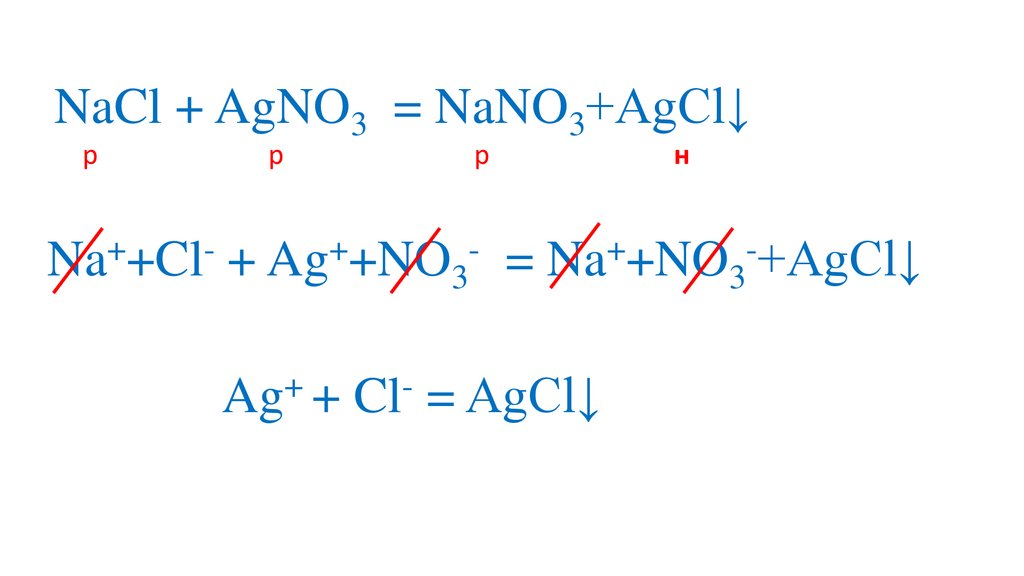






 chemistry
chemistry








