Similar presentations:
hlor
1.
Тема урока:Хлор
2.
История открытияК. Шееле
(1742-1786гг)
Хлор был получен
шведским химиком и
фармацевтом К. Шееле
в 1774 г. Название дано
по окраске
газообразного хлора ( от
греч. хлорос – желто зеленый).
3.
Положение в Периодической системе истроение атома
Хлор – элемент главной
подгруппы VII группы ПСХЭ.
Cl )2е )8е )7е
4.
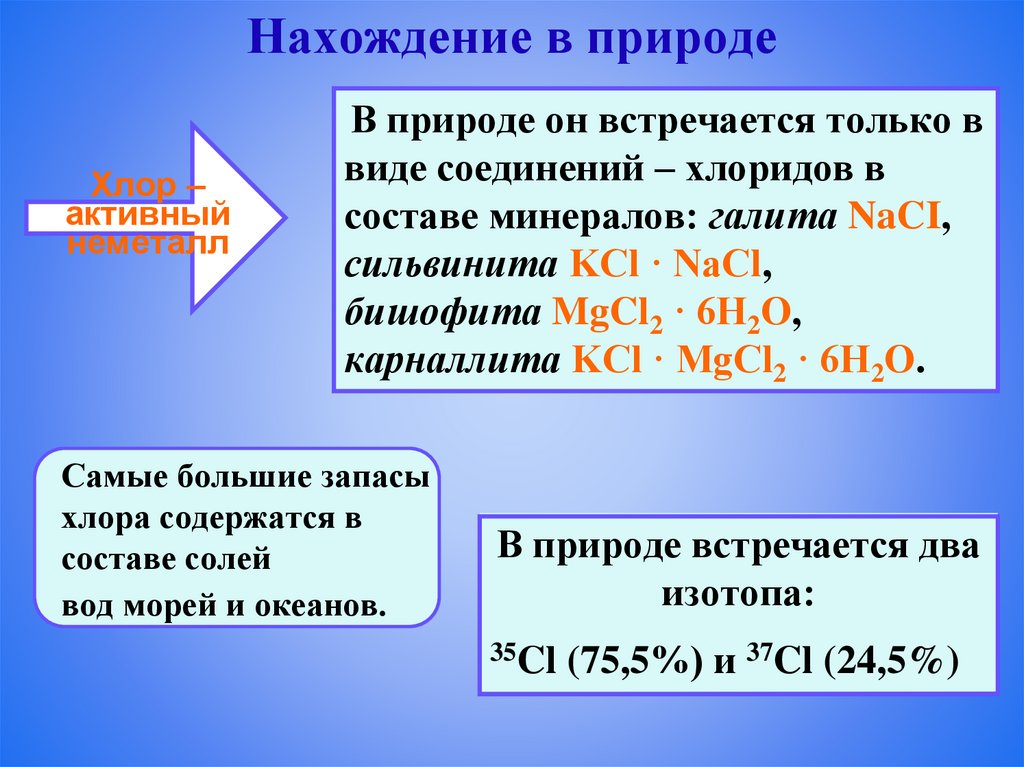
Нахождение в природеХлор –
активный
неметалл
В природе он встречается только в
виде соединений – хлоридов в
составе минералов: галита NaCI,
сильвинита KCl · NaCl,
бишофита MgCl2 · 6H2O,
карналлита KCl · MgCl2 · 6Н2O.
Самые большие запасы
хлора содержатся в
составе солей
вод морей и океанов.
В природе встречается два
изотопа:
35Cl (75,5%) и 37Cl (24,5%)
5.
Получение хлораВсе способы получения хлора сводятся к
окислению его ионов:
2Cl -1 - 2e = Cl20(Cl -1 - восстановитель, окисление)
• В промышленности
2 NaCl
2 NaCl + 2H2O
электрический
ток
электрический
ток
Cl2 + 2 Na
Cl2 + H2 + 2 NaOH
6.
• В лаборатории-1
+4
4 HCl + MnO2
2Cl -1 - 2e = Cl20
t
+2
0
MnCl2 + Cl2 + 2 H2O
1 восстановитель, окисление
Mn +4 + 2e = Mn+2 1 окислитель, восстановление
7.
Физические свойства• Газ желто-зеленого цвета, почти в 2,5
раза тяжелее воздуха, с резким
запахом, ядовит.
• Легко сжижается.
• В 1 объеме воды растворяется 2,5
объема хлора, этот раствор называется
хлорной водой.
8.
Химические свойстваХлор взаимодействует
с простыми веществами:
• с активными металлами
2 K + Cl2 = 2 KCI
9.
• с металлами принагревании
2 Fe + 3Cl2 = 2 FeCI3
Cu + Cl2 = CuCI2
• с водородом
2 Au + 3 Cl2 = 2 AuCI3
H2 + Cl2 = 2 HCl
• с неметаллами
2 P + 5Cl2 = 2 PCl5
Хлор непосредственно не реагирует с
кислородом, азотом и углеродом.
10.
Химические свойстваВзаимодействует со сложными веществами
• с водой
0
-1
+1
H2О + Cl2
HCl + НСlO
соляная
кислота
хлорноватистая
кислота
Хлорноватистая кислота неустойчива и
разлагается с образованием атомарного
кислорода
+1 -2
-1
0
HClO = HCl + O
атомарный
кислород
• вытесняет из солей бром и йод
11.
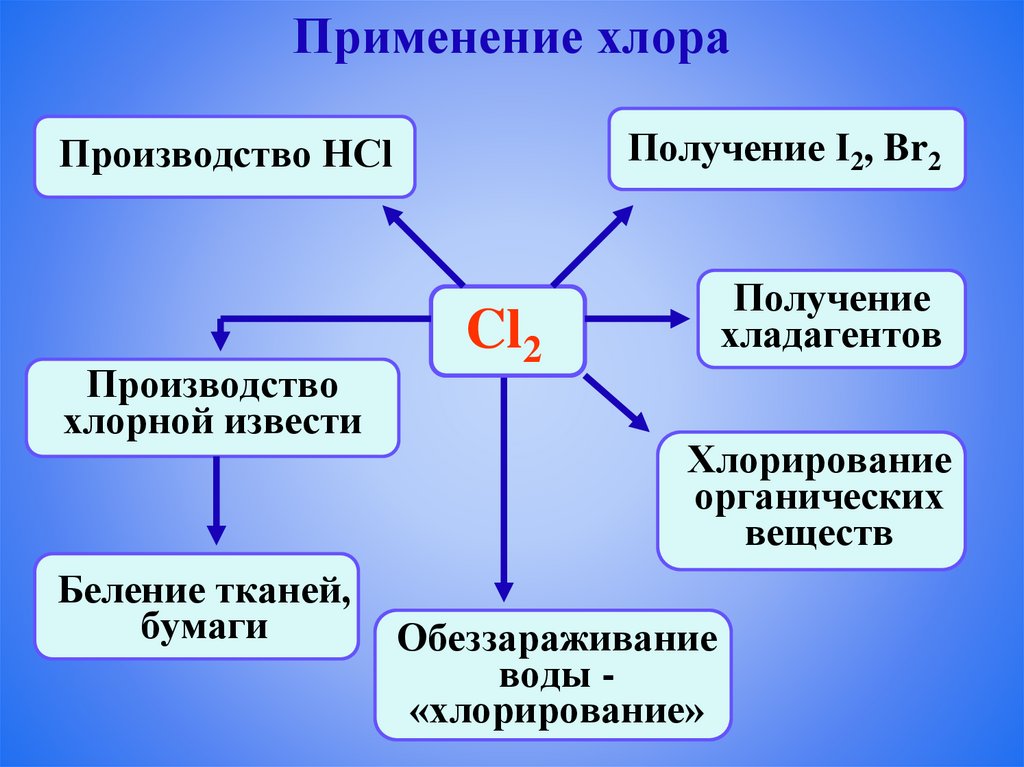
Применение хлораПолучение I2, Br2
Производство HCl
Производство
хлорной извести
Беление тканей,
бумаги
Получение
хладагентов
Cl2
Хлорирование
органических
веществ
Обеззараживание
воды «хлорирование»
12.
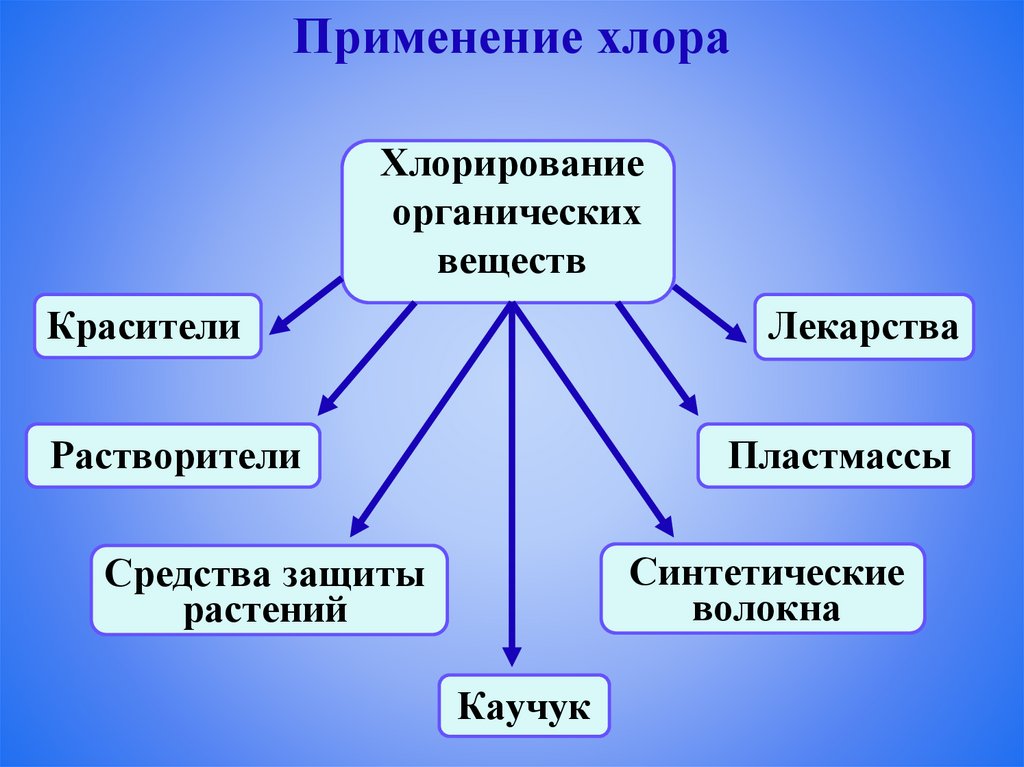
Применение хлораХлорирование
органических
веществ
Красители
Лекарства
Растворители
Пластмассы
Синтетические
волокна
Средства защиты
растений
Каучук
13.
Оконный профиль изготовленныйиз хлорсодержащих полимеров
Основным компонентом
отбеливателей является
хлорная вода
14.
• Хлор — токсичный газ, при попаданиив лёгкие вызывает ожог лёгочной ткани, удушье.
• Раздражающее действие на дыхательные пути
оказывает при концентрации в воздухе около
0,006 мг/л (т.е. в два раза выше порога
восприятия запаха хлора).
• При работе с хлором
следует пользоваться
защитной спецодеждой,
противогазом,
перчатками.
15.
• Хлор был одним из первых химическихотравляющих веществ,
использованных Германией в Первую мировую
войну.
• На короткое время
защитить органы
дыхания от попадания в
них хлора можно
тряпичной повязкой,
смоченной
раствором сульфита
натрия
Na2SO3 или тиосульфата
натрия Na2S2O3.
16.
Домашнее заданиеSS 14, упр. 1- 4 с.71













 chemistry
chemistry








