Similar presentations:
ТЭД_рН_гидролиз
1.
1ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ,
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ (pH),
ГИДРОЛИЗ СОЛЕЙ
Лектор:
Колядо Александр Владимирович
2. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
NaCl ⇄ Na+ + Cl ¯Катион
Анион
Степень диссоциации:
число молекул, распавшихся на ионы
α
100 %
общее число молекул электролита
3.
> 30 %<3%
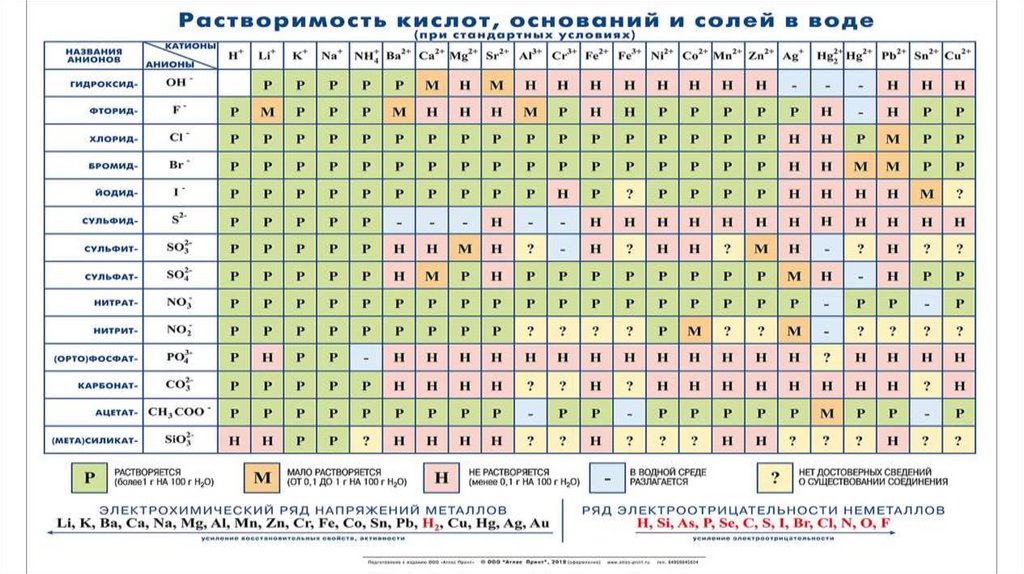
Сильные электролиты Слабые электролиты
1. HCl, HBr, HI, НNО3,
1. HF, H2S, HCN, Н3ВО3,
H2SO4, НСlО4, НСlО3,
Н2СО3, H2SiO3, HNO2,
Н2СrО4, Н2Сr2О7,
H3PO4, Н2НРО3, ,
НМnО4
HClO2, HClO
2. Все щелочи
2. Нерастворимые
3. Почти все
основания, NH4OH
растворимые соли
3. Некоторые соли
ZnCl2, HgCl2
4. Константа диссоциации
СН3СООНК р К дис
¯
+
⇄ СН3СОО + Н
СН СОО Н
3
СН 3СООН
Кдис(СН3СООН) = 1,8∙10–5
Кдис (НСN) = 8∙10–10
5. Электролитическая диссоциация воды
1,8 10 16H
OH
+
¯
K
Н2О ⇄ Н + ОН
дис
H 2O
где [H+], [OH¯] и [H2O] – молярные концентрации
частиц в воде.
Молярная концентрация воды (CM):
1 моль Н2О – 18 г
х моль Н2О – 1000 г в 1 л воды
x = 1000/18 = 55,5 моль/л
[H2O] = 55,5 моль/л
6.
Kдис
H 2O H OH 1,8 10 16 55,56 10 14
KH2O – константа воды
Ионное произведение воды:
KH2O = [H+]·[OH¯] = 10–14 моль/л
в чистой воде [H+] = [OH¯] = 10–7 моль/л
Нейтральная среда
Кислая среда
Щелочная среда
[H+] = [OH–] = 10–7
[H+] > 10–7 > [OH¯]
[H+] < 10–7 < [OH¯]
7.
Водородный показательpH = –lg[H+]
[H+] = 10–7
pH = –lg10–7 = 7 нейтральная среда
pH < 7 кислая среда
pH > 7 щелочная среда
8.
Задача 1. Дано: [H+] = 10–2 моль/лНайти: pH = ?
Решение: pH = –lg[H+] = –lg10–2 = 2
рН < 7 – среда кислая
Задача 2. Дано: [ОH–] = 10–4 моль/л
Найти: pH = ?
Решение: [H+]·[OH–] = 10–14
[H+] · 10–4 = 10–14
[H+] = 10–10
pH = –lg10–10 = 10 > 7 – среда щелочная
9. ГИДРОЛИЗ СОЛЕЙ
1. Гидролиз соли, образованной сильнымоснованием и слабой кислотой.
Na2CO3 ⇄ 2Na+ + CO32–
NaOН
Сильное
основание
pH > 7
H2CO3
Слабая
кислота
10.
I ст. CO32– + H+OН– ⇄ HCO3– + OН–pH > 7
Na2CO3 + H2O ⇄ NaHCO3 + NaOН
–
–
+
II ст. HCO + H OН ⇄ H CO
3
2
3
–
+ OН
pH > 7
NaHCO3 + H2O ⇄ H2CO3 + NaOН
11.
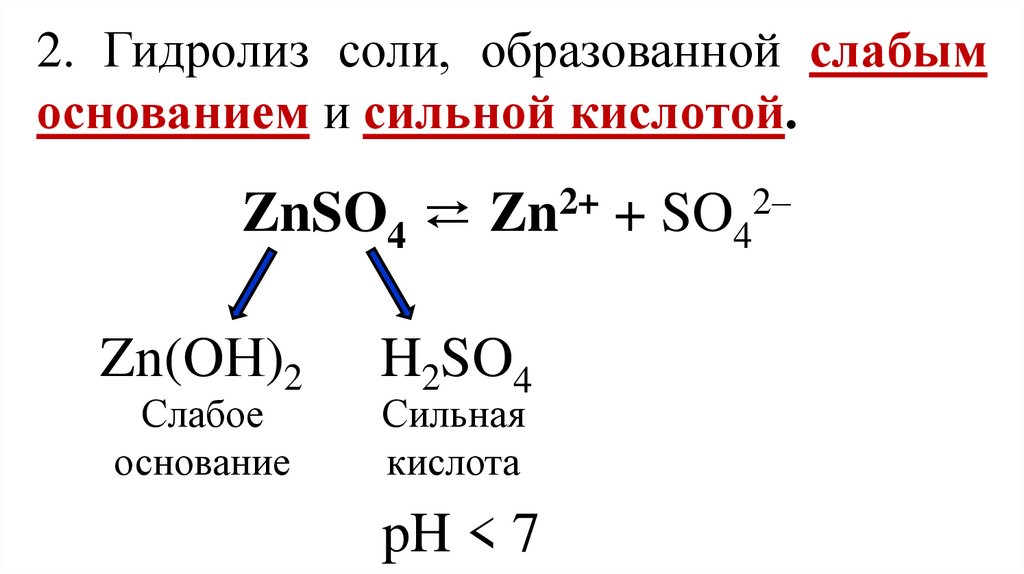
2. Гидролиз соли, образованной слабымоснованием и сильной кислотой.
ZnSO4 ⇄ Zn2+ + SO42–
Zn(OН)2
Слабое
основание
H2SO4
Сильная
кислота
pH < 7
12.
I ст. Zn2+ + H+OН– ⇄ ZnOH+ + Н+ pH < 72ZnSO4 + 2H2O ⇄ (ZnOH)2SO4 + H2SO4
II ст. ZnOH+ + H+OН– ⇄ Zn(OH)2 + Н+
pH < 7
(ZnOH)2SO4 + 2H2O ⇄ 2Zn(OH)2 + H2SO4
13.
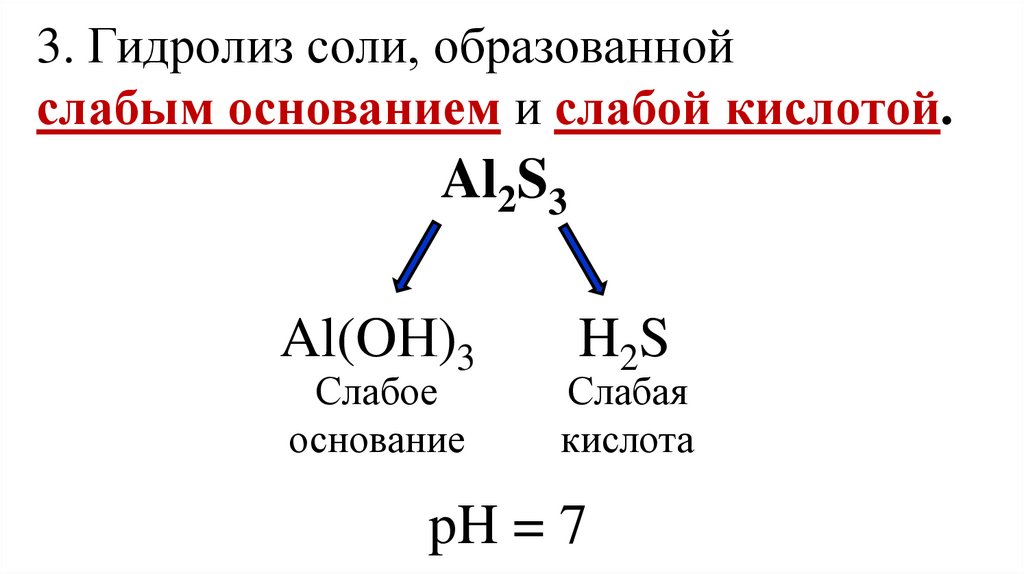
3. Гидролиз соли, образованнойслабым основанием и слабой кислотой.
Al2S3
Al(OН)3
Слабое
основание
H2S
Слабая
кислота
pH = 7
14.
Al2S3 + 6H2O → 2Al(OH)3 + 3H2S2Al3+ + 3S2– + 6H2O → 2Al(OH)3 + 3Н2S
15.
4. Соль образованнаясильным основанием и сильной кислотой
гидролизу не подвергается
NaCl + H2O ≠
NaOH
Сильное
основание
HCl
Сильная
кислота
pH = 7
гидролиз не идет
16. Совместный гидролиз двух солей
AlCl3 + Na2S + H2O = …Записываем обменную реакцию между солями:
2AlCl3 + 3Na2S = Al2S3 + 6NaCl
Гидролизу подвергается только Al2S3:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
Результат:
2AlCl3 + 3Na2S + 6H2O =
= 2Al(OH)3 + 3H2S + 6NaCl
17.
18.
Выполните задания1. Напишите уравнения диссоциации на ионы следующих
веществ: H2SO3, HClO4, Ca(OH)2, Fe2(SO4)3, Na2HPO4, AlCl3,
K2CO3, NaHSO4, H3PO4.
2. Запишите уравнения реакций в молекулярном и ионном
виде, протекающие между веществами:
а) сульфат никеля (II) и гидроксид натрия;
б) карбонат калия и азотная кислота;
в) гидроксид бария и соляная кислота.
3. При растворении 0,01 моль уксусной кислоты в воде 20%
всех растворённых молекул распалось на ионы. Сколько
отдельных частиц растворённого вещества содержит раствор?
19.
Выполните задания4. Определите концентрацию ионов K+ и SO42 в растворе
сульфата калия концентрацией 0,1 моль/л, считая
диссоциацию этой соли полной.
5. Определите эффективную концентрацию гидроксильных
ионов в 0,2М растворе гидроксида натрия, если кажущаяся
степень диссоциации NaOH равна 90%.
6. Составьте молекулярные уравнения для реакций,
сущность которых выражается следующими ионными
уравнениями:
а) Pb2+ + 2 Cl = PbCl2
б) Mg2+ + 2 OH = Mg(OH)2
20.
Выполните задания7. Определите рН 0,002М раствора азотной кислоты, считая
диссоциацию полной.
8. Определите рН раствора, содержащего в литре 0,4 г
гидроксида натрия, считая диссоциацию последнего полной.
9. Вычислите рН 0,01М раствора уксусной кислоты, степень
диссоциации которой в этом растворе равна 4,2%.
10. Определите концентрацию водородных и гидроксильных
ионов в растворе, водородный показатель которого равен 5.
11. Как измениться рН дистиллированной воды, если к
литру её прибавить 0,001 моль гидроксида натрия? Считать
диссоциацию полной.
21.
Выполните задания12. Составьте молекулярные и ионные уравнения гидролиза
следующих солей: K2S, FeCl3, Al2(SO4)3, Na2CO3.
13. Из предложенных солей: KCl, Na2S, Na2SO4, Be(NO3)2,
K2CO3, выберите ту, в которой лакмус окрасится в розовый
цвет. Ответ подтвердите, составив уравнения гидролиза соли.
14. Составьте уравнения совместного гидролиза,
протекающего при сливании растворов следующих солей:
а) Na2S и CrCl3;
б) Al2(SO4)3 и K2CO3;
в) FeCl3 и Na2CO3.
22.
Выполните задания15. Найти молярную концентрацию ионов Н+ в водных
растворах, в которых концентрация гидроксид-ионов (в
моль/л) составляет: а) 10 4; б) 3,2 10 4.
16. Найти молярную концентрацию ионов ОН в водных
растворах, в которых концентрация катионов водорода (в
моль/л) составляет: а) 10 3; б) 6,5 10 8.
17. Вычислите рН растворов, если:
а) [H+] = 3,5 10 6 моль/л;
б) [ОН ] = 9,5 10 10 моль/л;
а) рОН = 10,5.
23.
Выполните задания18. Написать в ионно-молекулярной форме уравнения
реакций, приводящих к образованию малорастворимых
осадков или газов:
а) Pb(NO3)2 + KI;
б) NiCl2 + H2S;
в) K2CO3 + HCl;
г) Na2SO3 + H2SO4.
19. Составьте в молекулярной форме уравнения реакций,
которые выражаются следующими ионно-молекулярными
уравнениями:
а) NO2 + H+ = HNO2;
б) Сu2+ + 2 OH = Cu(OH)2.
24.
Выполните задания20. Какие из перечисленных ниже солей подвергаются
гидролизу:
KNO3, NaNO2, KOCl, NaCl, CH3COONH4, CaCl2. NaClO4, KBr.
Для каждой из гидролизующихся солей написать уравнение
гидролиза в ионно-молекулярной форме и указать реакцию её
водного раствора.
21. При сливании водных растворов хлорида железа (III) и
сульфида калия образуется осадок гидроксида железа (III) и
выделяется газ. Составить молекулярное и ионномолекулярное уравнение происходящей реакции.









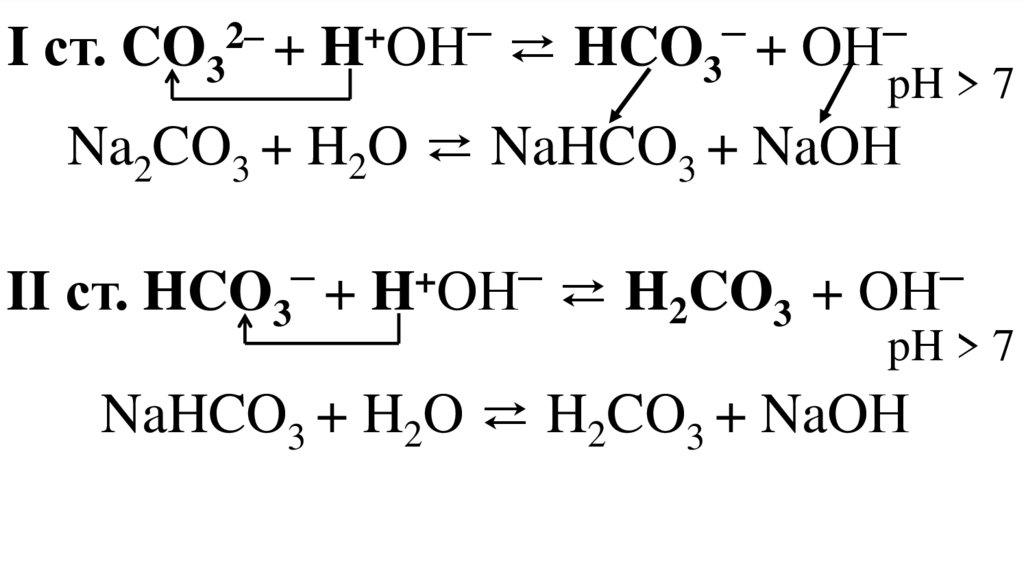
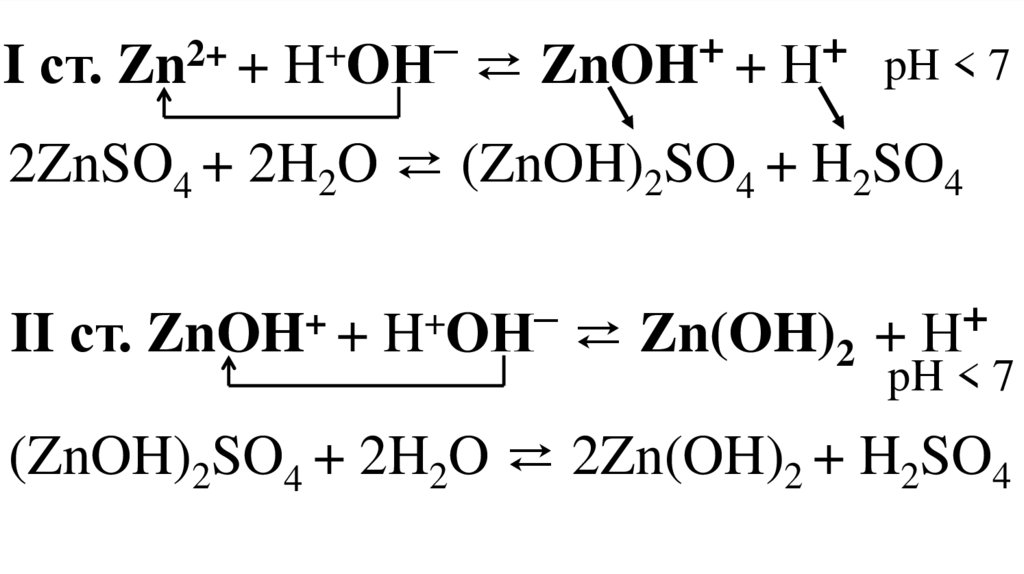
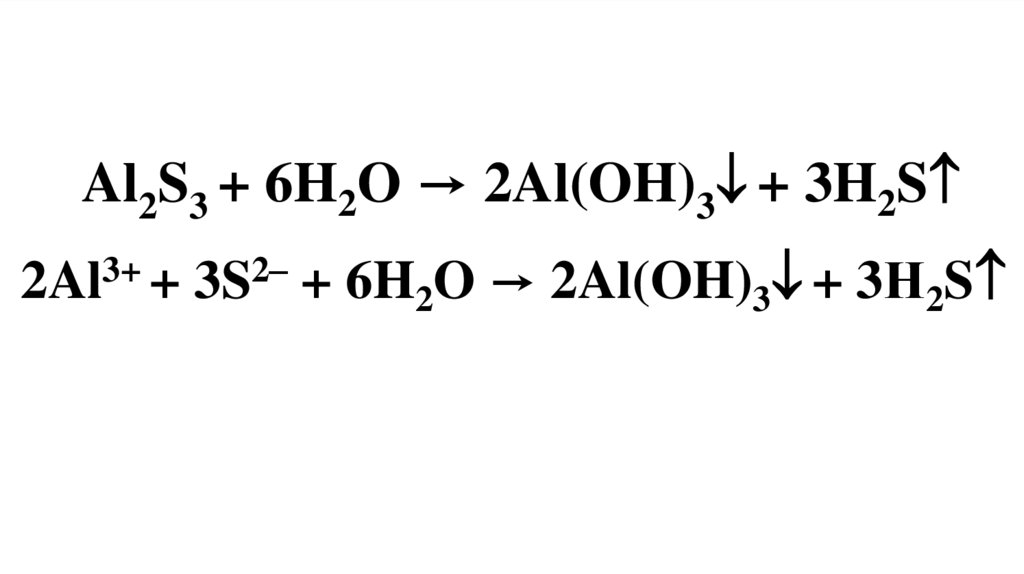









 chemistry
chemistry








