Similar presentations:
1_Сера и ее соединения
1.
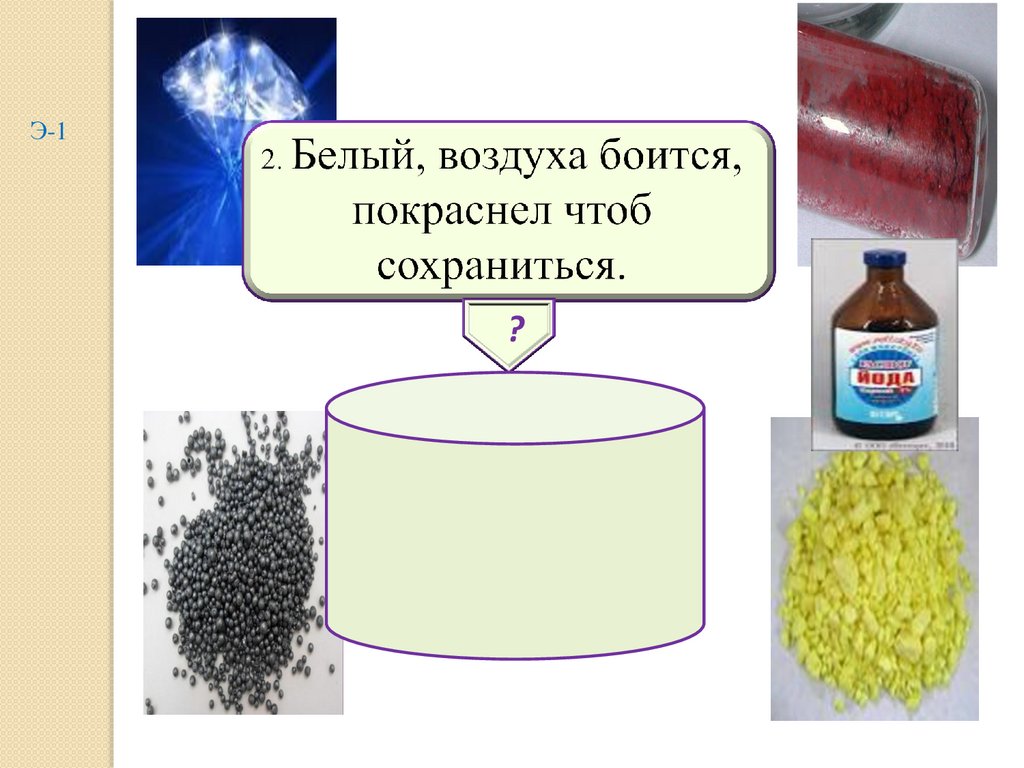
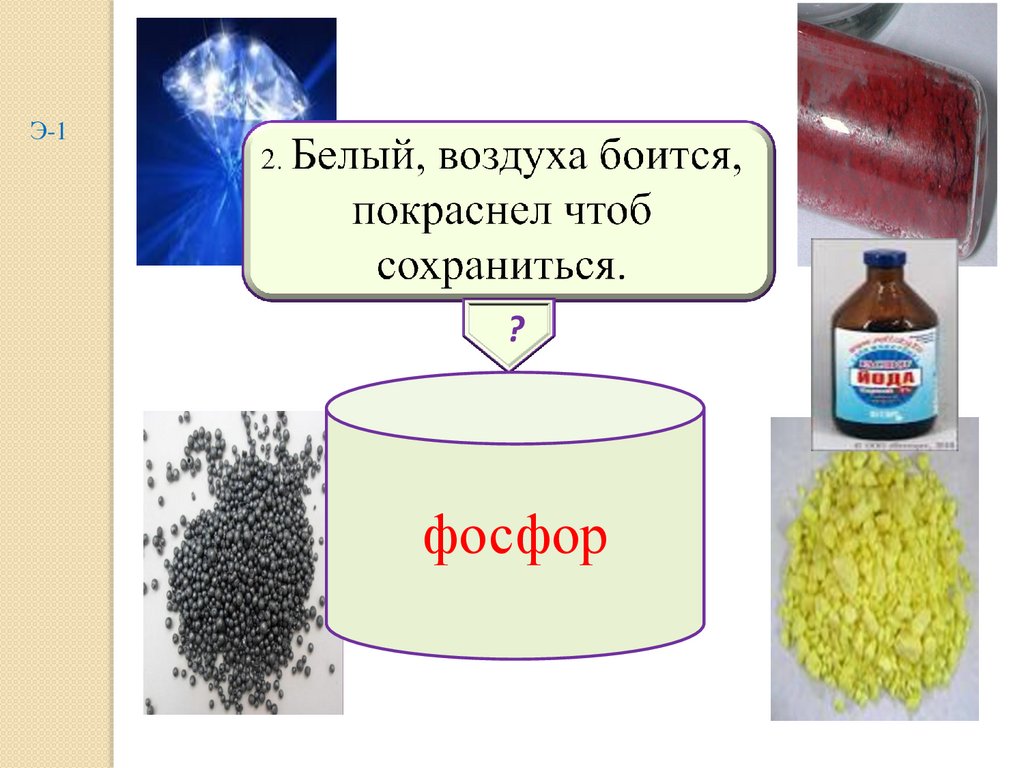
2.
Э-1?
3.
Э-1?
йод
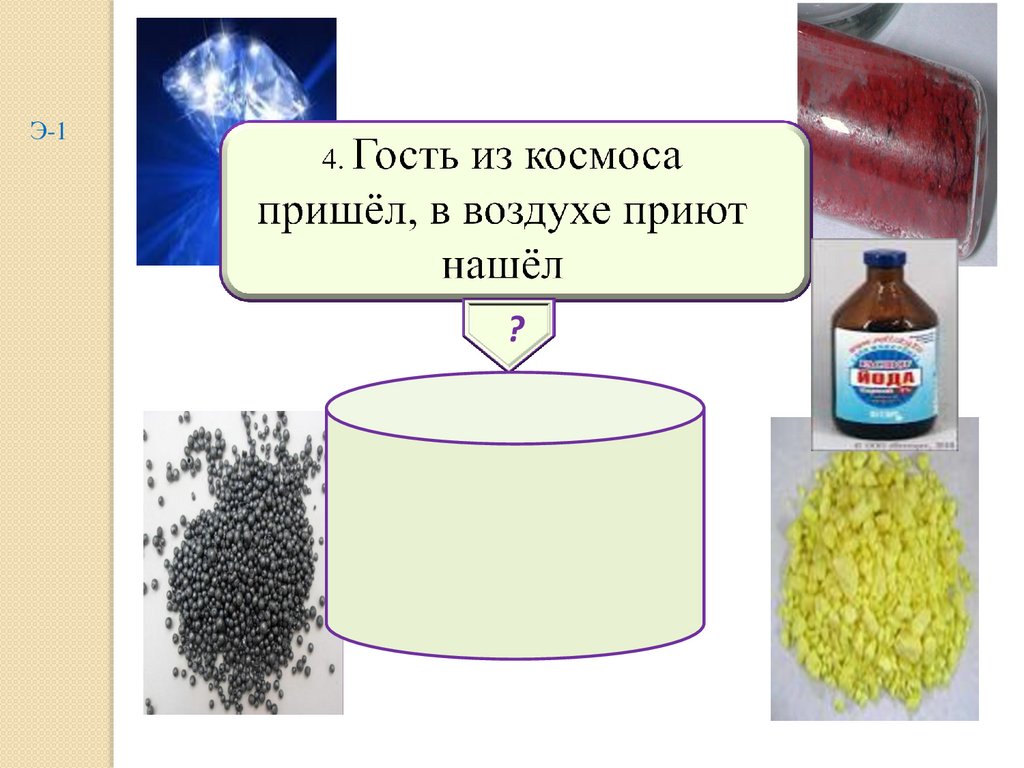
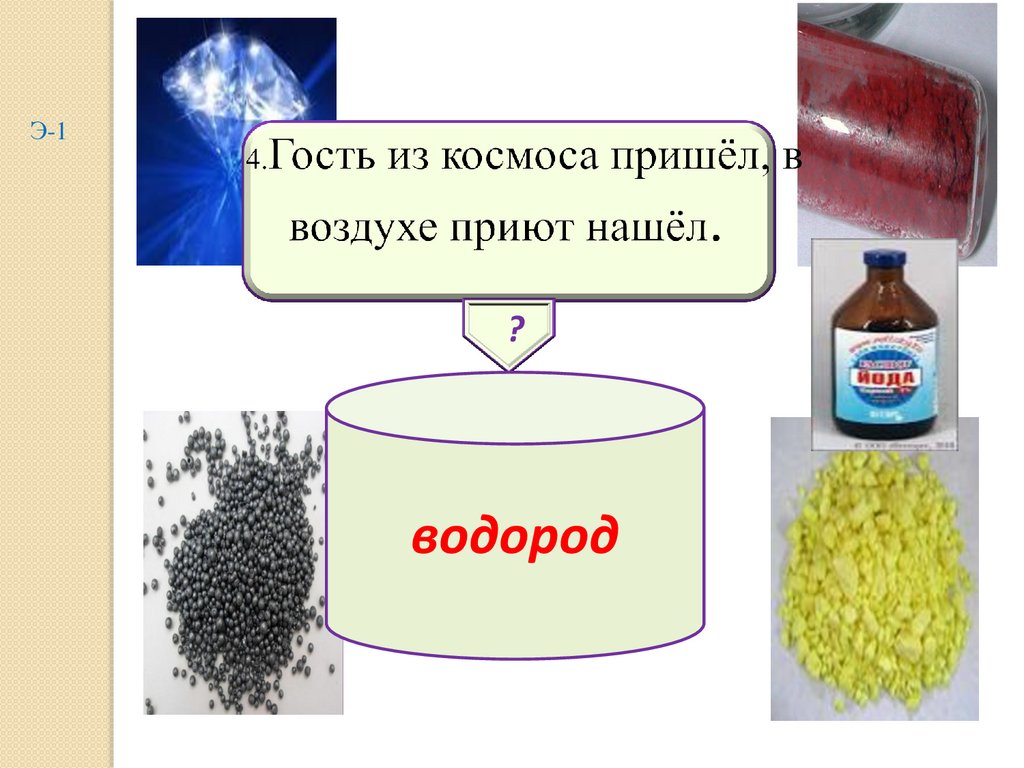
4.
Э-1?
5.
Э-1?
фосфор
6.
Э-1?
7.
Э-1?
сера
8.
Э-1?
9.
Э-1?
водород
10.
Э-1?
11.
Э-1?
неон
12.
13.
Сера и её соединения.14.
План изучения соединений серы1.Сера-химический элемент
2. Какими свойствами
характеризуются эти
соединения?
3.Какие из этих веществ
проявляют только
окислительные свойства, а
какие — и окислительные?
15.
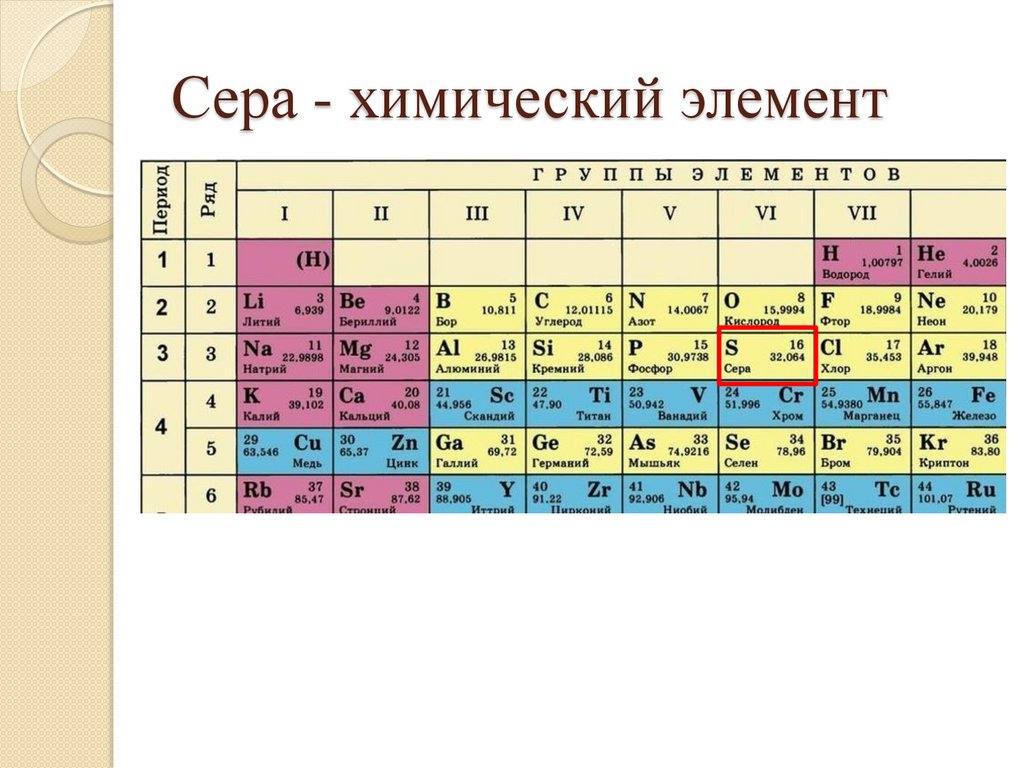
Сера-химический элемент16.
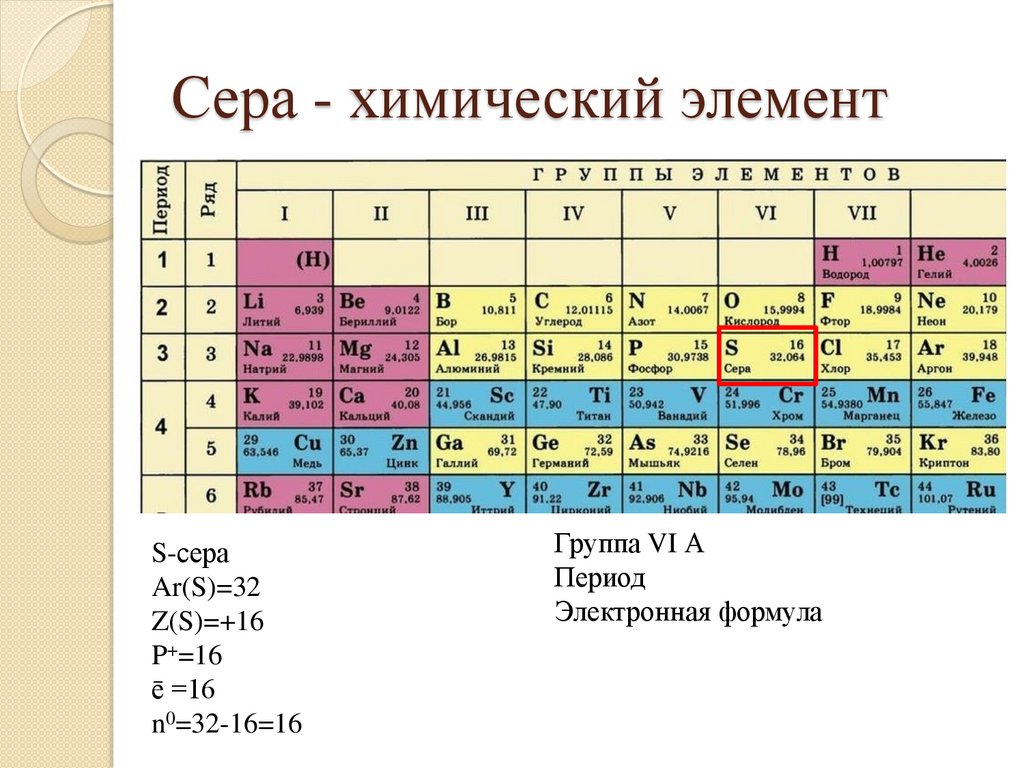
Сера - химический элемент17.
Сера - химический элементS-сера
Ar(S)=
Z(S)=
P+ =
ē=
n0=
Группа
Период
Электронная формула
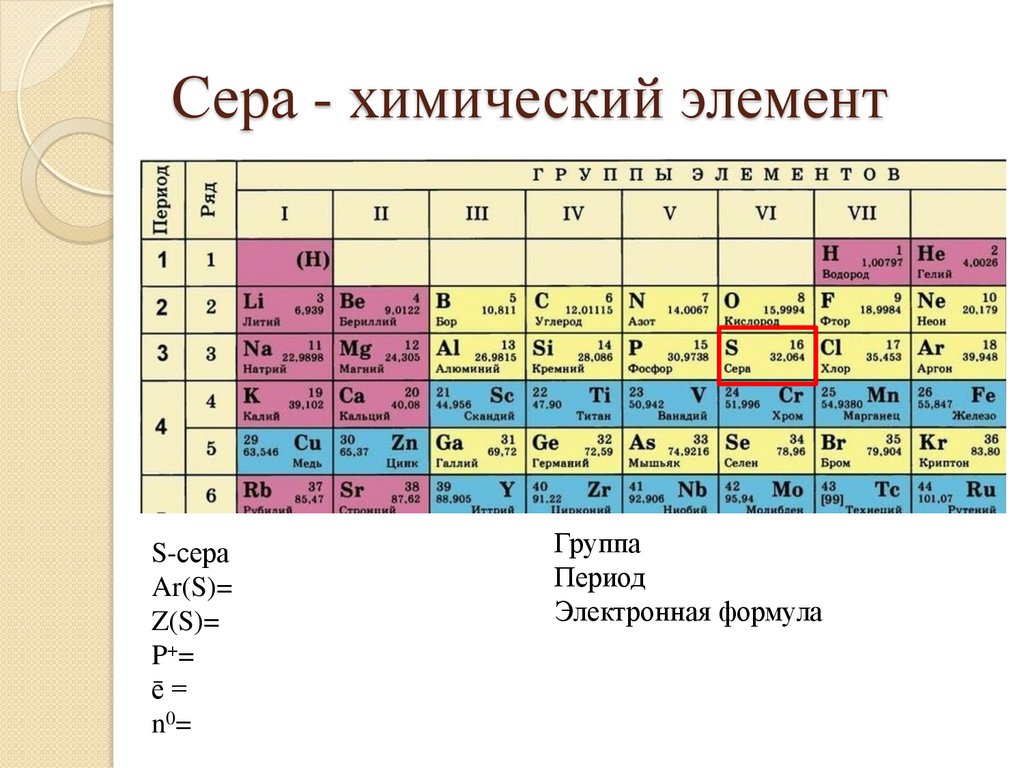
18.
Сера - химический элементS-сера
Ar(S)=
Z(S)=
P+ =
ē=
n0=
Группа
Период
Электронная формула
19.
Сера - химический элементS-сера
Ar(S)=32
Z(S)=
P+ =
ē=
n0=
Группа
Период
Электронная формула
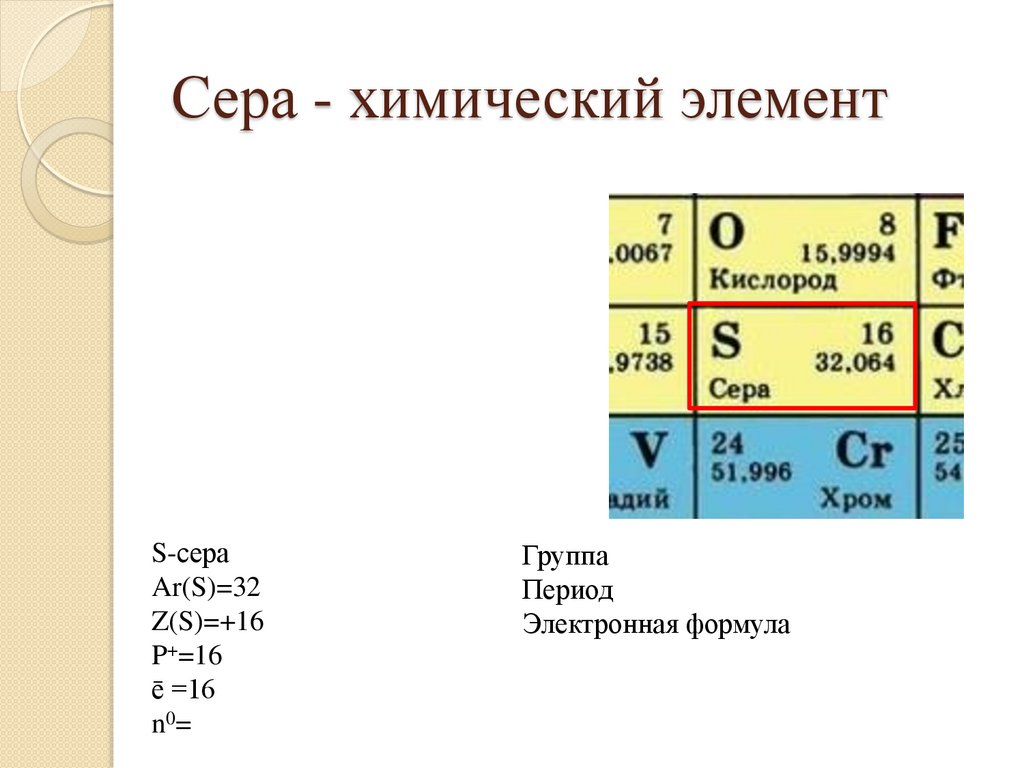
20.
Сера - химический элементS-сера
Ar(S)=32
Z(S)=+16
P+ =
ē=
n0=
Группа
Период
Электронная формула
21.
Сера - химический элементS-сера
Ar(S)=32
Z(S)=+16
P+=16
ē=
n0=
Группа
Период
Электронная формула
22.
Сера - химический элементS-сера
Ar(S)=32
Z(S)=+16
P+=16
ē =16
n0=
Группа
Период
Электронная формула
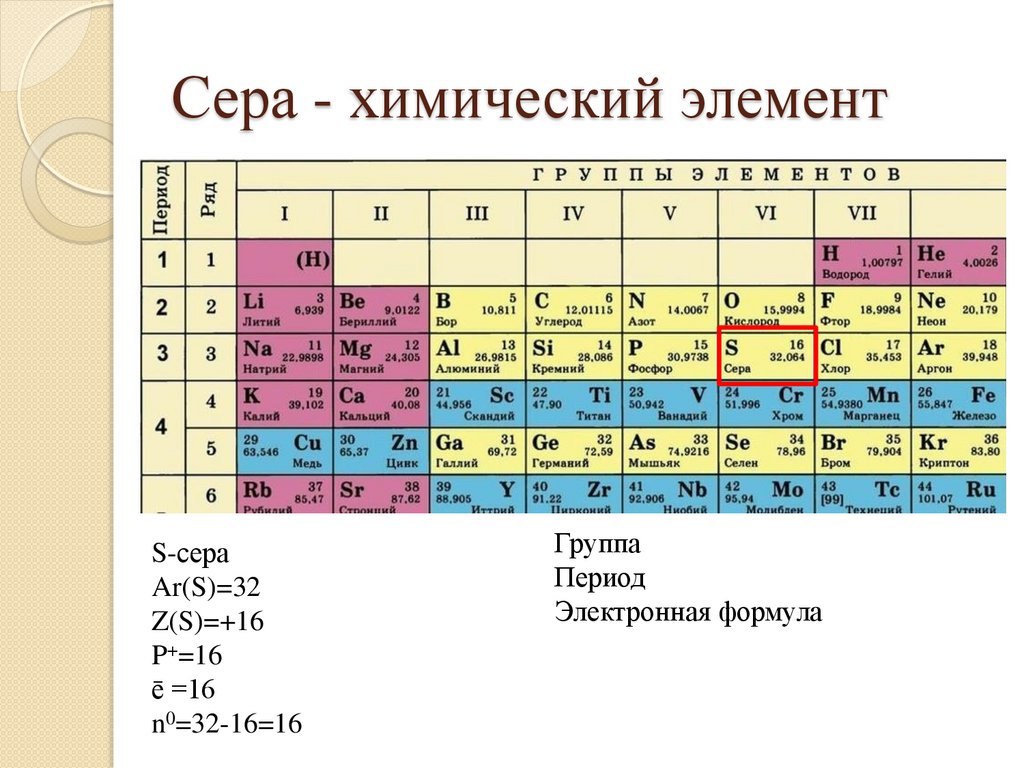
23.
Сера - химический элементS-сера
Ar(S)=32
Z(S)=+16
P+=16
ē =16
n0=32-16=16
Группа
Период
Электронная формула
24.
Сера - химический элементS-сера
Ar(S)=32
Z(S)=+16
P+=16
ē =16
n0=32-16=16
Группа
Период
Электронная формула
25.
Сера - химический элементS-сера
Ar(S)=32
Z(S)=+16
P+=16
ē =16
n0=32-16=16
Группа VI А
Период
Электронная формула
26.
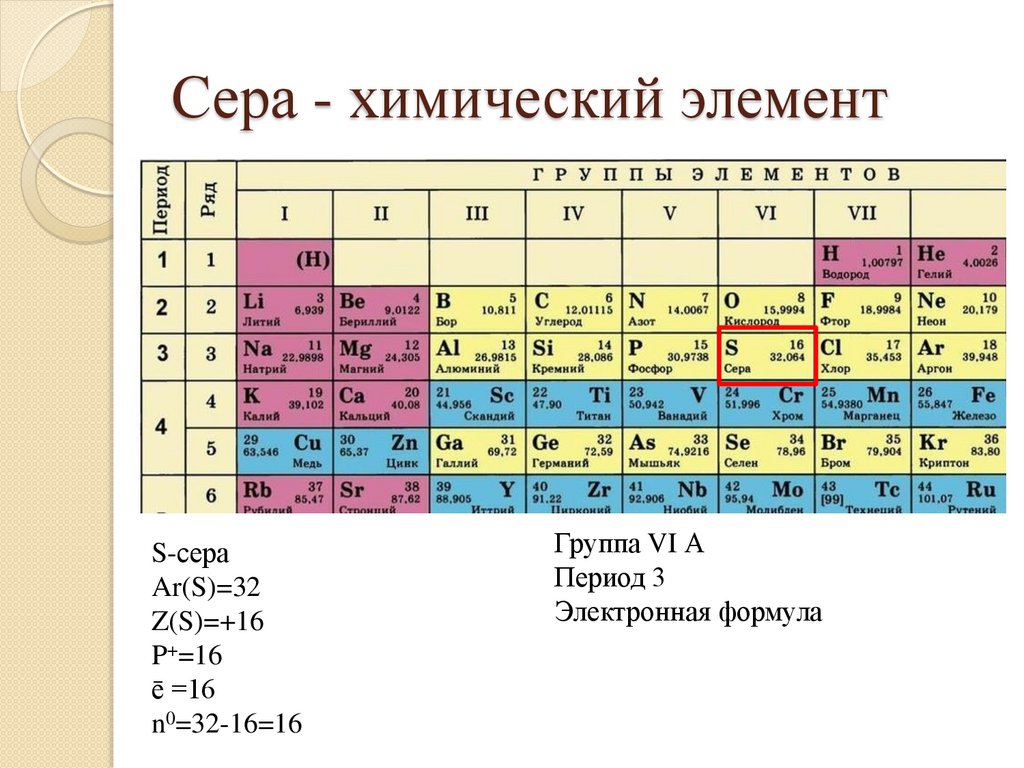
Сера - химический элементS-сера
Ar(S)=32
Z(S)=+16
P+=16
ē =16
n0=32-16=16
Группа VI А
Период 3
Электронная формула
27.
Сера - химический элемент28.
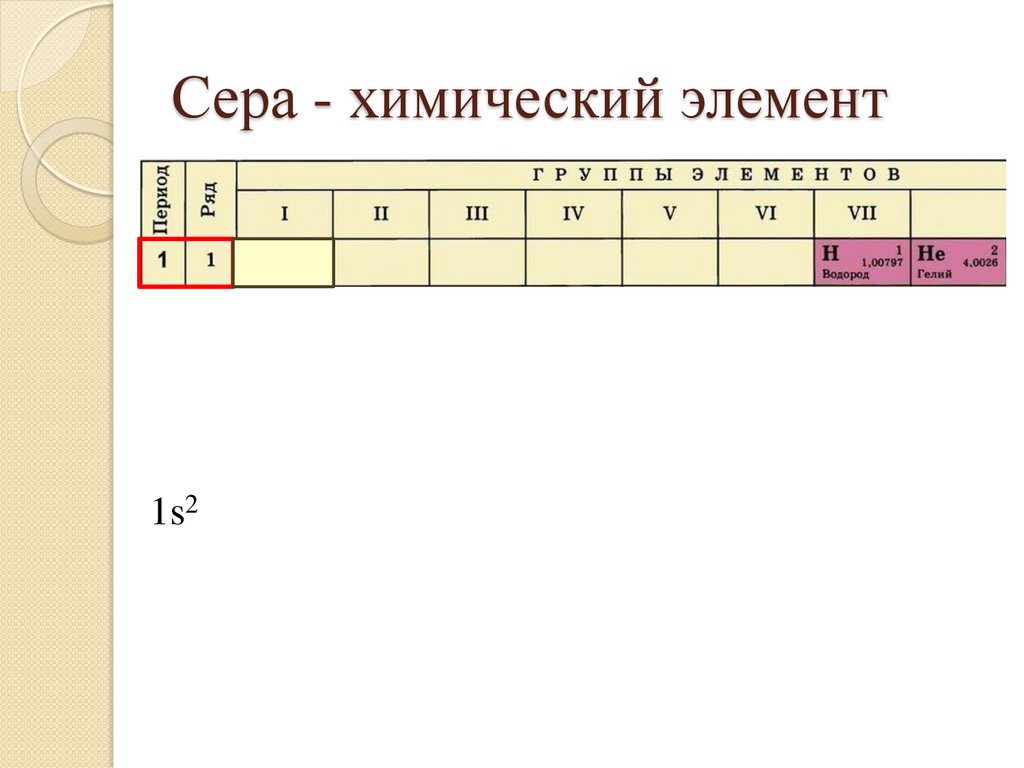
Сера - химический элемент1s22s22p63s23p4
29.
Сера - химический элемент1s22s22p63s23p4
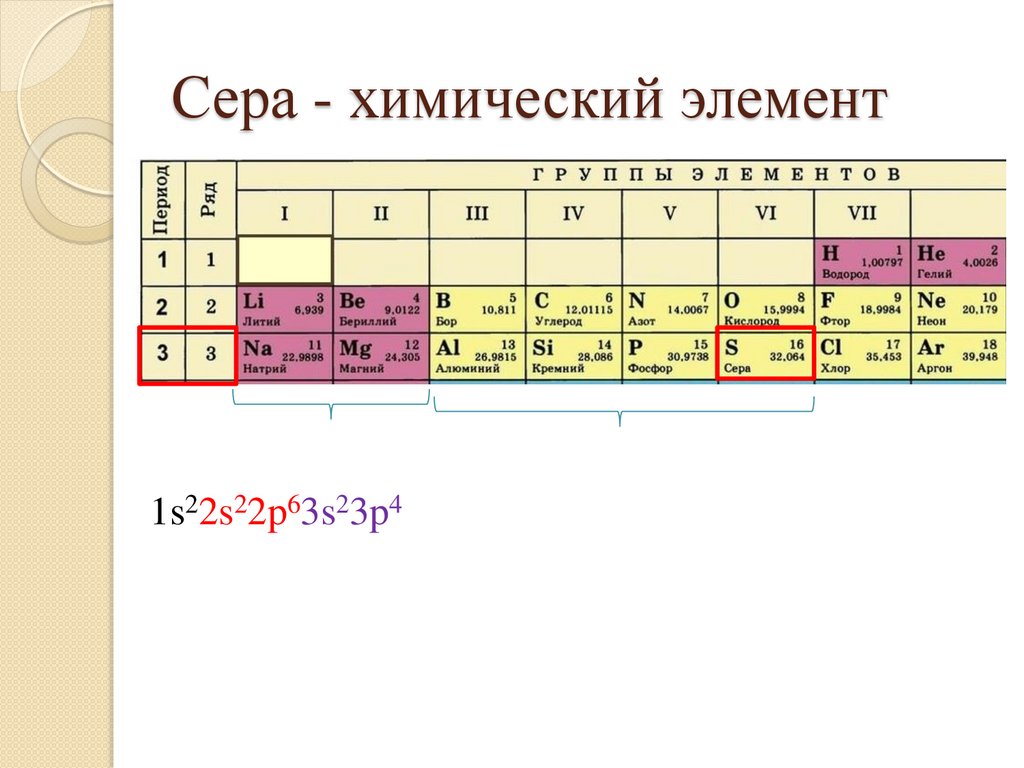
30.
Сера - химический элемент1s22s22p63s23p4
31.
Сера - химический элемент1s22s22p63s23p4
32.
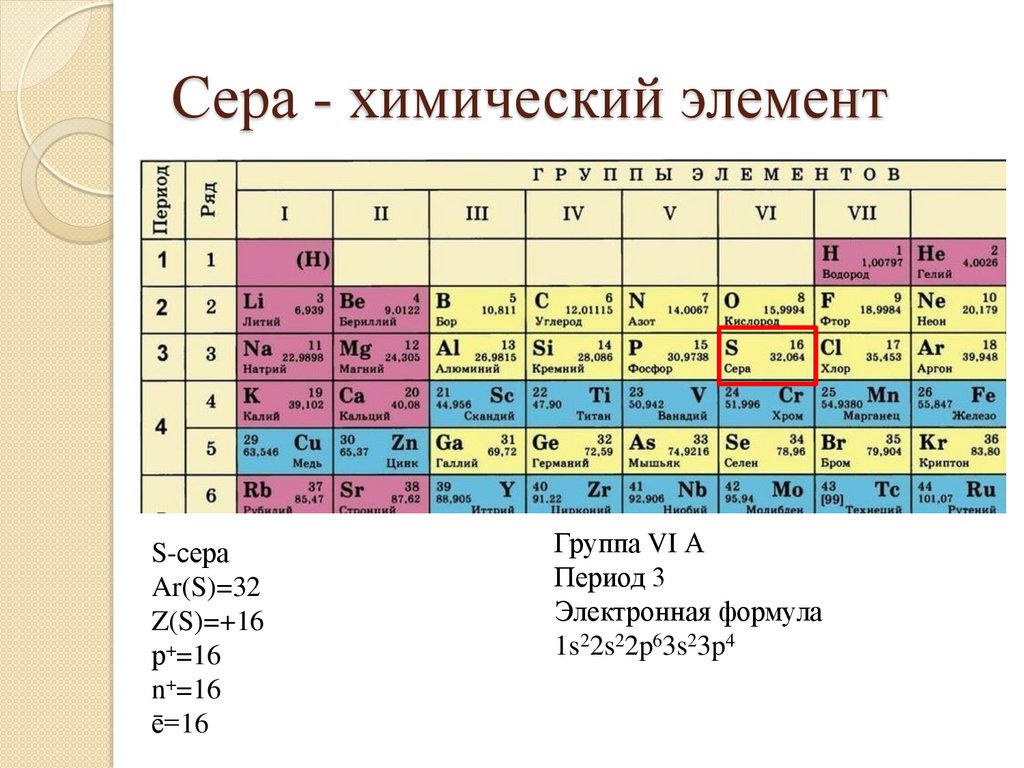
Сера - химический элементS-сера
Ar(S)=32
Z(S)=+16
р+=16
n+=16
ē=16
Группа VI А
Период 3
Электронная формула
1s22s22p63s23p4
33.
Распределяемся по группам1 ряд-оксид серы IV
2 ряд –сернистая кислота
3 ряд –оксид серы VI
34.
Работа в группах1. Формула, физические свойства
2. Окислительные свойства
3.Восстановительные свойства
4. Получение
35.
Проверка36.
Оксид серы IVSO2, бесцвет. газ с резким запахом
Окислительные свойства SO2:
S+4O2+H2S=3S0 +2H2O
S+4-окислитель
37.
Оксид серы IVSO2, бесцвет. газ с резким запахом
Восстановительные свойстваSO2:
S+4O2+2HNO3=H2S+6O4 +2NO2↑
S+4-восстановитель
38.
Оксид серы IVПолучение SO2:
Na2SO3+2HCl=2NaCl+SO2↑+H2O
SO2-обесцвечивает красители,
применяется как дезинфицирующее
средство.
39.
Оксид серы VISO3, бесцветная жидкость.
неорганическая кислота средней силы,
которая существует только в
разбавленных водных растворах
Кислотные свойства SO3:
S+6O3+H2О=H2S+6O4
40.
Оксид серы VISO3, бесцветная жидкость.
неорганическая кислота средней силы,
которая существует только в
разбавленных водных растворах
Кислотные свойства SO3:
S+6O3+H2О=H2S+6O4
S+6O3+2NaОH=Na2S+6O4 +2H2O
41.
Сернистая кислотаH2SO3, кислота средней силы
окислительные свойства H2SO3:
3H2S+4O3+ 2P=3H2S-2+P2O5+2O2↑
Восстановительные свойства:
Na2S+4O3+Cl2+H2O=Na2S+6O4 +2HCl
42.
Сернистая кислотаПолучение сернистой кислоты
SO2+H2O=H2SO3
Сернистая кислота применяется для отбеливания различных
материалов
43.
Сера в природеСера является шестнадцатым по
химической распространённости
элементом в земной коре.
Встречается в свободном
(самородном) состоянии и
связанном виде.
44.
Сера в природеАурипигмент
As2S3
сырье для получения
трехокиси мышьяка,
используется в
красильном деле и
других
производствах
45.
Сера в природеГаленит PbS
Галенит - важнейшая
свинцовая руда.
Небольшая часть
галенитовых руд
перерабатывается на
глет(PbO) с целью
получения
свинцовых
препаратов, в
частности красок,
глазури.
46.
Сера в природеКиноварь
HgS
является почти
единственным
источником
получения ртути.
47.
Сера в природеМолибденит
МоS2
Название происходит
от греческого слова
«молибдос» - свинец.
Синоним
молибденовый блеск.
единственный
промышленный источник молибдена,
расходуется на
изготовление
различных
высококачественных
сортов стали.
48.
Сера в природеПирит
FeS2
«Пирос» по-гречески
– огонь. «Огненный
камень». Это
название связано со
свойствами давать
искры при ударе, а
также с его сильным
блеском.
49.
Сера в природеХалькопирит
CuFeS2
Синоним
медный
колчедан.
Руды являются
одним из
главных
источников
меди.
50.
«Гипс»Сера в природе
CaSO4·2 H2O
модельный или лепной
применяется для
получения отливок,
слепков, лепных
украшений, в хирургии,
бумажном производстве
51.
52.
ЗакреплениеСера, сера, сера, эс.
Тридцать два - атомный вес.
Сера в воздухе сгорит,
Мы получим ангидрид.
Ангидрид её с водой
Станет серной кислотой.
Запишите уравнения химических реакций,
о которых идет речь в стихотворении.
53.
УравненияS0+O2=S+4O2
S0 восстановитель
S+4O2+H2O=H2S+6O4
S+4 окислитель
54.
Оцените свою деятельность по лестнице знанийВсе понимаю,
все
получится
5
Понимаю, но
нужно еще
доработать
4
Плохо понимаю
материал
3
55.
Домашнее задание§15, упр.1-2
Составить филворд по теме
«Кислородные соединения серы»






































 chemistry
chemistry








