Similar presentations:
химия 9 класс 01.12
1. ТЕМА УРОКА:
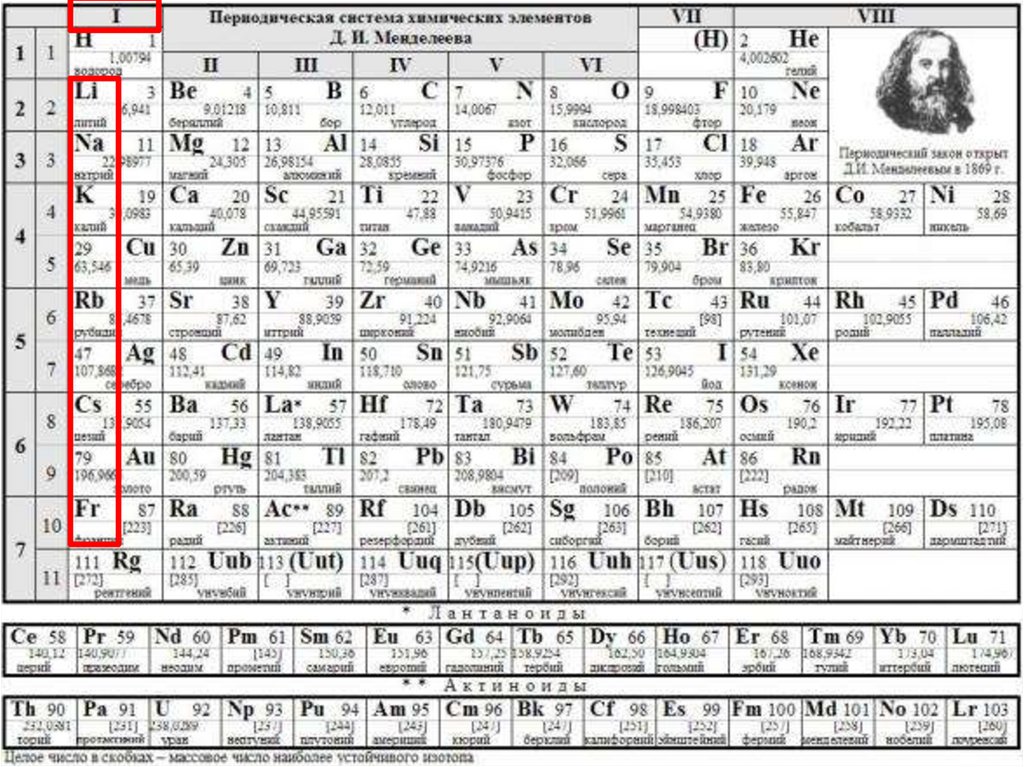
«Общая характеристика элементовI группы главной подгруппы
Периодической системы химических
элементов Д.И. Менделеева»
2. ЦЕЛЬ УРОКА:
Дать общую характеристику элементов I группы главнойподгруппы Периодической системы химических элементов
Д.И. Менделеева, повторить основные закономерности
изменения свойств элементов по вертикали (в группе),
металлическую связь и кристаллическую решетку,
физические свойства металлов
3. Разминка
РАЗМИНКАСамый распространенный металл в земной коре - A l
Самый твердый металл - C r
Самый тяжелый металл - O s
Основной компонент чугуна и стали - F e
При обычных условиях этот металл жидкий - H g
Самый тугоплавкий металл - W
4.
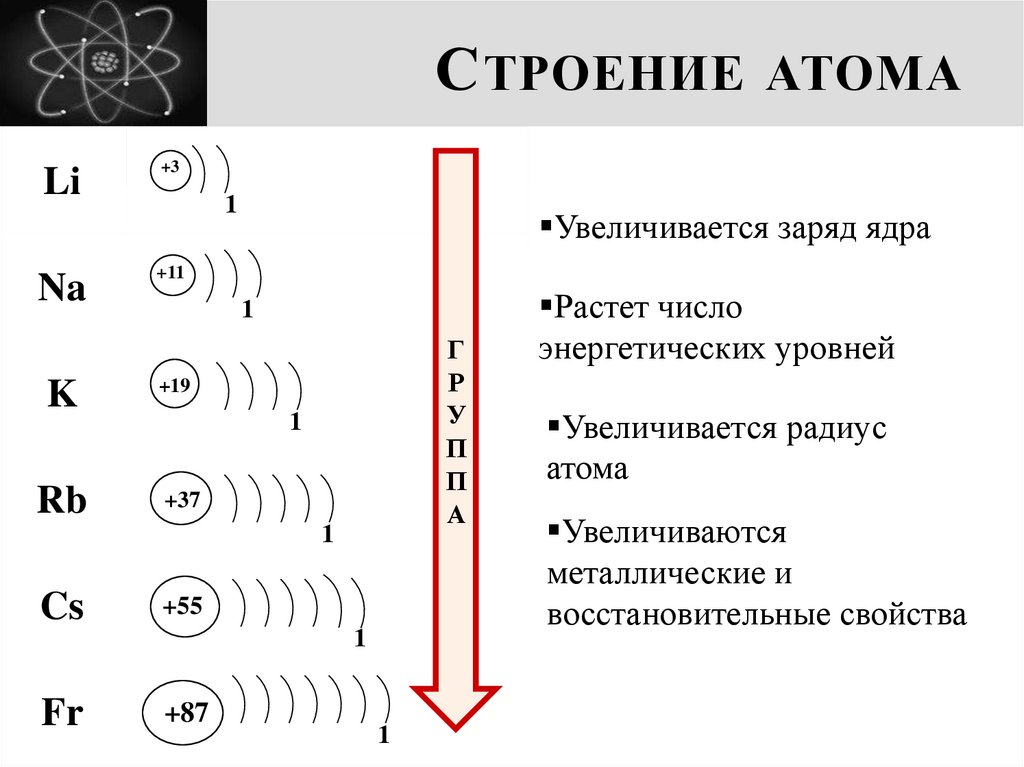
5. Строение атома
С ТРОЕНИЕ АТОМАLi
Na
+3
1
Увеличивается заряд ядра
+11
1
K
+19
Rb
+37
Г
Р
У
П
П
А
1
1
Cs
+55
1
Fr
+87
1
Растет число
энергетических уровней
Увеличивается радиус
атома
Увеличиваются
металлические и
восстановительные свойства
6. Степень окисления
С ТЕПЕНЬ ОКИСЛЕНИЯLi0
+3
Na0
+11
K0
+19
1
-1е
1
-1е
1
Rb0
+37
Cs0
+55
Fr0
-1е
-1е
1
-1е
1
+87
-1е
1
Li+1
Na+1
K+1
Rb+1
Cs+1
Fr+1
7. Запомни!
З АПОМНИ !Степень окисления металлов I группы
главной подгруппы в соединениях
постоянная и равна +1
+1
+1
+1
+1
+1
NaOH, K2O, Li3PO4,
+1
K2CO3, NaCl, Na2O2
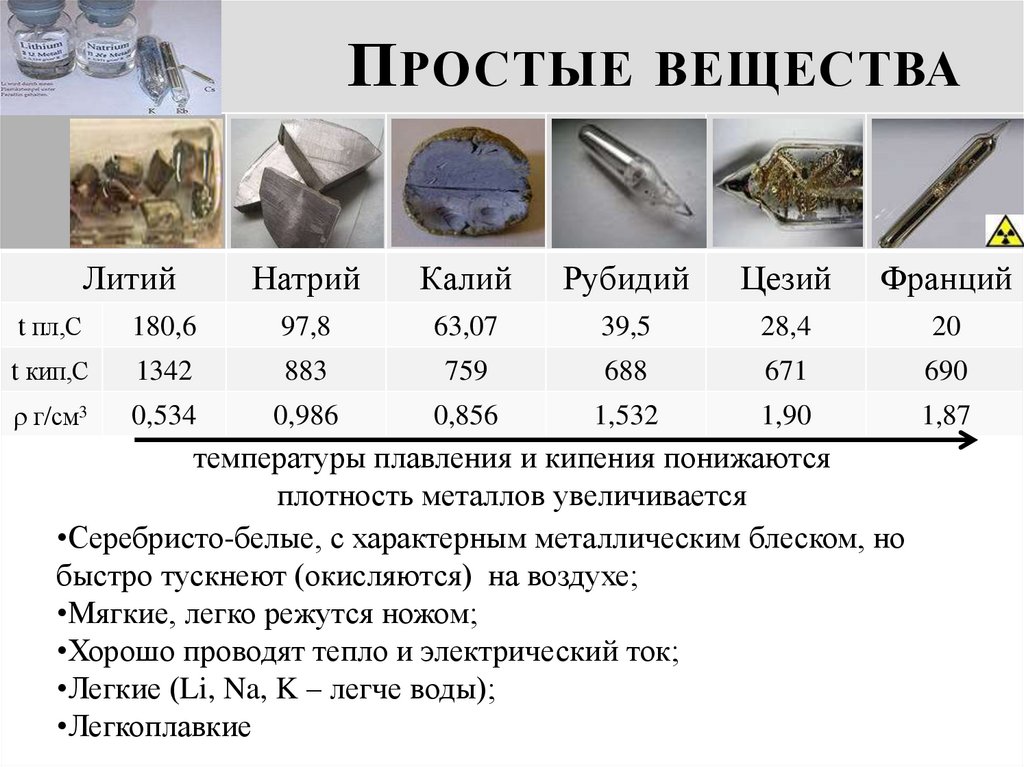
8. Простые вещества
П РОСТЫЕ ВЕЩЕСТВАЛитий
Натрий
Калий
Рубидий
Цезий
Франций
t пл,С
180,6
97,8
63,07
39,5
28,4
20
t кип,С
1342
883
759
688
671
690
г/см3
0,534
0,986
0,856
1,532
1,90
1,87
температуры плавления и кипения понижаются
плотность металлов увеличивается
•Серебристо-белые, с характерным металлическим блеском, но
быстро тускнеют (окисляются) на воздухе;
•Мягкие, легко режутся ножом;
•Хорошо проводят тепло и электрический ток;
•Легкие (Li, Na, K – легче воды);
•Легкоплавкие
9. Химические свойства
Х ИМИЧЕСКИЕ СВОЙСТВА• Металлы I группы главной подгруппы –
наиболее активные металлы,
обладают высокой восстановительной способностью
•В ряду Li - Na - K - Rb - Cs- Fr
химическая активность увеличивается
•Образуют соединения с ионной связью и ионной
кристаллической решеткой
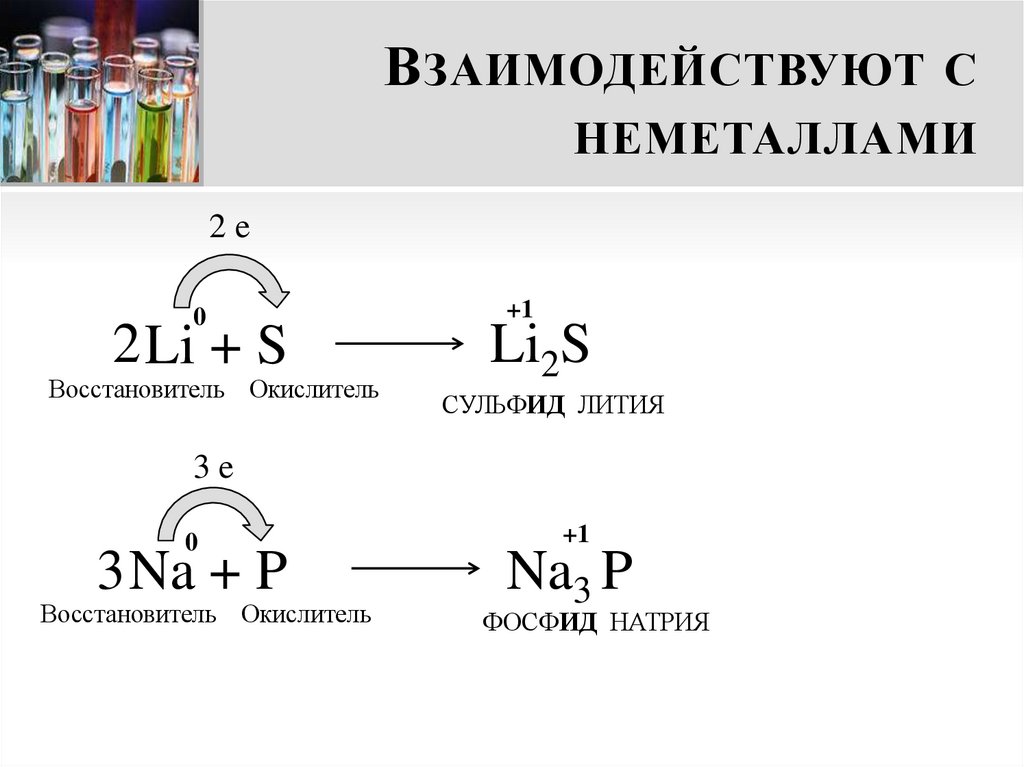
10. Взаимодействуют с неметаллами
В ЗАИМОДЕЙСТВУЮТ СНЕМЕТАЛЛАМИ
2e
0
2 Li + S
Восстановитель Окислитель
+1
Li2S
СУЛЬФИД ЛИТИЯ
3e
0
3 Na + P
Восстановитель Окислитель
+1
Na3 P
ФОСФИД НАТРИЯ
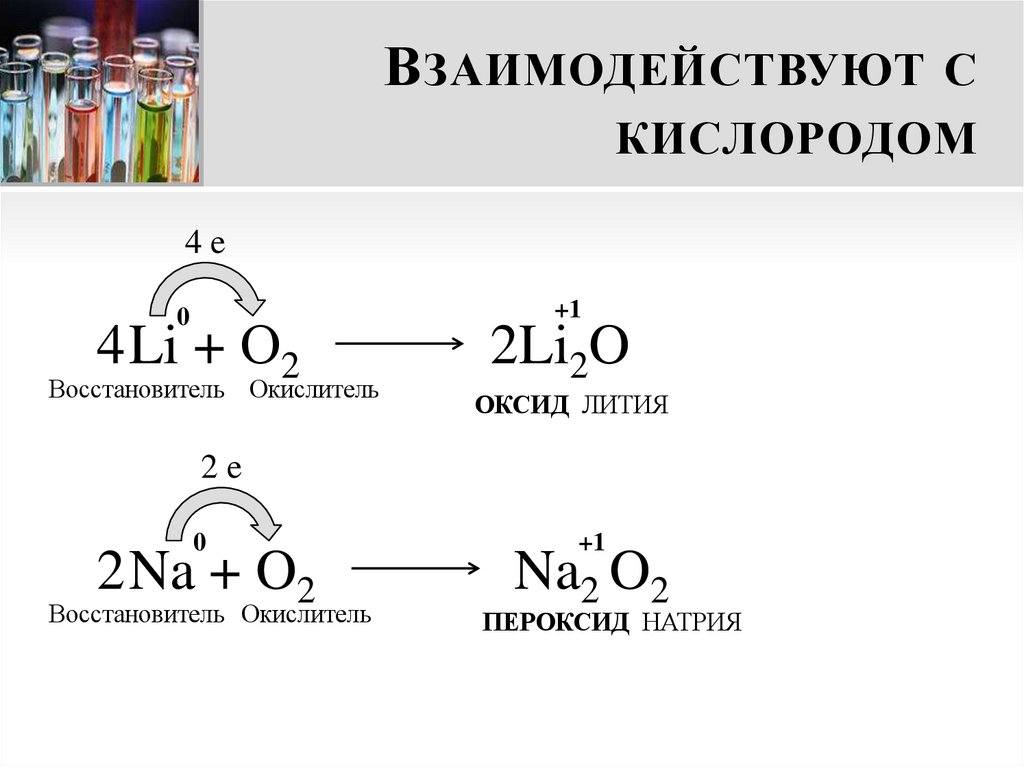
11. Взаимодействуют с кислородом
В ЗАИМОДЕЙСТВУЮТ СКИСЛОРОДОМ
4e
0
4 Li + О2
Восстановитель Окислитель
+1
2Li2O
ОКСИД ЛИТИЯ
2e
0
2 Na + O2
Восстановитель Окислитель
+1
Na2 O2
ПЕРОКСИД НАТРИЯ
12. Внимание!
В НИМАНИЕ !При взаимодействии с кислородом
только литий образует оксид.
Другие металлы I группы главной подгруппы
при взаимодействии с кислородом образуют
пероксиды и надпероксиды.
ПЕРОКСИД НАТРИЯ
+1
-1
-1
+1
Na
O
O
Na
13. A знаете ли вы?
A ЗНАЕТЕ ЛИ ВЫ ?При взаимодействии пероксида натрия с углекислым
газом протекает процесс, обратный дыханию углекислый газ связывается, а кислород выделяется:
2Na2О2 + 2СО2 → 2Na2CО3 + О2
На этой реакции основано применение
пероксида натрия для получения
кислорода на подводных лодках и для
регенерации воздуха в закрытых
помещениях.
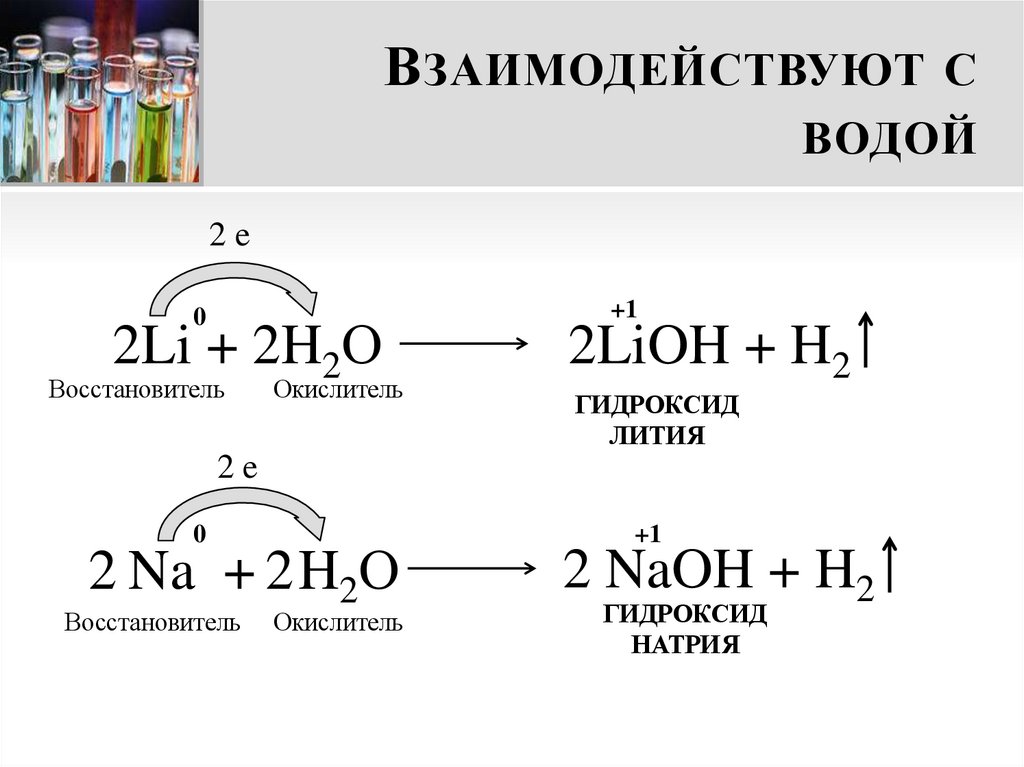
14. Взаимодействуют с водой
В ЗАИМОДЕЙСТВУЮТ СВОДОЙ
Металлы I группы главной подгруппы
реагируют с водой бурно, с выделением
теплоты. В результате взаимодействия
образуется щелочь и выделяется водород
Так как гидроксиды металлов
I группы главной подгруппы
образуют щелочи,
то их
групповое название –
ЩЕЛОЧНЫЕ МЕТАЛЛЫ
15. Взаимодействуют с водой
В ЗАИМОДЕЙСТВУЮТ СВОДОЙ
2e
0
2Li + 2H2О
Восстановитель
Окислитель
+1
2LiOH + H2
ГИДРОКСИД
ЛИТИЯ
2e
0
2 Na + 2 H2О
Восстановитель
Окислитель
+1
2 NaOH + H2
ГИДРОКСИД
НАТРИЯ
16. Хранение щелочных металлов
Х РАНЕНИЕ ЩЕЛОЧНЫХМЕТАЛЛОВ
Так как щелочные металлы легко окисляются и
обладают высокой химической активностью, их
хранят под слоем керосина
Беречь
от воды
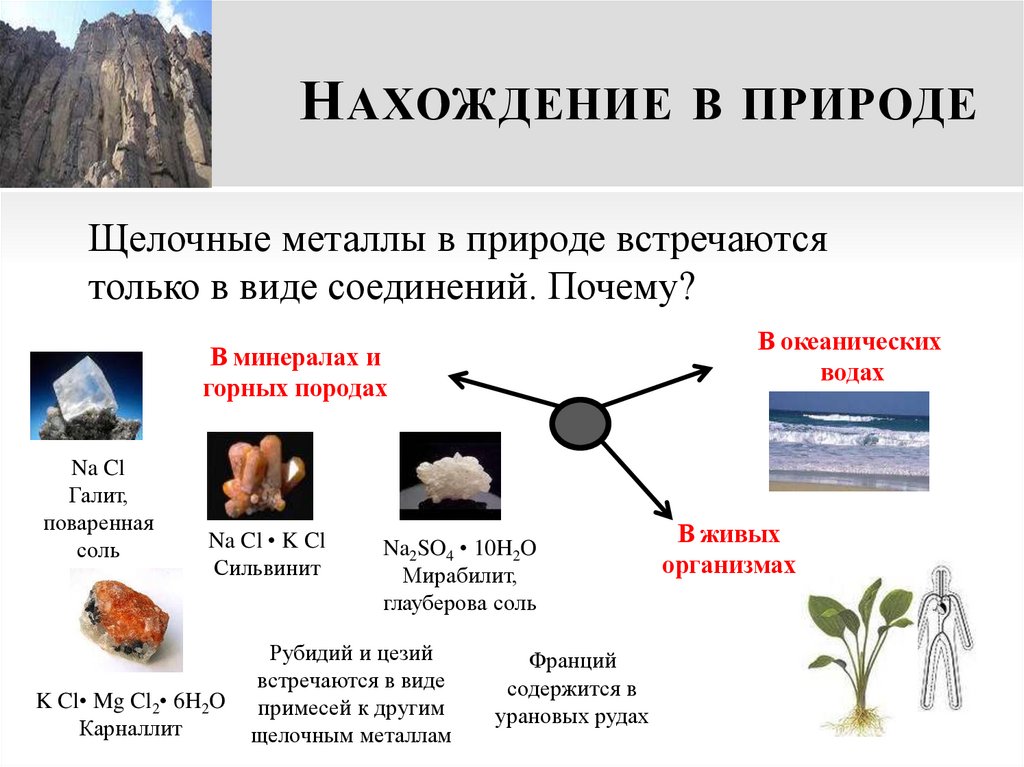
17. Нахождение в природе
Н АХОЖДЕНИЕ В ПРИРОДЕЩелочные металлы в природе встречаются
только в виде соединений. Почему?
В океанических
водах
В минералах и
горных породах
Na Cl
Галит,
поваренная
соль
Na Cl • K Cl
Сильвинит
K Cl• Mg Cl2• 6H2O
Карналлит
Na2SO4 • 10H2O
Мирабилит,
глауберова соль
Рубидий и цезий
встречаются в виде
примесей к другим
щелочным металлам
Франций
содержится в
урановых рудах
В живых
организмах
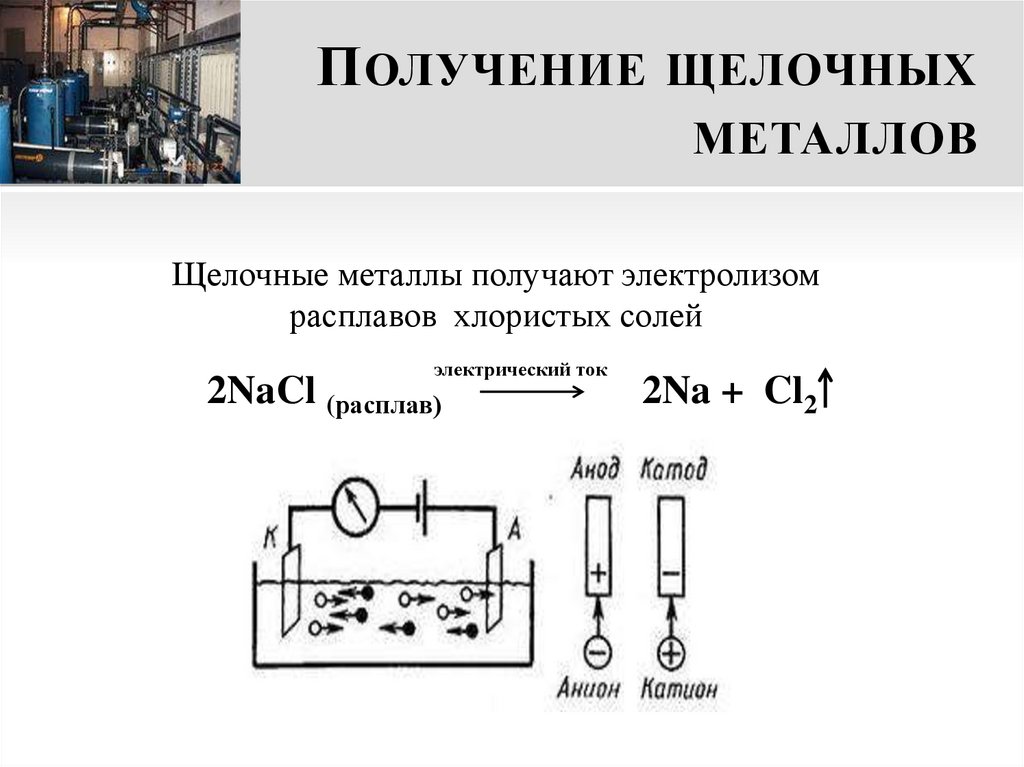
18. Получение щелочных металлов
П ОЛУЧЕНИЕ ЩЕЛОЧНЫХМЕТАЛЛОВ
Щелочные металлы получают электролизом
расплавов хлористых солей
электрический ток
2NaCl (расплав)
2Na + Cl2
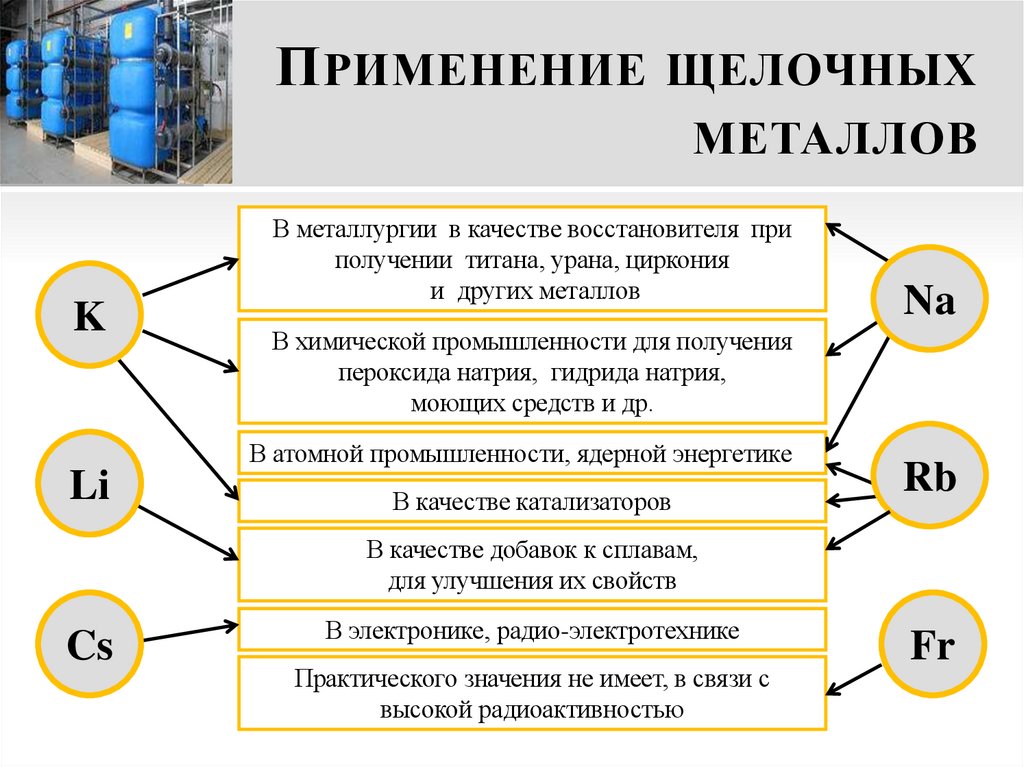
19. Применение щелочных металлов
П РИМЕНЕНИЕ ЩЕЛОЧНЫХМЕТАЛЛОВ
K
В металлургии в качестве восстановителя при
получении титана, урана, циркония
и других металлов
В химической промышленности для получения
пероксида натрия, гидрида натрия,
моющих средств и др.
В атомной промышленности, ядерной энергетике
Li
Na
В качестве катализаторов
Rb
В качестве добавок к сплавам,
для улучшения их свойств
Cs
В электронике, радио-электротехнике
Практического значения не имеет, в связи с
высокой радиоактивностью
Fr
20. Из истории
И З ИСТОРИИЛитий
• Открыт в 1817 году шведским химиком А. Арфведсоном.
Но в свободном виде был выделен позднее Г. Дэви путем
электролиза щелочи
1807 году английский химик Г.Дэви впервые получил в
Натрий • Всвободном
виде путем электролиза увлажненных твердых
Калий щелочей
Немецкие химики Р. Бунзен и Г. Кирхгоф с помощью
Рубидий • спектрального
анализа обнаружили в минералах в 1860
Цезий году – цезий, а в 1861 году – рубидий
Франций
• Открыт в 1939 году М. Перей при анализе продуктов
радиоактивного распада актиния. В 1946 году М. Пере
предложила назвать элемент в честь своей родины
Франции
21. Выбери правильный ответ
В ЫБЕРИ ПРАВИЛЬНЫЙОТВЕТ
1. Щелочной металл
a) Mg
б) Ba
в) Al
г) Rb
2. Наиболее ярко выражены металлические свойства
a) Cs
б) K
в) Fr
г) Li
3. При взаимодействии с кислородом образует пероксид
a) Ca
б) Na
в) Li
г) Mg
4. Степень окисления щелочных металлов
a) +1
б) +2
в) +3
г) +4












 chemistry
chemistry








