Similar presentations:
Кислород_ свойства_ получение и применение
1. Кислород – химический элемент и простое вещество
L/O/G/O2. ДЕВИЗ УРОКА:
Dum spiro – spero- пока дышу, надеюсь.
3. Кислород – химический элемент
Химический знакО
Химическая формула:
О2
Относительная атомная масса:
Ar = 16
Относительная молекулярная масса:
Мr = 32
Молярная масса:
М = 32 г/ моль
Степень окисления:
-2
4.
СловарьАЛЛОТРОПИЯ-
СУЩЕСТВОВАНИЕ У ОДНОГО И
ТОГО ЖЕ ЭЛЕМЕНТА
НЕСКОЛЬКИХ ПРОСТЫХ
ВЕЩЕСТВ
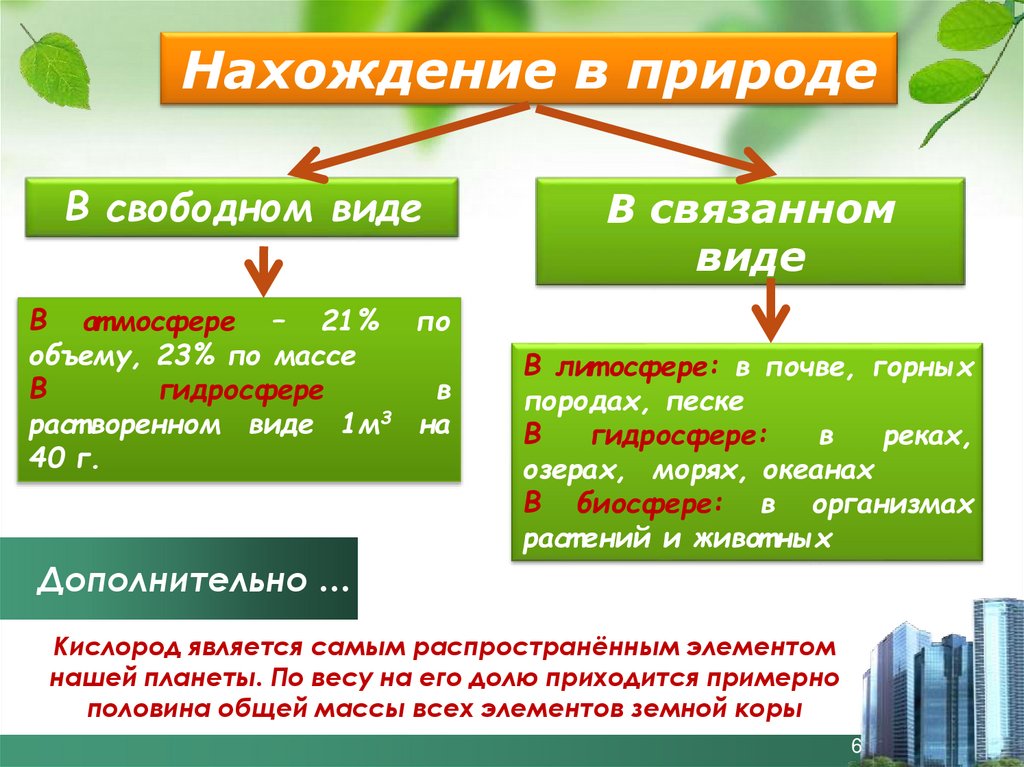
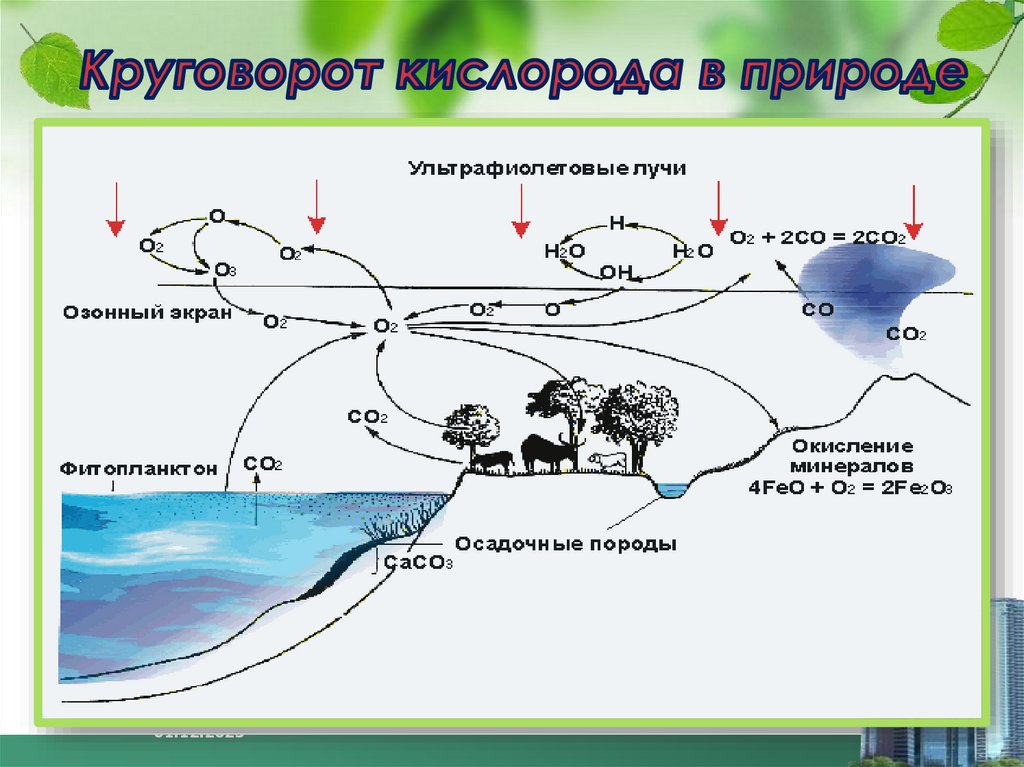
5. Нахождение в природе
Кислород вприроде
Кислород
О2
Озон О3
6.
Нахождение в природеВ свободном виде
В ат мосфере – 21% по
объему, 23% по массе
В
гидросфере
в
раст воренном виде 1м3 на
40 г.
В связанном
виде
В лит осфере: в почве, горных
породах, песке
В
гидросфере:
в
реках,
озерах, морях, океанах
В биосфере: в организмах
раст ений и живот ных
Дополнительно …
Кислород является самым распространённым элементом
нашей планеты. По весу на его долю приходится примерно
половина общей массы всех элементов земной коры
6
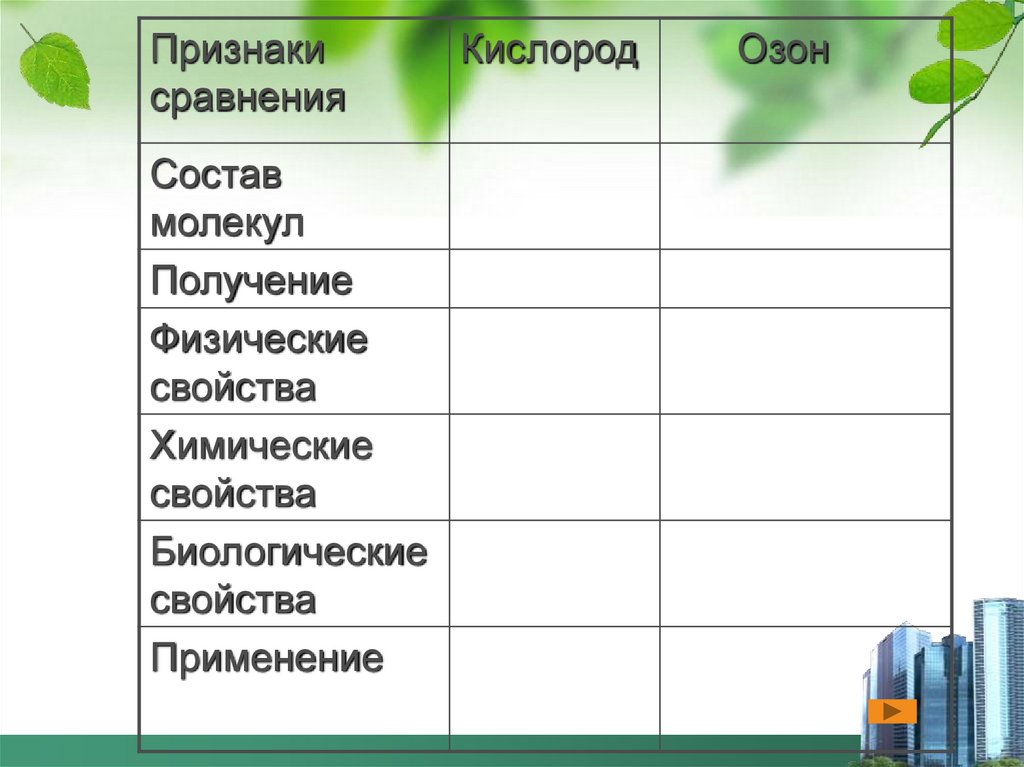
7.
Признакисравнения
Состав
молекул
Получение
Физические
свойства
Химические
свойства
Биологические
свойства
Применение
Кислород
Озон
8. Физические свойства
1)2)
3)
4)
5)
газ, без цвета, вкуса и
запаха;
немного тяжелее воздуха;
плохо растворяется в
воде;
жидкий кислород (темп.
кипения −182,98 °C) это
бледно-голубая жидкость;
твердый кислород (темп.
плавления −218,79 °C) —
синие кристаллы;
6) поддерживает
процессы дыхания и
горения
жидкий кислород
Твёрдый
кислород
9. Физические свойства озона
1)при обычных условиях голубой газ;
2)
тяжелее воздуха;
3)
растворимость в воде в 10 раз
выше, чем у кислорода;
4)
жидкий озон (темп. Кипения −111,9
°C) темно-синего цвета;
5)
твердый озон (темп. плавления
−251,4°C)
—
тёмно-синие,
практически чёрные кристаллы;
6)
запах — резкий,
«металлический».
специфический
Озон (от др.-греч. ὄζω —
пахну)
10. Значение кислорода в жизни живой природы
Человек в сутки вдыхаетпримерно
750
литров
кислорода.
Основные
поставщики
кислорода - тропические леса
и фитопланктон океана.
Ежегодно
в
результате
фотосинтеза в атмосферу
Земли поступает 3000 млрд.
тонн кислорода.
11. Озон в природе
Озон образуется в атмосфере навысоте 10-30 км при действием УФ
излучения на воздух и при грозовых
разрядах.
Содержание озона в воздухе:
Летом- до 7*10-9% (по объему),
зимой- до 2*10-10%
В атмосфере максимальная его
концентрация на высоте 20-25 км ,
где озон образует слой,
защищающий Землю от УФ- лучей.
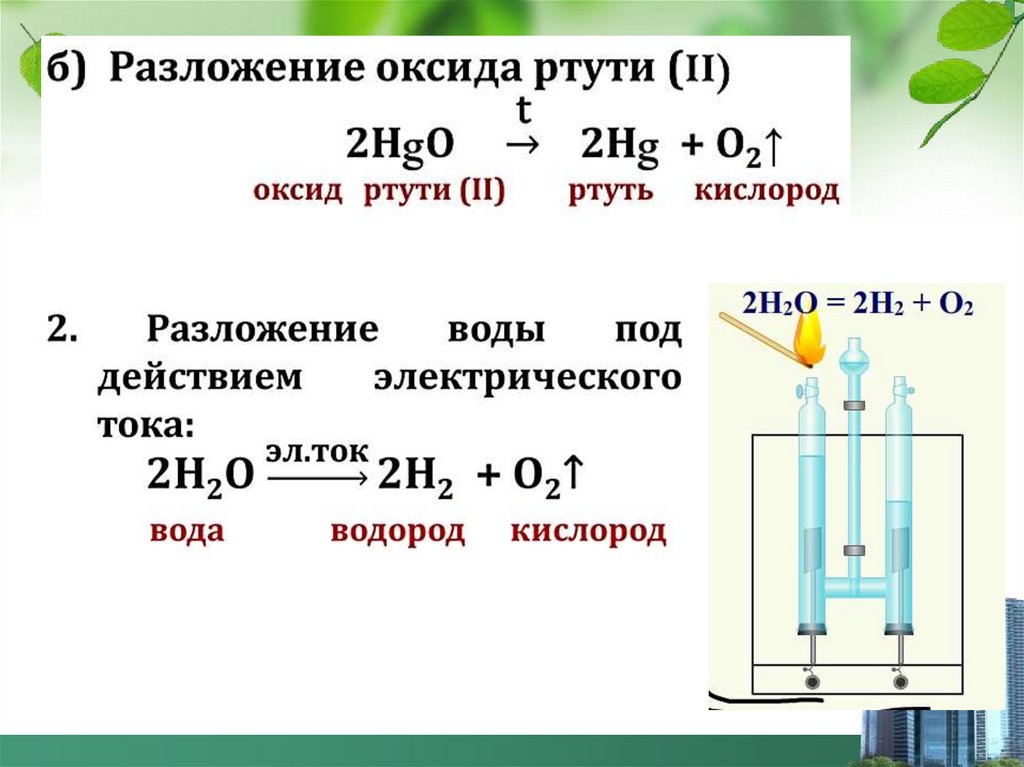
12.
Получениеи собирание кислорода в лаборатории
перманганат
калия
манганат
калия
оксид
марганца
(IV)
кислород
13.
14.
15. Распознавание кислорода: тлеющая лучинка вспыхивает.
16. Способы собирания кислорода:
Метод вытесненияМетод вытеснения воды,
воздуха, т.к. немного
т.к. кислород
тяжелее воздуха,
малорастворим в воде
собирается на дне
сосуда
Распознавание:
тлеющая лучинка
вспыхивает
17. Химические свойства кислорода
18. Химические свойства кислорода
Кислород энергично реагирует со многими веществами- простыми исложными. Наиболее известная из этих реакций сопровождается выделением
света и тепла. Это реакция горения.
Обратите внимание как энергично сгорают в кислороде уголь,
А также фосфор,
железо,
водород.
Способны реагировать с кислородом и сложные вещества:
СН4 + 2О2 = СО2 + 2Н2О (горение метана)
Взаимодействие веществ с кислородом называется реакцией окисления.
Продуктами реакции окисления являются сложные вещества - оксиды,
состоящие из двух элементов, один из которых кислород.
19.
Горение железа.Fe + О2 → Fe2O3
уравнять
20.
Горение фосфора.Р + О2 → Р2O5
уравнять
21.
Горение серы.S + О2 → SO2 уравнять
22.
Химические свойства.С неметаллами
C + O2 CO2
S + O2 SO2
2H2 + O2 2H2O
Со сложными веществами
4FeS2 + 11O2 2Fe2O3 +
8SO2
2H2S + 3O2 2SO2 + 2H2O
CH4 + 2O2 CO2 + 2H2O
Взаимодействие
веществ с кислородом называется
окислением. С кислородом
реагируют все элементы, кроме
Au, Pt, He, Ne и Ar, во всех
реакциях (кроме взаимодействия
со фтором) кислород - окислитель.
1. Неустойчив: O3 O2 + O
2. Сильный окислитель:
2KI + O3 + H2O 2KOH + I2 + O2
Обесцвечивает красящие
вещества, отражает УФ - лучи,
уничтожает микроорганизмы.
С металлами
2Mg + O2 2MgO
2Cu + O2 –t 2CuO
23.
Химическое взаимодействиевещества с кислородом
называется реакцией
окисления.
Реакции окисления,
сопровождающиеся
выделением теплоты и
света, называются
реакциями горения.
Реакции горения веществ —
это примеры быстрого
окисления, а вот гниение,
ржавление и т.п. — это
примеры медленного
окисления веществ
кислородом
24.
01.12.202525. Применение
1. Металлургия: производст во ст али,сжигание т оплива и др.
26. Применение
2. Сварка ирезка
металлов
27. Применение
3. Ракетное топливо: в качест ве окислит елядля ракет ного т оплива применяет ся жидкий
кислород, пероксид водорода, азот ная кислот а и
другие богат ые кислородом соединения.
28. Применение
4.Медицина:
кислород использует ся для
обогащения дыхат ельных газовых смесей при
нарушении
дыхания,
для
лечения
аст мы,
профилакт ики гипоксии в виде кислородных
кокт ейлей, кислородных подушек.
29. Применение
5.пищевой
промышленности
:
в
пищевой
промышленност и
кислород
зарегист рирован
в
качест ве
пищевой
добавки
E948, как пропеллент
(газ,
находящийся под давлением, выт еснит ель)
и упаковочный газ.
30.
Аллотропияспособность химического элемента
образовывать несколько простых
веществ.
Разные простые вещества,
образованные одним и тем
же химическим элементом,
называются
аллотропными
модификациями
(видоизменениями)
L/O/G/O
31.
Озон в природеСодержание озона в воздухе:
Летом- до 7*10-9% (по объему),
зимой- до 2*10-10%
В атмосфере максимальная его
концентрация на высоте 20-25 км ,
где озон образует слой,
защищающий Землю от УФ- лучей.
В чем причина образования «озоновых дыр»?
32.
Озон (от греч. ózo — пахну, пахнущий) —состоящая из трехатомных молекул
O3 аллотропная модификация кислорода. При
нормальных условиях — взрывчатый газ синеголубого цвета с резким характерным запахом,
в сжиженном состоянии темно-фиолетового
цвета (цвет индиго), в твердом виде
представляет собой кристаллы черного цвета с
фиолетовым отблеском.
33.
Физические свойства озонамолекулярная масса: 47,998 а.е.м.;
плотность газа при нормальных условиях: 2,1445 кг/м3.
Относительная плотность газа по кислороду 1,5; по воздуху: 1,62
(1,658);
плотность жидкости при −183°C: 1571 кг/м3;
температура кипения: −111,9°C. Жидкий озон — темно-фиолетового
цвета (цвет индиго);
температура плавления: −197,2 ± 0,2°C (приводимая обычно
−251,4°C ошибочна, так как при ее определении не учитывалась
большая способность озона к переохлаждению). В твердом
состоянии — черного цвета с фиолетовым отблеском;
растворимость в воде при 0°C: 0,394 кг/м3 (0,494 л/кг), она в 10 раз
выше по сравнению с кислородом;
в газообразном состоянии озон диамагнитен, в жидком —
слабопарамагнитен;
запах — резкий, специфический «металлический» (по Менделееву —
«запах раков»). Ядовит.
34. Получение озона
Озон образуется во многих процессах, сопровождающихся выделениематомарного кислорода, например при разложении перекисей,
окислении фосфора и т.п.
В промышленности его получают из воздуха или кислорода в
озонаторах действием электрического разряда. Сжижается O3 легче,
чем O2, и потому их несложно разделить.
Озон для озонотерапии в медицине получают только из чистого
кислорода. При облучении воздуха жестким ультрафиолетовым
излучением образуется озон. Тот же процесс протекает в верхних слоях
атмосферы, где под действием солнечного излучения образуется и
поддерживается озоновый слой.
В лаборатории озон можно получить реакциями пентафторида висмута
и некоторых сильных окислителей с водой.
3О2 2О3
35. Химические свойства озона
Озон — мощный окислитель, намногоболее реакционноспособный, чем
двухатомный кислород. Окисляет почти
все металлы (за исключением золота,
платины и иридия) до их высших
степеней окисления.
О3 О2 + О
2О О2 2О3 3О2
Ag + O3 AgO + O2
L/O/G/O
36.
Значение озона.Озоновый слой.
Применение озона.
1.Озонирование
воздуха.
2.Дезинфекция,
обеззараживание.
L/O/G/O
37. Домашнее задание
Изучить презентацию, заполнитьтаблицу(если не успели на уроке).
Выполнить задания:
Слайды 38-39
38. Дописать реакции и уравнять:
1. Ca + O2 →2. H2 + O2 →
3. Si
+ O2 →
4. N2 + O2 →
5. С2H6 + O2 →
39. Дописать пропущенное вещество, уравнять
… + O2 → As2O3Li + O2 →…
Mg + … → MgO
… + O2 → NO
Be + O2 → …


































 chemistry
chemistry








