Similar presentations:
Гетероциклы
1. Гетероциклические соединения
Кафедра медицинскойи фармацевтической химии
Гетероциклические
соединения
1
2.
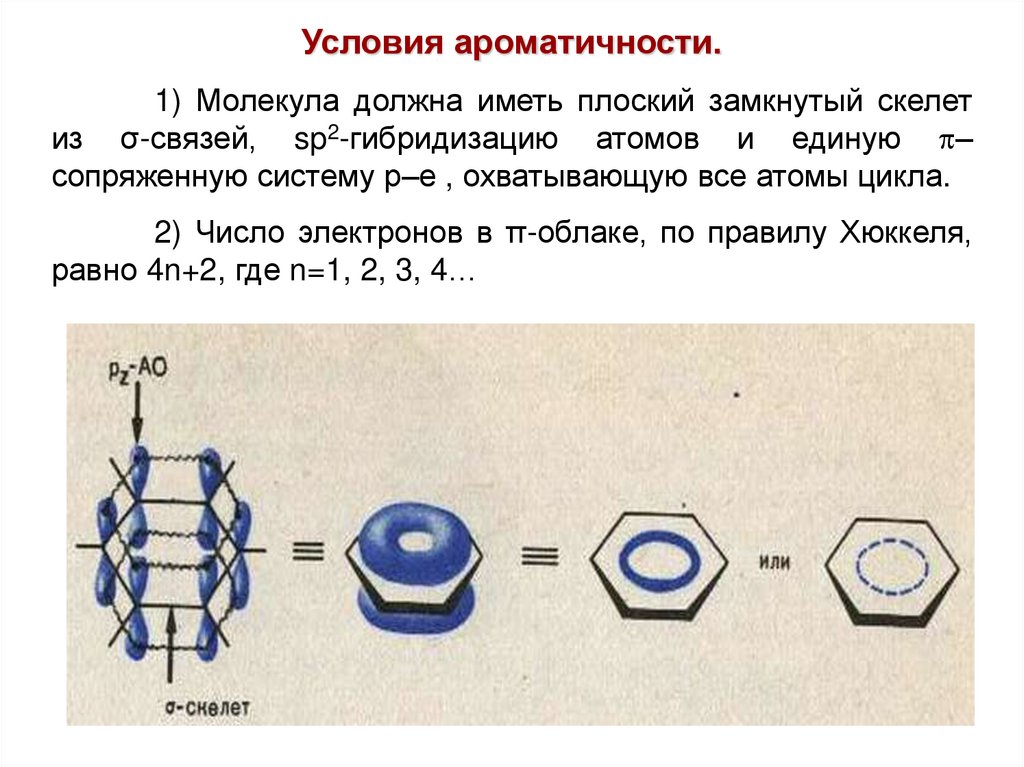
Условия ароматичности.1) Молекула должна иметь плоский замкнутый скелет
из σ-связей, sp2-гибридизацию атомов и единую p–
сопряженную систему р–е , охватывающую все атомы цикла.
2) Число электронов в π-облаке, по правилу Хюккеля,
равно 4n+2, где n=1, 2, 3, 4…
2
3.
Биологически важныегетероциклические
соединения
4.
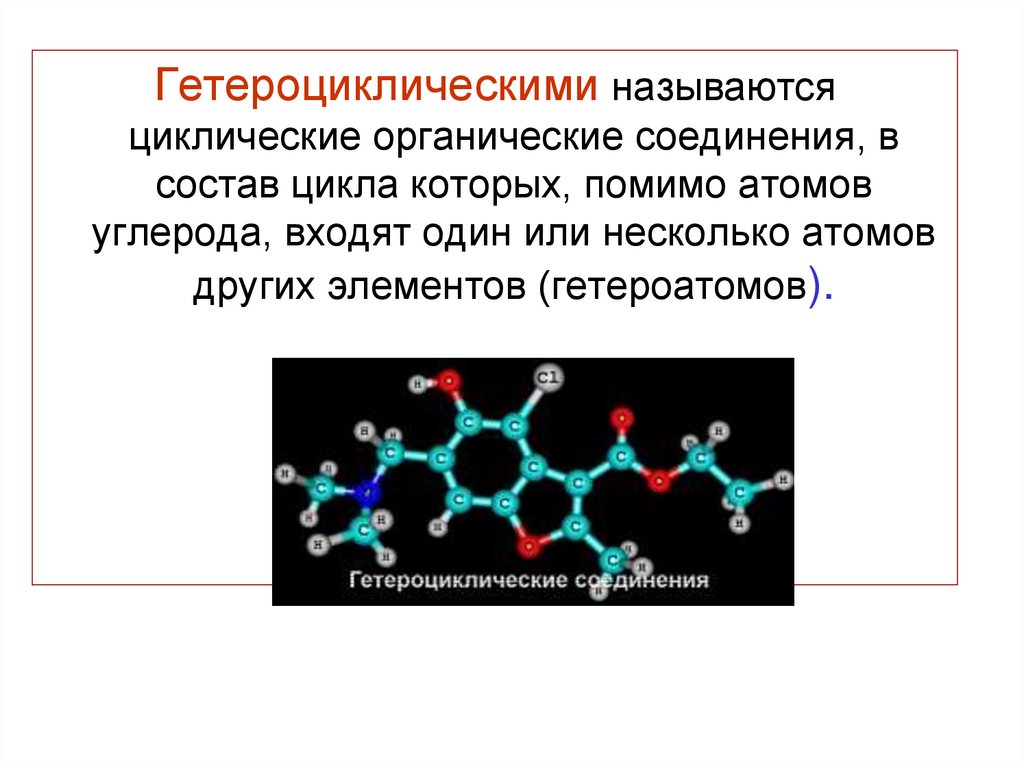
Гетероциклическими называютсяциклические органические соединения, в
состав цикла которых, помимо атомов
углерода, входят один или несколько атомов
других элементов (гетероатомов).
5.
Гетероциклические соединенияПятичленные гетероциклы Шестичленные гетероциклы
(π-избыточные)
(π-недостаточные)
- С одним гетероатомом
- С двумя гетероатомами
- С одним гетероатомом
- С двумя гетероатомами
5
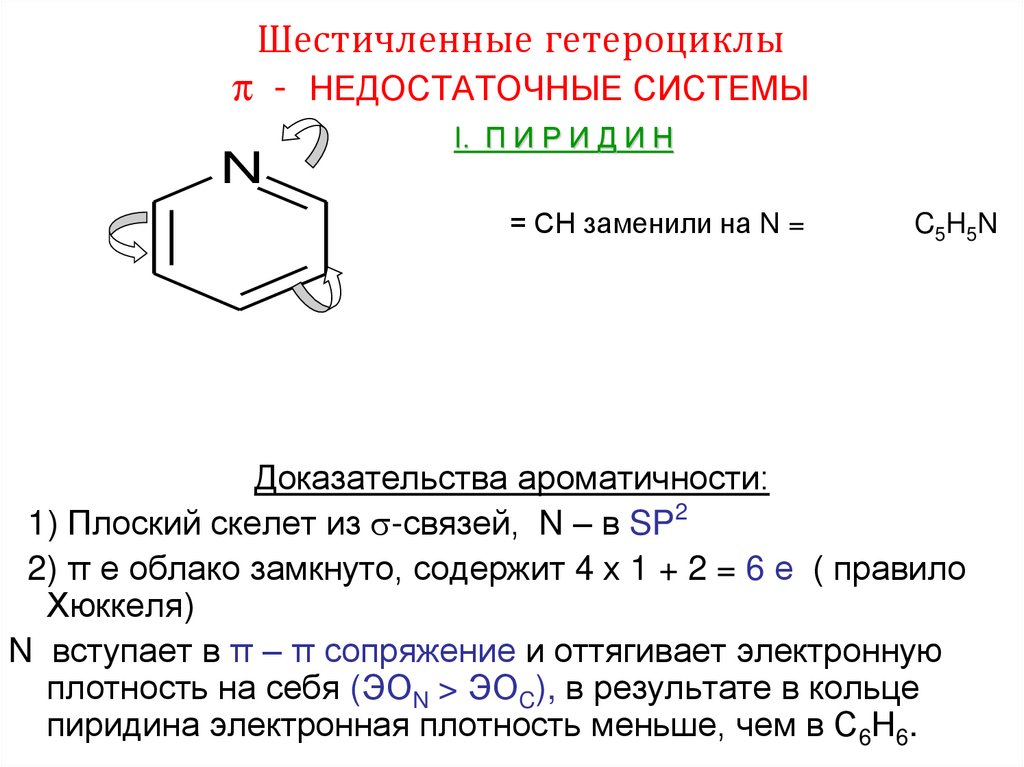
6. Шестичленные гетероциклы π - НЕДОСТАТОЧНЫЕ СИСТЕМЫ
NI. П И Р И Д И Н
= СН заменили на N =
C5 H 5 N
Доказательства ароматичности:
1) Плоский скелет из -связей, N – в SP2
2) π е облако замкнуто, содержит 4 х 1 + 2 = 6 е ( правило
Хюккеля)
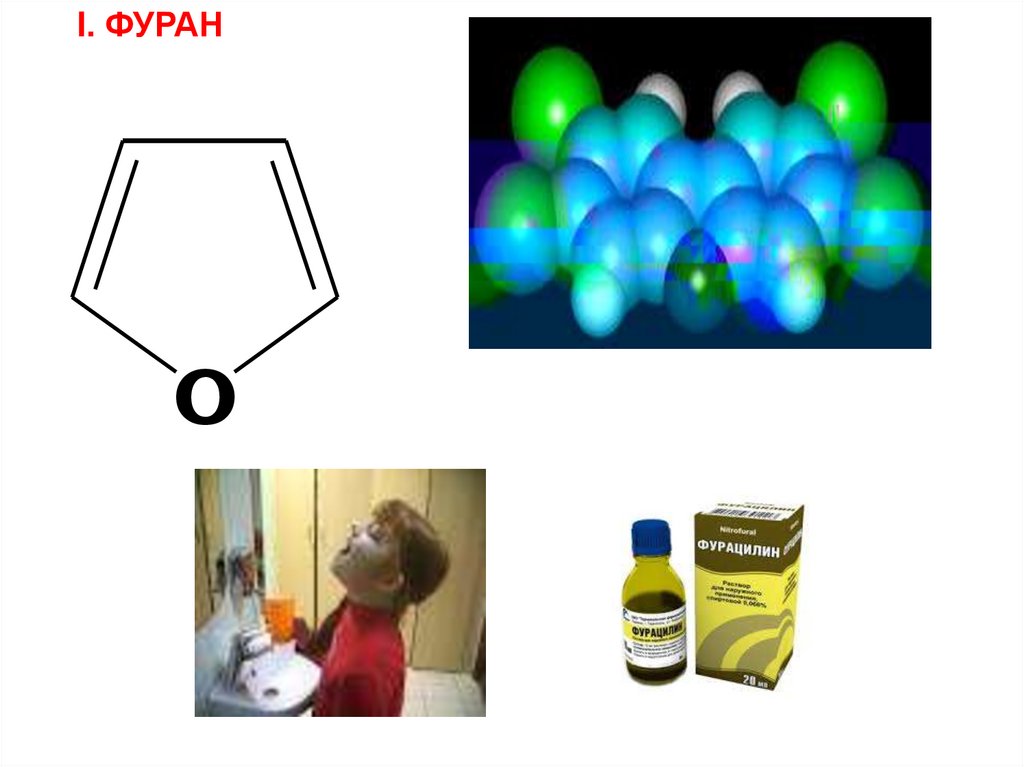
N вступает в π – π сопряжение и оттягивает электронную
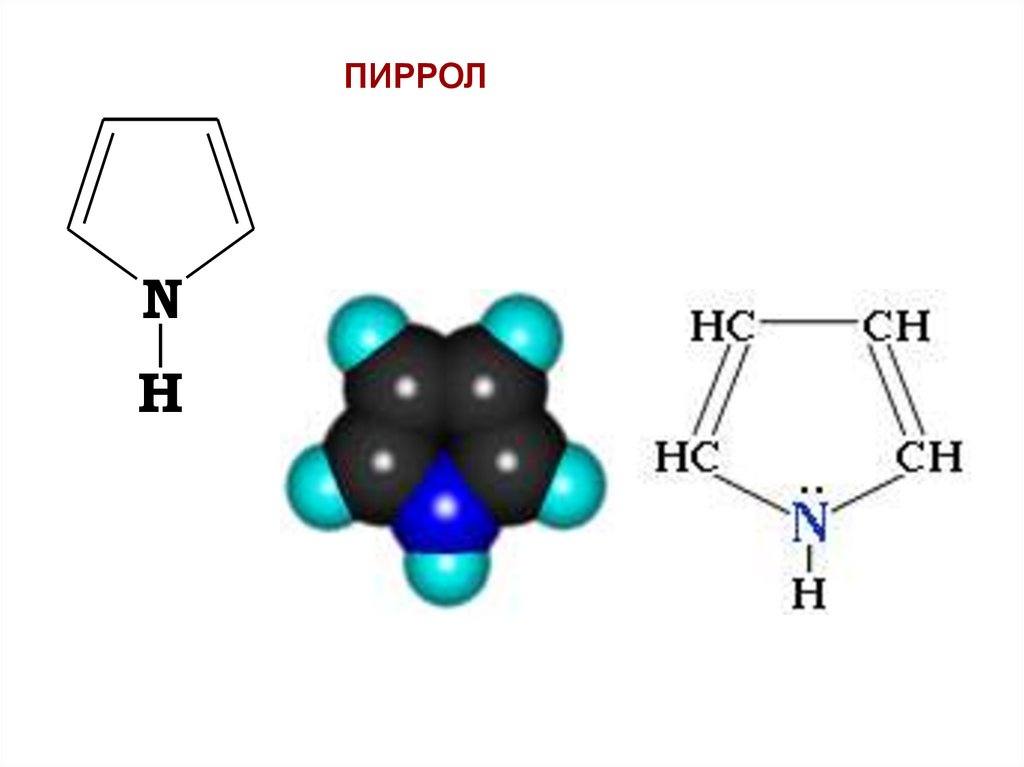
плотность на себя (ЭОN > ЭОC), в результате в кольце
пиридина электронная плотность меньше, чем в С6Н6.
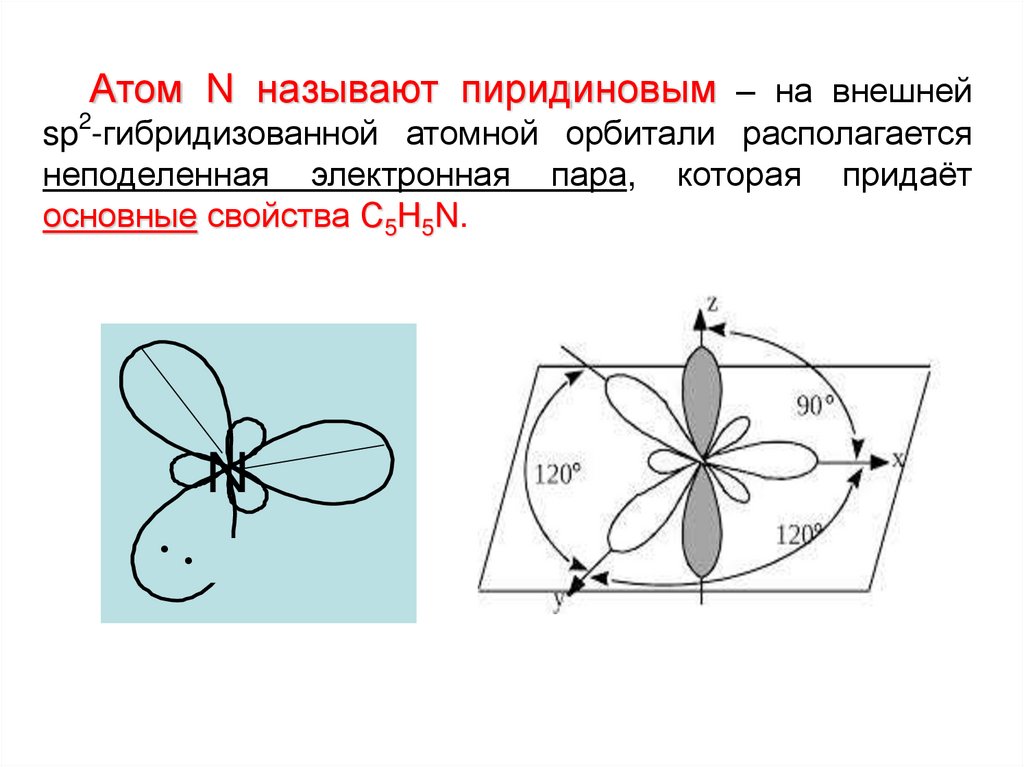
7.
Атом N называют пиридиновым – на внешнейsp2-гибридизованной атомной орбитали располагается
неподеленная электронная пара, которая придаёт
основные свойства С5Н5N.
N
•
8.
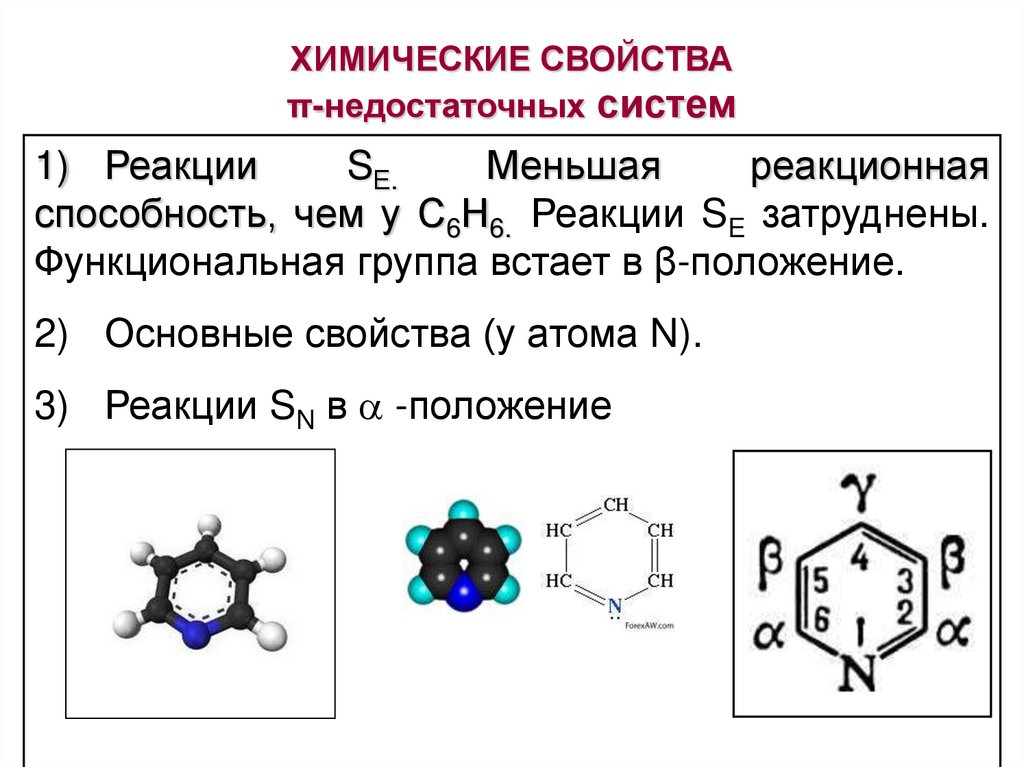
ХИМИЧЕСКИЕ СВОЙСТВАπ-недостаточных систем
1) Реакции
SЕ.
Меньшая
реакционная
способность, чем у С6Н6. Реакции SE затруднены.
Функциональная группа встает в β-положение.
2) Основные свойства (у атома N).
3) Реакции SN в -положение
9.
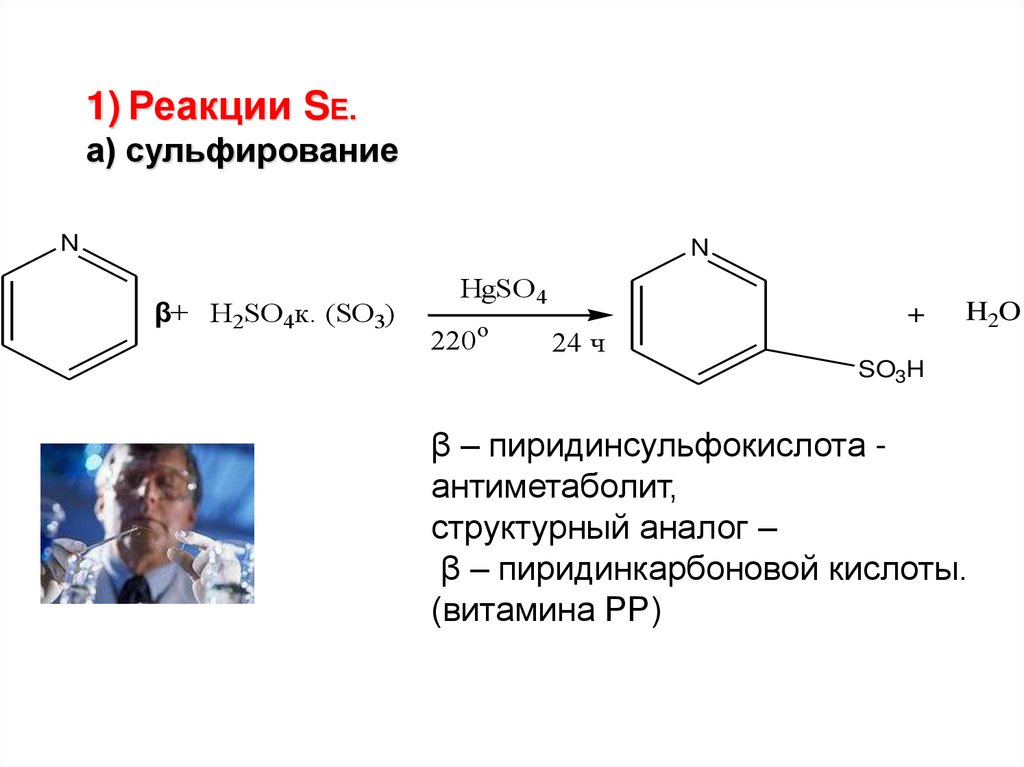
1) Реакции SЕ.а) сульфирование
N
N
β+ H2SO4к. (SO3)
HgSO 4
o
220
24 ч
+
H2O
SO3H
β – пиридинсульфокислота антиметаболит,
структурный аналог –
β – пиридинкарбоновой кислоты.
(витамина РР)
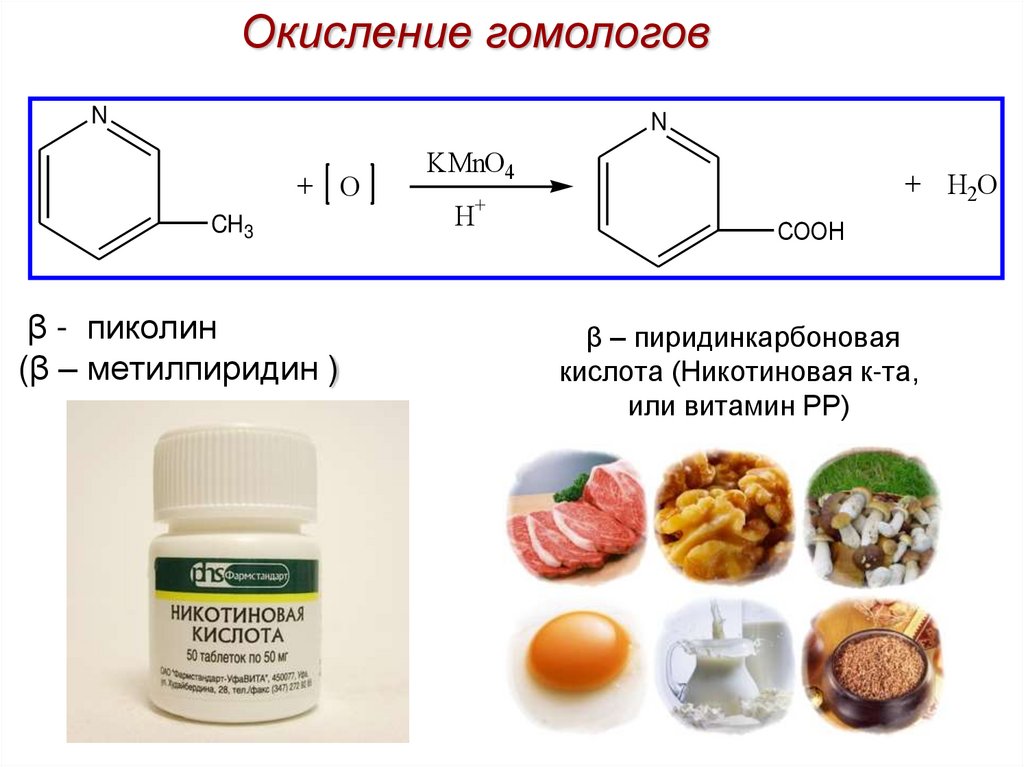
10. β – пиридинкарбоновая кислота (Никотиновая к-та, или витамин РР)
Окисление гомологовN
N
+ O
CH 3
β - пиколин
(β – метилпиридин )
KMnO4
+ H2O
+
H
COOH
β – пиридинкарбоновая
кислота (Никотиновая к-та,
или витамин РР)
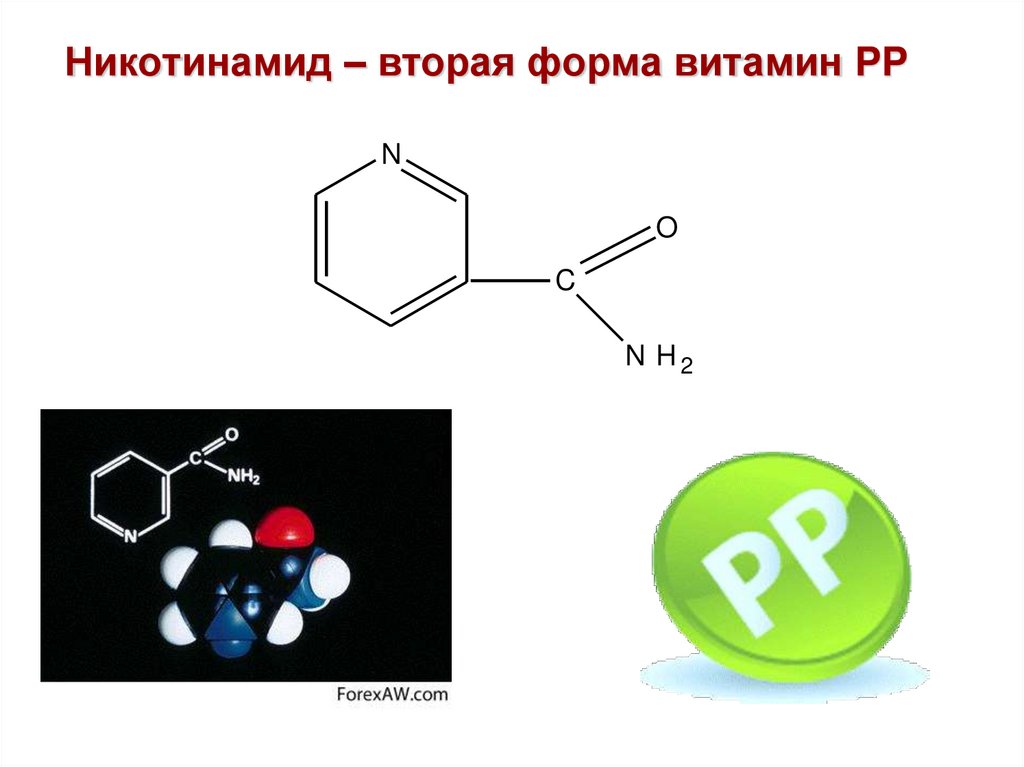
11. Никотинамид – вторая форма витамин PP
NO
C
N H2
12.
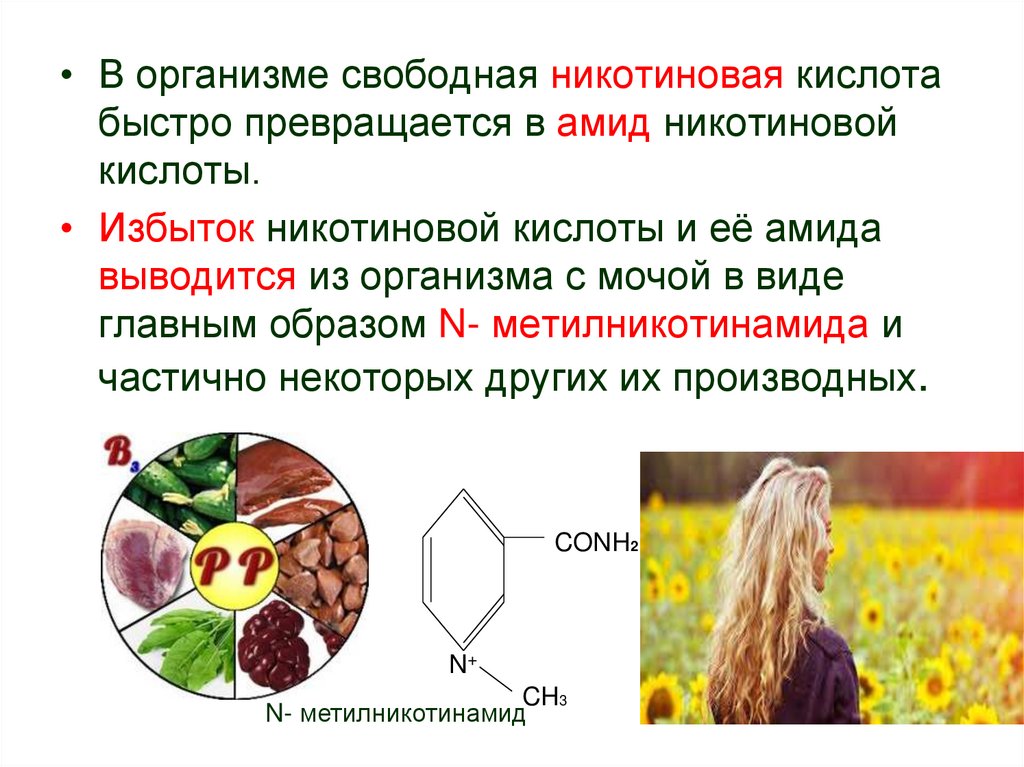
• В организме свободная никотиновая кислотабыстро превращается в амид никотиновой
кислоты.
• Избыток никотиновой кислоты и её амида
выводится из организма с мочой в виде
главным образом N- метилникотинамида и
частично некоторых других их производных.
CONH2
N+
CH3
N- метилникотинамид
13.
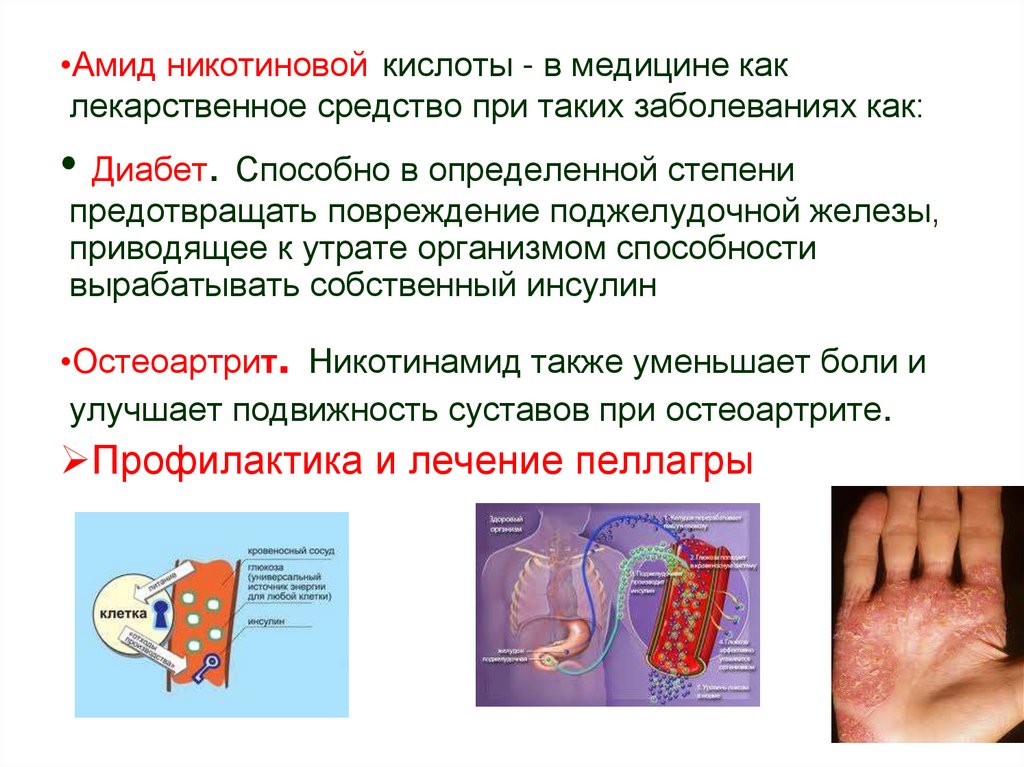
•Амид никотиновой кислоты - в медицине каклекарственное средство при таких заболеваниях как:
• Диабет. Способно в определенной степени
предотвращать повреждение поджелудочной железы,
приводящее к утрате организмом способности
вырабатывать собственный инсулин
•Остеоартрит. Никотинамид также уменьшает боли и
улучшает подвижность суставов при остеоартрите.
Профилактика и лечение пеллагры
14.
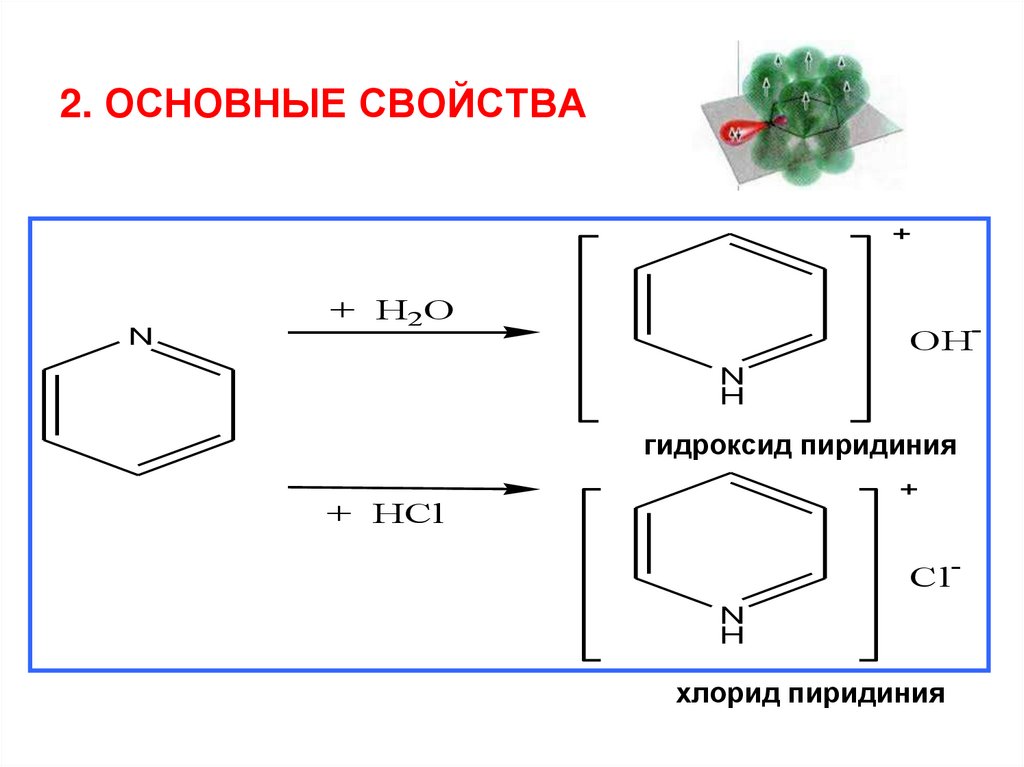
2. ОСНОВНЫЕ СВОЙСТВАN
+ H2O
OHN
H
гидроксид пиридиния
+ HCl
ClN
H
хлорид пиридиния
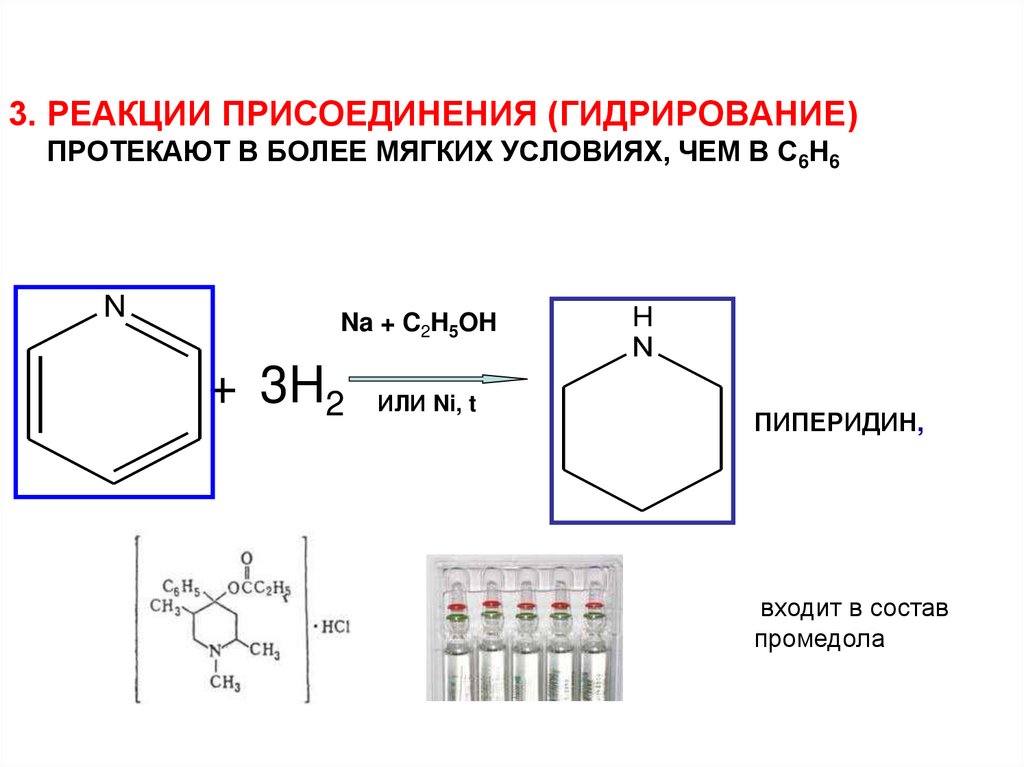
15.
3. РЕАКЦИИ ПРИСОЕДИНЕНИЯ (ГИДРИРОВАНИЕ)ПРОТЕКАЮТ В БОЛЕЕ МЯГКИХ УСЛОВИЯХ, ЧЕМ В С6Н6
N
Na + C2H5OH
+ 3Н2 ИЛИ Ni, t
H
N
ПИПЕРИДИН,
входит в состав
промедола
16. пиперидин
Встречается во многих алкалоидах: никотин, кониинАлкалоиды – гетероциклические азотсодержащие
основания растительного происхождения, обладающие
выраженным физиологическим действием
17. Кониин-производное пиперидина
яд, выделенный из болиголова: этим веществом былотравлен Сократ
N
H
CH2
CH2
CH3
18.
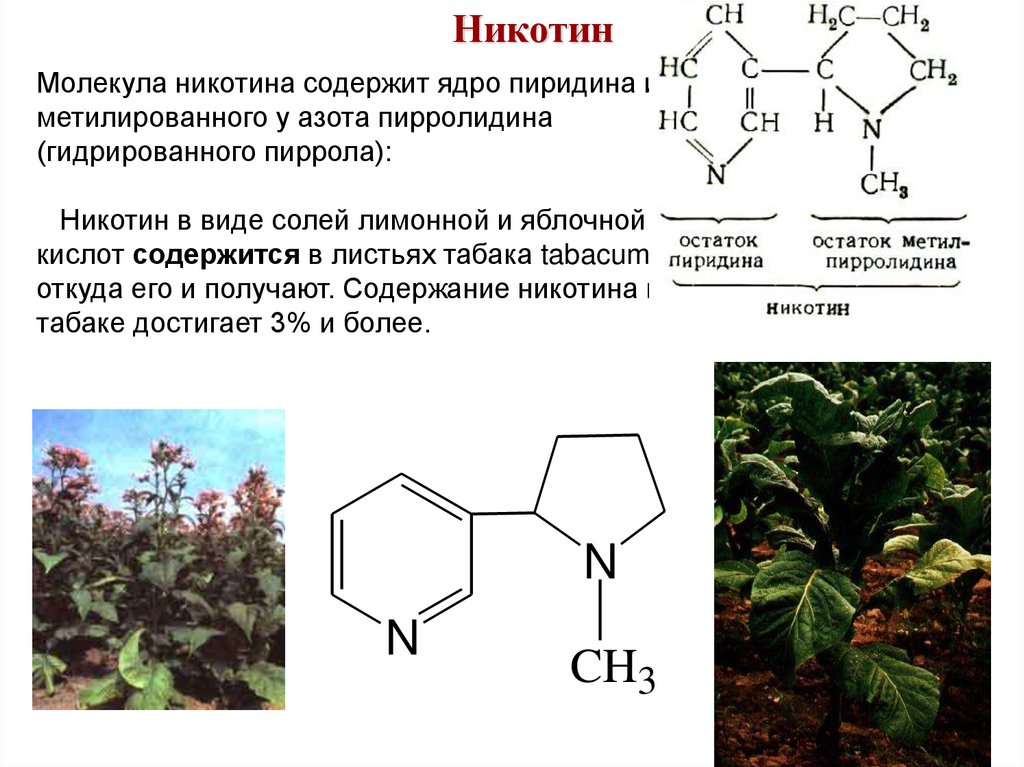
НикотинМолекула никотина содержит ядро пиридина и
метилированного у азота пирролидина
(гидрированного пиррола):
Никотин в виде солей лимонной и яблочной
кислот содержится в листьях табака tabacum,
откуда его и получают. Содержание никотина в
табаке достигает 3% и более.
N
N
CH3
19.
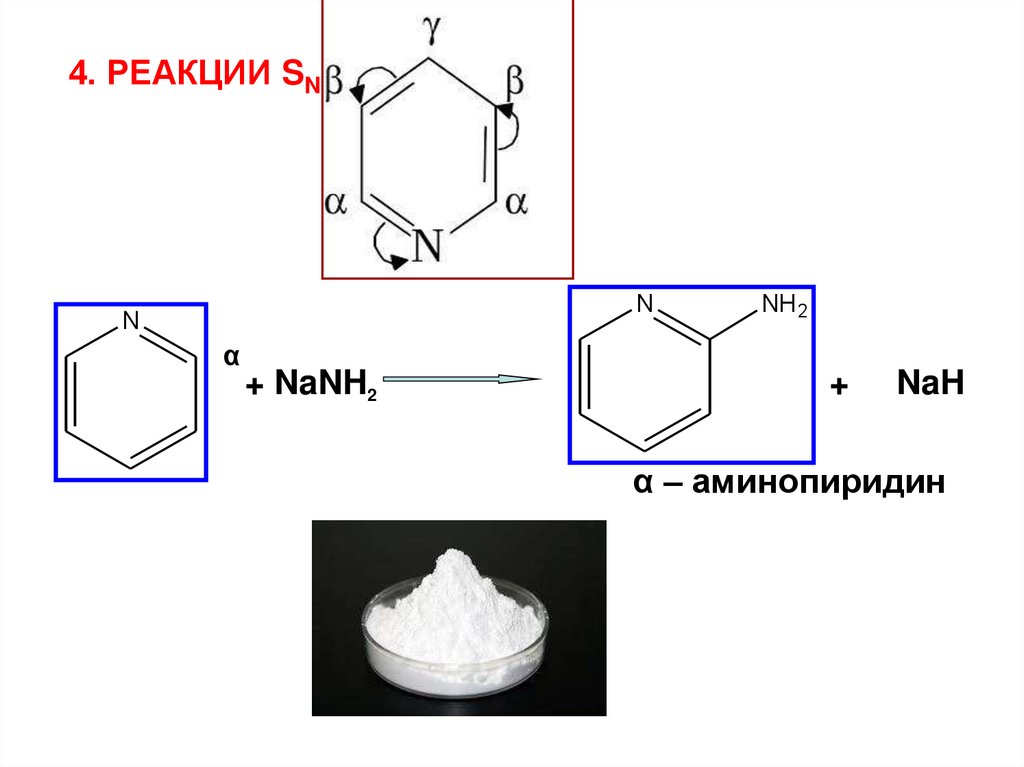
4. РЕАКЦИИ SNN
N
α
+ NaNH2
NH 2
+
NaH
α – аминопиридин
20. МЕДИКО-БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ
ВДЫХАНИЕ ПАРОВ ПИРИДИНА МОЖЕТ ПРИВЕСТИ К ТЯЖЕЛОМУПОРАЖЕНИЮ НЕРВНОЙ СИСТЕМЫ
ГОМОЛОГ ПИРИДИНА β – ПИКОЛИН ПРЕВРАЩАЕТСЯ В НИКОТИНОВУЮ
КИСЛОТУ, НИКОТИНАМИД, КОТОРЫЕ ИЗВЕСТНЫ КАК ДВЕ ФОРМЫ
ВИТАМИНА РР,
ДИЭТИЛАМИД НИКОТИНОВОЙ КИСЛОТЫ – КОРДИАМИН –
ЭФФЕКТИВНЫЙ СТИМУЛЯТОР ЦНС
ПИПЕРИДИН ВХОДИТ В СОСТАВ ПРОМЕДОЛА, ВСТРЕЧАЕТСЯ ВО
МНОГИХ алкалоидах.
21.
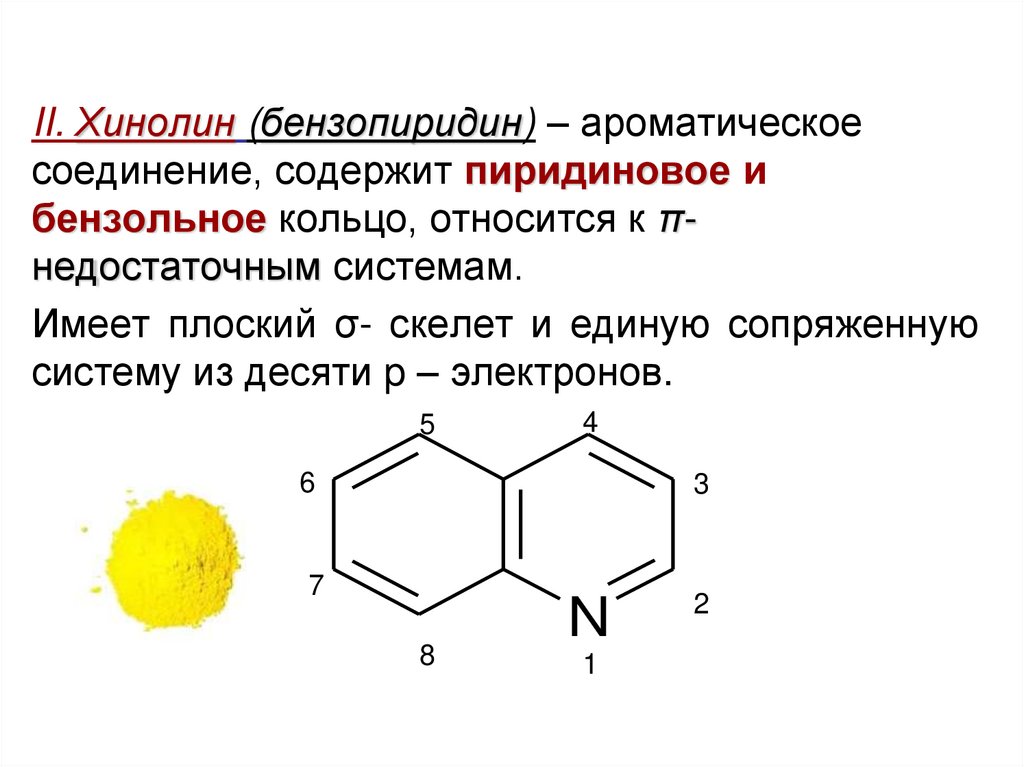
II. Хинолин (бензопиридин) – ароматическоесоединение, содержит пиридиновое и
бензольное кольцо, относится к πнедостаточным системам.
Имеет плоский σ- скелет и единую сопряженную
систему из десяти p – электронов.
5
4
6
3
7
8
N
1
2
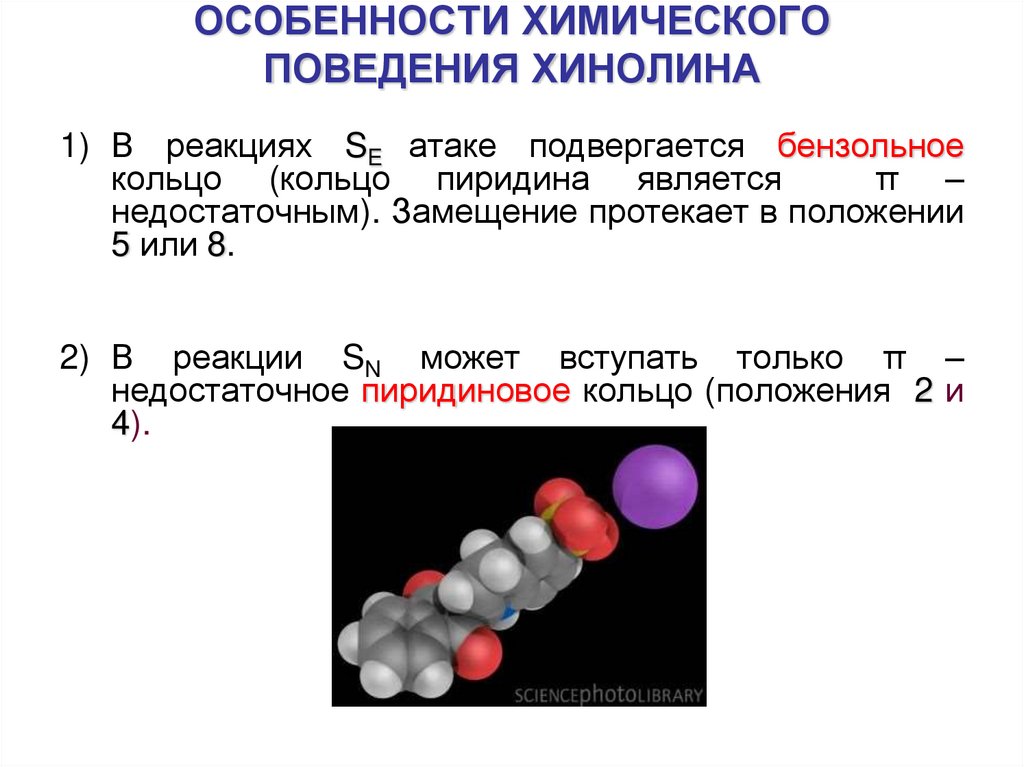
22. ОСОБЕННОСТИ ХИМИЧЕСКОГО ПОВЕДЕНИЯ ХИНОЛИНА
1) В реакциях SE атаке подвергается бензольноекольцо (кольцо пиридина является
π –
недостаточным). Замещение протекает в положении
5 или 8.
2) В реакции SN может вступать только π –
недостаточное пиридиновое кольцо (положения 2 и
4).
23.
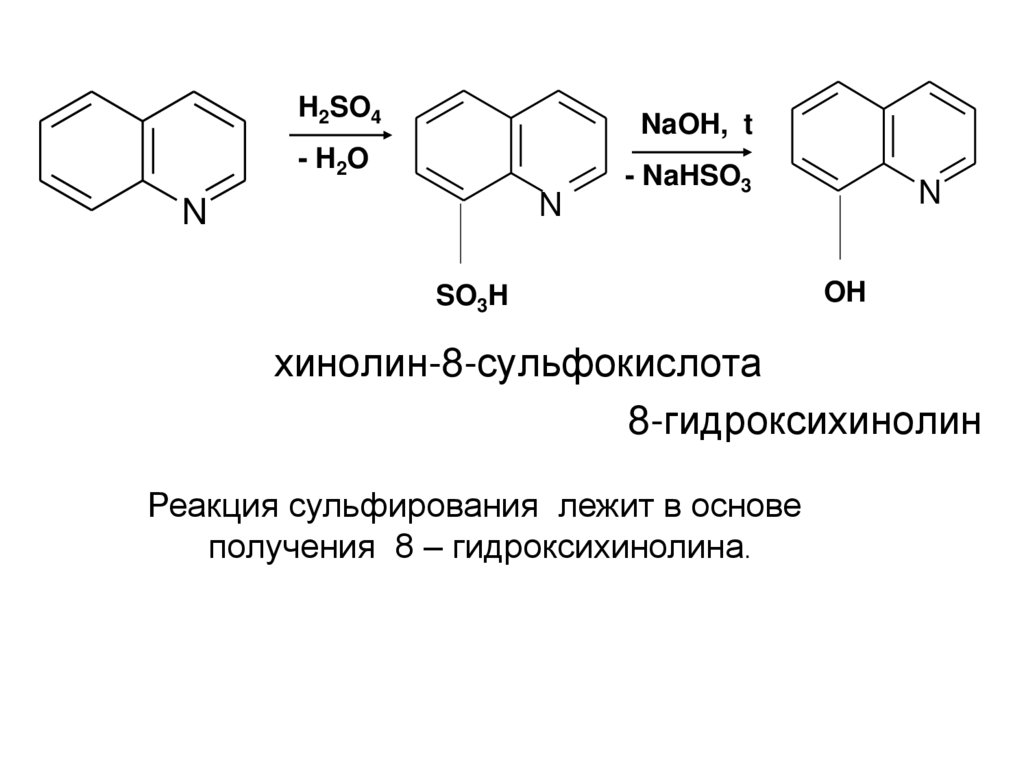
H2SO4NaOH, t
- H 2O
N
N
- NaHSO3
SO3H
N
OH
хинолин-8-сульфокислота
8-гидроксихинолин
Реакция сульфирования лежит в основе
получения 8 – гидроксихинолина.
24.
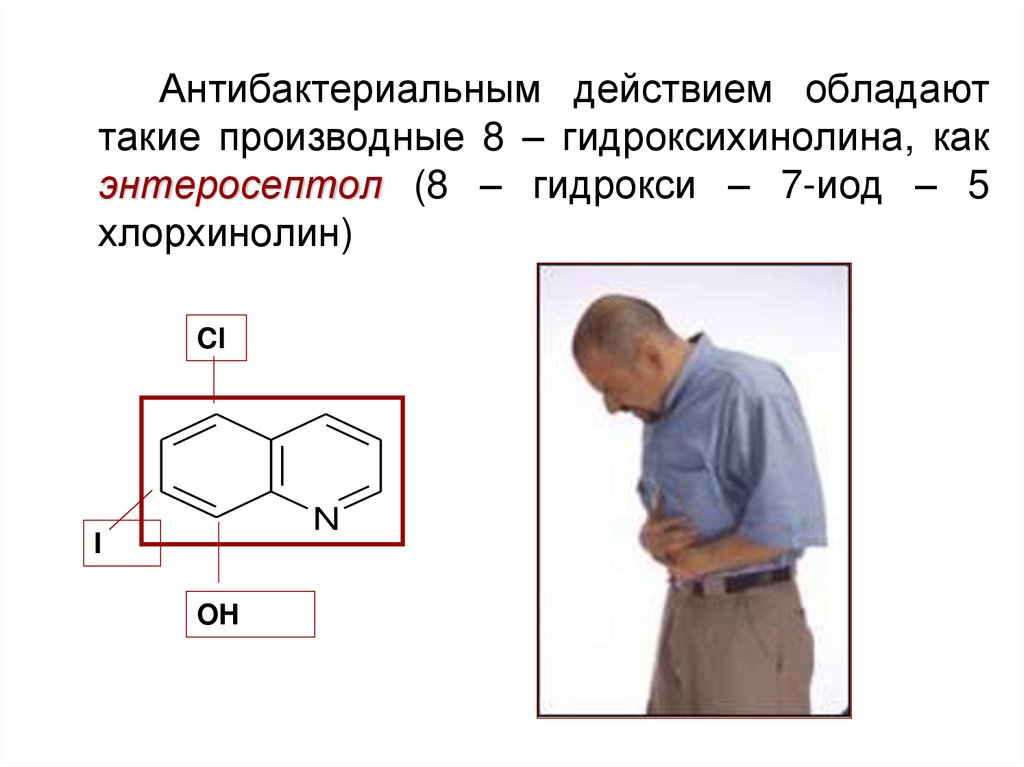
Антибактериальным действием обладаюттакие производные 8 – гидроксихинолина, как
энтеросептол (8 – гидрокси – 7-иод – 5
хлорхинолин)
Cl
N
I
OH
25.
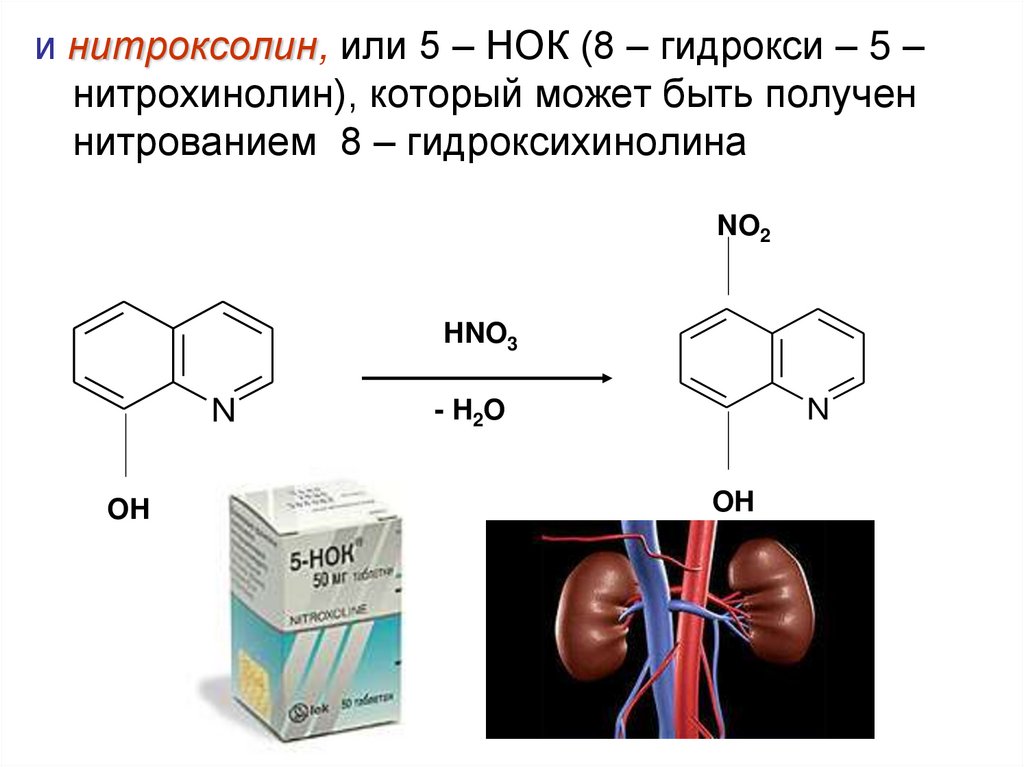
и нитроксолин, или 5 – НОК (8 – гидрокси – 5 –нитрохинолин), который может быть получен
нитрованием 8 – гидроксихинолина
NO2
HNO3
N
OH
N
- H 2O
OH
26.
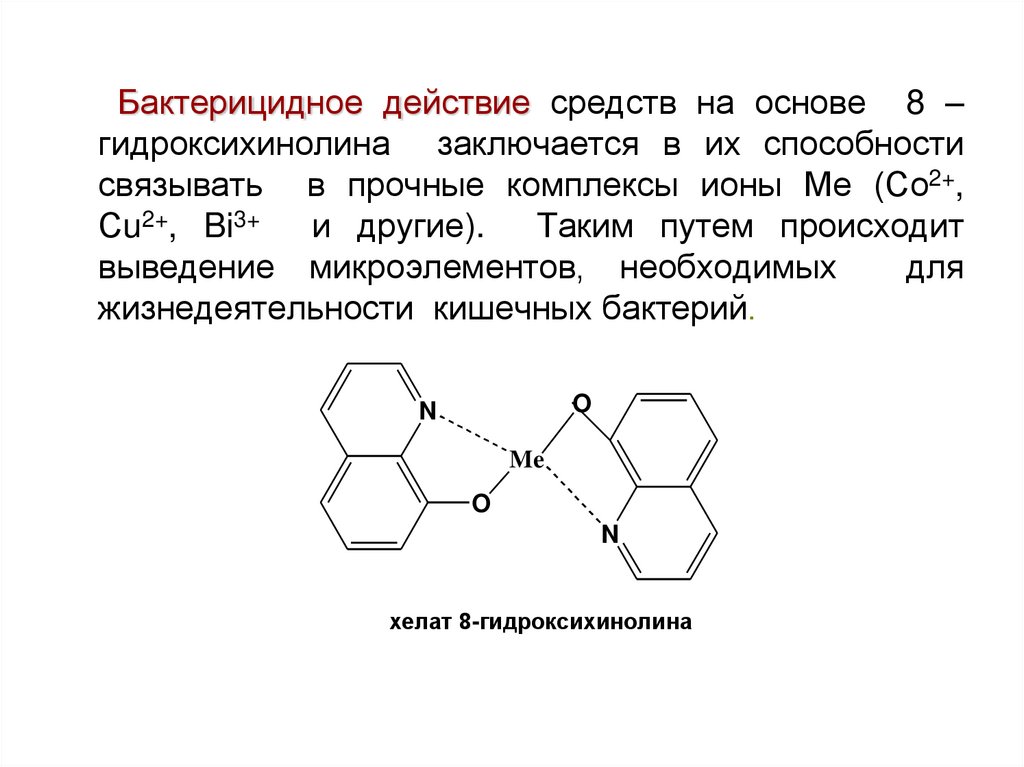
Бактерицидное действие средств на основе 8 –гидроксихинолина заключается в их способности
связывать в прочные комплексы ионы Ме (Со2+,
Сu2+, Bi3+
и другие).
Таким путем происходит
выведение микроэлементов, необходимых
для
жизнедеятельности кишечных бактерий.
O
N
Me
O
N
хелат 8-гидроксихинолина
27.
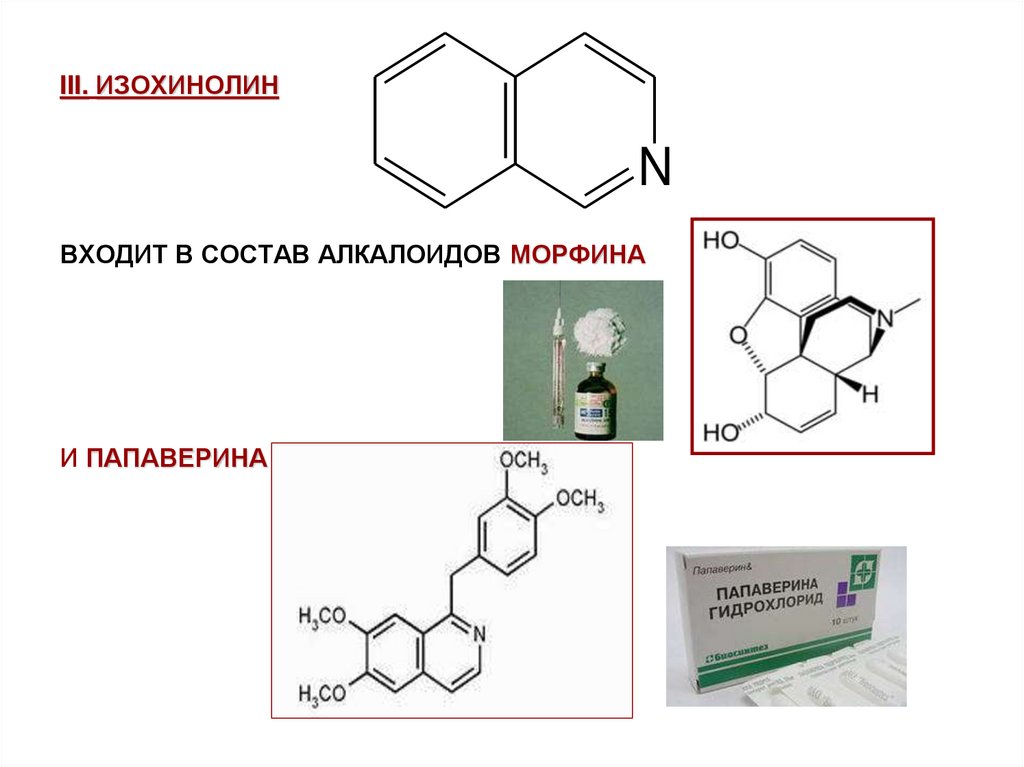
III. ИЗОХИНОЛИНN
ВХОДИТ В СОСТАВ АЛКАЛОИДОВ МОРФИНА
И ПАПАВЕРИНА
28.
Применяют морфин как болеутоляющеесредство при травмах и различных
заболеваниях, сопровождающихся сильными
болевыми ощущениями
29.
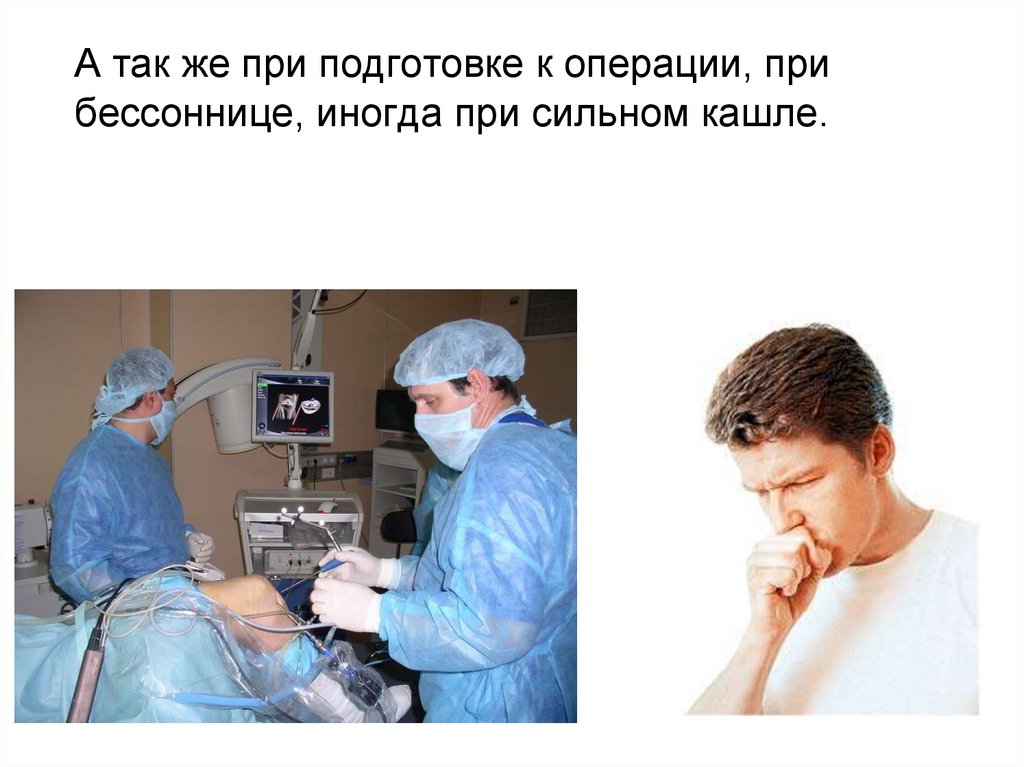
А так же при подготовке к операции, прибессоннице, иногда при сильном кашле.
30.
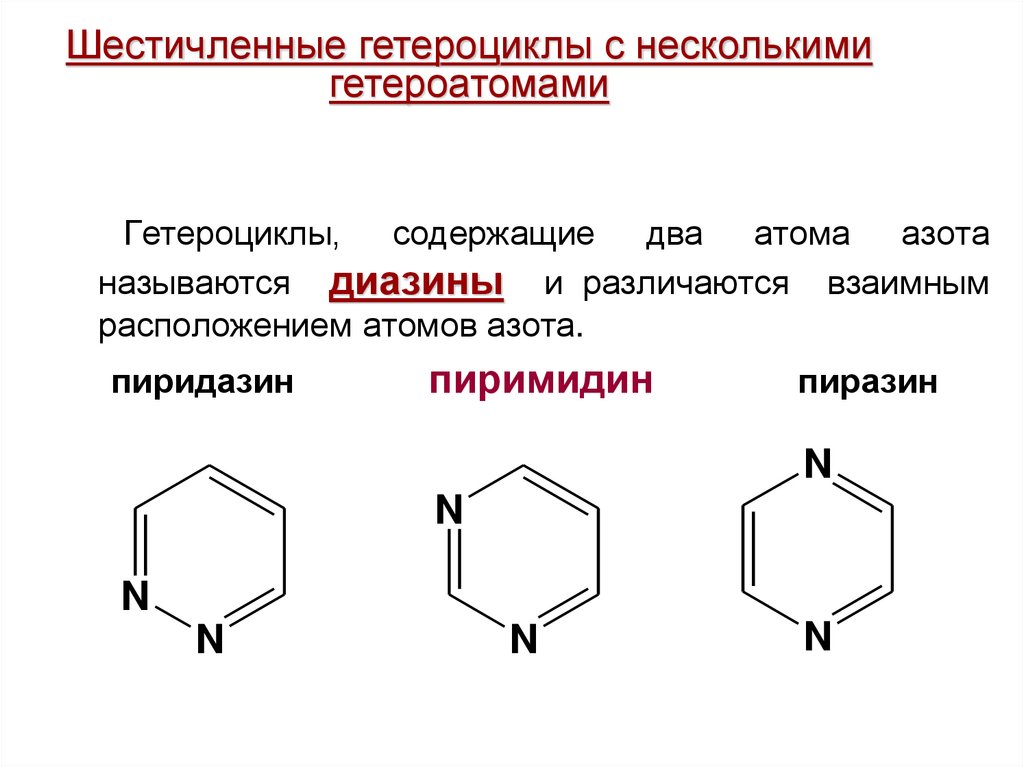
Шестичленные гетероциклы с несколькимигетероатомами
Гетероциклы, содержащие два атома азота
называются диазины и различаются взаимным
расположением атомов азота.
пиридазин
пиримидин
пиразин
N
N
N
N
N
N
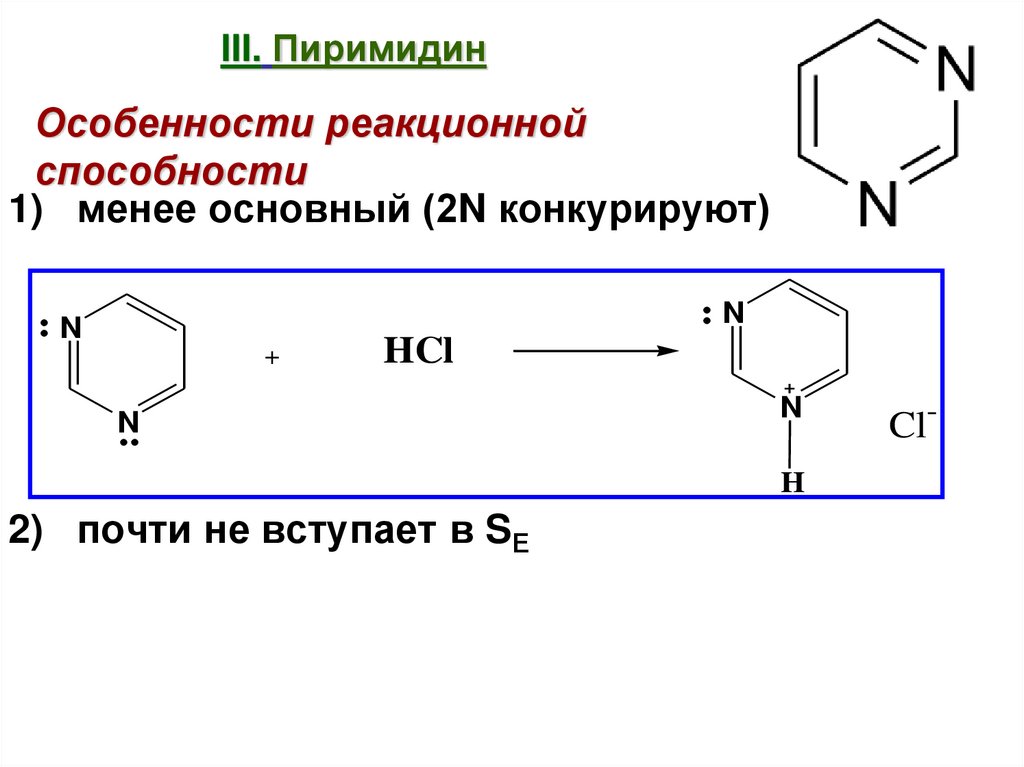
31. III. Пиримидин
Особенности реакционнойспособности
1) менее основный (2N конкурируют)
N
N
+
HCl
N
N
H
2) почти не вступает в SЕ
Cl-
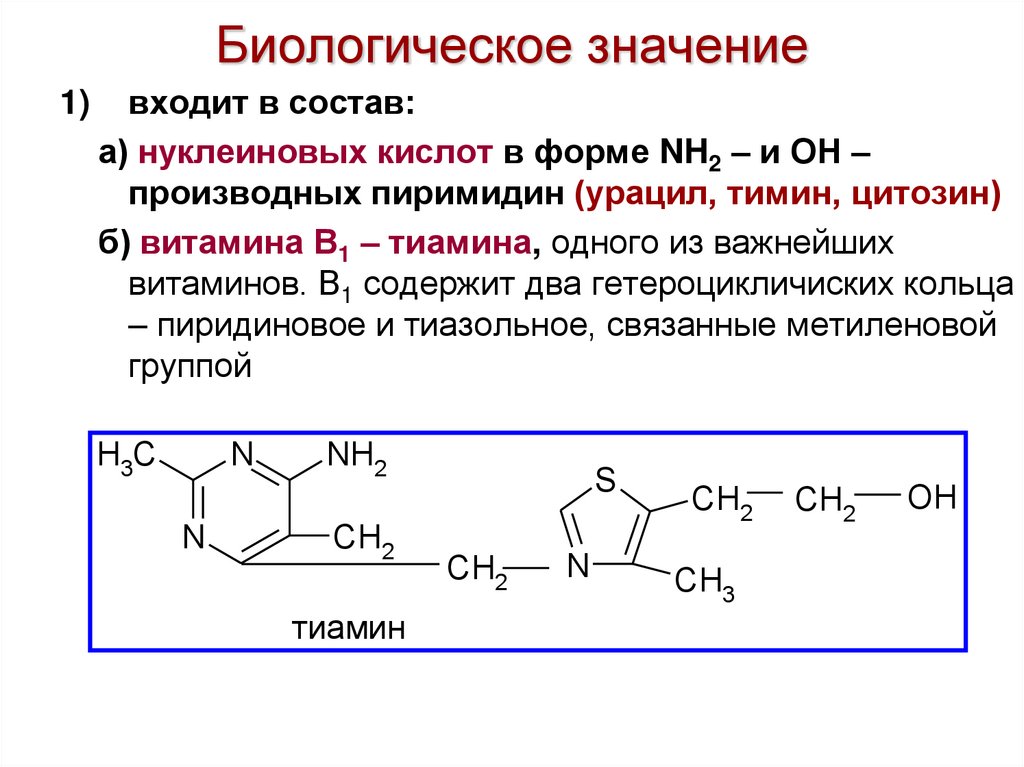
32. Биологическое значение
1)входит в состав:
а) нуклеиновых кислот в форме NH2 – и ОН –
производных пиримидин (урацил, тимин, цитозин)
б) витамина В1 – тиамина, одного из важнейших
витаминов. В1 содержит два гетероцикличиских кольца
– пиридиновое и тиазольное, связанные метиленовой
группой
H3C
N
N
NH2
CH2
тиамин
S
CH2
N
CH2
CH3
CH2
OH
33.
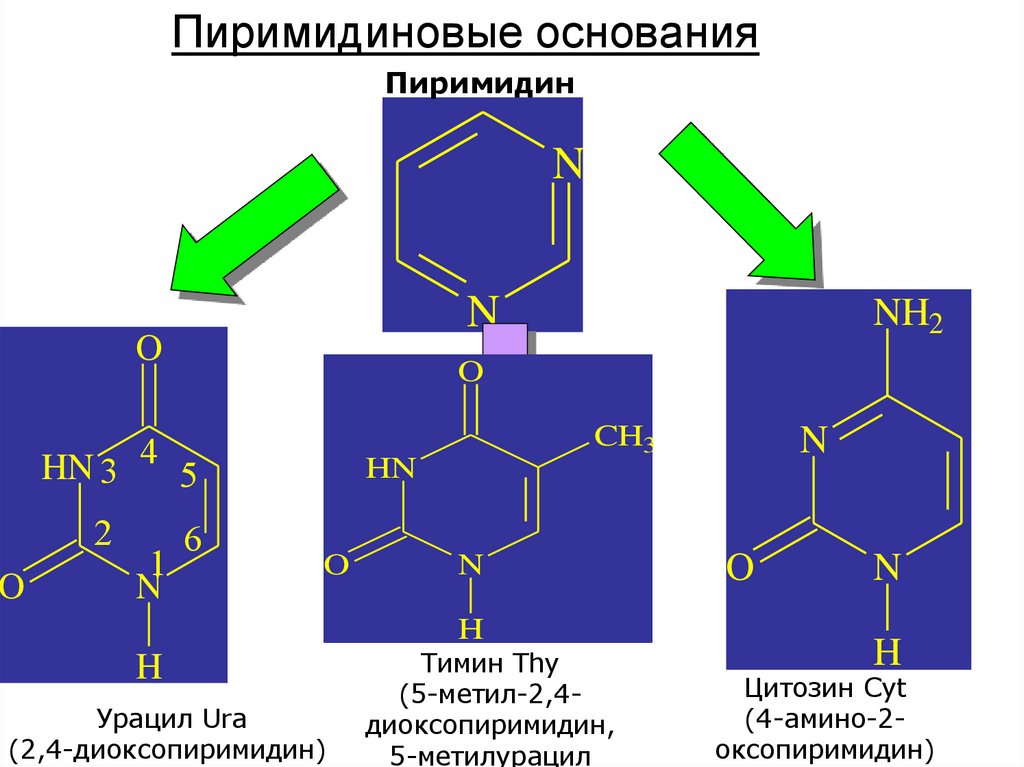
Пиримидиновые основанияПиримидин
N
N
O
HN 3
2
O
4
1
N
NH2
O
5
6
N
CH3
HN
O
N
H
H
Урацил Ura
(2,4-диоксопиримидин)
Тимин Thy
(5-метил-2,4диоксопиримидин,
5-метилурацил
O
N
H
Цитозин Cyt
(4-амино-2оксопиримидин)
34. Свойства тиамина
• Играет важную роль в метаболизме углеводов и жиров.• Незаменим для утилизации глюкозы
Поддерживает работу сердца,нервной и пищеварительной
систем.
• Недостаток витамина в пище приводит к тяжелому заболеванию
«бери-бери»
35. Источники витамина тиамина
0,96мкг0,72мкг
0,48мкг
0,51мкг
36.
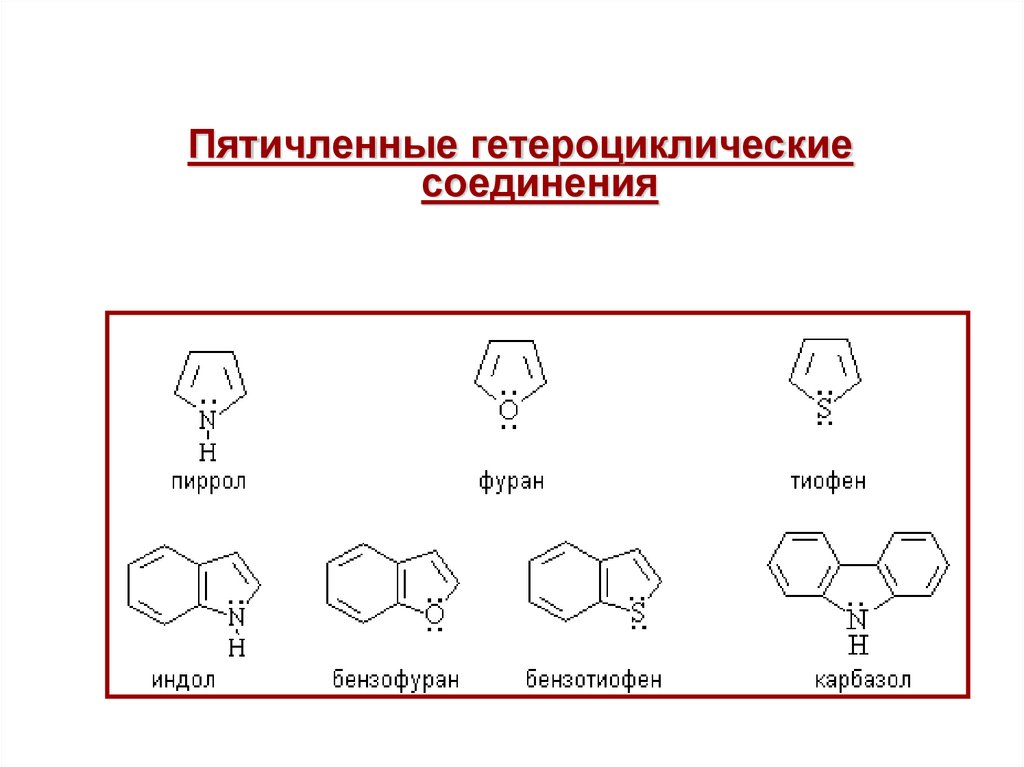
Пятичленные гетероциклическиесоединения
37.
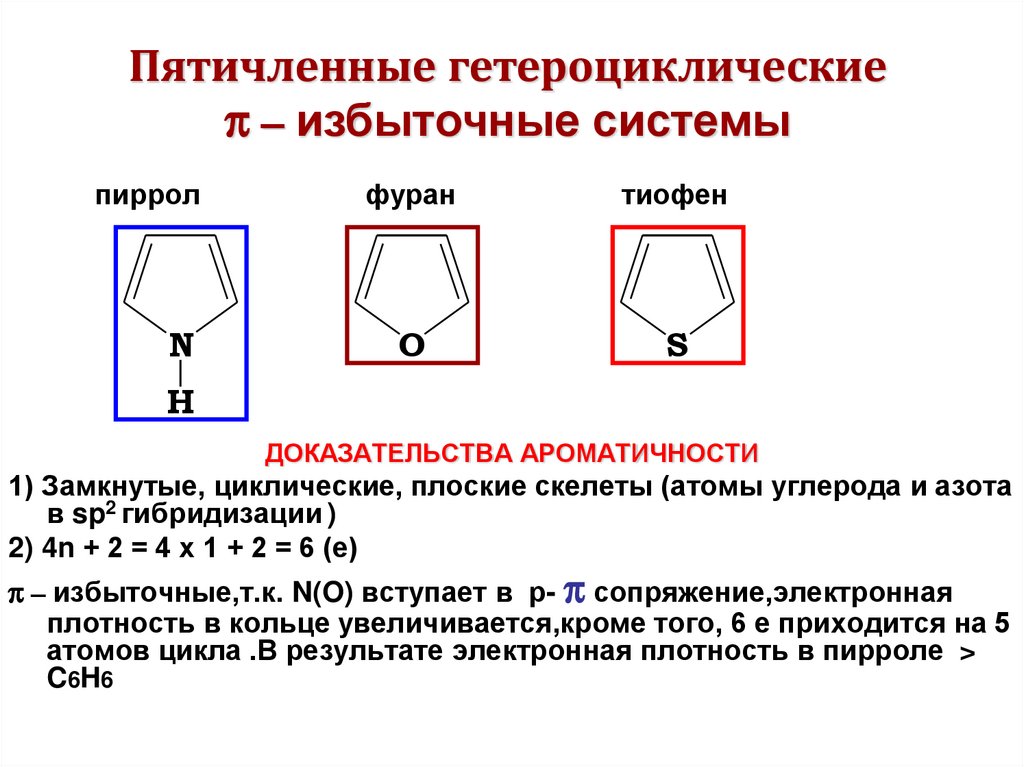
Пятичленные гетероциклическиеπ – избыточные системы
пиррол
N
фуран
тиофен
O
S
H
ДОКАЗАТЕЛЬСТВА АРОМАТИЧНОСТИ
1) Замкнутые, циклические, плоские скелеты (атомы углерода и азота
в sp2 гибридизации )
2) 4n + 2 = 4 х 1 + 2 = 6 (е)
π – избыточные,т.к. N(O) вступает в р- π сопряжение,электронная
плотность в кольце увеличивается,кроме того, 6 е приходится на 5
атомов цикла .В результате электронная плотность в пирроле >
C 6H 6
38.
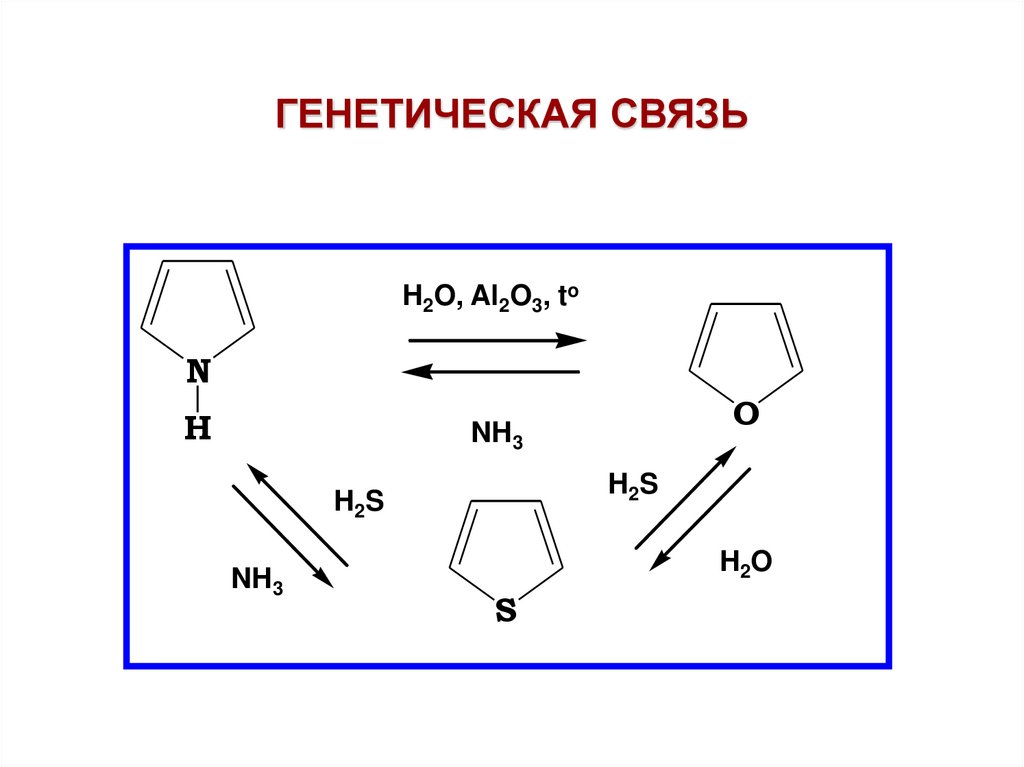
ГЕНЕТИЧЕСКАЯ СВЯЗЬH2O, Al2O3, to
N
H
O
NH3
H 2S
H 2S
NH3
H 2O
S
39.
I. ФУРАНO
40.
ПИРРОЛN
H
41.
Пиррольный атом азота имеет неподеленнуюэлектронную пару и участвует в р- p сопряжении.
Связь N–Н ослабляется, и пиррол проявляет
кислотные свойства.
N
H
42.
ХИМИЧЕСКИЕ СВОЙСТВА π-избыточных систем1) Реакции SЕ. Большая реакционная
способность, чем у С6Н6
а) алкилирование
б) галогенирование
в) ацилирование
г) сульфирование
д) нитрование
2) Слабокислые свойства
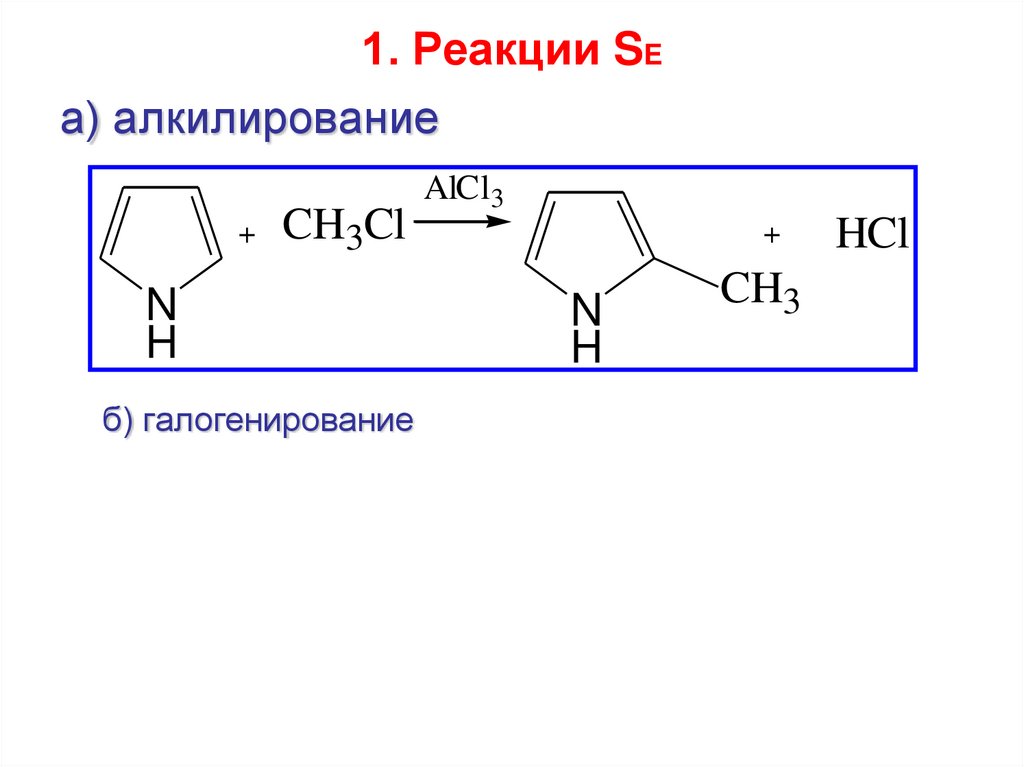
43. 1. Реакции SE
а) алкилирование+
CH3Cl
N
H
б) галогенирование
AlCl3
+
N
H
CH3
HCl
44.
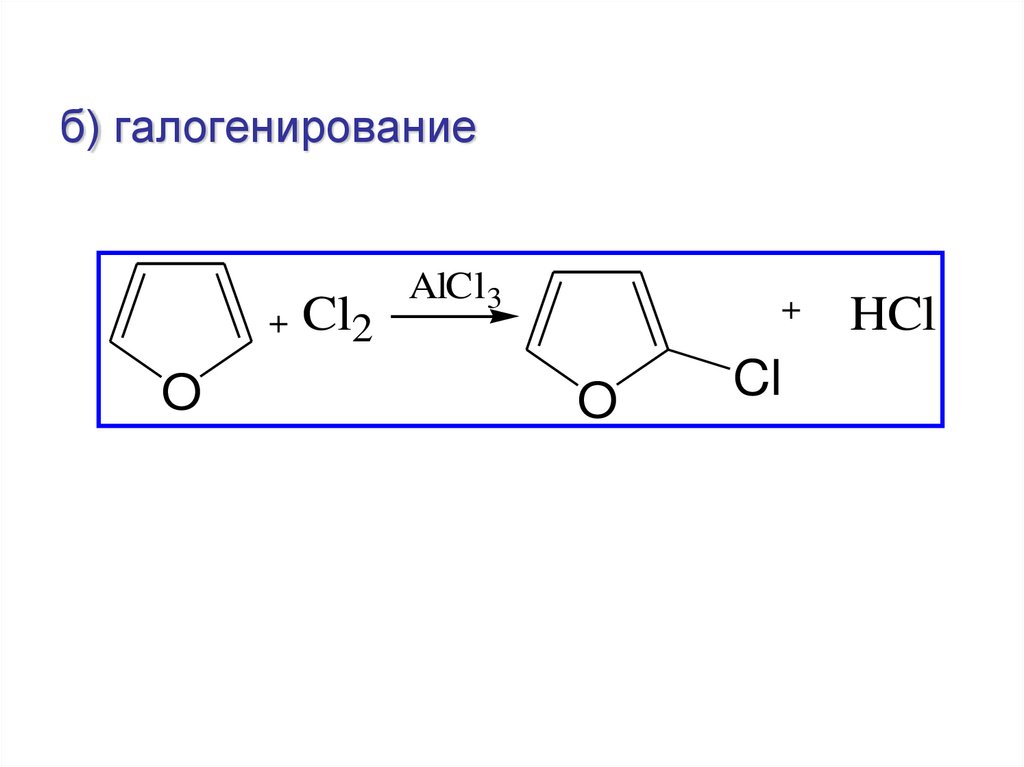
б) галогенирование+ Cl2
O
AlCl3
+
O
Cl
HCl
45.
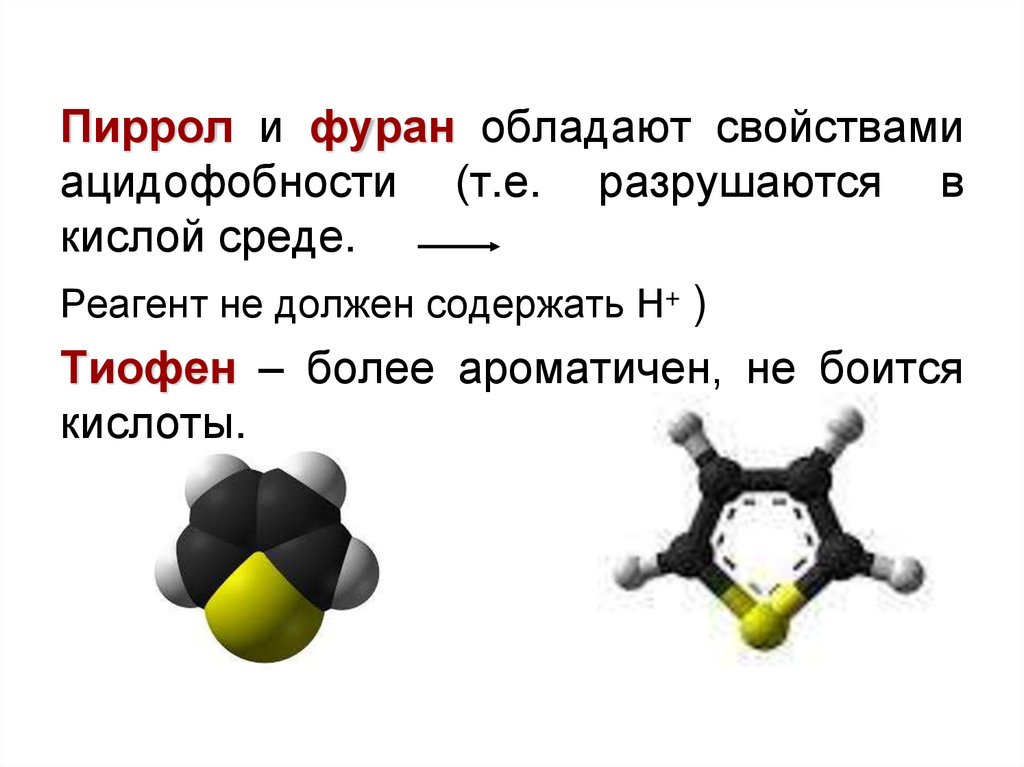
Пиррол и фуран обладают свойствамиацидофобности (т.е. разрушаются в
кислой среде.
Реагент не должен содержать Н+ )
Тиофен – более ароматичен, не боится
кислоты.
46.
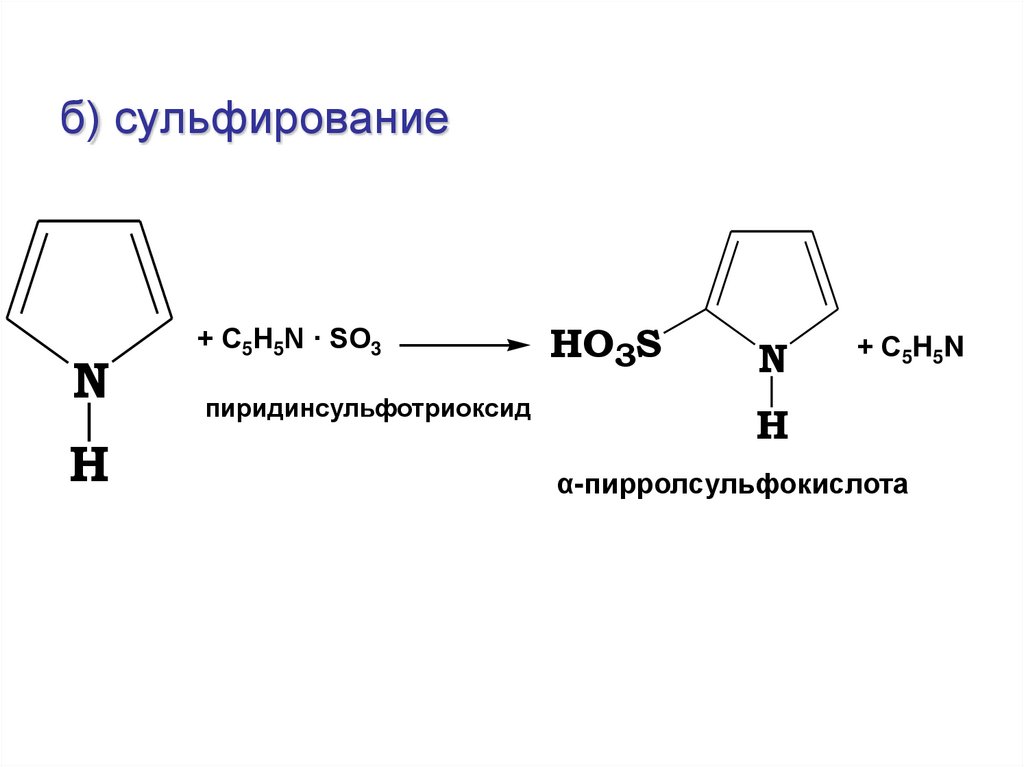
б) сульфированиеN
H
+ С5Н5N · SO3
пиридинсульфотриоксид
HO3S
N
+ С 5H 5N
H
α-пирролсульфокислота
47.
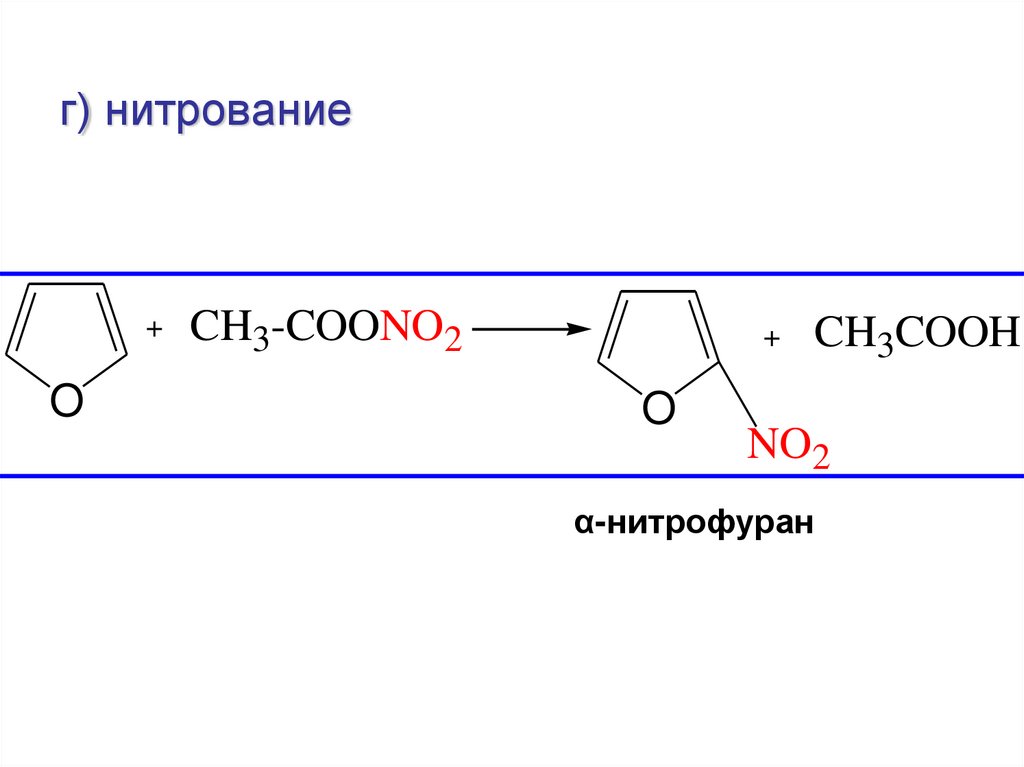
г) нитрование+
O
CH3-COONO2
+
O
CH3COOH
NO2
α-нитрофуран
48.
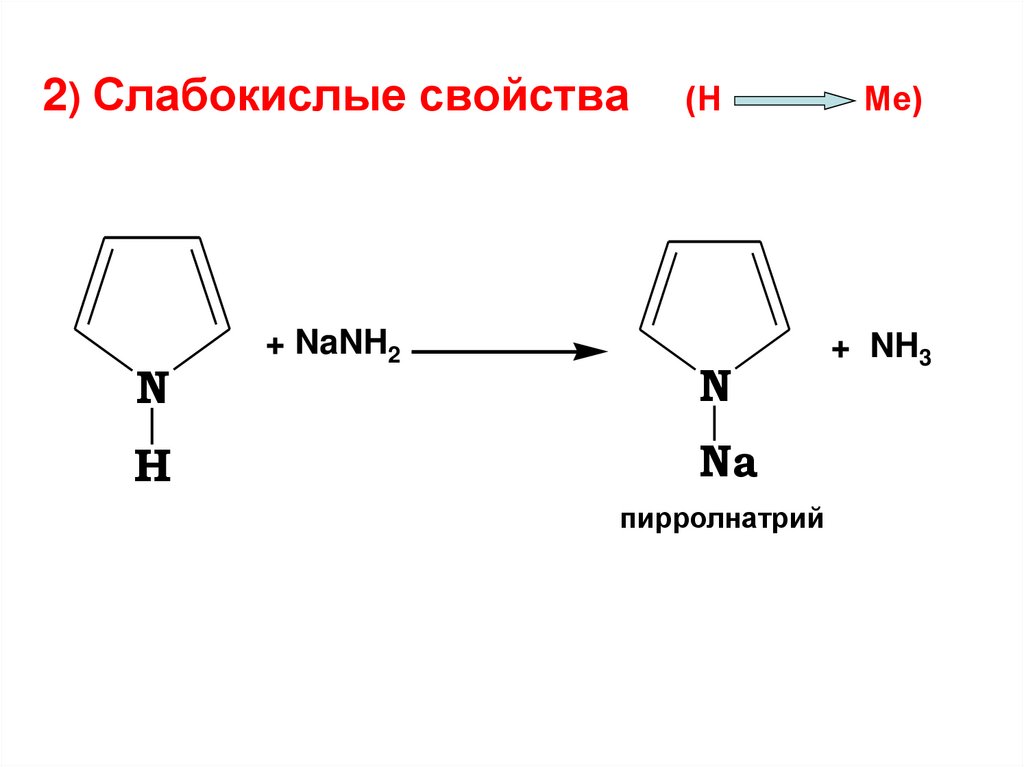
2) Слабокислые свойстваN
H
+ NaNH2
(Н
N
Na
пирролнатрий
Ме)
+ NH3
49.
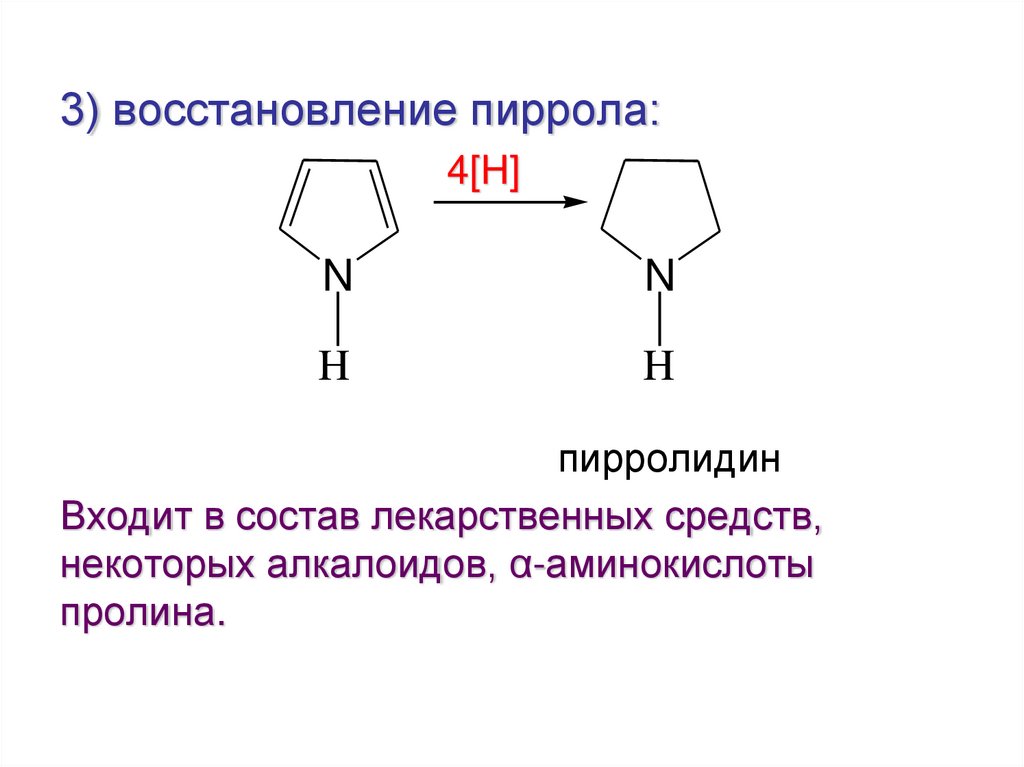
3) восстановление пиррола:4[H]
N
N
H
H
пирролидин
Входит в состав лекарственных средств,
некоторых алкалоидов, α-аминокислоты
пролина.
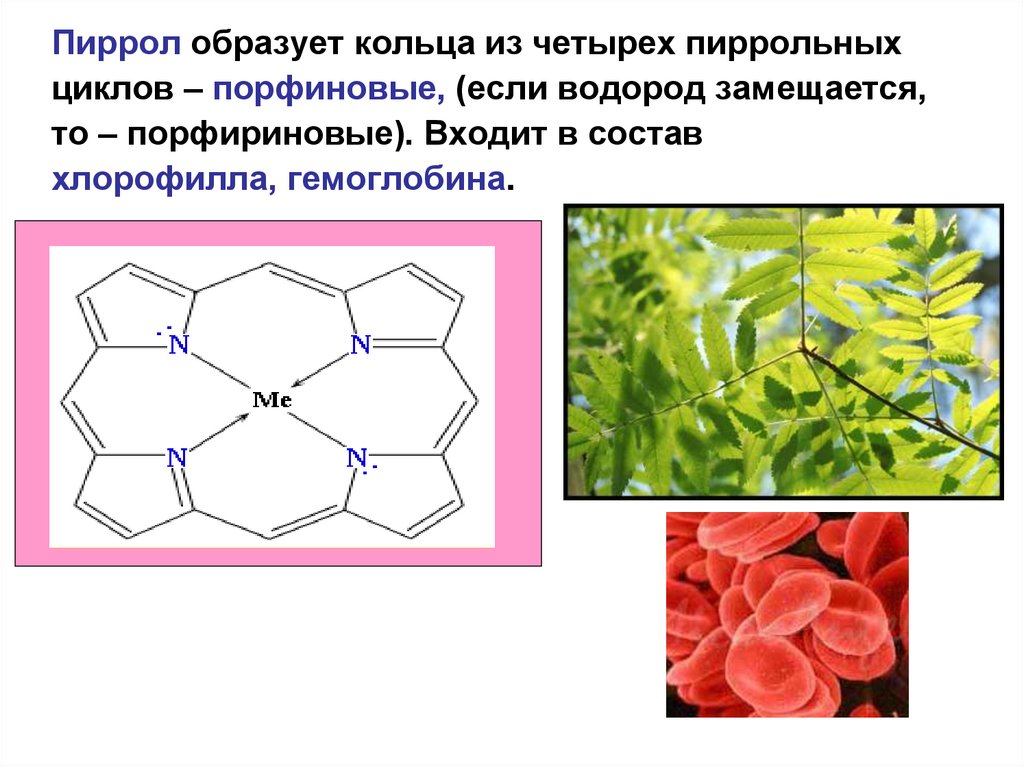
50.
Пиррол образует кольца из четырех пиррольныхциклов – порфиновые, (если водород замещается,
то – порфириновые). Входит в состав
хлорофилла, гемоглобина.
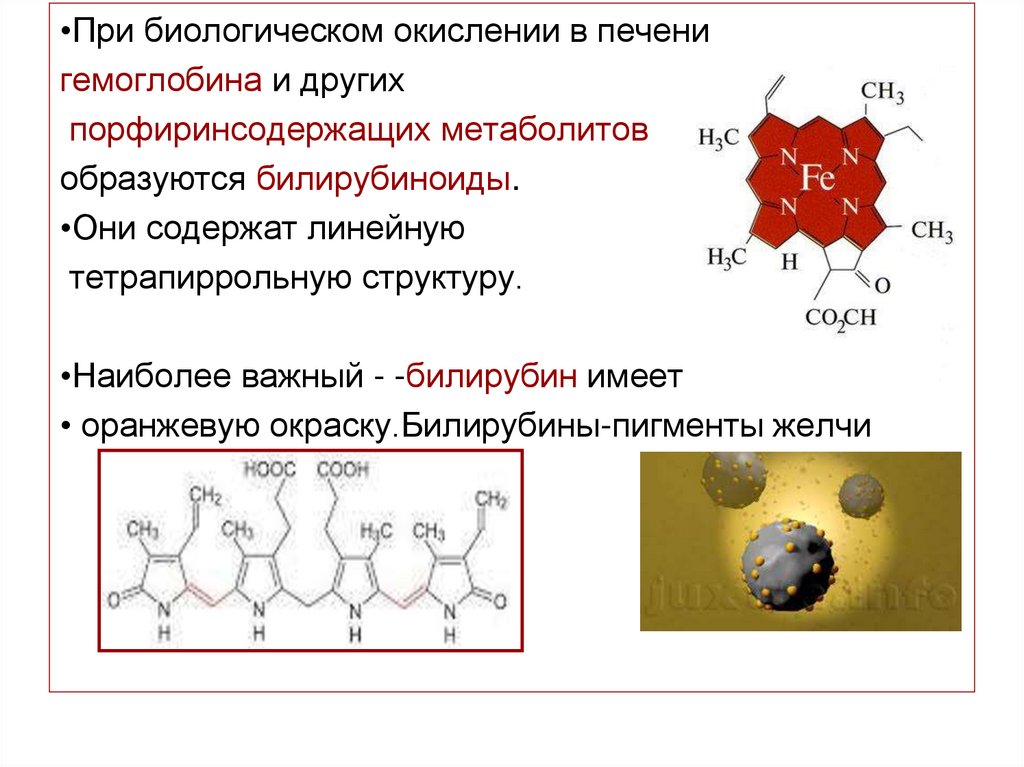
51.
•При биологическом окислении в печенигемоглобина и других
порфиринсодержащих метаболитов
образуются билирубиноиды.
•Они содержат линейную
тетрапиррольную структуру.
•Наиболее важный - -билирубин имеет
• оранжевую окраску.Билирубины-пигменты желчи
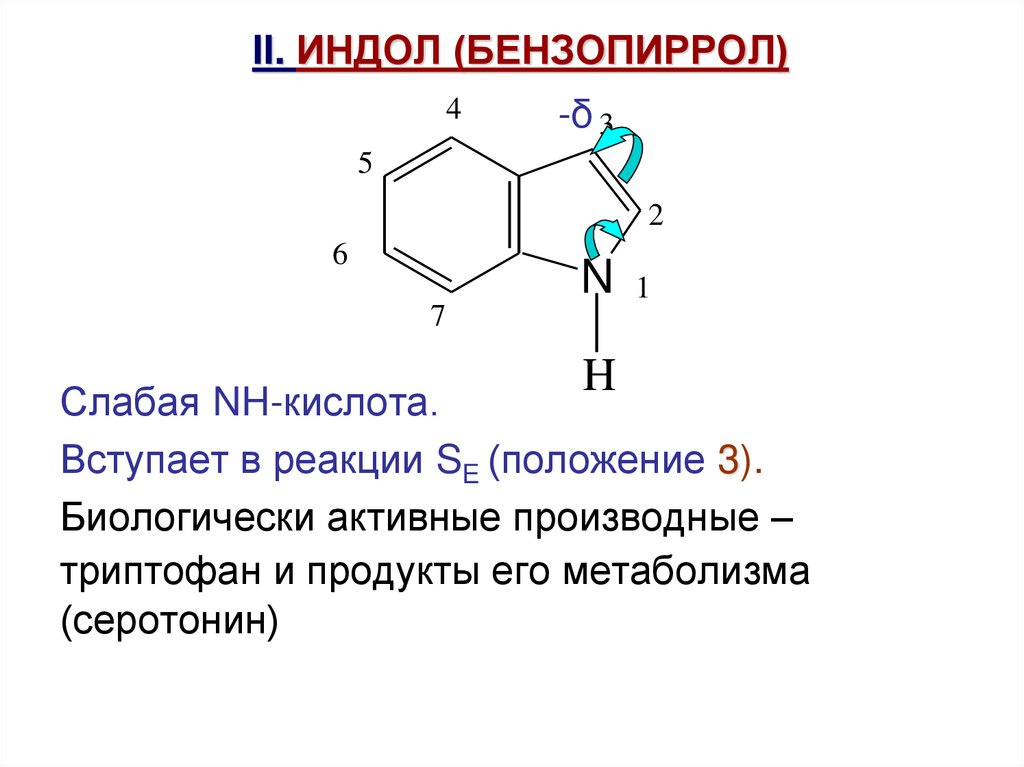
52. II. ИНДОЛ (БЕНЗОПИРРОЛ)
4-δ 3
5
2
6
N 1
7
H
Слабая NH-кислота.
Вступает в реакции SE (положение 3).
Биологически активные производные –
триптофан и продукты его метаболизма
(серотонин)
53. БИОЛОГИЧЕСКИ АКТИВНЫЕ ПРОИЗВОДНЫЕ ИНДОЛА
Триптофан – α-амино-β-(β‘-индолил) пропионовая кислота. Входит всостав полипептидов растительных и животных организмов.
Участвует в реакции гидроксилирования (получение 5гидрокситриптофана, который подвергается декарбоксилированию
с образованием 5-гидрокситриптамина(серотонина)
.
Серотонин является одним из нейромедиаторов головного мозга.
Нарушение его нормального обмена ведет к шизофрении. Гормон
удовольствия.
54.
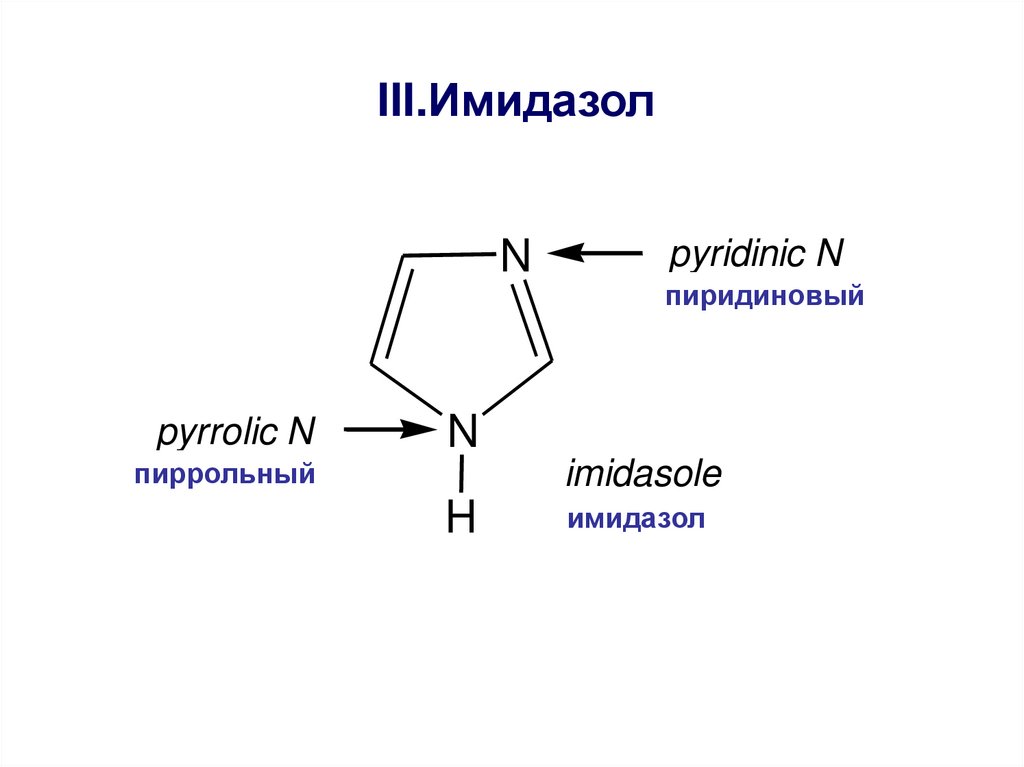
III.ИмидазолN
pyrrolic N
pyridinic N
пиридиновый
N
пиррольный
imidasole
H
имидазол
This compound possesses both weak acidic
and weak basic properties. As a result imidasole
possesses amphoteric properties.
55.
Имидазол-амфотерное соединение1. Проявляет слабокислотные свойства за
счет пиррольного N
2. Слабоосновные – за счет пиридинового N
образует соли с сильными кислотами и
щелочными металлами
NH кислотная группа и –N= основная
образуют межмолекулярные водородные
связи
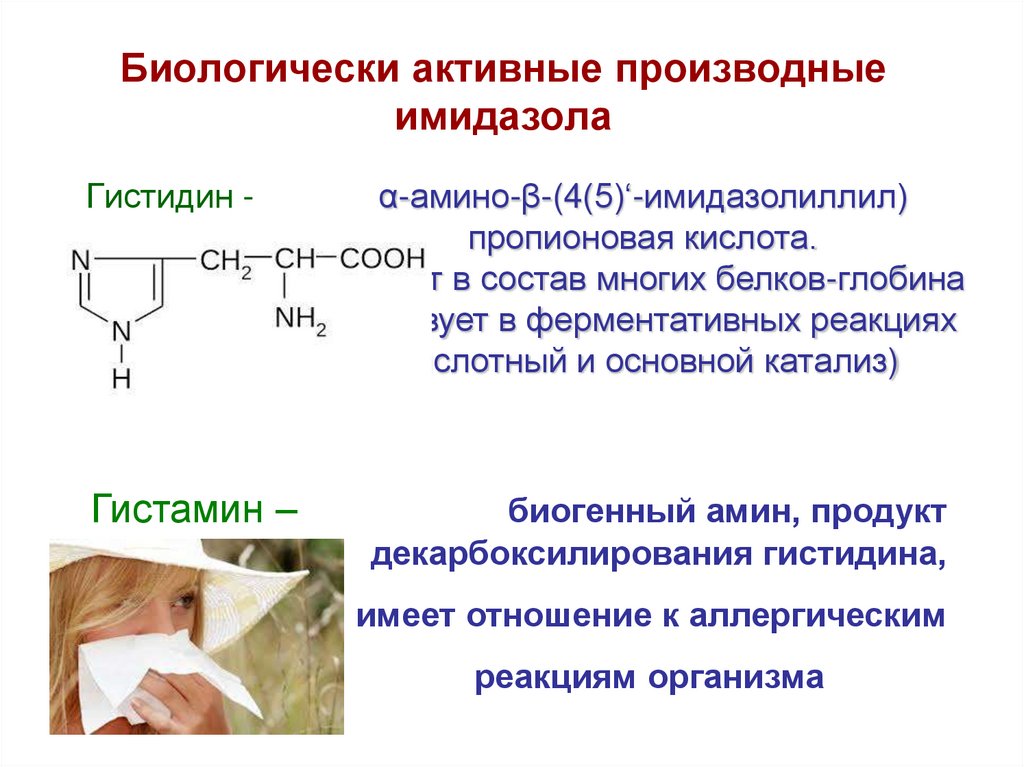
56. Биологически активные производные имидазола
Гистидин -Гистамин –
α-амино-β-(4(5)‘-имидазолиллил)
пропионовая кислота.
Входит в состав многих белков-глобина
Участвует в ферментативных реакциях
(кислотный и основной катализ)
биогенный амин, продукт
декарбоксилирования гистидина,
имеет отношение к аллергическим
реакциям организма
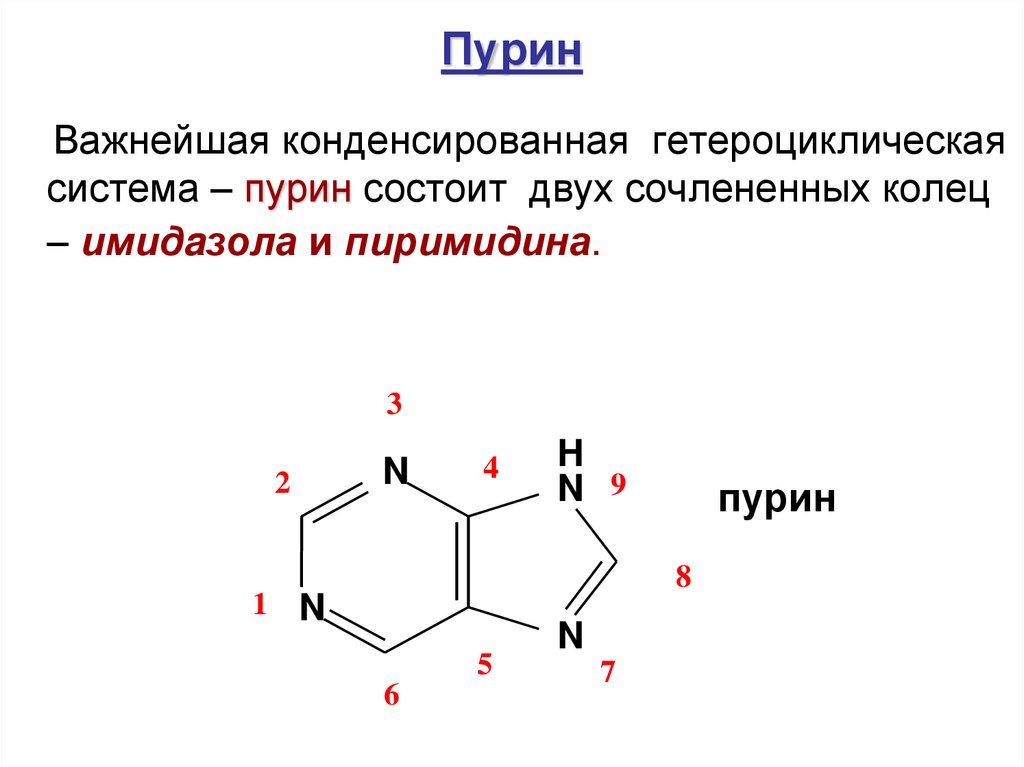
57. Пурин
Важнейшая конденсированная гетероциклическаясистема – пурин состоит двух сочлененных колец
– имидaзола и пиримидина.
3
2
N
4
H
N 9
пурин
8
1 N
5
6
N
7
58. Свойства пурина
1)Устойчив к действию окислителей
2)
Хорошо растворяется в воде
3)
Амфотерен, образует соли
не только с сильными
кислотами, но (благодаря наличию NH – группы) и со
щелочными Ме.
!Наиболее важны гидрокси – и аминопурины, принимающие
активное участие в процессах жизнедеятельности.
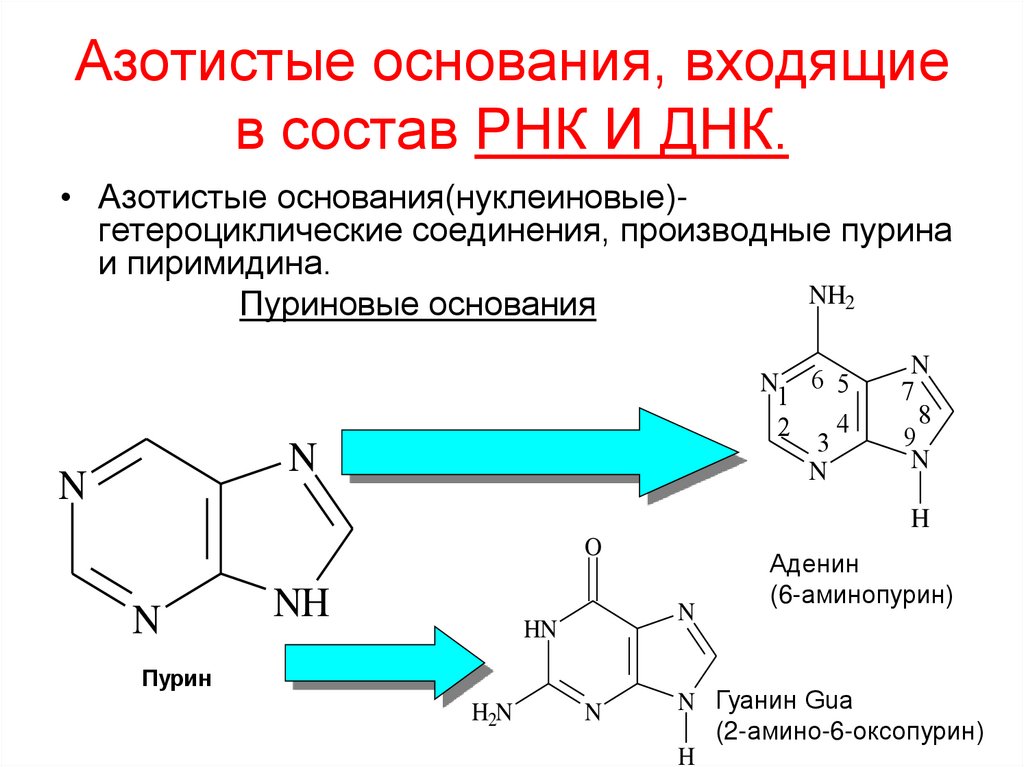
59. Азотистые основания, входящие в состав РНК И ДНК.
• Азотистые основания(нуклеиновые)гетероциклические соединения, производные пуринаи пиримидина.
NH2
Пуриновые основания
N1 6 5
4
2
3
N
N
N
N
7
8
9
N
H
O
N
NH
N
HN
Пурин
H2N
N
Аденин
(6-аминопурин)
N Гуанин Gua
(2-амино-6-оксопурин)
H
60.
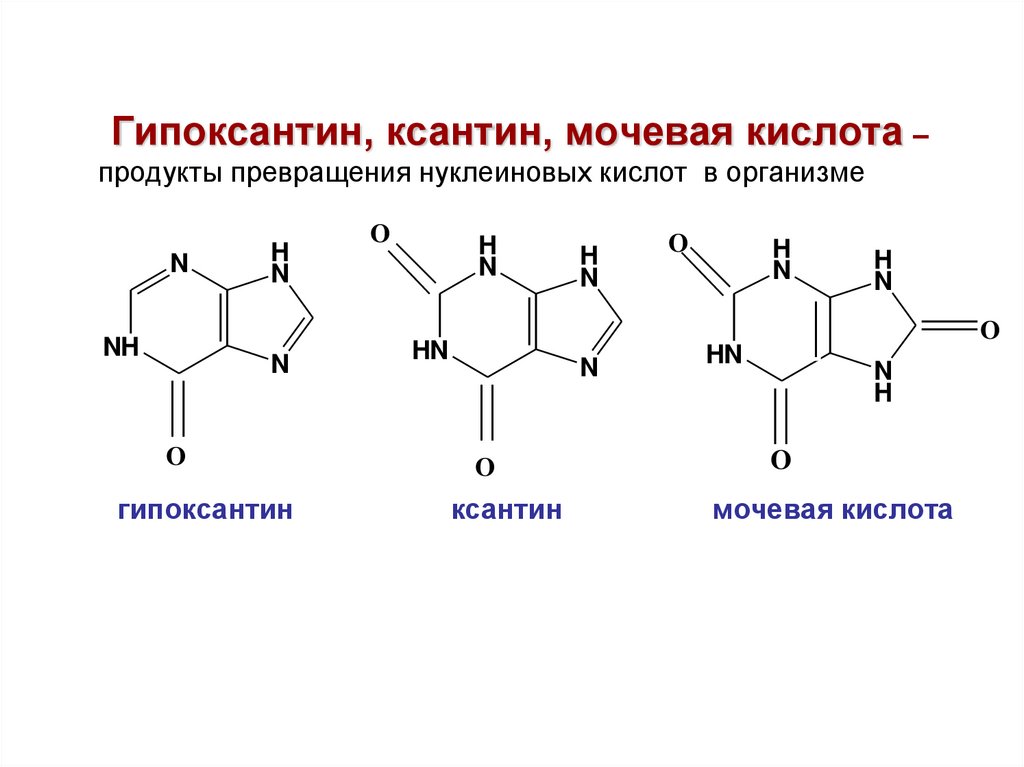
Гипоксантин, ксантин, мочевая кислота –продукты превращения нуклеиновых кислот в организме
N
NH
H
N
N
O
гипоксантин
O
H
N
H
N
O
H
N
H
N
O
HN
N
O
ксантин
HN
N
H
O
мочевая кислота
61.
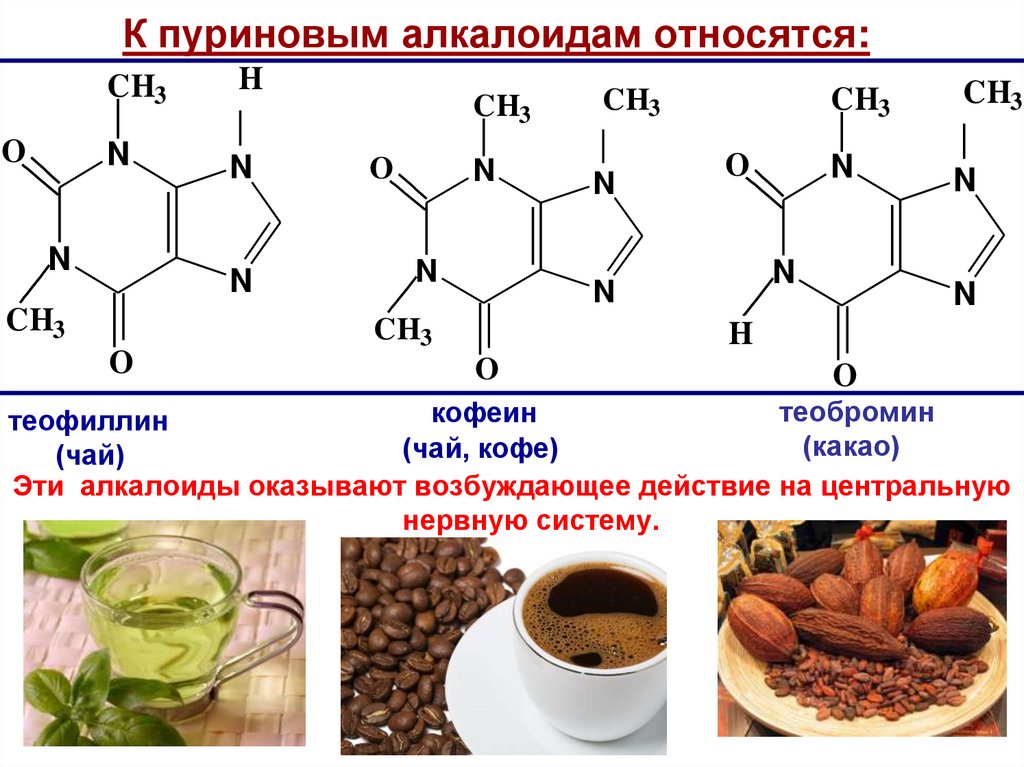
К пуриновым алкалоидам относятся:O
CH3
H
N
N
N
N
CH3
O
O
CH3
CH3
N
N
N
O
CH3
N
N
N
N
CH3
CH3
N
H
O
O
теобромин
кофеин
теофиллин
(какао)
(чай, кофе)
(чай)
Эти алкалоиды оказывают возбуждающее действие на центральную
нервную систему.
62.
СПАСИБОЗА ВНИМАНИЕ!
62












 chemistry
chemistry








