Similar presentations:
Кулонометрия (1)
1.
КулонометрияВыполнил: А.А. Никонов
Проверил: М.Ю. Кузьмина
2.
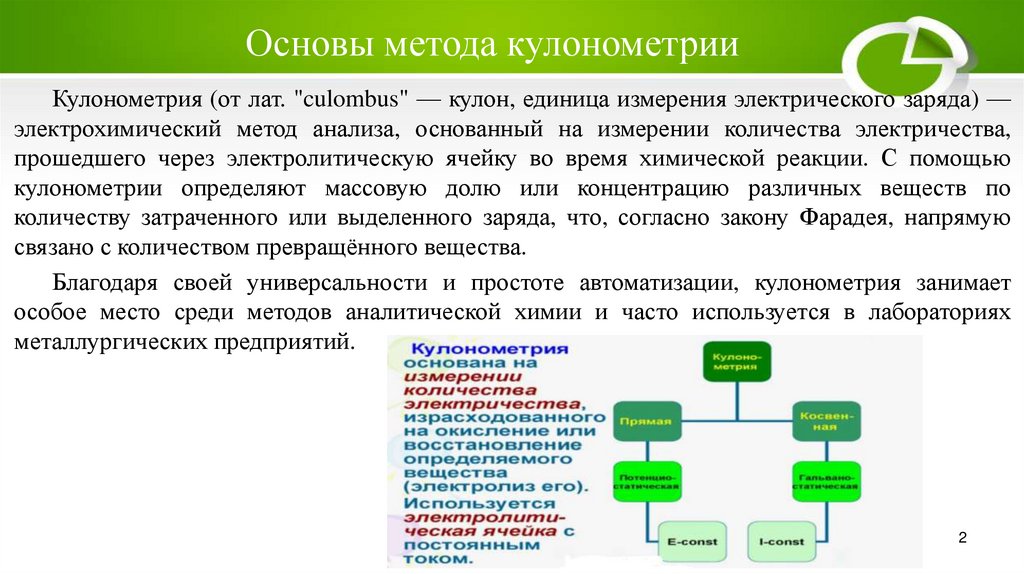
Основы метода кулонометрииКулонометрия (от лат. "culombus" — кулон, единица измерения электрического заряда) —
электрохимический метод анализа, основанный на измерении количества электричества,
прошедшего через электролитическую ячейку во время химической реакции. С помощью
кулонометрии определяют массовую долю или концентрацию различных веществ по
количеству затраченного или выделенного заряда, что, согласно закону Фарадея, напрямую
связано с количеством превращённого вещества.
Благодаря своей универсальности и простоте автоматизации, кулонометрия занимает
особое место среди методов аналитической химии и часто используется в лабораториях
металлургических предприятий.
2
3.
Основы метода кулонометрии1834 году Майкл Фарадей сформулировал количественные
законы электролиза, которые легли в основу кулонометрии как
научной дисциплины. В течение XX века появление точных
вольтметров, амперметров, а затем и автоматизированных
измерительных систем позволило превратить кулонометрию в
высокоточный и универсальный аналитический инструмент.
Метод разделяют на две основные группы:
Абсолютная (прямая) - количественно измеряют общий
прошедший заряд, соответствующий 100%-му превращению
анализируемого вещества до завершения реакции.
Титриметрическая (кулонометрическое титрование) - Потенциостатически поддерживая
определённый потенциал, аккуратно титруют определённой силой тока, фиксируя момент
завершения реакции (эквивалентная точка).
Пример абсолютной кулонометрии: Измерение кислорода в металле (например, железа)
по реакции восстановления и количеству выделенного заряда.
3
4.
Материалы электродов подбирают исходя анализируемого вещества и требуемой реакции:это могут быть платина, золото, графит, стеклоуглерод или специальные сплавы.
Ячейка изготавливается из химически инертного материала (стекло, керамика,
фторопласт), чтобы минимизировать сторонние реакции.
Для расчёта массы вещества:
Q •M
m =
n •F
m — масса вещества, выделенного или поглощённого на электроде,
Q — количество электричества (заряда), прошедшего через ячейку (Q=It),
M — молярная масса анализируемого вещества,
n — число электронов, участвующих в реакции,
F — постоянная Фарадея (F=96485 Кл/моль э−1).
4
5.
Для расчёта объёма газа (например, водорода, выделяемого на катоде):где, Vm — молярный объём газа (22,4 л/моль при 0∘C и 1 атм).
Современные кулонометры снабжены компьютерами, которые автоматически фиксируют
параметры, проводят интегрирование и выдают результат в автоматическом режиме.
Метод кульонометрии считается одним из наиболее точных, но требует соблюдения ряда
условий:
V=
Q •Vm
n•F
- строгая калибровка оборудования;
- высокая степень чистоты используемых реактивов;
- изоляция системы от внешних электрических и магнитных полей;
- контроль за температурой (влияет на электропроводность электролита и скорость реакций).
Современные методы кулонометрии позволяют определять вещества в экстремально
малых количествах — вплоть до нанограммов (например, для анализа следовых примесей в
специальных сталях и сверхчистых металлах).
5
6.
Виды кулонометрии1) Потенциостатическая кулонометрия (с контролируемым потенциалом) Это наиболее
селективный и широко используемый вариант прямой кулонометрии. Потенциал рабочего
электрода поддерживается постоянным с помощью устройства, называемого потенциостатом.
Значение потенциала выбирается таким образом, чтобы обеспечить количественное
протекание реакции с аналитом, но при этом избежать побочных реакций с другими
компонентами раствора.
Принцип: По мере протекания реакции концентрация аналита у поверхности электрода
уменьшается, что приводит к экспоненциальному спаду силы тока во времени согласно
уравнению Коттрелла. Электролиз прекращают, когда ток спадает до очень малого значения
(фонового тока), составляющего 0.1% или менее от начального. Общий заряд Q находится
путём интегрирования кривой "ток-время".
Преимущества: Высокая селективность. Можно определять одно вещество в присутствии
других, если их потенциалы восстановления или окисления достаточно различаются (обычно
разница > 200 мВ).
6
7.
2) Гальваностатическая (амперостатическая) кулонометрия (с контролируемым током) Вэтом методе через ячейку пропускают ток постоянной и точно известной силы (I=const).
Электролиз ведут до полного превращения аналита. Момент окончания реакции определяют
по резкому изменению потенциала рабочего электрода, которое происходит, когда аналит
исчерпан, и на электроде начинает протекать другой процесс (например, восстановление
растворителя).
Принцип: Время t, необходимое для полного превращения вещества, измеряется с высокой
точностью. Заряд рассчитывается по простой формуле Q=I.t.
Применение в металлургии: Определение толщины гальванических покрытий. Например,
на деталь с медным покрытием подают анодный ток постоянной силы. Медь растворяется
(Cu−2e−→Cu2+). Когда всё покрытие растворится, потенциал резко изменится. По времени
растворения t и зная плотность меди, можно рассчитать толщину покрытия.
7
8.
Принцип действия и закон ФарадеяПринцип действия кулонометрии элегантен в своей простоте и базируется на одном из
самых фундаментальных законов физической химии — законе электролиза Фарадея. По своей
сути, кулонометрия — это метод, в котором мы "считаем" атомы или молекулы вещества,
подсчитывая количество электронов, затраченных на их химическое превращение.
В начале XIX века учёные уже знали, что электрический ток может вызывать химические
реакции (электролиз), но связь между количеством электричества и количеством
прореагировавшего вещества оставалась качественной. Революционный вклад Майкла
Фарадея заключался в том, что он установил строгую количественную зависимость. Он
доказал, что электролиз — это не просто явление, а точный стехиометрический процесс,
подчиняющийся строгим законам.
Традиционно выделяют два закона электролиза, которые вместе формируют единую и
полную картину процесса.
1. Прямая пропорциональная.
Масса вещества (m), выделившегося на электроде или вступившего в реакцию, прямо
пропорциональна количеству электричества (Q), прошедшего через электролит.(m = k ⋅ Q)
8
9.
2. Роль химического аквивалента.Второй закон объясняет, от чего зависит сам коэффициент пропорциональности k и
связывает его с химическими свойствами вещества.
Химический эквивалент (Mэ) — это молярная масса вещества, делённая на число
электронов (n), которые участвуют в электродной реакции с одной частицей этого вещества.
Пример 1. M э=Mn . Для восстановления иона серебра Ag++e−→Ag, один ион принимает 1
электрон, поэтому n=1. Химический эквивалент серебра равен его молярной массе:
Mэ(Ag)=1107.87 г /моль1 =107.87 г/моль.
Пример 2. Для восстановления иона двухвалентной меди Cu2++2e−→Cu, один ион
принимает 2 электрона, поэтому n=2. Химический эквивалент меди равен половине её
молярной массы: Mэ(Cu)=263.55 г /моль2 =31.77 г/моль.
Пример 3. Для восстановления иона трёхвалентного
+3e−→Al, n=3. Mэ(Al)=326.98 г /моль3 =8.99 г/моль.
9
10.
Применение кулонометрии в металлургииВ металлургической промышленности, где от химического состава материала
напрямую зависят его механические, физические и эксплуатационные свойства, точность
и надежность аналитического контроля играют первостепенную роль. Кулонометрия,
будучи одним из немногих абсолютных (первичных) методов анализа, занимает в этой
сфере особое место. Она не просто используется для рутинного контроля, но и служит в
качестве арбитражного метода для проверки и калибровки других, более экспрессных, но
менее точных инструментальных методов, таких как оптико - эмиссионная или
рентгенофлуоресцентная спектрометрия.
Это, без сомнения, самая важная и широко распространённая область применения
кулонометрии в металлургии. Содержание таких элементов, как углерод, сера, кислород,
водород и азот, даже в следовых количествах, кардинально влияет на качество стали,
титановых, алюминиевых и других сплавов, вызывая хрупкость, снижая коррозионную
стойкость и свариваемость.
10
11.
Спасибо за внимание11










 chemistry
chemistry








