Similar presentations:
Электрохимические методы анализа: кондуктометрия, потенциометрия, полярография
1.
Электрохимические методы анализа:кондуктометрия, потенциометрия, полярография
1
2.
23.
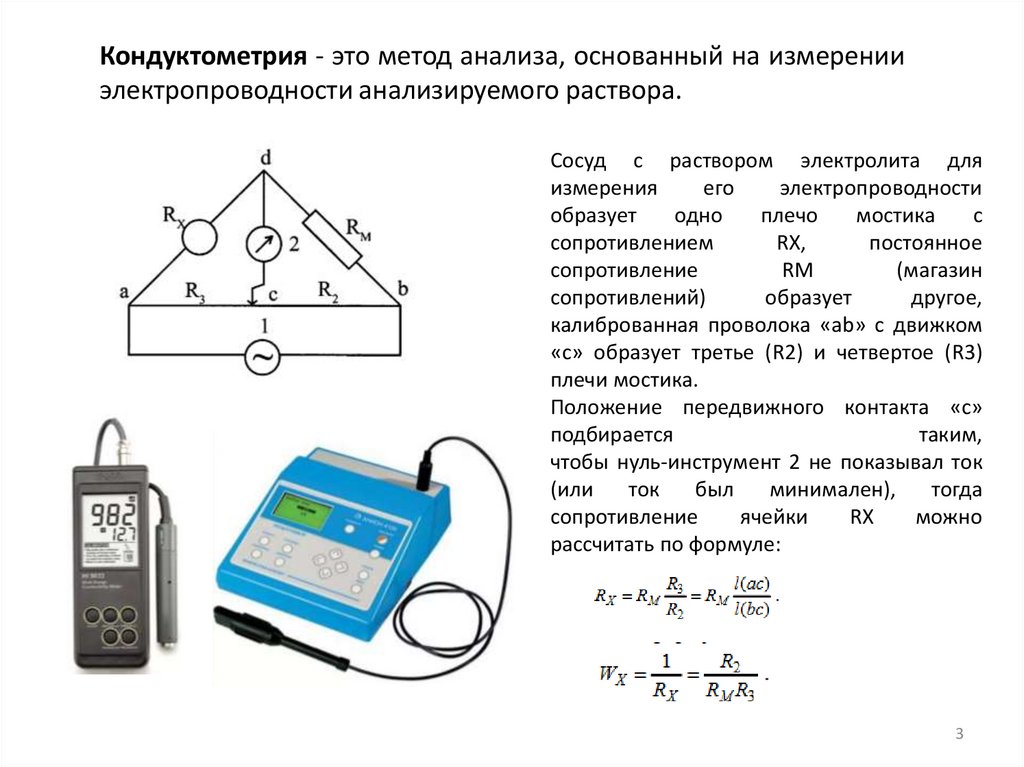
Кондуктометрия - это метод анализа, основанный на измеренииэлектропроводности анализируемого раствора.
Сосуд с раствором электролита для
измерения
его
электропроводности
образует
одно
плечо
мостика
с
сопротивлением
RX,
постоянное
сопротивление
RM
(магазин
сопротивлений)
образует
другое,
калиброванная проволока «аb» с движком
«с» образует третье (R2) и четвертое (R3)
плечи мостика.
Положение передвижного контакта «с»
подбирается
таким,
чтобы нуль-инструмент 2 не показывал ток
(или
ток
был
минимален),
тогда
сопротивление
ячейки
RX
можно
рассчитать по формуле:
3
4.
Различают прямую и косвенную кондуктометрию (последняя называетсякондуктометрическим титрованием)
Прямая кондуктометрия находит в аналитической химии ограниченное
применение в связи с тем, что электропроводность является величиной
аддитивной и определяется присутствием всех ионов в растворе. Другими
словами, прямая кондуктометрия не обеспечивает селективность
определения. Прямые кондуктометрические измерения применяются в
основном для контроля качества воды, используемой в лабораторной практике
или для технологических процессов. Кроме того, кондуктометрические
детекторы входят в состав некоторых жидкостных хроматографов.
4
5.
Значительнобольшее
применение
имеет
кондуктометрическое
титрование. Кондуктометрическое титрование может быть использовано
для всех типов объемного анализа: кислотно-основного, окислительновосстановительного, осаждения, комплексообразования, ионного обмена и
экстрагирования.
Методом кондуктометрического титрования определяют многие катионы и анионы.
Нитратом серебра титруют хлорид, бромид, иодид, цианид, оксалат, салицилат и
некоторые другие анионы. Титрованием в среде 90%-го спирта определяют Сl- в
природных водах при содержании порядка 10 мкг. Титрование ацетатом или хлоридом
бария применяют для определения сульфата, хромата, карбоната, оксалата, цитрата и
других анионов обычно при добавлении в анализируемый раствор спирта. Сульфаты
таким методом определяют в природных водах и аналогичных объектах.
5
6.
ПотенциометрияМетод анализа основан на зависимости равновесного электродного потенциала
(Е) от активности (a) или концентрации (с) вещества в растворе. Для измерений
необходимо составить гальванический элемент из подходящего индикаторного
электрода и электрода сравнения, а также прибор для измерения потенциала
индикаторного электрода. Индикаторный электрод — это электрод, потенциал
которого зависит от активности или концентрации определяемых ионов.
Требования к индикаторным электродам:
1) электрод должен обратимо реагировать на изменение активности или
концентрации определяемых ионов;
2) потенциал его должен устанавливаться быстро (это особенно важно при
проведении потенциометрического титрования);
3) электрод не должен влиять на состав раствора (например, часто используемый
платиновый электрод может катализировать протекание некоторых реакций);
4) электрод должен быть химически устойчив по отношению к веществам,
находящимся в растворе (например, цинковый электрод в кислых растворах
может растворяться);
5) электрод должен быть неполяризуемым, т. е. его потенциал не должен
меняться при протекании тока;
6) электрод должен иметь простую конструкцию.
6
7.
Электрод сравнения — это электрод, относительно которого измеряютпотенциал индикаторного электрода (он нужен для измерения ЭДС
гальванического элемента).
Требования к электродам сравнения:
1) потенциал электрода должен оставаться постоянным и не зависеть
от состава анализируемого раствора;
2) электрод должен иметь низкое сопротивление.
Остальные требования к электроду сравнения такие же, как к
индикаторному электроду.
7
8.
ВОЛЬТАМПЕРОМЕТРИЯ, ПОЛЯРОГРАФИЯВольтамперометрия основана на изучении поляризационных или
вольтамперных кривых (кривых зависимости силы тока I от напряжения Е),
которые получают в процессе электролиза раствора анализируемого
вещества при постепенном повышении напряжения с одновременной
фиксацией при этом силы тока.
Вольтамперометрию,
связанную с использованием
ртутного
капающего
электрода (РКЭ), называют
полярографией.
8
9.
Этоодин
из
наиболее
универсальных
методов
определения следовых количеств
веществ,
он
позволяет
одновременного
определять
несколько
компонентов
(в
оптимальных
условиях
эксперимента — до четырех-пяти),
а
также
имеет
линейную
зависимость тока от концентрации
в диапазоне 10-8—10-2 М.
9
10.
КУЛОНОМЕТРИЯКулонометрическими называют электрохимические методы анализа,
основанные на измерении количества электричества, прошедшего через
электролитическую ячейку при электрохимическом окислении или
восстановлении вещества на рабочем электроде.
В основе кулонометрических измерений лежат процессы электролиза,
т.е. окислительно-восстановительные реакции, протекающие на электродах при
прохождении через анализируемый раствор электрического тока.
Кулонометрия – это безэталонный метод анализа. Массу определяемого
вещества
при
кулонометрических
определениях
рассчитывают
непосредственно из величины аналитического сигнала. Количественные
расчёты в кулонометрии основаны на законах Фарадея для электролиза.
Математическое выражение объединённого закона Фарадея имеет вид
где m – масса вещества, окисленного (восстановленного) в процессе
электролиза в граммах; M – молярная масса вещества (г/моль); n – число
электронов, участвующих в электродной реакции; F – постоянная Фарадея (F
=96487 Кл/моль), Q – количество электричества, Кл., I –сила тока в амперах, τ–
10
время электролиза в сек
11.
В зависимости от условий измерения аналитического сигнала различаютпотенциостатическую и гальваностатическую кулонометрию. В первом случае
определения проводят при постоянном потенциале, во втором – при
постоянной силе тока.
В зависимости от применения различают прямую кулонометрию и
кулонометрическое титрование (косвенная кулонометрия). В случае прямой
кулонометрии определяемое вещество реагирует непосредственно на
поверхности электрода. При кулонометрическом титровании определяемое
вещество непосредственно не участвует в электродной реакции, но
взаимодействует с продуктом электролиза.
11











 chemistry
chemistry








