Similar presentations:
Лекция 3-4 Растворы и коллиг
1.
Кафедра медицинской ифармацевтической химии
Растворы.
«Способы выражения концентраций.
Сильные и слабые электролиты.
Закон разведения Оствальда»
1
2.
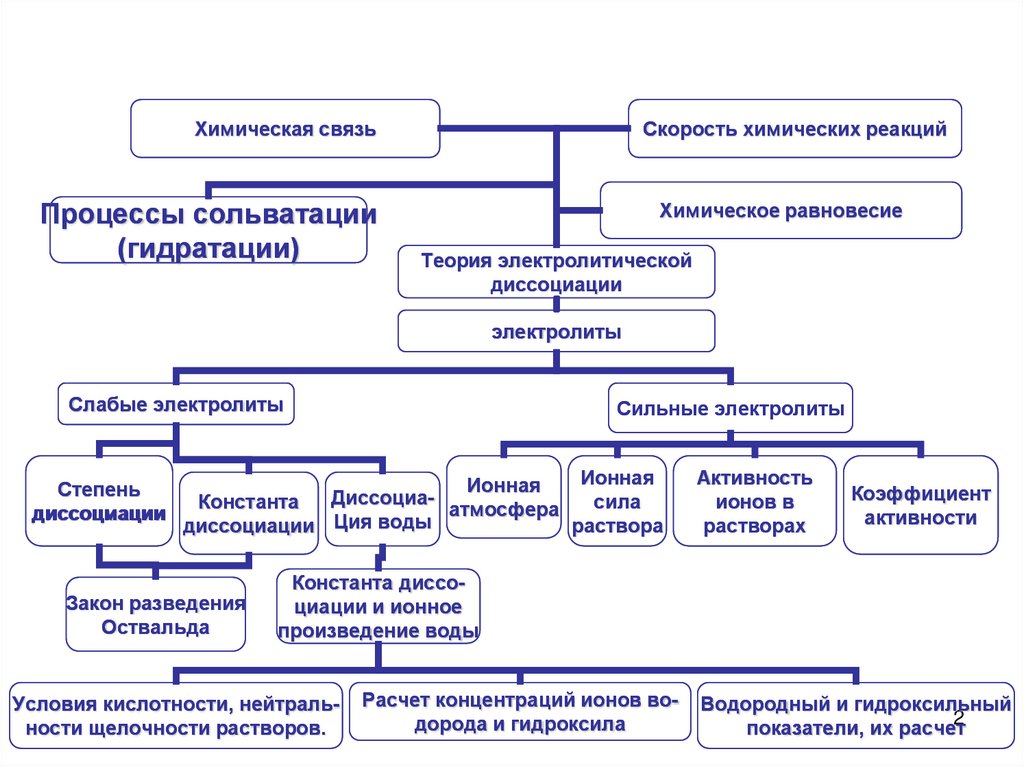
Химическая связьПроцессы сольватации
(гидратации)
Скорость химических реакций
Химическое равновесие
Теория электролитической
диссоциации
электролиты
Слабые электролиты
Степень
диссоцмации
диссоциации
Сильные электролиты
Ионная
Ионная
Диссоциасила
Константа
атмосфера
Ция
воды
раствора
диссоциации
Закон разведения
Оствальда
Активность
ионов в
растворах
Коэффициент
активности
Константа диссоциации и ионное
произведение воды
Условия кислотности, нейтральности щелочности растворов.
Расчет концентраций ионов водорода и гидроксила
Водородный и гидроксильный
2
показатели, их расчет
3.
Растворы- гомогенные термодинамически устойчивые системы, состоящие
из двух и большего числа компонентов, состав которых может
изменяться в пределах, допустимых растворимостью.
Точка зрения Менделеева:
Раствор - это сложная равновесная
химическая система, образованная
растворителем, растворенным веществом и
продуктами их взаимодействия.
Д. И. Менделеев
(8.02.1834 – 02.02.1907)
NB! Гидратная теория Менделеева стала oдной из
основ современной теории растворов.
«В растворе при обычной температуре происходит образование
и разрушение ассоциатов (соединениий) – частиц растворителя –
3
гидратов - с частицами растворенного вещества»
4.
Раствор может иметь любое агрегатное состояние:жидкое
газообразное
(газовая смесь).
твердое
4
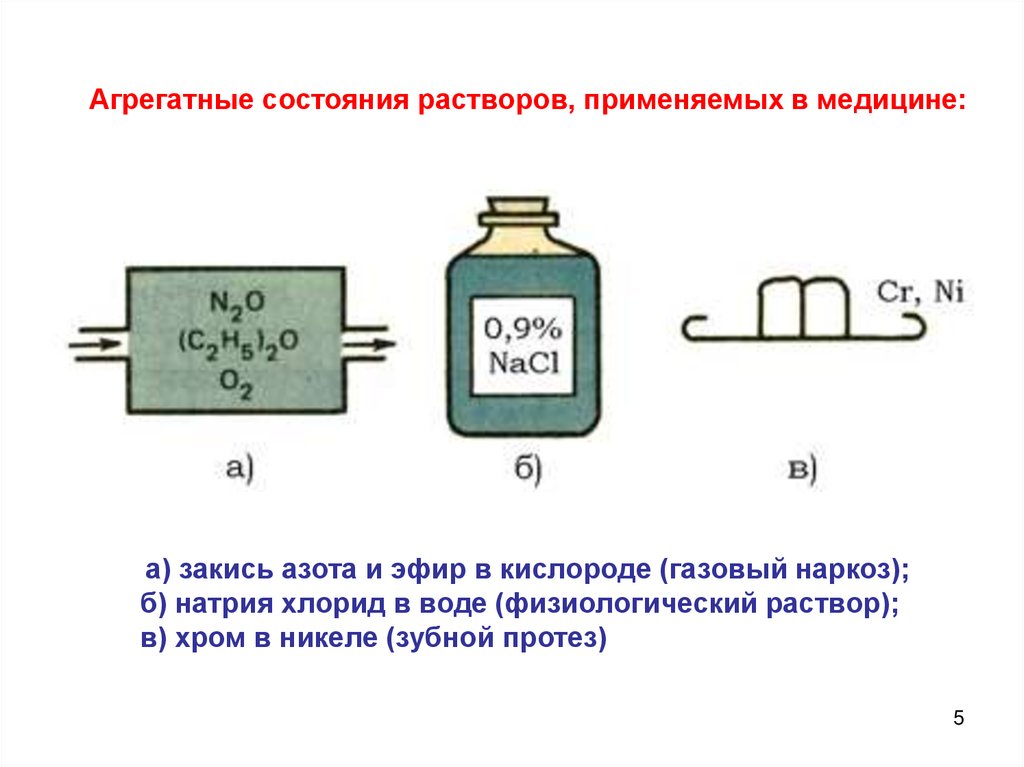
5.
Агрегатные состояния растворов, применяемых в медицине:а) закись азота и эфир в кислороде (газовый наркоз);
б) натрия хлорид в воде (физиологический раствор);
в) хром в никеле (зубной протез)
5
6.
Классификация1. По молярной массе растворенного вещества
а) М < 5000 г/моль истинные растворы – растворы низкомолекулярных соединений.
Характеризуются
гомогенностью
состава и отсутствием поверхности
раздела
между
растворенным
веществом и растворителем. Размер
растворенных частиц (ионов и молекул)
меньше 10-9 м.
б) М > 5000 г/моль растворы высокомолекулярных соединений (ВМС).
ВМС - полимеры, макромолекулы которых состоят мономерных
звеньев, соединенных между собой химическими связями.
Растворы полиэлектролитов - растворы ВМС, в состав которых
6
входят функциональные группы, способные к ионизации.
7.
2. По наличию или отсутствию электролитическойдиссоциации
Растворы электролитов — в которых вещества
диссоциируют на ионы (соли, кислоты и гидроксиды - КNО3,
НСl, КОН).
Растворы неэлектролитов – в которых вещества
практически не диссоциируют в воде( растворы сахарозы,
глюкозы, мочевины. )
Растворы амфолитов - веществ, которые могут
диссоциировать и по кислотному, и по основному типу:
Аl(ОН)3 ,глицин.
3. По концентрации
а) разбавленные растворы ~ до 10 %;
в) средней концентрации ~ 10 - 30%
б) концентрированные ~ 30 % и выше;
7
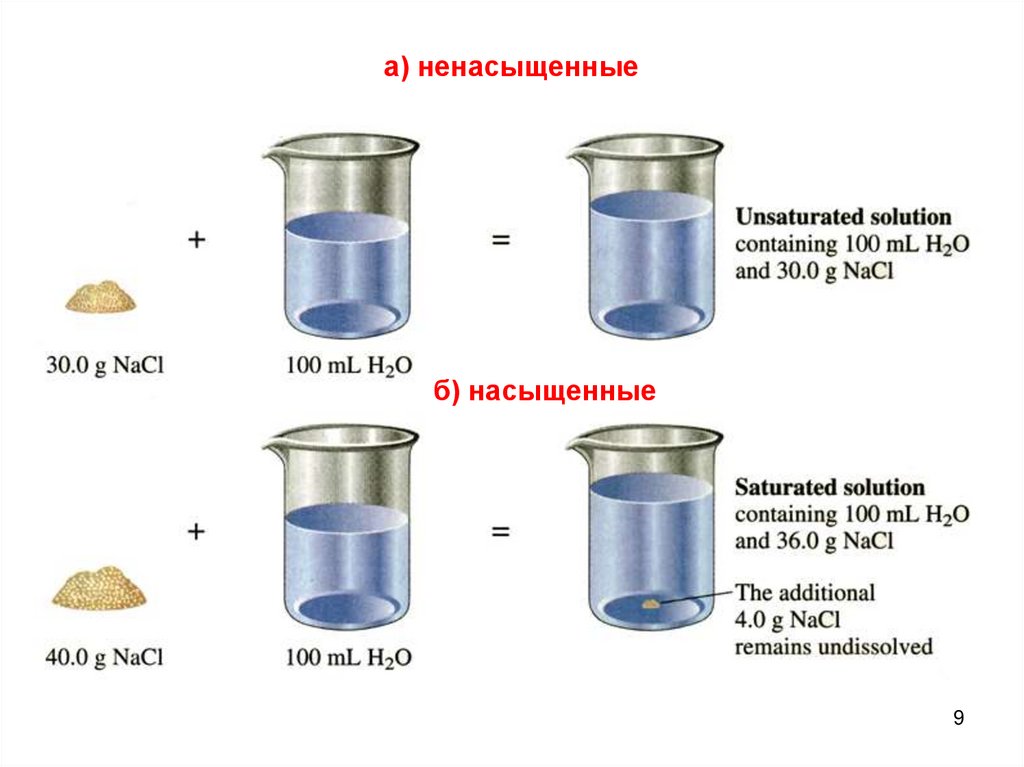
8.
4. По равновесному состояниюа) Ненасыщенный - раствор, в котором еще можно растворить
добавочное количество данного вещества.
б) Насыщенный - раствор, в котором данное вещество при
данной температуре больше не растворяется, т. е. раствор,
находящийся в равновесии с растворяемым веществом.
8
9.
а) ненасыщенныеб) насыщенные
9
10.
в) пересыщенные –содержащие значительно больше растворенного вещества чем
его требуется для насыщения при данной температуре
Пересыщенные растворы являются неустойчивыми
системами, способными к существованию только при
отсутствии в системе твердых частиц растворенного вещества.
Возможность длительного существования таких растворов
объясняется трудностью первоначального возникновения
мельчайших «зародышевых» кристалликов-центров 10
кристаллизации.
11. Растворимость
Растворимость – способность вещества растворяться в томили ином растворителе.
Мерой растворимости вещества при данных условиях
является его содержание в насыщенном растворе.
S – растворимость - масса вещества,
способная растворяться в 100 г растворителя (воды).
11
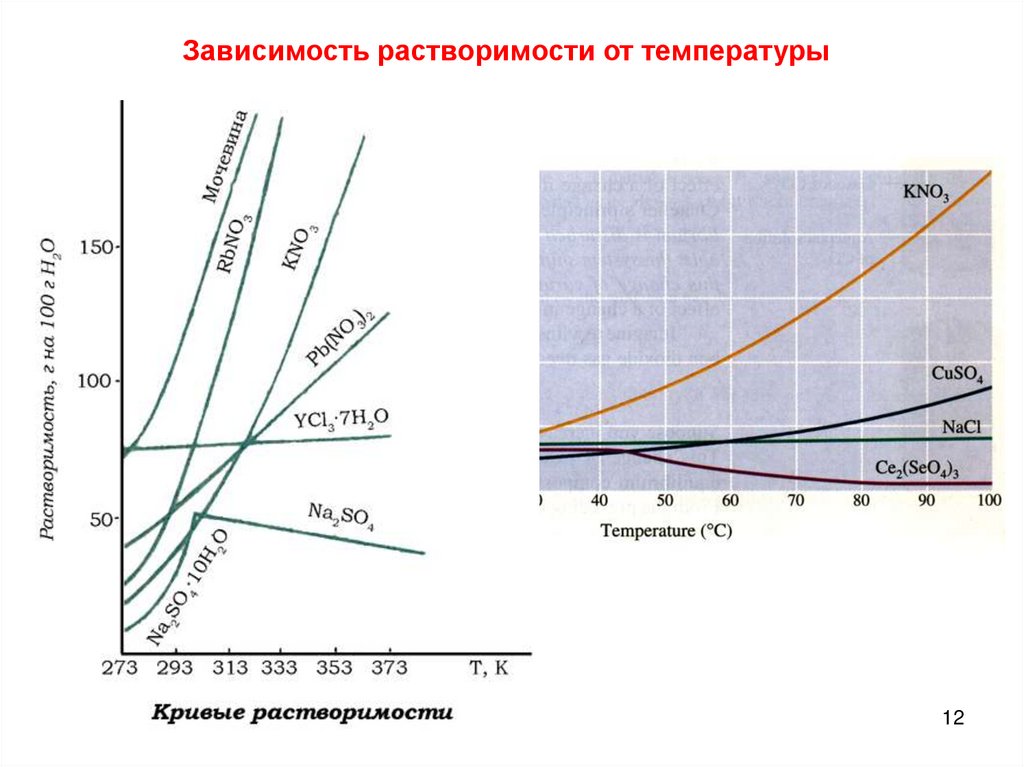
12.
Зависимость растворимости от температуры12
13.
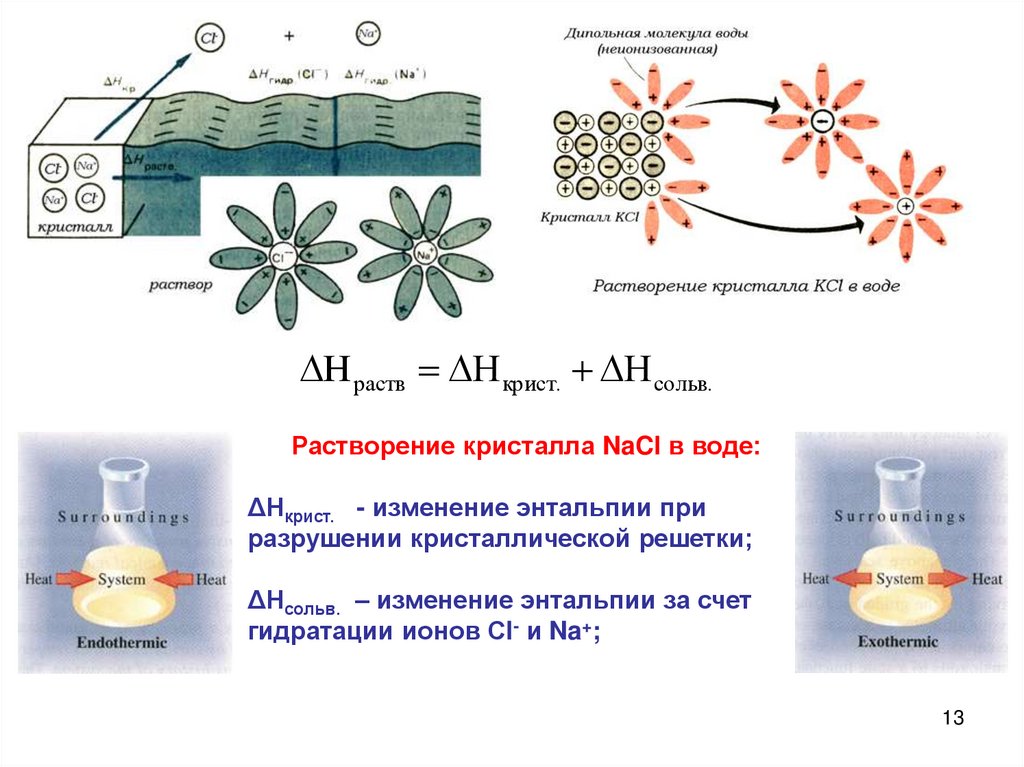
H раств H крист. H сольв.Растворение кристалла NaCl в воде:
ΔНкрист. - изменение энтальпии при
разрушении кристаллической решетки;
ΔНсольв. – изменение энтальпии за счет
гидратации ионов Сl- и Na+;
13
14.
2. Слабые электролиты диссоциируют обратимо, ступенчато.CH 3COOH
CH 3COO H
α – степень диссоциации
Кд – константа диссоциации
Степень диссоциации (ионизации) - отношение числа молекул,
распавшихся на ионы, к общему числу молекул в растворе.
Сдиссоц.
, 0 1
Собщ.
α зависит от:
Природы вещества и растворителя;
Концентрации;
Температуры;
Присутствия одноименного иона.
14
15.
Закон разбавления Оствальда2
Cα
Кд
1 α
(02.09.1853 – 4.06.1932)
О нем говорили:
«Потолкуй с Оствальдом
полчаса, и ты будешь
иметь работу на полгода»
Нобелевская премия (1909г)
« в знак признания работ по
катализу, а также за исследования
основных принципов управления
химическим равновесием и
скоростями реакций»
С 1887 года работал в одной
лаборатории с Вант-Гоффом,
Аррениусом и Нернстом.
15
16.
Вывод закона разведения ОствальдаC
С С
C
CH3COOH
CH3COO- H
[CH 3COO ][H ] CαCα Cα 2
Кд
, α 1
[CH 3COOH]
C Cα 1 α
При <<1
К д C·α2
α К д /С
[H ] C ·α C К д /С C2 К д /С К д·С
[H ] К д ·С
16
17.
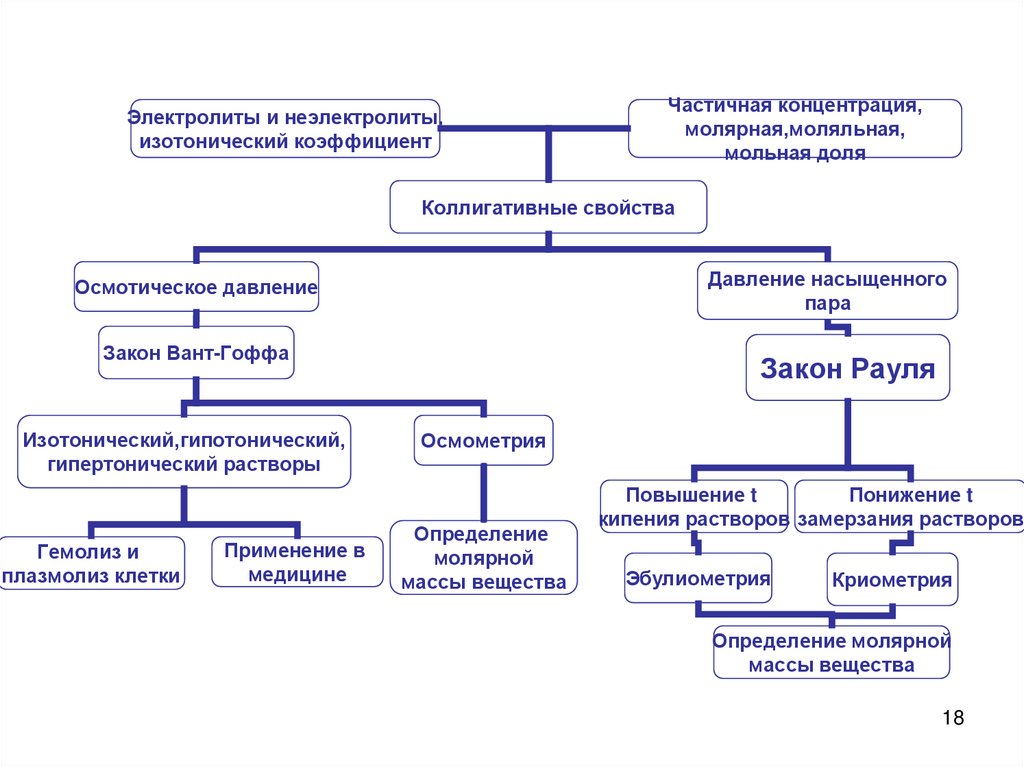
"Коллигативные свойства растворов."17
18.
Электролиты и неэлектролиты,изотонический коэффициент
Частичная концентрация,
молярная,моляльная,
мольная доля
Коллигативные свойства
Давление насыщенного
пара
Осмотическое давление
Закон Вант-Гоффа
Изотонический,гипотонический,
гипертонический растворы
Гемолиз и
плазмолиз клетки
Применение в
медицине
Закон Рауля
Осмометрия
Определение
молярной
массы вещества
Повышение t
Понижение t
кипения растворов замерзания растворов
Эбулиометрия
Криометрия
Определение молярной
массы вещества
18
19.
Коллигативные (коллективные) - зависят от количестваимеющихся молекул или ионов растворенного вещества, а не
от природы растворенных частиц
Понижение давления пара растворителя.
Повышение температуры кипения растворителя.
Понижение температуры замерзания растворителя.
Явление осмотического давления.
Коллигативные свойства позволили Аррениусу показать, что
молекулы растворенного вещества в растворе диссоциируют
на ионы.
Коллигативные свойства используются главным образом для
определения молекулярных масс неизвестных веществ.
19
20.
1. Понижение давления пара растворителя:(нелетучее вещество в летучем растворителе)
Закон Рауля:
а) Парциальное давление
насыщенного пара данного компонента
над раствором прямо пропорционально
его мольной доле:
P P
o
H 2O
Рауль Франсуа
(10.05.1830 – 1.06.1901)
Основное
направление
научных исследований – химия
растворов. Его имя связано
главным образом с созданием
основ
криоскопии.
Открыл
носящий его имя закон о
понижении
давления
пара
растворителя.
Сконструировал
газовую горелку.
·NH2O
б) Относительное понижение
давления растворителя равно мольной
доле растворенного вещества.
P
o
H 2O
o
H 2O
P
P
NA
20
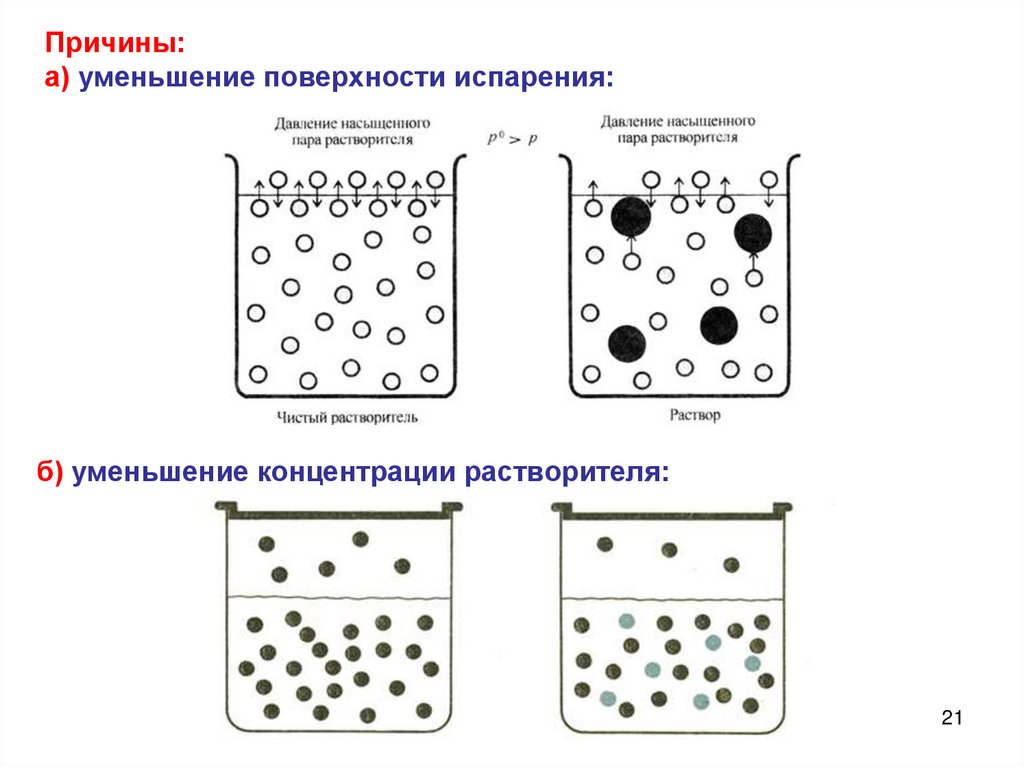
21.
Причины:а) уменьшение поверхности испарения:
б) уменьшение концентрации растворителя:
21
22.
Для идеальных растворов понижение давления насыщенногопара растворителя не зависит от природы растворенного
нелетучего вещества.
Для реальных растворов, где имеют место межмолекулярные
взаимодействия, в это
уравнение необходимо ввести
изотонический коэффициент:
p0 p
i 1
iN A , причем :
0
i 1
p
i 1
для электролитов
для неэлектролитов
для веществ, склонных к
диссоциации
22
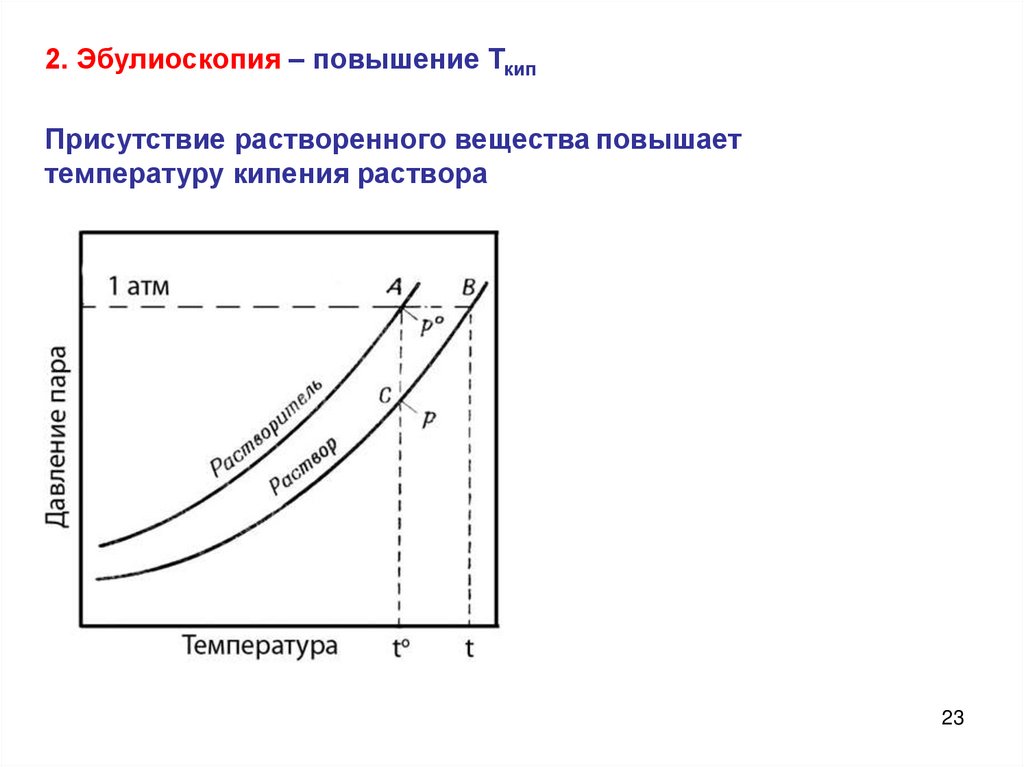
23.
2. Эбулиоскопия – повышение ТкипПрисутствие растворенного вещества повышает
температуру кипения раствора
23
24.
Т кип К э ·m,Кэ – эбулиоскопическая константа (град/моль·кг);
m – моляльность (число моль вещества в 1000 г растворителя;)
mв ва ·1000
Т кип К э
M·m р ля
Эбулиоскопия - способ определения М вещества
24
25.
mв ва ·1000М Кэ
Т кип ·m р ля
Значения Кэ
Растворитель
Вода
Бензол
Анилин
Эбулиоскопическ
ая константа
Кэ, оС
0,516
2,57
3,69
Растворитель
Этиловый спирт
Уксусная кислота
CCl4
Эбулиоскопическ
ая константа Кэ,
оС
1,16
3,10
5,00
25
26.
3. Криоскопия – понижение Т замерзанияПрисутствие растворенного вещества понижает
температуру замерзания раствора.
Причина - молекулам растворителя сложней образовать
гомогенные кристаллы твердой фазы.
26
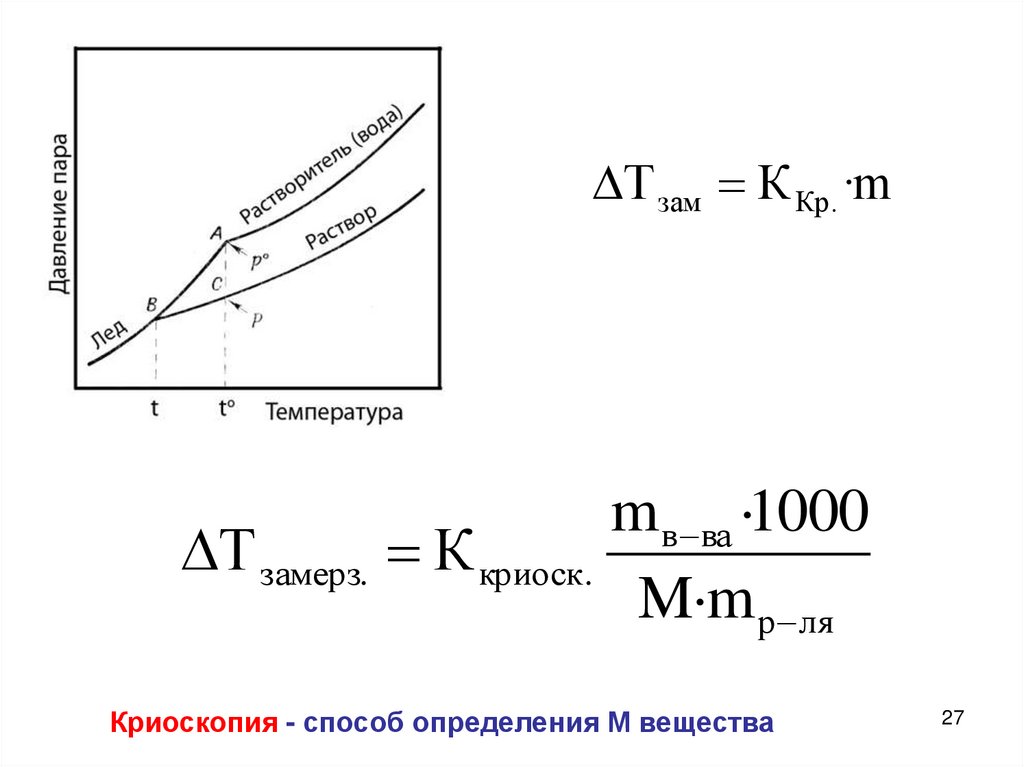
27.
Т зам К Кр . ·mmв ва ·1000
Т замерз. К криоск.
M·m р ля
Криоскопия - способ определения М вещества
27
28.
mв ва ·1000М К криоск.
Т замерз. ·m р ля
Значения Ккр
Растворитель
Криоскопическая
константа Ккр, оС
Вода
Бензол
Анилин
Фенол
1,86
5,12
5,87
7,27
28
29.
Растворы различныхвеществ в воде замерзают
при температуре ниже 0oС
Одномоляльные растворы
различных веществ в воде
замерзают при температуре
29
-1.86oС
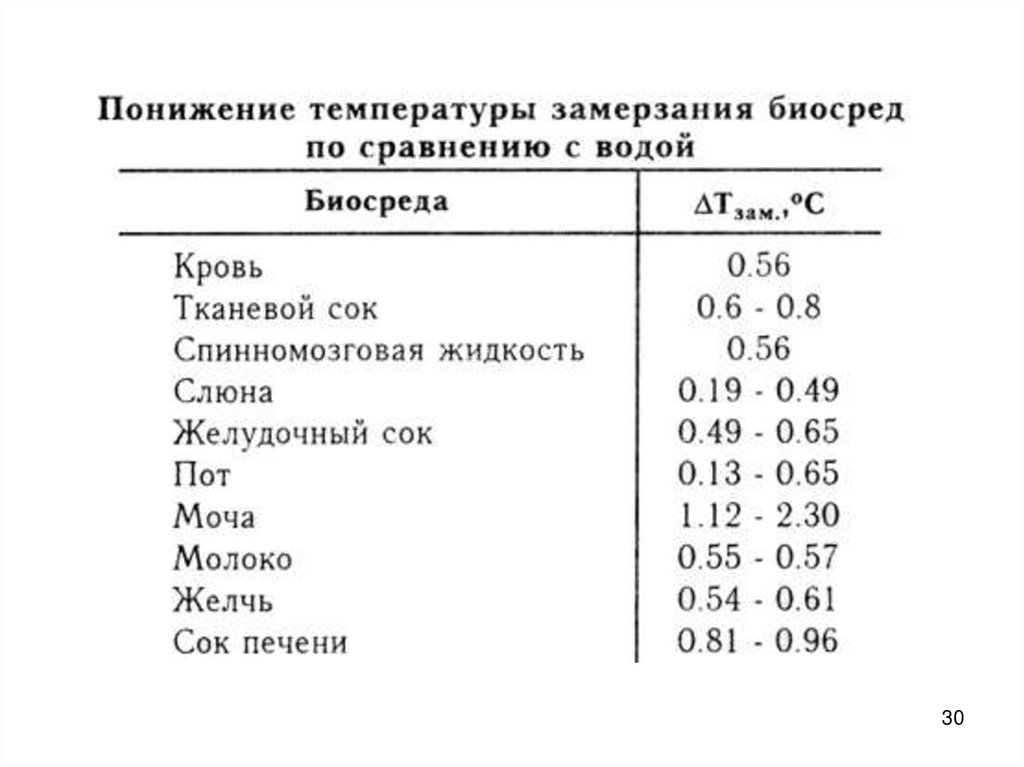
30.
3031.
Антифризы - вещества, понижающие температурузамерзания водных растворов
неорганические:
хлориды
аммония, натрия, магния, кальция, а
также карбонат калия.
органические: этиловый спирт,
глицерин и этиленгликоль.
Насыщенный раствор хлорида
кальция остается жидким до - 55 °С.
31
32.
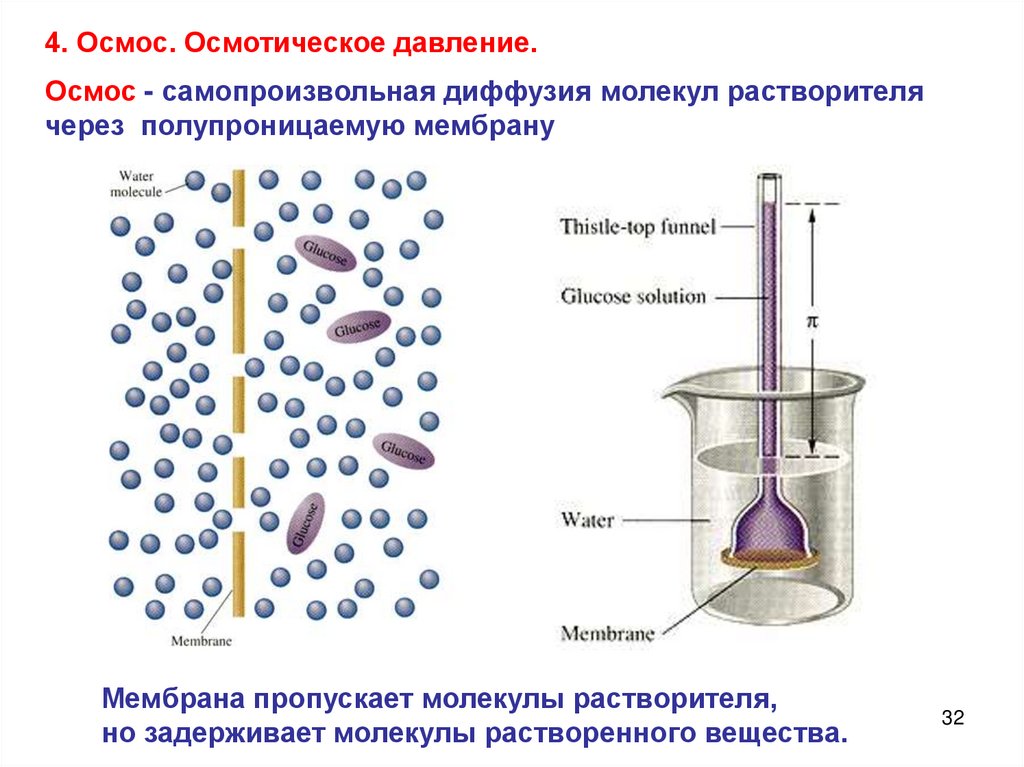
4. Осмос. Осмотическое давление.Осмос - самопроизвольная диффузия молекул растворителя
через полупроницаемую мембрану
Мембрана пропускает молекулы растворителя,
но задерживает молекулы растворенного вещества.
32
33.
Причина осмоса - стремление вещества распределятьсяравномерно по всему объему растворителя.
Осмотическое давление – минимальное гидравлическое
давление, которое нужно приложить к раствору, чтобы
осмос прекратился
Осмотическое давление
плазмы крови человека - 7.4-7.8 атм
( 740 – 780 кПа)
рыб
до15 атм.
растений
до 100 атм.
прорастающих семян
до 400 атм.
33
34.
Закон Вант-ГоффаP cМ RT
Вант-Гофф и Вильгельм
Оствальд в лаборатории
nRT
P
V
Осмотическое давление вещества в
растворе равно тому давлению,
которое оно оказывало, если бы
находилось в том же объеме, будучи в
газообразном состоянии.
Уравнение осмотического давления находит широкое
применение, при определении молекулярных весов
макромолекул (каучук, целлюлоза, белки)
34
35.
Для растворов электролитов в формулу вводитсякоэффициент Вант-Гоффа i
P ic М RT
i показывает, во сколько раз истинная концентрация
кинетически активных частиц в растворе электролита больше,
чем в растворе неэлектролита с той же концентрацией
Коэффициент Вант-Гоффа можно определить
вышеизложенными методами
C эл
π эл.
t зам. эл.
t кип . эл.
Pосм.эл.
i
Cнеэл π неэл. t зам. неэл. t кип . неэл. Pосм.неэл.
35
36.
Онкотическое давление– осмотическое давление, создаваемое за счет наличия белков
в биожидкостях организма и составляет 0,5% от общего
осмотического давления плазмы ( 0.025 – 0.04 атм )
Разрушение белков при гнойных
процессах сильно увеличивает
величину онкотического давления.
При заболеваниях, сопровождающихся уменьшением
концентрации белков крови, онкотическое давление падает.
Возникают так называемые онкотические отеки подкожной
клетчатки.
Онкотическое давление играет важную роль в процессах
всасывания жидкости из тканей в кровеносные сосуды.
36
37.
--COO
Na+
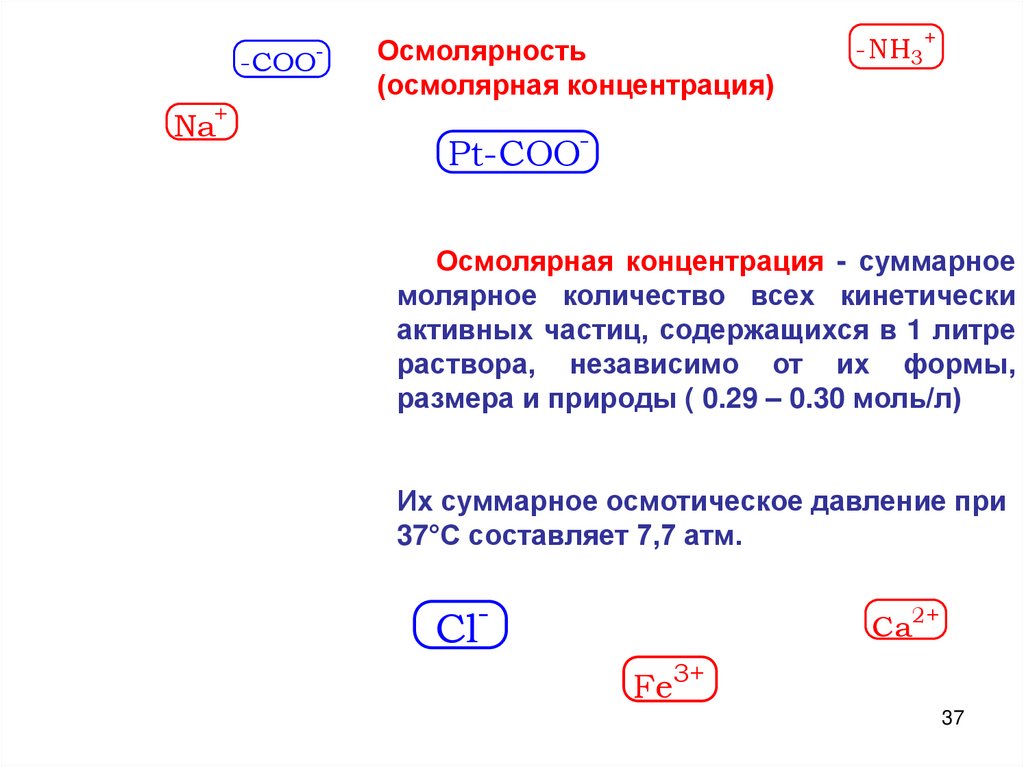
Осмолярность
(осмолярная концентрация)
-NH3+
Pt-COOОсмолярная концентрация - суммарное
молярное количество всех кинетически
активных частиц, содержащихся в 1 литре
раствора, независимо от их формы,
размера и природы ( 0.29 – 0.30 моль/л)
Их суммарное осмотическое давление при
37°С составляет 7,7 атм.
Cl-
Ca2+
Fe3+
37
38.
Физиологические растворы0,9%-ный ( 0,15 М ) раствор NаСl и 5% - ный ( 0,3М ) раствор
глюкозы создают такое же давление, следовательно, являются
изотоническими по отношению к крови.
Истинно физиологическими !!!
считаются растворы, включающие соли, белки и другие вещества в
пропорциях, соответствующих их содержанию в крови человека и
используемые в аппарате «искусственная почка»
38
39.
Изо-, гипер- и гипотонические растворыИзотонические - с одинаковым осмотическим давлением (0.9%)
Гипертонические - с большим осмотическим давлением (>0.9%)
Гипотонические - с меньшим осмотическим давлением (<0.9%)
Во всех случаях, когда в кровяное русло, мышечную ткань,
спинномозговой канал в терапевтических целях вводят растворы,
необходимо избегать «осмотического конфликта».
39
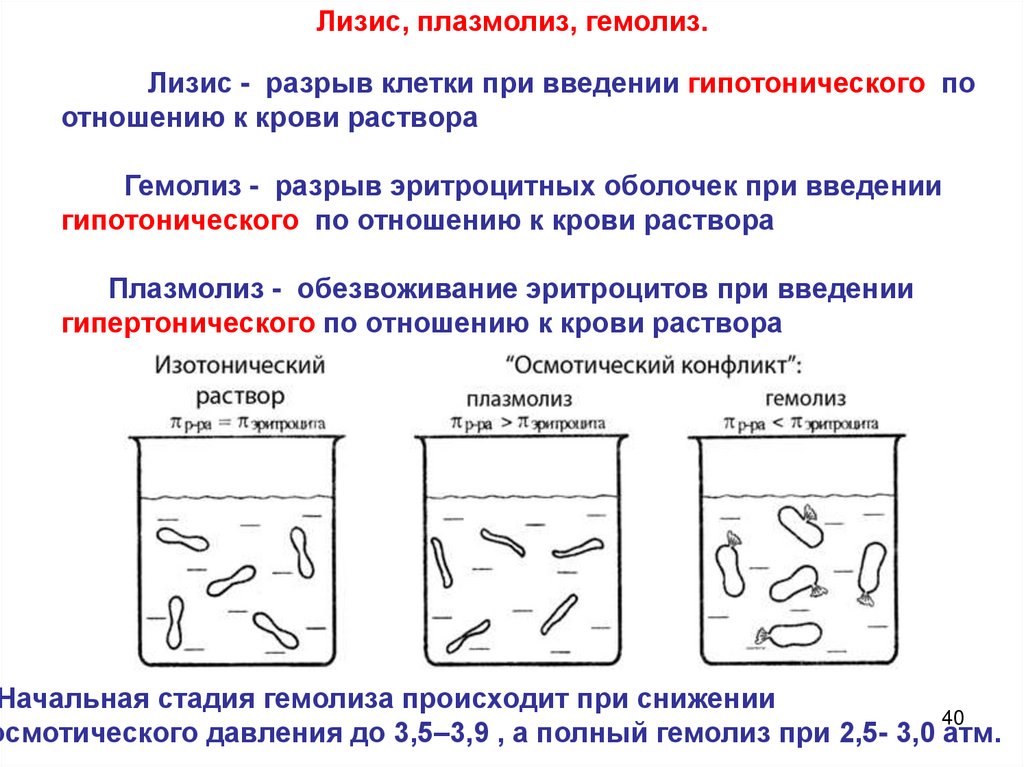
40.
Лизис, плазмолиз, гемолиз.Лизис - разрыв клетки при введении гипотонического по
отношению к крови раствора
Гемолиз - разрыв эритроцитных оболочек при введении
гипотонического по отношению к крови раствора
Плазмолиз - обезвоживание эритроцитов при введении
гипертонического по отношению к крови раствора
Начальная стадия гемолиза происходит при снижении
40
осмотического давления до 3,5–3,9 , а полный гемолиз при 2,5- 3,0 атм.
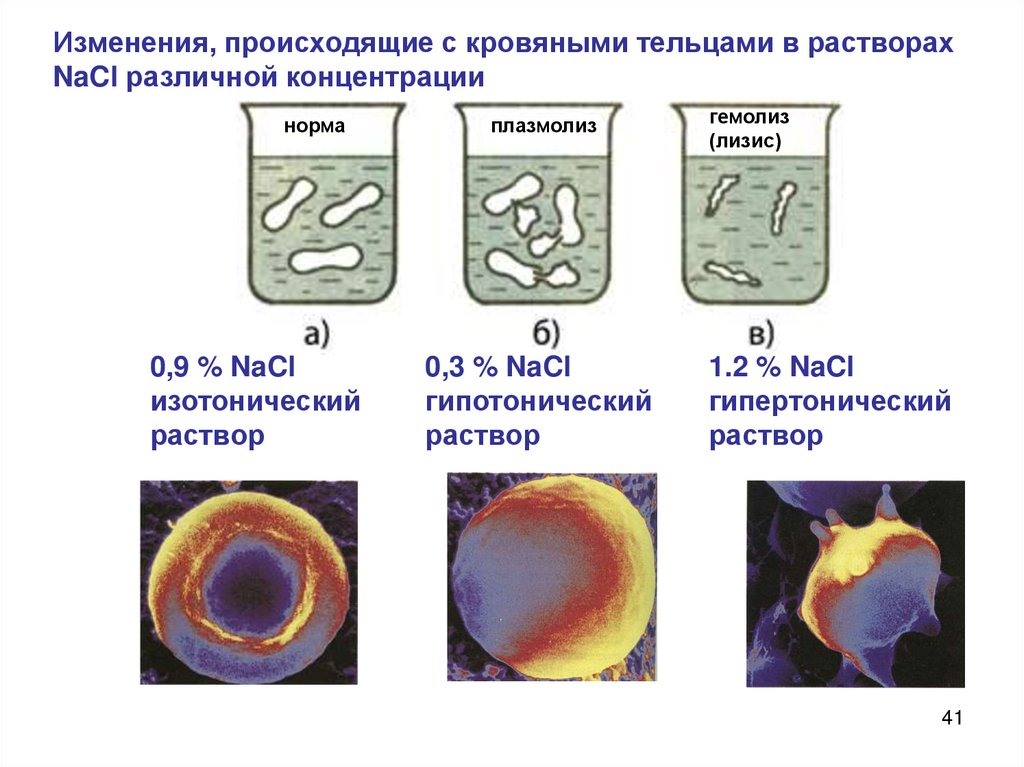
41.
Изменения, происходящие с кровяными тельцами в растворахNaCl различной концентрации
норма
0,9 % NaCl
изотонический
раствор
плазмолиз
0,3 % NaCl
гипотонический
раствор
гемолиз
(лизис)
1.2 % NaCl
гипертонический
раствор
41
42.
Консервирование продуктовпитания происходит благодаря
уничтожению микроорганизмов
вследствие их плазмолиза.
Плазмолиз также наблюдается при посыпании ягод или фруктов
сахаром, а овощей, мяса или рыбы - солью.
42
43.
Тургор– осмотическое набухание клетки с появлением сильного
внутреннего давления
Тургор определяет объем и форму клеток (эритроцитов).
Для нормального функционирования тургорное давление
должно быть ниже осмотического - только в этих условиях
наблюдается активный транспорт в клетку.
Испарение
воды
листьями
в
окружающую
среду
(транспирация) поддерживается накоплением воды через ствол
и ветви за счет осмотического давления.
43
44.
Значение осмотического давления (примеры)1. Слабительное действие глауберовой соли Na2SO4·10H2O и
горькой соли MgSO4·7H2O.
Плохая всасываемость стенками желудка вызывает интенсивный
переход воды внутрь кишечника, способствуя послабляющему
действию.
2. При очистке ран от гноя и носителей инфекции используют
гипертонические марлевые повязки, пропитанные 10%-ным
раствором NaCI или этанолом .
3. При глаукоме гипертонические растворы вводят внутривенно
чтобы снизить внутриглазное давление.
44
45.
4. Осмос и диализ - основа ряда физиологических процессов:усвоение пищи, окислительные процессы связанные с
дыхательной цепи, распределение питательных веществ,
жидкостной
обмен
в
тканях,
выделение
продуктов
жизнедеятельности.
5. Осмос при купании
В пресной воде болевые ощущения, резь в глазах более
заметны (осмос воды направлен внутрь глазного яблока).
В
морской
воде
замечается
покраснение
глаз
с
незначительными болевыми ощущениями (осмос воды направлен
из глазного яблока в морскую воду)
45
































 chemistry
chemistry








