Similar presentations:
Гравиметрический анализ
1. Гравиметрический метод анализа
Теоретические основы гравиметрического метода анализаОсновные этапы методики гравиметрического анализа
Расчет результатов гравиметрического анализа
2. Гравиметрический анализ. Теоретические основы гравиметрического метода анализа
В гравиметрическом анализе используетсяпрямое определение массы вещества при
помощи взвешивания.
Определение массы является и начальной, и
конечной стадией анализа.
Основной прибор – аналитические весы.
3. Гравиметрический анализ. Теоретические основы гравиметрического метода анализа
Гравиметрический метод анализа основан назаконах
- сохранения массы вещества при химических
превращениях;
- постоянства состава;
- законе эквивалентов.
В основе гравиметрического метода анализа
лежат различные химические реакции –
разложения, замещения, обмена,
комплексообразования.
4. Гравиметрический анализ. Теоретические основы гравиметрического метода анализа
Применение гравиметрического метода анализа:установление химического состава многих веществ;
определение атомных масс элементов;
определение гигроскопической влаги;
арбитражные анализы.
Достоинства метода :
- высокая точность анализа,
- простота (метод не требует сложной аппаратуры и
специальных знаний),
- доступность (возможность проведения анализа
практически в любой химической лаборатории).
Недостатки гравиметрического метода
заключаются в длительности проводимого анализа (от
нескольких часов до нескольких суток).
5. Гравиметрический анализ. Теоретические основы гравиметрического метода анализа
Типы гравиметрических определений.Метод отгонки
Определение зольности угля, сланца, торфа
Для этого навеску анализируемой пробы взвешивают,
сжигают (муфельный шкаф, Т>500-600°C)и золу опять
взвешивают.
Обязательное условие – взвешивание до постоянной
массы (∆m ≤ 0,0002г – Sr – величина погрешности
взвешивания на аналитических весах).
Содержание золы определяют по формуле:
mз
Зольность( )
100%
mнав
6. Гравиметрический анализ. Теоретические основы гравиметрического метода анализа
Типы гравиметрических определений.Метод отгонки
Определение влажности (влаги), кристаллизационной
воды
После взвешивания навески пробы определяемую
составную часть удаляют при нагревании (сушильный
шкаф, Т ≥ 105±5°С), а остаток взвешивают
Обязательное условие – взвешивание до постоянной массы
(∆m ≤ 0,0002г – Sr – величина погрешности взвешивания
на аналитических весах).
mН 2О mн mвысуш.остатка
H O
2
mH 2O
mнав
100%
7. Гравиметрический анализ. Теоретические основы гравиметрического метода анализа
Типы гравиметрических определений.Метод осаждения – основной метод гравиметрии
Определяемую составную часть осаждают в виде
химического соединения со строго определенным составом.
Полученный осадок отделяют и промывают, высушивают и
взвешивают.
Обязательное условие – взвешивание до постоянной
массы (∆m ≤ 0,0001г – Sr – величина погрешности
взвешивания на аналитических весах).
Ba 2 SO42 BaSO4 определение _ сульфатов
M BaSO4
M SO2
4
mBaSO4
mSO2
4
; mSO2 mBaSO4
4
M SO2
4
M BaSO4
8. Выполнение гравиметрического анализа
Взвешиваниенавески,
содержащей
определяемый
компонент
9. Выполнение гравиметрического анализа
Растворениенавески
10. Выполнение гравиметрического анализа
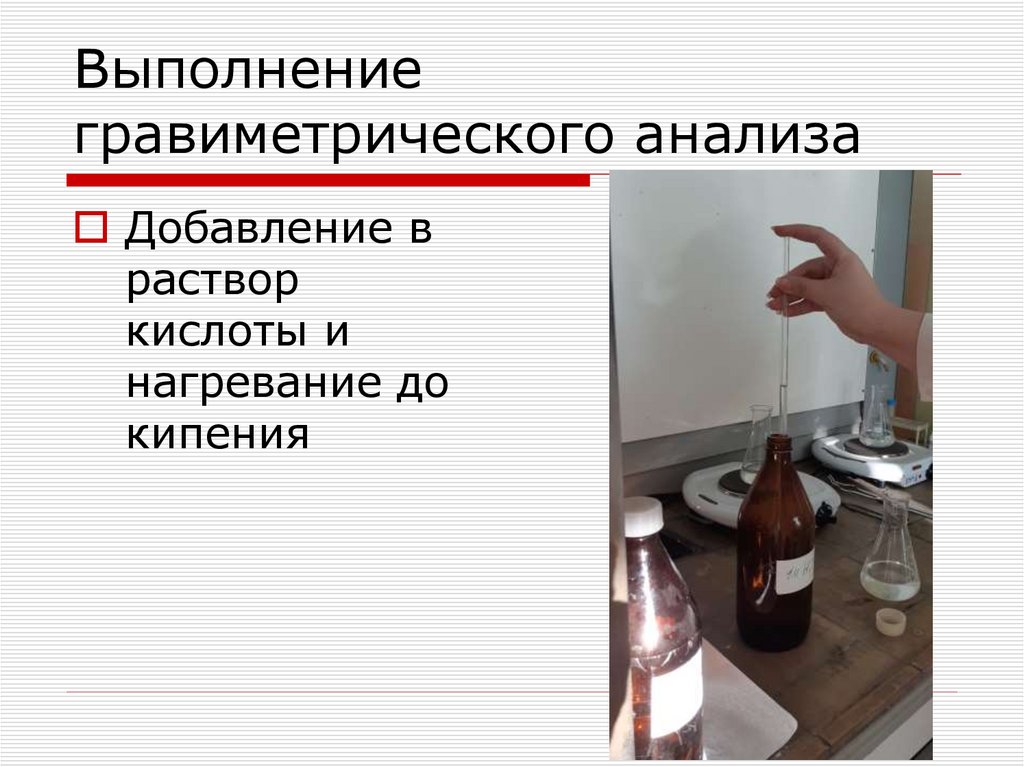
Добавление враствор
кислоты и
нагревание до
кипения
11. Выполнение гравиметрического анализа
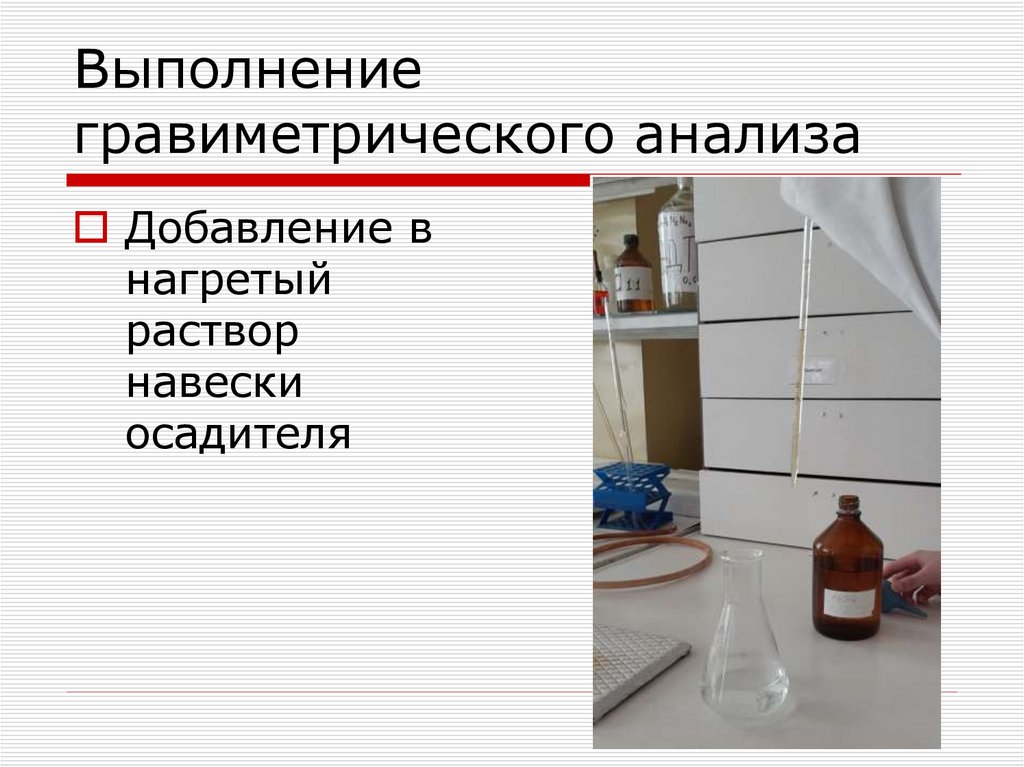
Добавление внагретый
раствор
навески
осадителя
12. Выполнение гравиметрического анализа
Образованиеосадка
13. Выполнение гравиметрического анализа
Фильтрованиеотделениераствора от
осадка
14. Выполнение гравиметрического анализа
Взвешиваниепустого тигля
15. Выполнение гравиметрического анализа
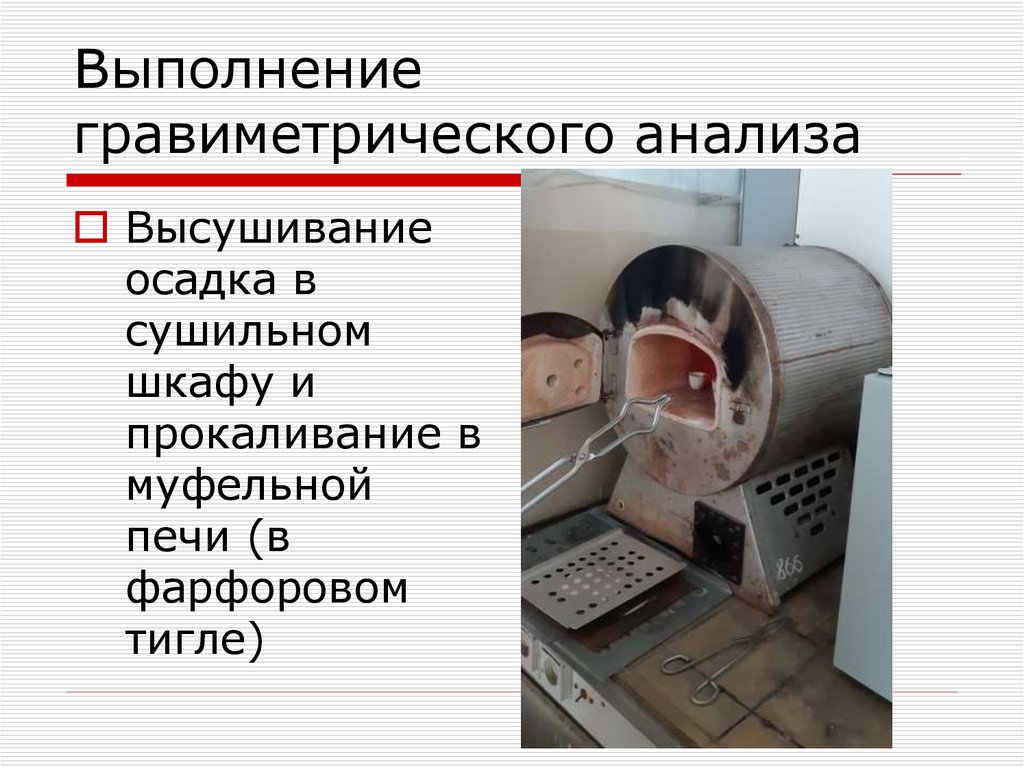
Высушиваниеосадка в
сушильном
шкафу и
прокаливание в
муфельной
печи (в
фарфоровом
тигле)
16. Выполнение гравиметрического анализа
Взвешиваниетигля с осадком
после
прокаливания и
охлаждения
17. Вычисления в гравиметрическом анализе
15. По разнице в весе пустого тигля и тигля с осадкомвычислить массу гравиметрической формы осадка.
Записать результат.
16. Произвести вычисления.
16.1 Расчет процентного содержания серы в молекуле
сульфата бария.
Находим молярную массу сульфата бария:
М(ВаSO4) = d
d – 100%
mS - молярная масса серы в
mS – k%
молекуле BaSO4
Вычисляем процентное содержание серы в сульфате:
k% = (mS * 100%) / d
18. Вычисления в гравиметрическом анализе
16.2 Расчет массы серы в осадке.Примерная масса осадка ~ 0.5 г (для расчета взять
полученную массу гравиметрической формы осадка (см.
выше пункт №15) и подставить в формулу свой результат)
0.5 г – 100%
Y г - k%
16.3
Y г = (0.5 г * k%) / 100%
Расчет процентного содержания серы в навеске.
mн – 100%
Y г - Х%
X = (Y г * 100%) / mн
19. Оформление результатов в виде итоговой таблицы
Расчетные или практически полученные данныеЗначение массы,
объема, % содержания
Масса навески (формула вещества)
Масса или объем осадителя (формула вещества)
Масса пустого тигля
Масса тигля после прокаливания
Масса полученного осадка (формула вещества)
Процентное содержание определяемого компонента
в исследуемом осадке
Масса определяемого компонента в осадке
Процентное содержание определяемого компонента
в навеске
Вывод должен содержать сведения о процентном содержании
определяемого компонента в навеске.
20. Гравиметрический анализ. Теоретические основы гравиметрического метода анализа
Важнейшим этапом гравиметрическогоопределения в методе осаждения является
получение осадка, без примесей и
крупнокристаллического
21. Гравиметрический анализ. Теоретические основы гравиметрического метода анализа
Требования, предъявляемые к осаждаемой форме (ОсФ) вгравиметрии
Осадок должен быть достаточно малорастворим.
Желательно, чтобы осадок был крупнокристаллическим, т.к.
такой осадок проще промывать и отделять.
Осадок не должен поглощать из раствора примеси.
Осадок должен иметь постоянный состав.
ОсФ должна легко и просто превращаться в весовую
(гравиметрическую). Например, ОсФ Fe2O3·xH2O при
прокаливании легко превращается в весовую форму Fe2O3
со строго определенным составом.
Осаждаемая форма может соответствовать гравиметрической
22. Гравиметрический анализ. Теоретические основы гравиметрического метода анализа
Требования, предъявляемые к гравиметрической форме (ГФ)Точное соответствие состава химической формуле.
Достаточная термическая и химическая устойчивость, т.е. ГФ
осадка не должна поглощать из воздуха СО2 и Н2О, не должна
окисляться и т.д
Содержание определяемого элемента в ГФ должно быть как
можно меньшим, а Мгр.ф. – как можно большим, т.к. в этом
случае погрешности взвешивания меньше скажутся на
результатах анализа.
Необходимая для гравиметрического определения масса ГФ
определяется, с одной стороны, погрешностью весов, с другой
- оптимальной массой осаждаемой формы.
Обычно рекомендуемая масса ГФ для кристаллических
осадков не превышает > 0,5 г, а для аморфных > 0,1 г.
23. Гравиметрический анализ. Теоретические основы гравиметрического метода анализа
Требования, предъявляемые к осадителю1. Осадитель должен быть специфичен, т.е. он должен
осаждать данный ион и не осаждать другие.
Например, А13+ нельзя осадить в присутствии Fe3+ , с помощью
NH4OH, т.к. в этом случае получается смешанный осадок
Al(OH)3 и Fe(OH)3. Учитывая амфотерность алюминия, А13+
следует осаждать с помощью Na2S2O3, который не дает осадка с
Fe3+.
2. Осадитель должен быть легко удаляемым (летучим) для
очищения осадка на стадии высушивания и прокаливания.
Например: Ag+ в виде AgCl с помощью HCl, а не NaCl;
Fe3+ в виде Fe(OH)3 с помощью NH4OH, а не NaOH.
24. Гравиметрический анализ. Теоретические основы гравиметрического метода анализа
Требования, предъявляемые к осадителю3. Осадитель должен образовывать осадок с максимально
малой растворимостью, т.е. с малым значением
произведения растворимости (ПР)
Для однотипных соединений BaSO4 имеет
минимальную величину ПР, следовательно при
определении Ва2+ будут минимальные потери.
Соединение
BaC2O4
BaCO3
BaCrO4
BaSO4
Ks
1.6·10-4
8·10-9
2.4·10-
1.1·1010 min
10
25. Гравиметрический анализ. Теоретические основы гравиметрического метода анализа
Требования, предъявляемые к осадителю4. При выборе осадителя нужно точно рассчитывать
необходимый избыток осадителя, т.к. при его излишнем
количестве возможно:
проявление амфотерности ( в случае образования
гидроксидов), приводящее к растворению осадка;
образование комплексных и кислых солей
Ag HCl AgCl H
AgCl HCl H AgCl2 раствор
Pb 2 H 2 SO4 PbSO4
PbSO4 H 2 SO4 Pb( HSO 4 ) 2 раствор
Для достижения полноты осаждения добавляется полуторный избыток
(+50%) осадителя летучего и 10-20% осадителя нелетучего.
Количество осадителя рассчитывается по уравнению реакции.
26. Гравиметрический анализ. Теоретические основы гравиметрического метода анализа
Осадители в гравиметрииОсадитель
Кислоты
HCL,H2SO4, HNO3
Основания
NH3·H2O
Соли
(NH4)2C2O4
BaCL2
MgCL2(аммон.буфер)
Электролитическое
восстановление
Органические реагенты
О-оксихинолин
Диметилглиоксим
ДДЭТК
1-нитрозо-2-нафтол
Щавелевая кислота
Тетрафенилборат натрия
Осаждаемые ионы
Гравиметрическая форма
Ag(I),Ba(II), Sr(II),Pb(II), Sn(IV)
AgCL, MSO4, SnO2
Al(III), Fe(III), Sc(III), Sn(IV)
MnOm
Ca(II), Th(IV)
SO42PO43Cu(II), Zn(II), Ni(II), Co(II), Ag(I),
Sn(II), Sb(III), Cd(II), Bi(III),
CaC2O4, cao; ThO2
BaSO4
MgP2O7
Металлы
Mg(II), Zn(II), Co(II), Mn(II), Ni(II), Pb(II),
Pd(II), AL(III), Fe(III), In(III), Bi(III)
M(Ox)n, MnOm
Ni(II), Pd(II)
рН ~1-2 (многие металлы)
Co(II), Cu(II), Pd(II)
M(DMG)2, MO
Оксиды металлов
Оксиды металлов
Ca(II)
CaC2O4, cao
Rb(I), K(I), Cs(I), Tl(I), Ag(I), NH4+
Компл.соед.состава 1:1, M2O
27. Кристаллические осадки
1.2.
3.
4.
При образовании кристаллических осадков выделение вещества из
раствора идет на поверхности уже образовавшихся зародышей, за
счет их постепенного роста.
Условия образования:
Использование разбавленных и нагретых растворов пробы и
осадителя, т.к. более крупные кристаллы образуются в растворе,
содержащем меньшее число зародышей, а также предварительное
подкисление раствора пробы.
Медленное добавление осадителя (в первые моменты буквально по
каплям) с целью предотвратить образование большого количества
зародышевых частиц.
Постоянное перемешивание раствора, препятствующее образованию
новых зародышей.
Использование стадии «старения» осадка.
В ходе «старения - созревания» мелкие кристаллы растворяются, а
крупные кристаллы – увеличиваются из-за обмена ионов
кристаллической решетки с ионами раствора на поверхности
кристалла, при этом осадок очищается, примеси переходят в раствор.
28. Аморфные осадки
При образовании аморфных осадков в первый же моментслияния растворов образуется большое количество
зародышевых кристаллов, впоследствии соединяющиеся
(слипающиеся) в более крупные агрегаты, которые и оседают
на дно. Таким образом, аморфные осадки фактически
состоят из мельчайших кристаллов.
Псевдокристаллические осадки
Процессы, происходящие при образовании аморфных
осадков
1) Коагуляция - слипание мелких частиц в крупные агрегаты (с
определенным электрическим зарядом), оседающие из
раствора в виде хлопьев (т.наз. Гель).
2) Пептизация – обратный процесс разрушения
(растворения)осадка, превращение геля в коллоид из-за
потери электрического заряда.
29. Загрязнение осадков
1. СоосаждениеОсновная причина – адсорбция развитой поверхностью
осадка ионов из раствора.
Предотвращение соосаждения:
1) получение крупнокристаллических осадков при
повышенной Т°С,
2) промывание осадка,
30 перекристаллизация (старение)осадка.
30. Загрязнение осадков
2. Окклюзия (включение примесей внутрь растущихагрегатов или кристаллов осадка)
Причина – быстрый рост кристаллов или агрегатов
осадка
Предупреждение окклюзии - медленное добавление
осадителя.
Устранение окклюзии:
1) Переосаждение осадка;
2) Перекристаллизация (старение) осадка
3. Механический захват примесей маточного раствора и
молекул растворителя характерен для образования
аморфных осадков
31. Фильтрование и промывание осадков
Фильтрование – отделение твердой фазы осадка отматочного раствора.
Для ускорения фильтрования - Декантация – сливание
жидкости с отстоявшегося осадка.
Для отделения осадка - Фильтрующий (пористый)
материал – бумага (беззольные фильтры разной
плотности –маркировка по цвету упаковки:черная, синяя,
красная, белая и желтая «лента»), вата, ткань, стекло
(фильтры пористые Шотта), фарфор (керамиковые
фильтры и тигли фильтрующие Гуча), асбест.
Материал фильтра определяют:
- свойства и структура осадка;
- размер частиц;
- температура дальнейшей
- обработки осадка.
32. Фильтрование и промывание осадка
Промывание – очищение осадка от остатковраствора и сорбированных примесей.
Промывная жидкость выбирается по типу
промываемого осадка.
Для аморфных осадков – растворы сильных
электролитов (для предотвращения
пептизации).
Для кристаллических осадков – очищенная
вода, разбавленные растворы осадителей
(для уменьшения растворимости).
33.
Высушивание и прокаливание осадков• Условия выбирают на основании
термогравиметрических
исследований (анализ термограммы)
• Продолжительность устанавливают
экспериментально (до достижения
постоянной массы)
• Термически нестойкие осадки
высушивают на воздухе или в эксикаторах
над осушителями
• Т.к. возможно промывание осадков не
водой и водными растворами, а спиртом или
эфиром высушивают в эксикаторах и
сушильных шкафах
34. Расчет результатов гравиметрического анализа
На примере определения сульфатовBa 2 SO42 BaSO4
M BaSO4
M SO2
4
mBaSO4
mSO2
(%)
4
4
SO (%)
2
4
; mSO2 mBaSO4
mBaSO4 FSO2
4
P
BaSO4
M SO2
4
M BaSO4
mBaSO4 FSO2
4
;
BaSO4
100%( где _ Р навеска _ пробы)
mГФ F
100%
P
mГФ F
Зная (%), рассчитывают _ mнав. : Р
100%
(%)
35. Погрешности гравиметрического анализа
Причины систематических погрешностей:- Потери от растворимости(неправильный выбор
промывной жидкости или фильтра);
- Неполное превращение ОсФ в ГФ;
- Неустойчивость ГФ при хранении;
- Недостаточное охлаждение перед
взвешиванием;
- Применение загрязненных реактивов и т.д.
Способ выявление систематической погрешности –
проведение холостого опыта через все стадии
анализа
































 chemistry
chemistry








