Similar presentations:
Гравиметрический анализ
1.
Гравиметрический анализ2.
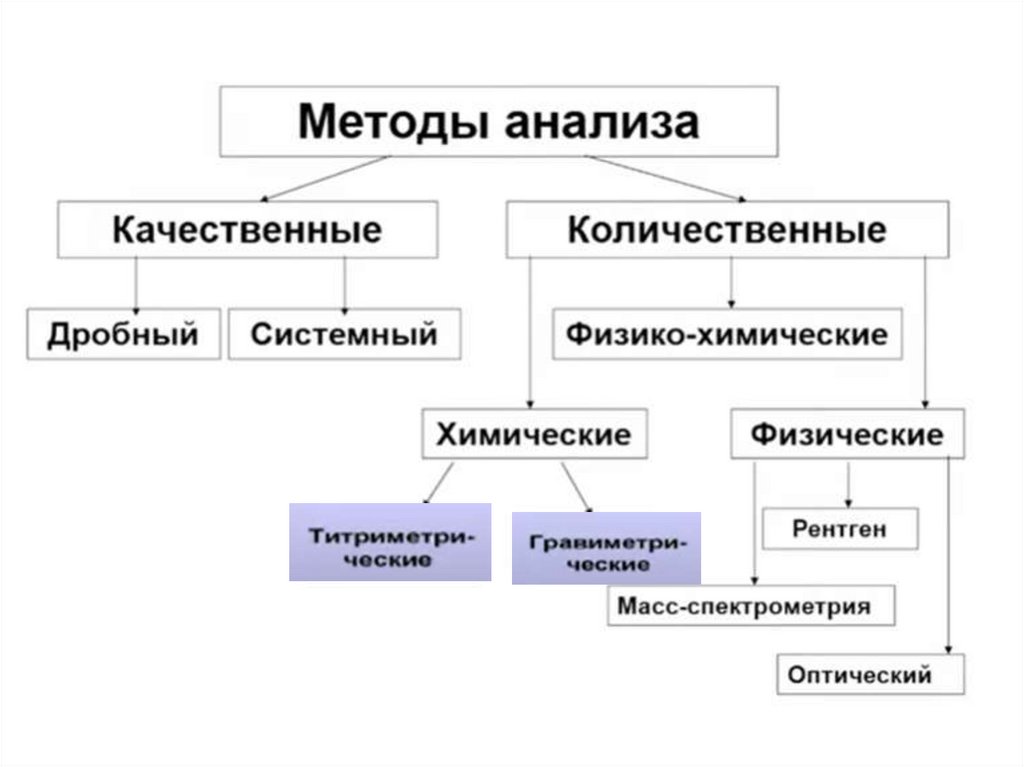
• Задачей количественного анализа являетсяопределение количественного содержания
элементов, ионов или химических соединений,
входящих в состав исследуемых веществ и
материалов.
2
3.
4.
Гравиметрический анализ• Гравиметрический анализ основан на законе
сохранения массы и постоянства состава вещества
и заключается в определении массы
определенного компонента, выделенного в
чистом виде или полученного в виде
соединения известного химического состава.
• Аналитическим сигналом является масса
вещества, как правило, продукта химической
реакции.
5.
6.
7.
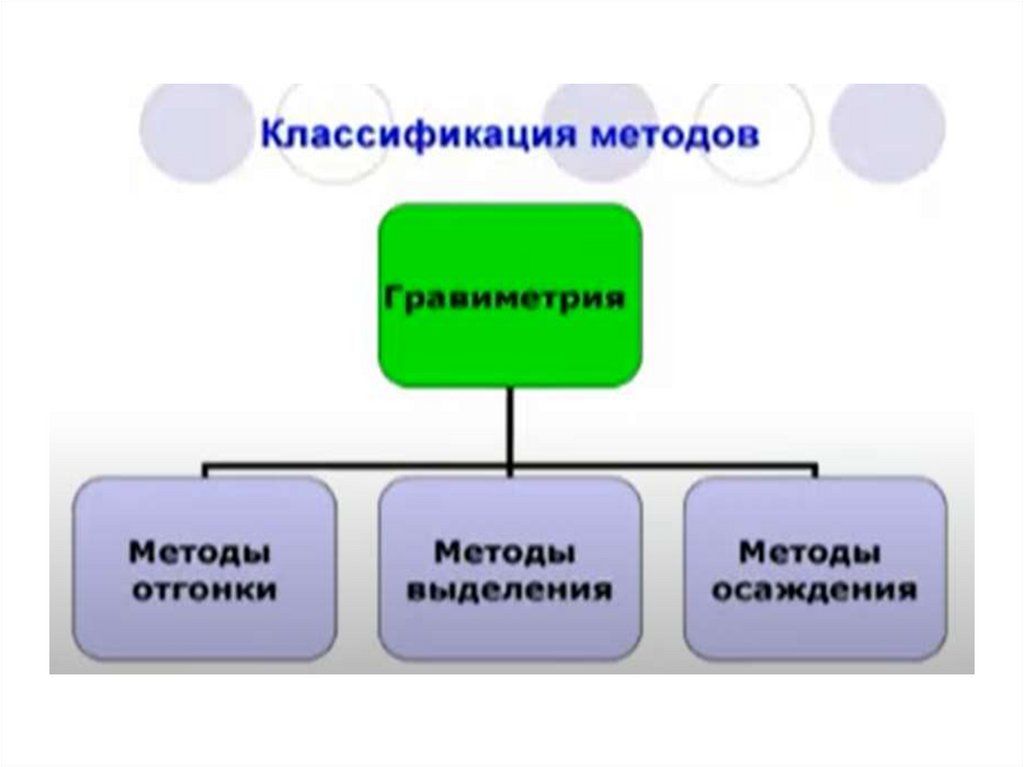
Метод отгонкиОпределяемый компонент выделяют из анализируемой пробы в
виде газообразного соединения и измеряют либо массу отогнанного
вещества (прямой метод), либо массу остатка (косвенный метод).
Примером прямого метода отгонки является определение оксида
углерода (IV) в карбонатных породах.
Сначала выделяют диоксид углерода, действуя на пробу кислотой:
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
Полученный газ пропускают через сосуд с поглотителем – щелочью:
CO2 + 2NaOH = Na2CO3 + H2O.
В результате поглощения диоксида углерода масса поглотителя
увеличивается и по ее приросту можно рассчитать содержание
СаСО3 в пробе.
8.
• Косвенные методы отгонки широкоприменяются для определения
кристаллизационной воды в солях, воды в
почве и лекарственном растительном сырье. О
количестве аналита судят по убыли массы
пробы. Методы отгонки используют при
определении летучих компонентов
9.
10.
Метод осаждения• основан на количественном осаждении искомого
иона в виде малорастворимого соединения
определенного химического состава, которое
после отделения и термообработки взвешивают.
11.
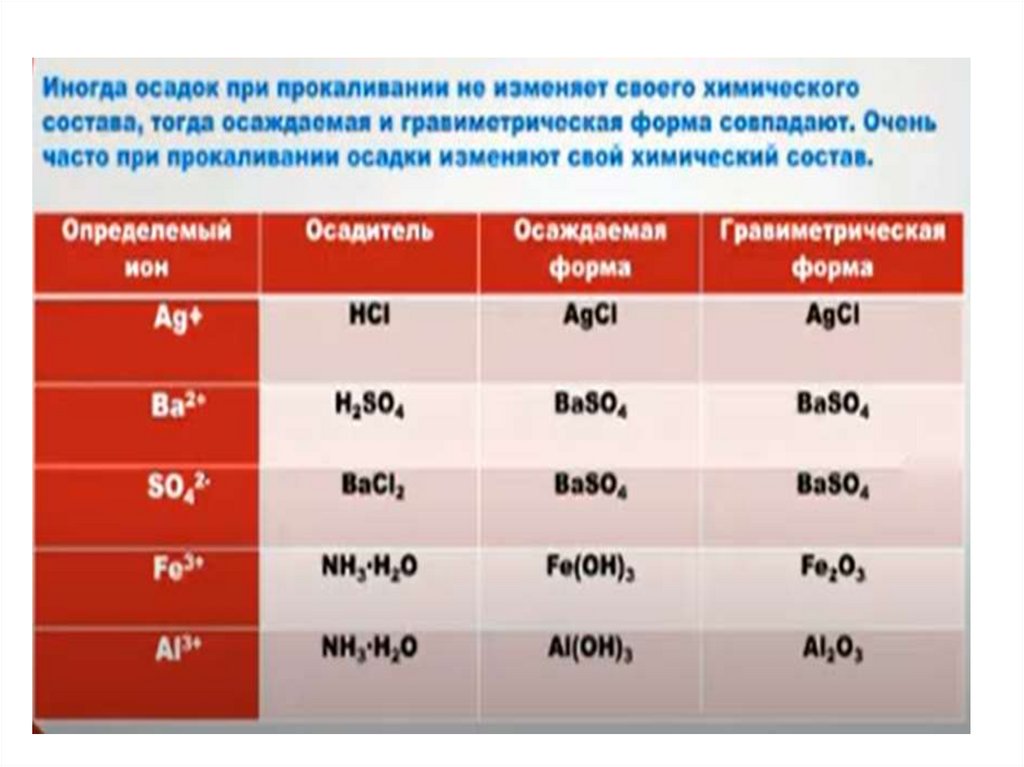
Основные понятия метода осаждения• Осаждаемая форма – это химический состав осадка,
в виде которого осаждают определяемый компонент.
Требования к осаждаемой форме:
• 1. быть практически нерастворимой, так как Ks
осадка не должен превышать 1∙10-8;
• 2. образовывать достаточно крупные кристаллы, что
способствует быстрому фильтрованию и легкому
отмыванию осадка от примесей;
• 3. легко и полностью превращаться в
гравиметрическую
форму.
12.
• Гравиметрическая форма – химический составвысушенного (прокаленного) и взвешенного осадка.
Требования к гравиметрической форме:
• 1. иметь определенную химическую формулу, по
которой можно вычислить содержание определяемого
компонента;
• 2. быть химически устойчивой на воздухе;
• 3. содержание определяемого элемента в
гравиметрической форме должно быть как можно
меньшим, так как в этом случае погрешности
взвешивания в меньшей мере скажутся на
результатах анализа.
13.
• Осадитель – это реагент, с помощью которогоопределяемый компонент переводят в
малорастворимое соединение.
Осадитель должен:
• 1. образовывать осадок с исследуемым
компонентом с наименьшей растворимостью;
• 2. быть летучим веществом, т.е. легко удаляться при
нагревании и прокаливании осаждаемой формы;
• 3. быть специфичным, то есть осаждать
определяемый ион
и не затрагивать другие ионы
в растворе.
14.
Неорганические осадители• Неорганические осадители (NH3∙H2O, H2S, H2SO4,
HCl, BaCl2) образуют с определяемыми ионами
малорастворимые соли или гидроксиды.
• Основным недостатком неорганических
осадителей является малая селективность.
Например, при осаждении Fe3+ водным раствором
аммиака в присутствии Al3+ образуются два
гидроксида – Fe(OH)3 и Al(OH)3, поэтому до
осаждения необходимо разделять эти ионы.
15.
Органические осадители• Органические осадители образуют с определяемыми
ионами малорастворимые соли или комплексные
соединения.
• Например, оксалат аммония осаждает ионы Ca2+ в виде
малорастворимого оксалата кальция. Оксихинолин
образует малорастворимые окрашенные комплексы с
ионами магния и алюминия.
• Органические осадители имеют ряд существенных
преимуществ по сравнению с неорганическими:
• - высокая селективность;
• - малая растворимость и чистота образующихся
осадков;
• - большая молярная масса осадков (точность анализа
повышается за счет малого значения гравиметрического
фактора F).
16.
17.
18.
Погрешности гравиметрического анализаГравиметрический анализ относится к методам, дающим наиболее правильные
результаты. Высокая правильность гравиметрии обусловлена малой
систематической ошибкой измерения, связанной с точностью взвешивания на
аналитических весах. Так, для весов с точностью взвешивания 0,0002 г
систематическая ошибка измерения составляет 0,05%.
Основными источниками систематических ошибок являются:
– загрязнение осаждаемой формы посторонними примесями, не удаленными при
промывании и прокаливании;
– растворимость осадков;
– потери, связанные с превращением осаждаемой формы в гравиметрическую форму.
Для уменьшения погрешностей анализа желательно, чтобы значение
гравиметрического фактора было наименьшим (гравиметрическая форма имела
возможно бóльшую молярную массу при небольшом содержании определяемого
компонента в ней). Эти требования могут быть выполнены путем правильного выбора
реагента-осадителя, условий осаждения, фильтрования, промывания и термообработки
осадка.
19.
• Безэталонный(результат получают непосредственно изизмерений).
• Универсальный (можно определить большинство
неорганических катионов и анионов, нейтральных
молекул (H2O, CO2)и органических соединений.
• Высокоточный при анализе простых объектов с
содержанием компонента > 1 % (D = 0,1 – 0,2 %).
• Дешевый и доступный.
20.
• Относительно низкая чувствительность (> 1%).• Длительность анализа.
• Невысокая селективность.
21.
Расчеты в гравиметрическом анализе• Для расчета массы навески анализируемого
вещества необходимо знать примерное содержание
определяемого компонента в исследуемой пробе,
форму полученного осадка (кристаллическая или
аморфная), ожидаемую массу гравиметрической
формы и учитывать точность взвешивания. Для
кристаллических осадков масса гравиметрической
формы должна быть примерно 0,1 – 0,5 г (для легких
осадков от 0,1 до 0,2 г, для тяжелых 0,2 – 0,4 г, для
очень тяжелых – от 0,4 до 0,5 г), для объемных
аморфных осадков – около 0,1 г.
22.
• Масса навески пробы для проведения единичногоопределения равна:
где g – масса навески, г;
m – масса гравиметрической формы, г;
P – массовая доля определяемого компонента, %;
F – гравиметрический фактор.
23.
• Гравиметрический фактор (F) – отношение молярных массопределяемого компонента и его гравиметрической формы,
умноженных на соответствующие стехиометрические
коэффициенты:
• где a и b – коэффициенты, обеспечивающие равенство числа молей
определяемого компонента в числителе и знаменателе;
• M – молекулярная масса определяемого компонента, г/моль;
• MA – молекулярная масса гравиметрической формы, г/моль.
• При расчете гравиметрического фактора атомные и молярные
массы должны быть взяты со всеми значащими цифрами.
Вычисленный гравиметрический фактор должен быть округлен
до числа, содержащего не менее четырех значащих цифр.
24.
• Если анализируемое вещество – жидкость, то расчетнеобходимого объема его (мл) проводят по формуле:
• где ρ – плотность, г/мл.
• Осаждение считают количественным, если концентрация
определяемого компонента в растворе не превышает 10-6
моль/л и остаточное количество осаждаемого вещества не
превышает погрешности взвешивания на аналитических
весах (0,0002 г). Для более полного выделения осаждаемого
компонента вводят избыток осадителя по сравнению с
величиной, рассчитанной согласно стехиометрии реакции.
25.
• Количество осадителя (объем или масса) определяетсярастворимостью осаждаемой формы и летучестью
осадителя. Если осадитель летучее соединение, то берут
его двукратный избыток, для нелетучих – 30 % избыток.
• где VB – объем раствора осадителя, мл;
• 1,5 – коэффициент, определяющий избыток осадителя;
• g – масса навески, г;
• a, b – стехиометрические коэффициенты реакции;
• MB – молекулярная масса осадителя, г/моль;
M – молекулярная масса анализируемого вещества, г/моль;
• ρ – плотность раствора осадителя, г/мл;
• w – массовая доля осадителя в растворе, %.
26.
• Концентрацию примесей Cn, остающихся в осадкепосле n – го промывания рассчитывают по формуле:
• где C0 – начальная концентрация примесей в осадке, моль/л,
• V0 – объем жидкости, удерживаемой осадком, мл,
V – объем одной порции промывной жидкости, мл.
27.
• Число промываний (n) равно:• Затраченный объем (Vn) промывной жидкости
равен:
28.
• Масса определяемого компонента (mопр) ванализируемом образце:
• Массовая доля (P) определяемого компонента в
анализируемом образце:
29.
Примеры• Пример 1. Рассчитайте массу навески пробы,
содержащей около 65% Ca(OH)2, необходимую
для гравиметрического определения Ca2+
осаждением оксалатом аммония.
• Пример 2. Рассчитайте объем осадителя – 10% го раствора H2SO4 (M = 98 г/моль, ρ = 1,070 г/мл),
необходимый для осаждения BaSO4 из навески
BaCl2 ∙2H2O, равной 0,5236 г.
30.
• Пример 3. Сколько раз необходимо промыть осадок,чтобы содержание примесей в нем уменьшилось в
100 раз, если осадок удерживает 5 мл жидкости и
промывание его проводят порциями по 10 мл?
• Пример 4. Рассчитайте содержание (%) бария в
образце, если из 0,4694 г его получено 0,2794 г
BaSO4.
• Пример 5. Рассчитайте гравиметрические
факторы при определении следующих компонентов:
Fe, FeO, Fe2(SO4)3, Fe2O3. Гравиметрической формой
является Fe2O3.



























 chemistry
chemistry








