Similar presentations:
Презентация к уроку_ _Медь и ее соединения_ 11 класс ЕН профиль
1. МЕДЬ
Учитель химии Маринина В.Р.Ачинская Мариинская гимназия
МЕДЬ
СОЕДИНЕНИЯ МЕДИ
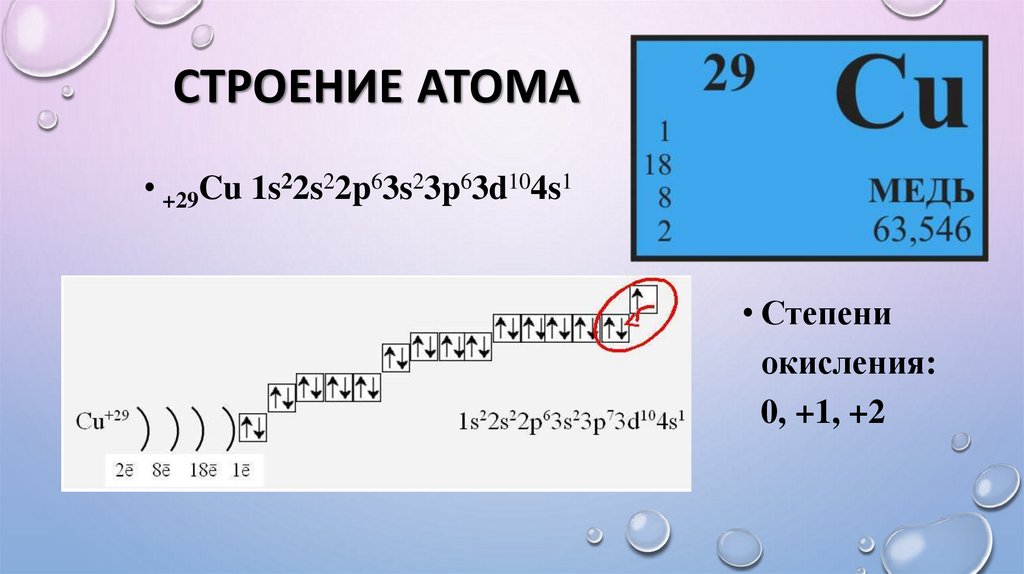
2. СТРОЕНИЕ АТОМА
• +29Cu 1s22s22p63s23p63d104s1• Степени
окисления:
0, +1, +2
3. Физические свойства
ФИЗИЧЕСКИЕ СВОЙСТВА• МЕТАЛЛ ОРАНЖЕВОКРАСНОГО ЦВЕТА;
• МЯГКИЙ;
• ПЛАСТИЧНЫЙ;
• ВЫСОКАЯ ЭЛЕКТРО- И
ТЕПЛОПРОВОДНОСТЬ;
• Тпл = 1083ОС; Ткип = 2567ОС
4. Нахождение в природе
НАХОЖДЕНИЕ В ПРИРОДЕХалькопирит
CuFeS2
Лазурит
Cu3(CO3)2(OH)2
Ковеллин
CuS
Халькозин
Cu2S
Малахит
Cu2(OH)2CO3
5. Получение
ПОЛУЧЕНИЕ• ПИРОМЕТАЛЛУРГИЧЕСКИЙ МЕТОД - из сульфидных руд:
1) Обжиг сульфидов: 2CuS + 3O2 → 2CuO + 2SO2
2) восстановление меди из оксида: CuO + C → Cu + CO↑
• ЭЛЕКТРОЛИЗ РАСТВОРОВ СОЛЕЙ МЕДИ:
2CuSO4 + 2H2O → 2Cu + O2 + 2H2SO4
• ГИДРОМЕТАЛЛУРГИЧЕСКИЙ МЕТОД – вытеснение из
солей меди активными металлами
CuSO4 + Fe = Cu + FeSO4
Очистка меди
гальваническим
рафинированием:
6. Химические свойства меди
ХИМИЧЕСКИЕ СВОЙСТВА МЕДИ• НЕ ВЗАИМОДЕЙСТВУЕТ – с водородом, азотом, углеродом.
7. Химические свойства меди
ХИМИЧЕСКИЕ СВОЙСТВА МЕДИ• С концентрированными серной кислотой при нагревании:
Cu + 2H2SO4(конц.) → CuSO4 + SO2 + 2H2O
• С азотной кислотой:
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO + 4H2O
• С концентрированными галогенводородными кислотами без
доступа воздуха: 2Cu + 4HCL(конц.) → 2H[CuCl2] + H2↑
• Вытесняет менее активные металлы из их солей:
Hg(NO3)2 + Cu = Cu(NO3)2 + Hg
• Окисляется оксидом азота (IV): 2Cu + NO2 = Cu2O + NO
8. Медь с концентрированной азотной кислотой
МЕДЬС
КОНЦЕНТРИРОВАННОЙ
АЗОТНОЙ
КИСЛОТОЙ
9. Оксиды
ОКСИДЫОксид меди (II) CuO
Оксид меди (I) Cu2O
ПОЛУЧЕНИЕ
Cu(OH)2 → CuO + H2O
2Cu + O2 → 2CuO
Cu2(OH)2CO3 → 2CuO + CO2 + H2O
2Cu(NO3)2 → 2CuO + 4NO2 + O2
CH3CHO + 2Cu(OH)2 → CH3COOH + Cu2O↓ + 2H2O
ОСНОВНЫЕ СВОЙСТВА
3CuO + 2NH3 → 3Cu + N2 + 3H2O
CuO + 2HCl → CuCl2 + H2O
CuO + SO3 → CuSO4
Cu2O + 4NH3 + H2O → 2[Cu(NH3)2]OH
Cu2O + 2HCl → 2CuCl↓ + H2O
Cu2O + 3H2SO4(конц.) → 2CuSO4 + SO2 + 3H2O
2Cu2O + O2 → 4CuO
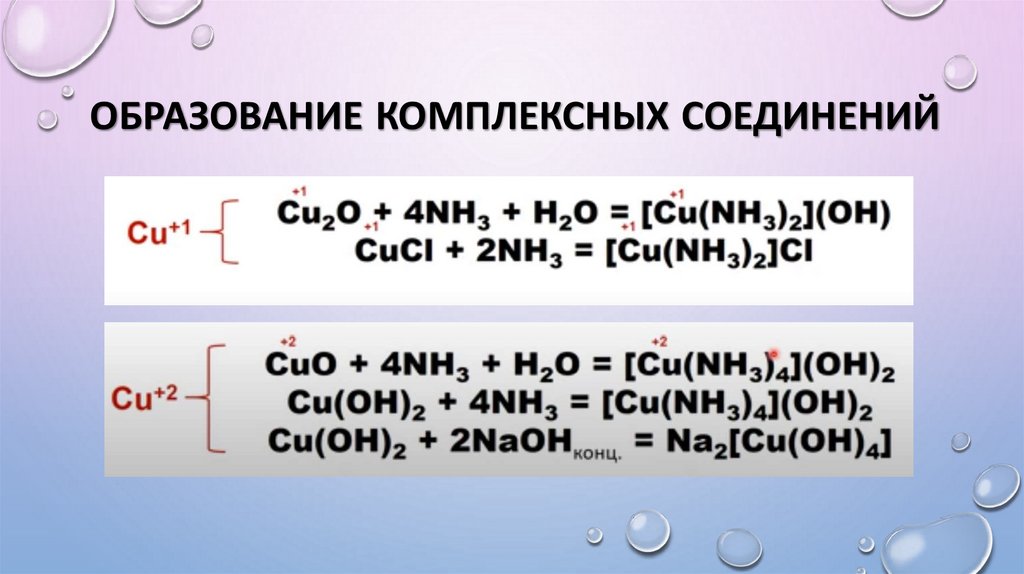
10. Образование комплексных соединений
ОБРАЗОВАНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ11. Соли меди
СОЛИ МЕДИ• ПРОКАЛИВАНИЕ – реакции
сопропорционирования:
Cu + CuO → Cu2O
CuCl2 + Cu → 2CuCl
• ОКИСЛИТЕЛЬНЫЕ СВОЙСТВА:
Медный купорос
CuSO4*5H2O
2CuSO4 + 4KI → 2CuI↓ + I2 + 2K2SO4
2CuSO4 + Na2SO3 + 2H2O → Cu2O↓ + Na2SO4 + 2H2SO4
• СОВМЕСТНЫЙ ГИДРОЛИЗ:
2CuSO4 + 2Na2CO3 + H2O → (CuOH)2CO3↓ + 2Na2SO4 + CO2
12. Качественная реакция на ион меди:
КАЧЕСТВЕННАЯ РЕАКЦИЯ НА ИОН МЕДИ:• Взаимодействие солей меди (II) с щелочами –
образование голубого студенистого осадка:
CuSO4 + 2NaOH → Cu(OH)2 ↓ + Na2SO4
• Соли меди (II) окрашивают
пламя в зеленый цвет.
13. Применение
ПРИМЕНЕНИЕ• ИЗГОТОВЛЕНИЕ ЭЛЕКТРИЧЕСКИХ ПРОВОДОВ И КАБЕЛЕЙ;
• В ТЕПЛООБМЕННОЙ АППАРАТУРЕ;
• В МЕТАЛЛУРГИИ ДЛЯ ПОЛУЧЕНИЯ СПЛАВОВ: БРОНЗЫ, ЛАТУНИ, МЕЛЬХИОРА;
• В РАДИОЭЛЕКТРОНИКЕ;
• МЕДНЫЙ КУПОРОС – ПРИ КРАШЕНИИ ТКАНЕЙ, В КАЧЕСТВЕ ПЕСТИЦИДА;
• ВАЖНЫЙ МИКРОЭЛЕМЕНТ В ЖИВЫХ ОРГАНИЗМАХ.











 chemistry
chemistry








