Similar presentations:
Areny_2024_YpVjF7
1.
АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ. ОДНОЯДЕРНЫЕАРЕНЫ
Термин «ароматические» первоначально применяли для органических соединений,
которые или сами имели приятный запах, или же выделялись из природных
веществ, обладающих приятным запахом. В дальнейшем название сохранилось за
большой группой органических соединений, проявляющих сходные с бензолом
свойства.
К ароматическим углеводородам относят соединения, молекулы которых содержат
одно или несколько бензольных колец.
В зависимости от числа бензольных циклов, входящих в состав молекулы,
различают одноядерные (моноциклические) и многоядерные (полициклические)
арены. Многоядерные арены подразделяются на арены с конденсированными
циклами (аннелированные) и изолированными циклами.
2.
ОДНОЯДЕРНЫЕ АРЕНЫ. СТРОЕНИЕ БЕНЗОЛА. АРОМАТИЧНОСТЬПростейшим представителем одноядерных ароматических углеводородов является
бензол С6Н6. Впервые бензол был получен Майклом Фарадеем в 1825 году из
конденсированных остатков светильного газа, образующегося в процессе переработки
каменного угля. Однако строение его молекулы в течение многих лет оставалось для
химиков загадкой. Несмотря на то что формула С6Н6 предполагает достаточно
выраженный не насыщенный характер, бензол, в отличие от непредельных
соединений, оказался относительно инертным веществом. Так, он сравнительно
устойчив к нагреванию и действию окислителей, практически не вступает в
характерные для ненасыщенных соединений реакции присоединения. Напротив, для
бензола более характерными оказались не свойственные непредельным
соединениям реакции замещения. Составу С6Н6 приписывались разные структурные
формулы, но все они не объясняли в полной мере химических свойств бензола.
Важным этапом в установлении строения бензола явилась высказанная немецким
химиком Фридрихом Августом Кекуле идея о циклическом строении его молекулы. В
1865 году Кекуле предложил формулу в виде цикла из шести атомов углерода с
чередующимися простыми и двойными связями. Эта формула известна в
органической химии как формула Кекуле:
3.
Формула Кекуле предполагает равноценность всех атомов углерода в молекуле, чтопозже было подтверждено исследованиями Альберта Ладенбурга (1874) и Эдуарда
Вроблевского (1878). Вместе с тем в соответствии с формулой Кекуле бензол должен
иметь два 1,2-дизамещенных изомера:
4.
Немецкий химик-органик. Научные интересы —теоретическая органическая химия и органический
синтез. Предложил циклическую структурную
формулу бензола (1865). Синтезировал
тиоуксусную (1854), гликолевую (1856) кислоты,
трифенилметан (1872), антрахинон (1878).
Предложил методы синтеза тиофена. Высказал
(1857) мысль о валентности как о целом числе
единиц сродства, которым обладает атом.
Президент Немецкого химического общества (1878,
1886, 1891)
5.
Правильно отражая некоторые свойства бензола, формула Кекуле тем не менее несогласовывалась с рядом установленных фактов. По-прежнему оставалось неясным,
почему при наличии в молекуле трех двойных связей бензол проявляет значительную
инертность в реакциях присоединения и гораздо более склонен к реакциям
замещения, почему он устойчив к нагреванию и действию окислителей. Все это
возвращало химиков к пересмотру структуры бензола. В соответствии с
современными представлениями, основанными на данных квантовой химии и физикохимических исследований, молекула бензола представляет собой правильный
плоский шестиугольник. Все углеродные атомы находятся в состоянии sp2гибридизации. Каждый атом углерода образует три σ-связи (одну С—Н и две С—С),
лежащие в одной плоскости под углом 120° друг к другу (рис. 14.1, а) и предоставляет
одну p-орбиталь для образования замкнутой сопряженной системы, электронная
плотность которой равномерно распределена (делокализована) между углеродными
атомами и сконцентрирована в основном над и под плоскостью σ-скелета молекулы
(рис. 14.1, б)
6.
7.
Образование замкнутой сопряженной системы (ароматического секстета)является для молекулы бензола энергетически выгодным процессом.
Экспериментально установлено, что сопряжение в цикле приводит к
уменьшению энергии на 150,7 кДж/моль, то есть реально бензол оказался на
150,7 кДж/моль стабильнее, чем это можно было предположить, исходя из
формулы Кекуле. Разность энергий реального состояния молекулы бензола и
рассчитанной для гипотетической структуры — 1,3,5-циклогексатриена
составляет энергию сопряжения, или энергию резонанса, и является причиной
высокой устойчивости молекулы. С позиций теории молекулярных орбиталей
при перекрывании шести p-атомных орбиталей образуется шесть πмолекулярных орбиталей, из которых три — связывающие, а три —
разрыхляющие π-МО. Каждая МО характеризуется определенной энергией и
может быть заполнена двумя электронами с антипараллельными спинами. В
основном состоянии шесть π-электронов занимают три связывающие π-МО,
которые обладают более низкой энергией. Высокоэнергетичные разрыхляющие
π*-МО остаются незаполненными (рис. 14.2).
8.
Рис. 2. Энергетические уровни шести π-молекулярных орбиталей бензола и схематическое изображение трех связывающих π-МО(π1, π2 и π3)
9.
Повышенная устойчивость молекулы бензола определяется энергией низшей π1МО, в которой π-электронное облако охватывает все углеродные атомы цикла(рис. 2). В результате сопряжения все углерод-углеродные связи в молекуле
бензола выравнены. Таким образом, в бензольном кольце нет простых и двойных
связей. На каждую углерод-углеродную связь, помимо двух σ-электронов,
приходится электронная плотность одного π-электрона. Такую связь называют
ароматической. Если длина простой связи C—C в алканах составляет 0,154 нм,
длина двойной связи в алкенах — 0,134 нм, то длина углерод-углеродной связи в
молекуле бензола рав на 0,139 нм, то есть является промежуточной между длиной
одинарной и двойной связи. Делокализация π-электронной плотности и
выравненность связей в бензольном кольце графически изображается в виде
окружности внутри правильного шестиугольника:
10.
Однако наряду с таким изображением в химии широко используется и формула Кекуле,которая особенно удобна для описания механизмов реакций. Но, применяя формулу
Кекуле, необходимо подразумевать делокализацию π-электронной плотности и
выравненность связей в бензольном кольце. Совокупность специфических свойств
бензола, а именно высокая стабильность, инертность в реакциях присоединения и
склонность к реакциям замещения, получила общее название «ароматичность», или
«ароматические свойства». В 1931 году немецкий ученый Эрих Хюккель на основе
квантово-химических расчетов с помощью метода МО сформулировал правило
стабильности циклических сопряженных систем, которое представляет собой
теоретически обоснованный метод, позволяющий предсказать, будет ли циклическая
сопряженная система ароматической или нет. Согласно правилу Хюккеля критерием
ароматичности органического соединения является наличие в его структуре плоского
цикла, содержащего замкнутую сопряженную систему, включающую (4n + 2) πэлектронов, где n = 0,1,2,3 и т. д. К наиболее распространенным ароматическим
системам, содержащим 6π-электронов (n = 1), относится бензол и его производные.
Правило Хюккеля применимо и к системам с конденсированными ядрами, такими как
нафталин, антрацен и фенантрен:
11.
СПОСОБЫ ПОЛУЧЕНИЯ. Природные источникиОсновными природными источниками ароматических углеводородов являются нефть и
каменный уголь. Получение из нефти. В сырой нефти содержится небольшое количество
ароматических углеводородов. Поэтому с целью увеличения их массовой доли нефть
подвергают так называемой ароматизации, то есть нагревают при высокой температуре
и давлении в присутствии катализаторов. При этом протекают процессы
дегидрирования, изомеризации и циклизации. Ниже приведены схемы некоторых
типичных реакций:
В результате ароматизации исходное сырье, содержащее около 10 % аренов и 65 % алканов, превращается в
продукт, включающий 50—65 % аренов. Важный вклад в изучение процессов, протекающих при ароматизации
нефти, внесли известные ученые Н.Д. Зелинский, Б.А. Казанский, А.Ф. Платэ и др.
12.
Получение из каменного угля.При нагревании каменного угля без доступа воздуха до 1000—1300 °С образуется
кокс, коксовый газ и каменноугольная смола. В 1 м3 коксового газа содержится около
30 г бензола и 10 г толуола. Каменно-угольная смола представляет собой сложную
смесь органических соединений. Подвергая ее фракционной перегонке, получают
одноядерные ароматические углеводороды (бензол, толуол, ксилолы), многоядерные
арены (нафталин, антрацен), фенолы, гетероциклические соединения и др. Всего из
каменноугольной смолы выделено свыше 120 индивидуальных веществ.
13.
Синтетические методы полученияЦиклотримеризация алкинов. При нагревании в присутствии активированного угля или
комплексных никельорганических катализаторов алкины образуют бензол и его
гомологи.
Взаимодействие смеси алкил- и арилгалогенидов с металлическим натрием (реакция
Вюрца—Фиттига). При обработке металлическим натрием смеси галогеналканов и
галогенаренов образуются гомологи бензола:
14.
ХИМИЧЕСКИЕ СВОЙСТВАРеакционная способность бензола и его гомологов определяется, главным об
разом, наличием в структуре замкнутой π-электронной системы, которая
является областью повышенной электронной плотности молекулы и способна
притягивать положительно заряженные частицы — электрофилы. Поэтому
ароматические углеводороды, как и алкены, обладают нуклеофильным
характером. Однако арены, в отличие от ненасыщенных соединений, при
взаимодействии с электрофильными реагентами более склонны не к
реакциям присоединения, а замещения, поскольку при этом сохраняется
их ароматическая система. Эти реакции называют реакциями
электрофильного замещения SЕ.
Реакции присоединения для аренов менее характерны, так как они приводят
к нарушению ароматичности. С трудом вступают ароматические
углеводороды и в реакции окисления.
Для ароматических соединений наиболее
типичны реакции электрофильного замещения!
15.
РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ (SЕ)Бензол и его гомологи сравнительно легко вступают в реакции электрофильного
замещения. Электрофильная частица, атакующая π-электронную систему
бензольного кольца, может быть представлена положительно заряженным ионом
Е+ или частью нейтральной молекулы, имеющей центр с пониженной электронной
плотностью Е δ+ ->Х δ-. Образование электрофильных частиц для участия в реакции
возможно различными способами — под действием π-электронной системы
бензольного кольца, катализатора, растворителя и др. Несмотря на большое
разнообразие электрофильных реагентов и ароматических систем, подавляющее
большинство реакций электрофильного замещения в ароматическом ряду
рассматривается в рамках единого общего механизма. При атаке электрофильной
частицей π-электронной системы бензольного кольца сначала в результате
электростатического взаимодействия образуется не устойчивый π-комплекс:
16.
π-Комплекс представляет собой координационное соединение, в котором бензольноекольцо является донором электронов, а электрофил — акцептором. Образование πкомплекса является быстрой и обратимой стадией реакции. Ароматичность
бензольного кольца при этом не нарушается. Во многих случаях π-комплекс удалось
обнаружить при помощи электронных спектров поглощения. Поглощая некоторое
количество энергии, π-комплекс превращается затем в σ-комплекс (карбокатион). В
отличие от π-комплекса, в σ-комплексе электрофильная частица образует ковалентную
связь с одним из атомов углерода бен зольного кольца за счет двух его π-электронов.
При этом происходит нарушение ароматической системы бензольного цикла, так как
один из атомов углерода переходит из состояния sp2- в состояние sp3-гибридизации.
Оставшиеся четыре π-электрона бензольного кольца делокализованы между пятью
атомами углерода. Строение σ-комплекса можно представить в виде резонансного
гибрида структур I, II, III, но чаще его изображают структурой IV:
17.
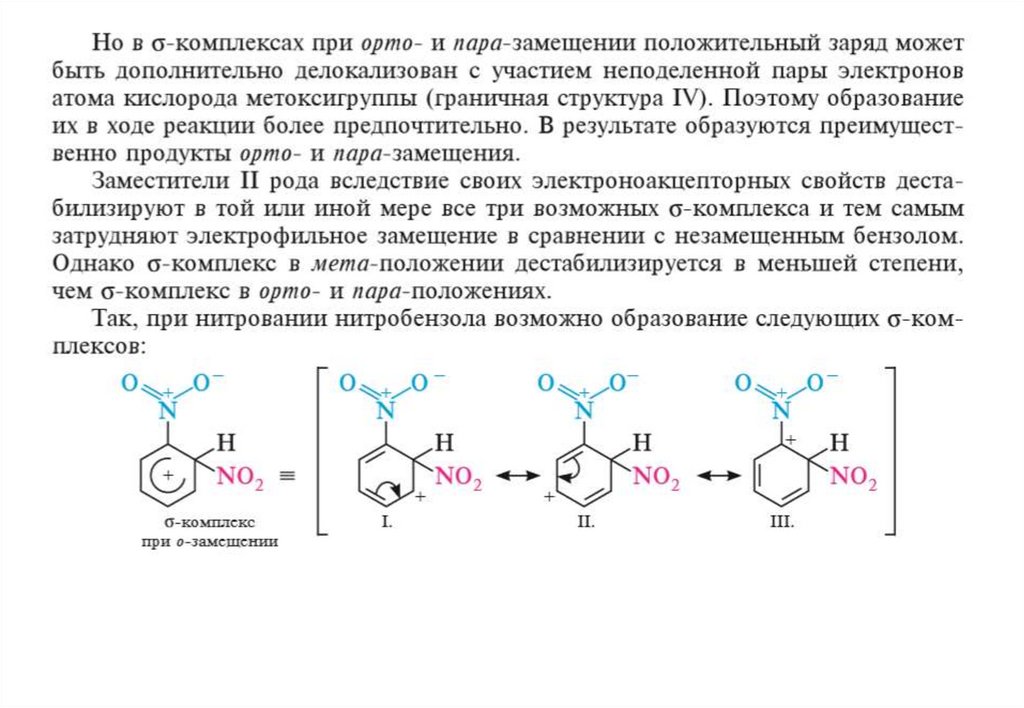
Образование σ-комплекса является наиболее высокоэнергетичной стадией реакции,определяющей скорость всего процесса. Протекание электрофильного замещения
через стадию σ-комплекса подтверждено многочисленными исследованиями. В
некоторых случаях σ-комплекс удалось обнаружить спектральными методами и
даже выделить в кристаллическом виде. Несмотря на относительную стабильность
σ-комплекса за счет распределения положительного заряда между пятью атомами
углерода, он значительно менее устойчив, чем структуры с ароматическим
секстетом электронов. Стремясь к дальнейшей стабилизации, σ-комплекс
отщепляет протон от атома углерода, связанного с электрофилом, и тем самым
восстанавливает ароматичность бензольного кольца:
Восстановление ароматической структуры дает выигрыш энергии, равный 42 кДж/моль.
К наиболее важным реакциям электрофильного замещения в бензольном
ядре относятся реакции нитрования, сульфирования, галогенирования,
алкилирования и ацилирования.
18.
19.
20.
21.
Под действием катализатора, на атоме металла которого имеется дефицитэлектронной плотности, молекула галогена поляризуется. Атакующей электрофильной
частицей в этом случае служит либо комплекс поляризованной молекулы галогена с
кислотой Льюиса, либо катион галогена, образующийся в процессе ионизации данного
комплекса:
22.
23.
Молекулярный йод, в сравнении с хлором и бромом, является слабымгалогенирующим агентом. При взаимодействии йода с бензолом равновесие реакции
практически полностью смещено в сторону исходных веществ:
Поэтому прямое йодирование аренов проводят йодом в присутствии окислителей,
таких как HNO3 или HgO. Роль окислителя состоит в связывании образующегося
йодоводорода:
24.
Для алкилирования аренов, помимо галогеналканов, могут быть использованы спиртыи алкены. Реакции с участием спиртов протекают в присутствии кислот Льюиса или
минеральных кислот (H3PO4, H2SO4):
25.
26.
27.
28.
29.
30.
31.
32.
33.
34.
35.
36.
37.
38.
39.
40.
41.
42.
43.
НАФТАЛИН44.
45.
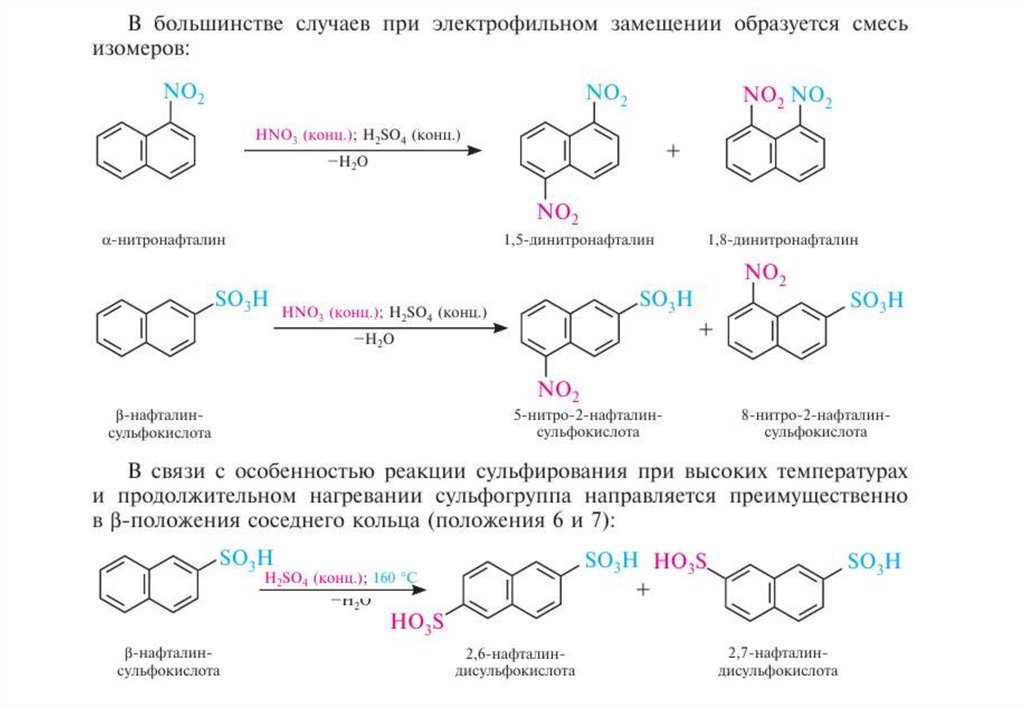
Способы полученияНафталин, его монометильные и некоторые диметильные производные в
промышленности получают, главным образом, из каменноугольной смолы (содержание
нафталина в каменноугольной смоле составляет около 10 %)
46.
Строение нафталина47.
48.
химические свойства49.
50.
Алкилирование и ацилирование.В присутствии кислот Льюиса (AlCl3, SnCl4 и др.) нафталин взаимодействует с
галогеналканами и галогенангидридами карбоновых кислот с образованием смеси
α- и β-замещенных изомеров
51.
52.
53.
54.
ориентация замещения в нафталиновом ядре55.
56.
57.
58.
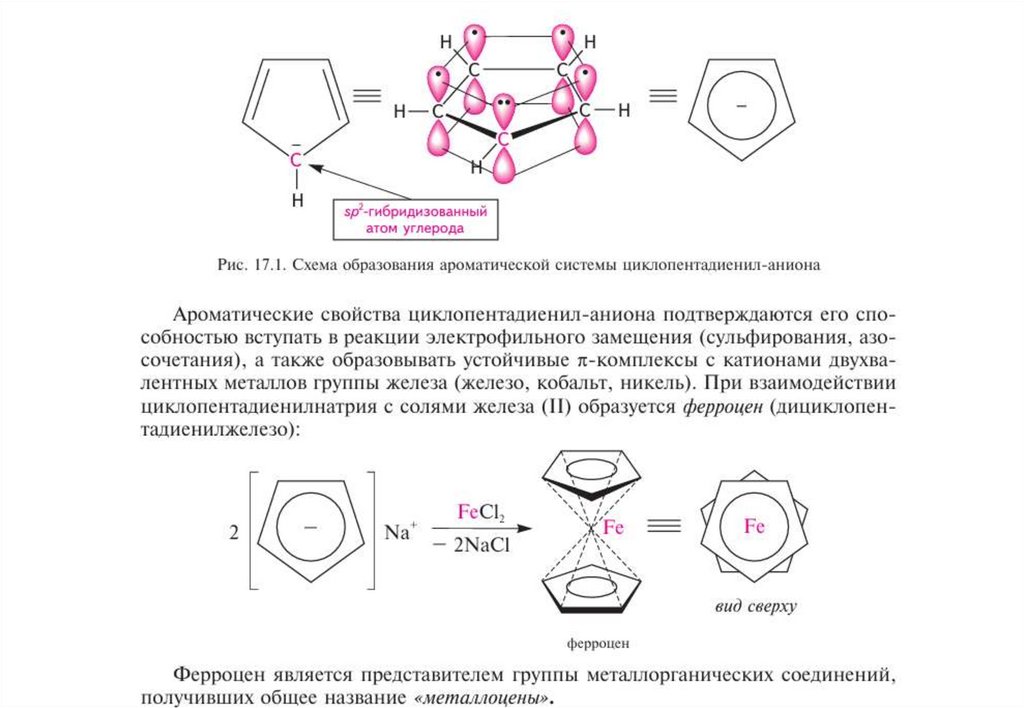
циклопентадиенил-анион59.
60.
61.
62.
АЗУЛЕНАзулен представляет собой бициклическую конденсированную систему, со стоящую
из циклопентадиенового и циклогептатриенового колец. Молекула азулена имеет
биполярное строение — атомы углерода пятичленного цикла несут частичный
отрицательный, а семичленного — частичный положительный заряд :
Образование биполярной структуры обусловлено стремлением каждого коль ца иметь
ароматический секстет p-электронов. Такая возможность появляется при переходе
одного электрона из семичленного цикла в пятичленный, вслед ствие чего пятичленное
кольцо приобретает отрицательный заряд, а семичленное — положительный. Поэтому
азулен можно рассматривать как конденсированную систему, со стоящую из
циклопентадиенил-аниона и тропилий-катиона. Азулен обладает ароматичностью.
Ароматический характер азулена проявляется в склонности к реакциям
электрофильного замещения (галогенирование, нитрование, сульфирование,
ацилирование), которые протекают по пятичленному кольцу в положениях 1 или 1 и 3.
При нагревании азулен изомеризуется в нафталин:




























































 chemistry
chemistry








