Similar presentations:
Презентация по химии _Строение электронных оболочек атомов. Квантовые числа_
1. Квантовые числа
Бочкарева Алла АлександровнаЛ_5_2
КВАНТОВЫЕ ЧИСЛА
24.11.2025
1
2.
Состояние электрона в атоме определяетсянабором 4-х чисел, которые называются
квантовыми.
n-главное квантовое число
Определяет номер
энергетического уровня
n=1, 2, 3, 4,…, кроме 0
24.11.2025
2
3.
l-побочное (орбитальное) квантовоечисло
Определяет форму электронного облака
в пространстве
l=0, 1, 2, 3, … (n-1)
0 - s-облако
1 - p-облако
24.11.2025
2 - d-облако
3 - f-облако
3
4.
m-магнитное квантовое числоОпределяет направленность
электронного облака в
пространстве
m=-l,…-2, -1, 0, +1, +2, … +l
24.11.2025
4
5.
s-спиновое квантовое числоОпределяет спин электрона,
т.е.вращательный момент
s=-1/2, +1/2
24.11.2025
5
6.
Электроны заселяют орбитали в соответствие соследующими правилами:
Принцип наименьшей энергии
электроны заполняют атомные орбитали,
начиная с подуровня с меньшей энергией.
Заполнение орбиталей происходит в следующем порядке:
1s<2s<2p<3s<3p<4s<3d<4p<5s≈4d<5p<6s≈
4f≈5d<6p<7s≈5f≈6d<7p
24.11.2025
6
7.
Правило КлечковскогоКлечковский Всеволод
Маврикиевич
(28.11.1900 -2.05.1972)
Советский агрохимик. Впервые организовал широкие экспериментальные
исследования питания растений с применением радиоактивных изотопов.
Ввел правила формирования электронных конфигураций атомов по мере
роста заряда ядра.
24.11.2025
7
8.
Правило Клечковского(правило последовательности заселения
электронных орбиталей или (n+l)-правило)
сначала заселяются орбитали с меньшим
значением суммы главного и побочного
квантовых чисел
Атом К :
для 4s –подуровня: n=4, l=0, n+l=4+0=4,
для 3d-подуровня: n=3, l=2, n+l=3+2=5
24.11.2025
8
9.
Принцип ПаулиВ атоме не может быть двух электронов
с одинаковым набором четырёх квантовых
чисел
Нобелевская премия (1945 г.)
«За открытие принципа запрета,
который называют также принципом
запрета Паули".
Вольфганг Паули
(25.04.1890 –
15.12.1958)
24.11.2025
9
10.
Принцип Паулив любой многоэлектронной системе не
может быть больше одного электрона с
одинаковым набором квантовых чисел
или
на каждой орбитали может быть лишь
два электрона с антипараллельными
спинами
24.11.2025
10
11.
Правило Хунда (1927 )При заполнении орбиталей
суммарный спин должен
быть максимальным
Вольфганг Хунд
(1896-1986)
+ 0.5
- 0.5
+ 1.5
Немецкий физик-теоретик.
Один из создателей метода
молекулярных орбиталей (МО) для
описания химической связи.
Изучал магнетизм, атомные и
молекулярные спектры
24.11.2025
11
12.
Правило ГундаПри наличии орбиталей с одинаковой
энергией каждая орбиталь заселяется
вначале одним электроном
Количество неспаренных электронов
должно быть максимальным
24.11.2025
12
13.
24.11.202513
14.
Рефлексия1. Охарактеризовать состояние каждого
электрона в атоме кислорода.
2. Сравнить строение атома и иона хлора.
3. Атом элемента имеет на 6 электронов
больше, чем ион магния. Назовите
элемент, составьте электронную формулу
его атома и иона.
24.11.2025
14
15.
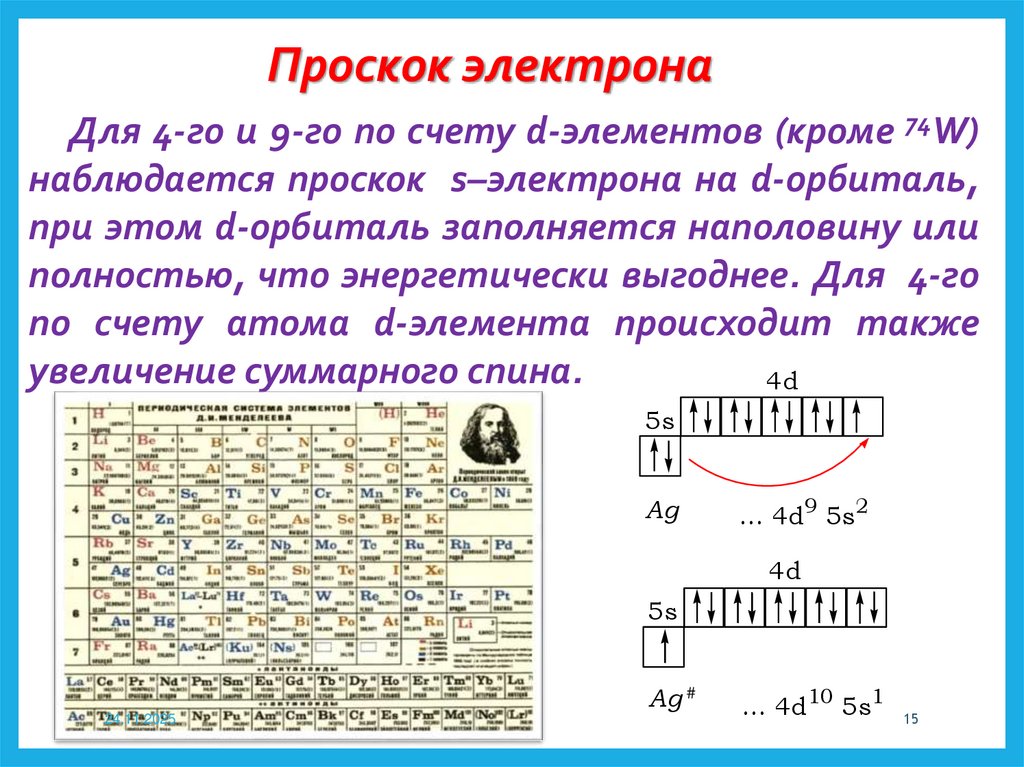
Проскок электронаДля 4-го и 9-го по счету d-элементов (кроме 74W)
наблюдается проскок s–электрона на d-орбиталь,
при этом d-орбиталь заполняется наполовину или
полностью, что энергетически выгоднее. Для 4-го
по счету атома d-элемента происходит также
увеличение суммарного спина.
4d
5s
Ag
... 4d9 5s2
4d
5s
Ag #
24.11.2025
... 4d10 5s1
15
16.
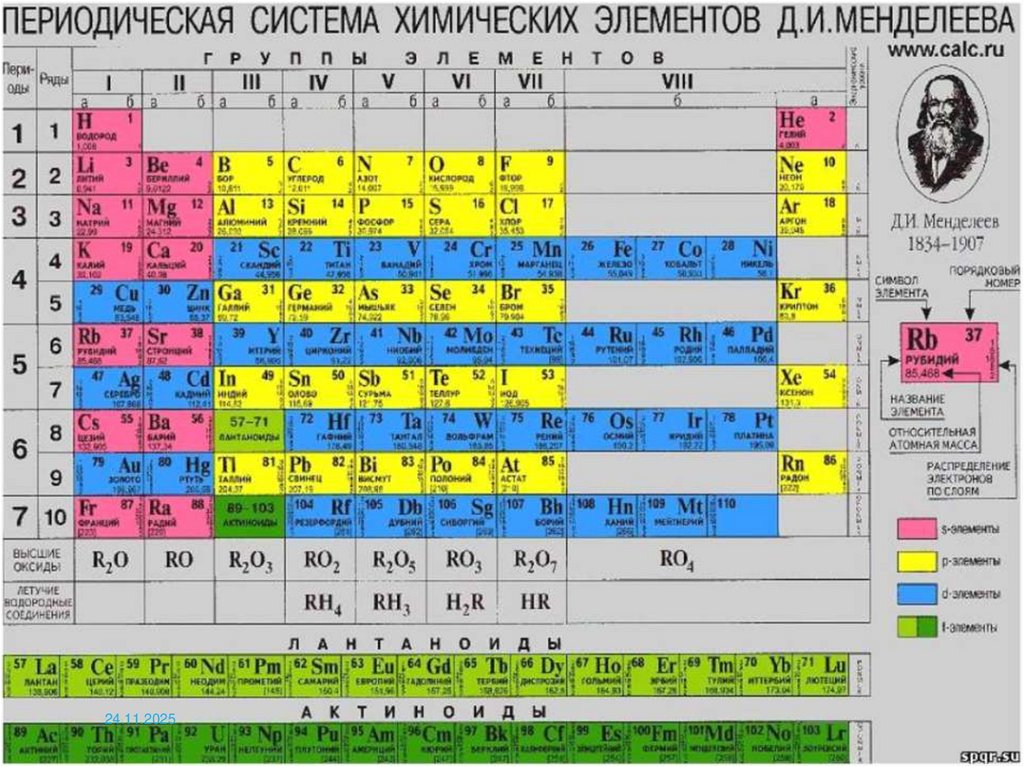
Поиск элементов в ПТ по состояниюэлектронов в атоме
s, p n
d n+1
f n+2
g n+3
h n+4
S- и p-элементы ищем
энергетического уровня;
в
периоде,
совпадающем
с
номером
d-элементы – в (n+1) периоде;
f-элементы - в (n+2) периоде и т.д.
24.11.2025
16
17.
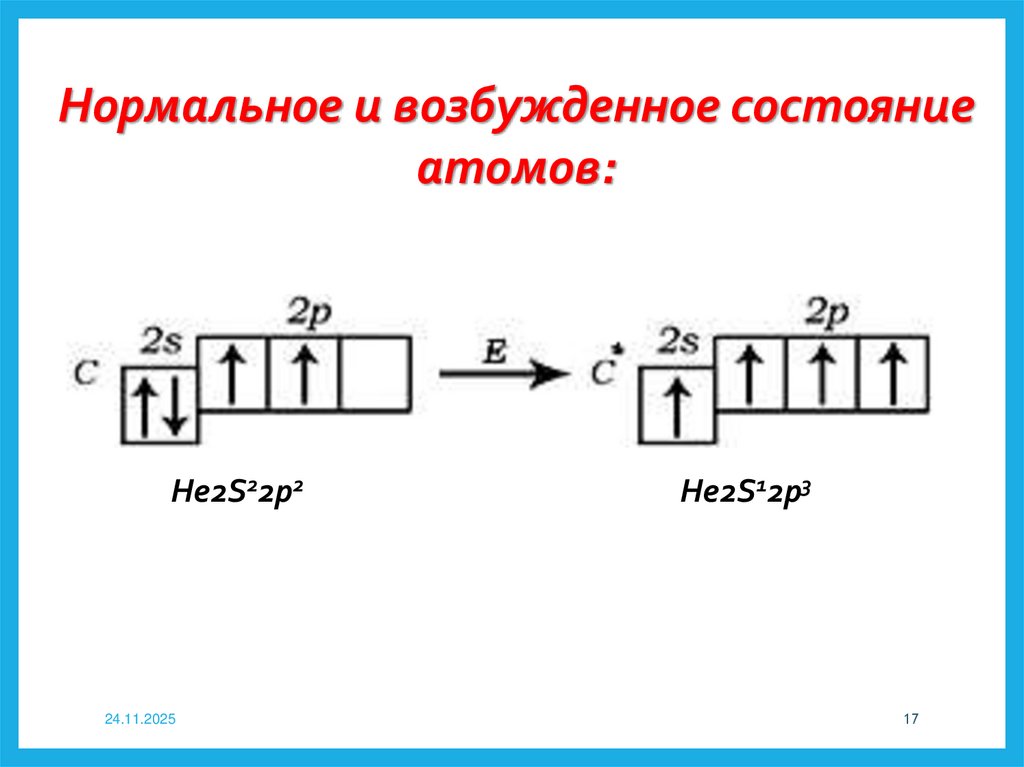
Нормальное и возбужденное состояниеатомов:
He2S22p2
24.11.2025
He2S12p3
17
18.
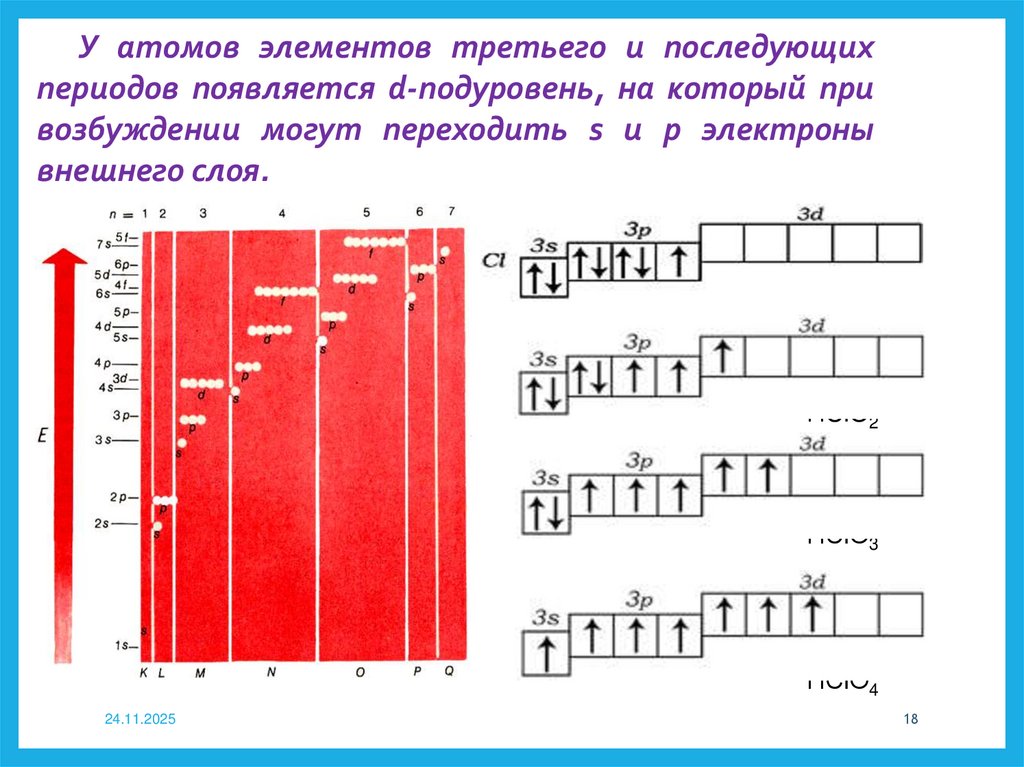
У атомов элементов третьего и последующихпериодов появляется d-подуровень, на который при
возбуждении могут переходить s и р электроны
внешнего слоя.
НClO
НClO2
НСlО3
НСlО4
24.11.2025
18














 chemistry
chemistry








