Similar presentations:
1_ФГОС_Сера
1.
Кто такиеО2
алькогены?
Кислород из атмосферы,
двое «редких» братьев, сера,
И полоний несомненно…
сера
селен
теллур
2.
§13. Сера.3.
Цель урока:Формирование умений характеризовать аллотропные
видоизменения серы, ее химические свойства,
биологическую роль и области применения
Проблемный вопрос урока:
Какими особыми свойствами обладает простое вещество
сера? Каково биологическое значение серы? Где она
применяется?
4.
Исторические сведенияСера известна людям очень давно. Она считалась наиболее совершенным
выразителем одного из «основных начал» природы – горючести.
Месторождения этого желтого горючего вещества разрабатывались греками
и римлянами, особенно в Сицилии.
С помощью серы люди защищались от врагов-завоевателей. При обороне
крепостей от неприятеля на головы осаждавших выливали расплавленную
серу.
Сера вместе с селитрой, смолой и нефтью входила в состав древней
зажигательной смеси – «греческого огня», который применялся и на суше и в
морских сражениях.
Позднее оказалось, что сера – важная составная часть пороха . Немецкий
химик и металлург Георгиус Агриколла (1494 – 1555) указывал, «что сера
входит в состав ужасного изобретения – порошка, который может метать
далеко вперед куски железа, бронзы или камня – орудие войны нового типа».
5.
Общая характеристика халькогеновпериод
группа
VI A группа
8
О
2 кислород
Химические элементы ─ халькогены,
Краткая характеристика:
в подгруппе халькогенов с ростом порядкового
номера:
1. Заряд ядра (Z); увеличивается:
2. количества электронов на внешнем слое;
15,9994
3
4
5
6
S
16
3. радиус атома, нм;
сера
32,06
0,066
O
Se
34
селен
78,96
Te
52
теллур
127,6
Po
84
полоний [209]
0,104
S
0,117
Se
0,137
Te
4. прочность связи валентных электронов
с ядром;
5. электроотрицательность (ЭО);
ЭО
3,44
O
2,58
S
2,55
Se
6. неметаллические свойства;
7. окислительные свойства;
2,1
Te
2
Po
6.
Общая характеристика халькогеновпериод
группа
VI A группа
8
О
2 кислород
15,9994
3
4
5
6
S
Химические элементы ─ халькогены,
Краткая характеристика:
в подгруппе халькогенов с ростом порядкового
номера:
1. Заряд ядра (Z); увеличивается:
2. количества электронов на внешнем слое;
не изменяется
16
3. радиус атома, нм;
сера
32,06
0,066
O
Se
34
селен
78,96
Te
52
теллур
127,6
Po
84
полоний [209]
0,104
S
0,117
Se
0,137
Te
4. прочность связи валентных электронов
с ядром;
5. электроотрицательность (ЭО);
ЭО
3,44
O
2,58
S
2,55
Se
6. неметаллические свойства;
7. окислительные свойства;
2,1
Te
2
Po
7.
Общая характеристика халькогеновпериод
группа
VI A группа
8
О
2 кислород
15,9994
3
4
5
6
S
Химические элементы ─ халькогены,
Краткая характеристика:
в подгруппе халькогенов с ростом порядкового
номера:
1. Заряд ядра (Z); увеличивается:
2. количества электронов на внешнем слое;
не изменяется
16
3. радиус атома, нм;
сера
32,06
0,066
O
Se
34
селен
78,96
Te
52
теллур
127,6
Po
84
полоний [209]
0,104
S
0,117
Se
увеличивается:
0,137
Te
4. прочность связи валентных электронов
с ядром;
5. электроотрицательность (ЭО);
ЭО
3,44
O
2,58
S
2,55
Se
6. неметаллические свойства;
7. окислительные свойства;
2,1
Te
2
Po
8.
Общая характеристика халькогеновпериод
группа
VI A группа
8
О
2 кислород
15,9994
3
4
5
6
S
Химические элементы ─ халькогены,
Краткая характеристика:
в подгруппе халькогенов с ростом порядкового
номера:
1. Заряд ядра (Z); увеличивается:
2. количества электронов на внешнем слое;
не изменяется
16
3. радиус атома, нм;
сера
32,06
0,066
O
Se
34
селен
78,96
Te
52
теллур
127,6
Po
84
полоний [209]
0,104
S
0,117
Se
увеличивается:
0,137
Te
4. прочность связи валентных электронов
с ядром; уменьшается:
5. электроотрицательность (ЭО);
ЭО
3,44
O
2,58
S
2,55
Se
6. неметаллические свойства;
7. окислительные свойства;
2,1
Te
2
Po
9.
Общая характеристика халькогеновпериод
группа
VI A группа
8
О
2 кислород
15,9994
3
4
5
6
S
Химические элементы ─ халькогены,
Краткая характеристика:
в подгруппе халькогенов с ростом порядкового
номера:
1. Заряд ядра (Z); увеличивается:
2. количества электронов на внешнем слое;
не изменяется
16
3. радиус атома, нм;
сера
32,06
0,066
O
Se
34
селен
78,96
Te
52
теллур
127,6
Po
84
полоний [209]
0,104
S
0,117
Se
увеличивается:
0,137
Te
4. прочность связи валентных электронов
с ядром; уменьшается:
5. электроотрицательность (ЭО); уменьшается:
ЭО
3,44
O
2,58
S
2,55
Se
6. неметаллические свойства;
7. окислительные свойства;
2,1
Te
2
Po
10.
Общая характеристика халькогеновпериод
группа
VI A группа
8
О
2 кислород
15,9994
3
4
5
6
S
Химические элементы ─ халькогены,
Краткая характеристика:
в подгруппе халькогенов с ростом порядкового
номера:
1. Заряд ядра (Z); увеличивается:
2. количества электронов на внешнем слое;
не изменяется
16
3. радиус атома, нм;
сера
32,06
0,066
O
Se
34
селен
78,96
Te
52
теллур
127,6
Po
84
полоний [209]
0,104
S
0,117
Se
увеличивается:
0,137
Te
4. прочность связи валентных электронов
с ядром; уменьшается:
5. электроотрицательность (ЭО); уменьшается:
ЭО
3,44
O
2,58
S
2,55
Se
2,1
Te
2
Po
6. неметаллические свойства; уменьшаются:
7. окислительные свойства;
11.
Общая характеристика халькогеновпериод
группа
VI A группа
8
О
2 кислород
15,9994
3
4
5
6
S
Химические элементы ─ халькогены,
Краткая характеристика:
в подгруппе халькогенов с ростом порядкового
номера:
1. Заряд ядра (Z); увеличивается:
2. количества электронов на внешнем слое;
не изменяется
16
3. радиус атома, нм;
сера
32,06
0,066
O
Se
34
селен
78,96
Te
52
теллур
127,6
Po
84
полоний [209]
0,104
S
0,117
Se
увеличивается:
0,137
Te
4. прочность связи валентных электронов
с ядром; уменьшается:
5. электроотрицательность (ЭО); уменьшается:
ЭО
3,44
O
2,58
S
2,55
Se
2,1
Te
2
Po
6. неметаллические свойства; уменьшаются:
7. окислительные свойства;
уменьшаются:
12.
периодгруппа
VI A группа
+8
8
O
2
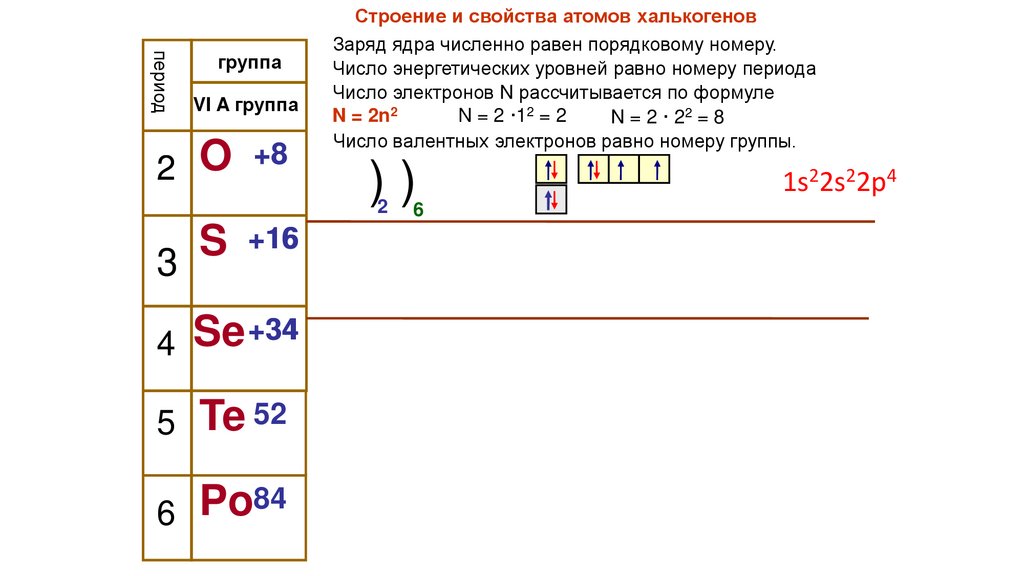
Строение и свойства атомов халькогенов
Заряд ядра численно равен порядковому номеру.
Число энергетических уровней равно номеру периода
Число электронов N рассчитывается по формуле
N = 2n2
N = 2 ·12 = 2
N = 2 · 22 = 8
Число валентных электронов равно номеру группы.
))
2
+16
16
S
3
+34
34
Se
4
5 Te 52
84
Po
6
6
1s22s22p4
13.
периодгруппа
VI A группа
+8
8
O
2
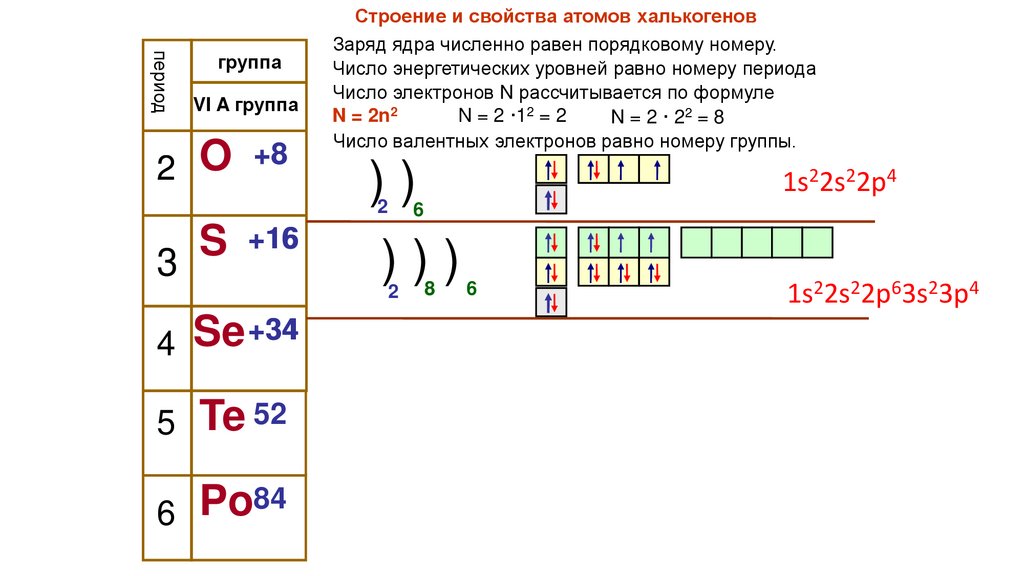
Строение и свойства атомов халькогенов
Заряд ядра численно равен порядковому номеру.
Число энергетических уровней равно номеру периода
Число электронов N рассчитывается по формуле
N = 2n2
N = 2 ·12 = 2
N = 2 · 22 = 8
Число валентных электронов равно номеру группы.
))
2
+16
16
S
3
5 Te 52
84
Po
6
6
)))
2
+34
34
Se
4
1s22s22p4
8
6
1s22s22p63s23p4
14.
Сера – химический элемент1.Положение серы в ПСХЭ Д.И.Менделеева
2.Строение атома
3.Сравнение строения атома кислорода и серы
4.Нахождение серы в природе
15.
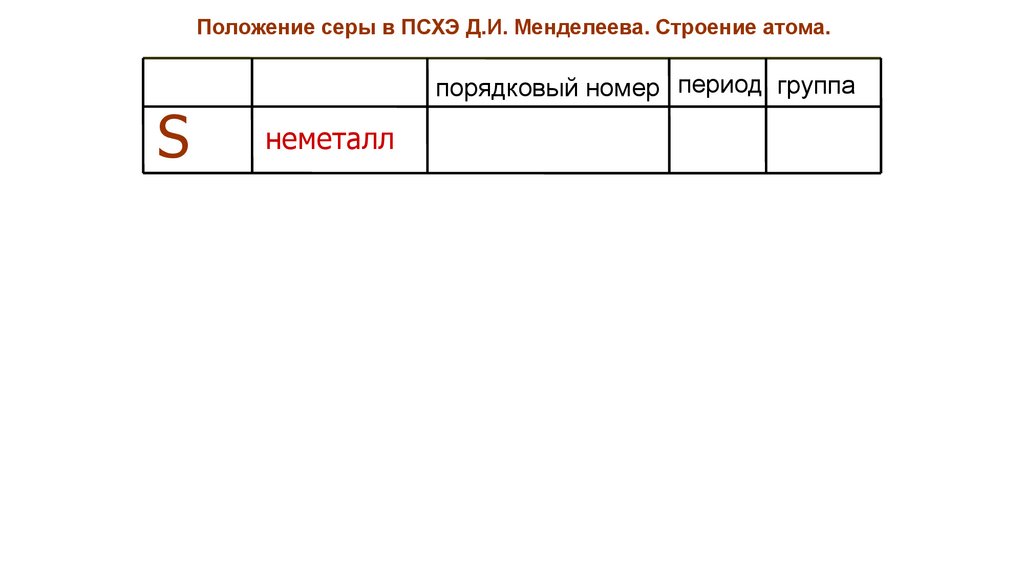
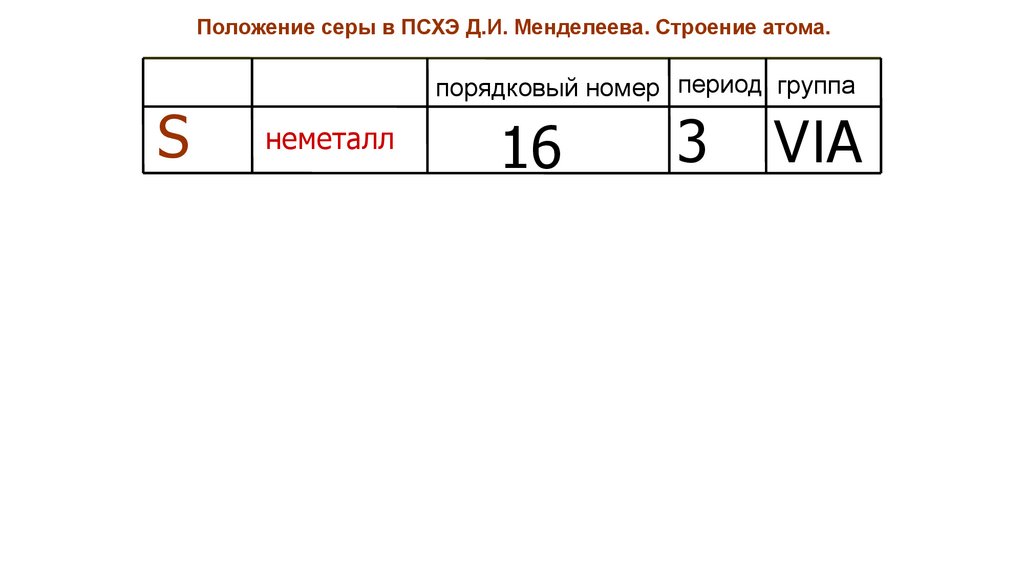
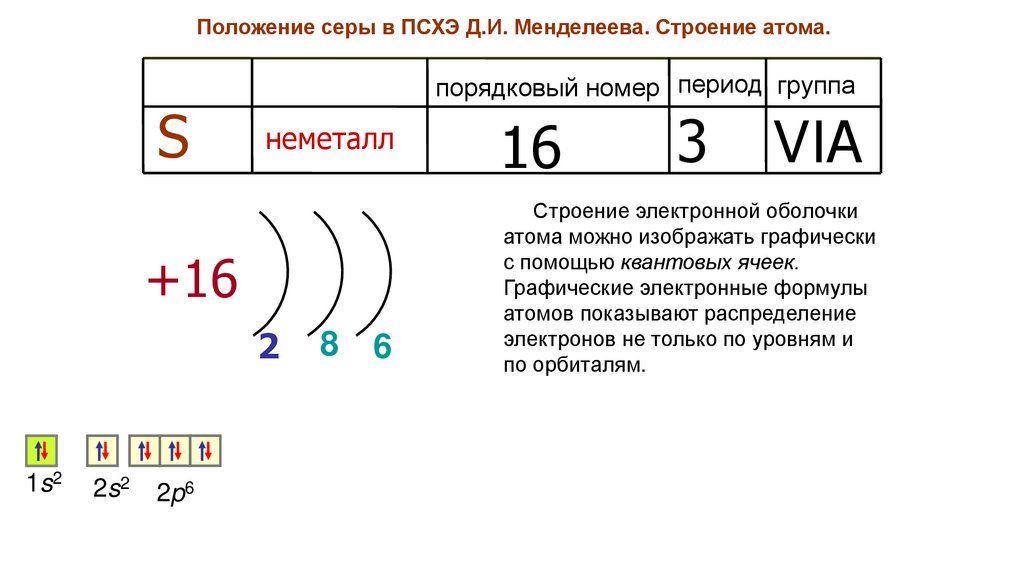
Положение серы в ПСХЭ Д.И. Менделеева. Строение атома.S
порядковый номер период группа
неметалл
16.
Положение серы в ПСХЭ Д.И. Менделеева. Строение атома.S
порядковый номер период группа
неметалл
16
3
VIA
17.
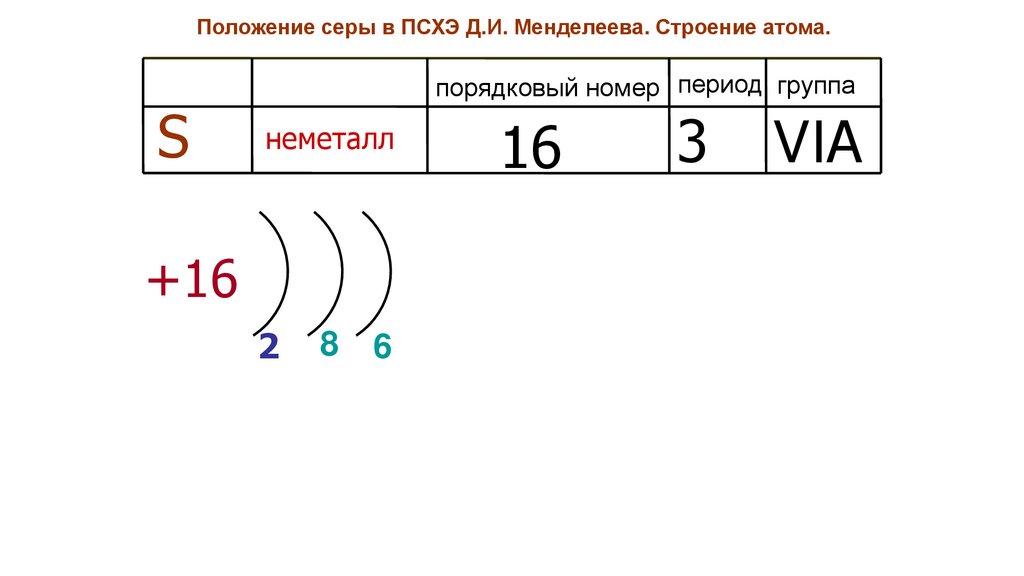
Положение серы в ПСХЭ Д.И. Менделеева. Строение атома.S
порядковый номер период группа
неметалл
+16
2
8
6
16
3
VIA
18.
Положение серы в ПСХЭ Д.И. Менделеева. Строение атома.S
порядковый номер период группа
неметалл
+16
2
8
6
16
3
VIA
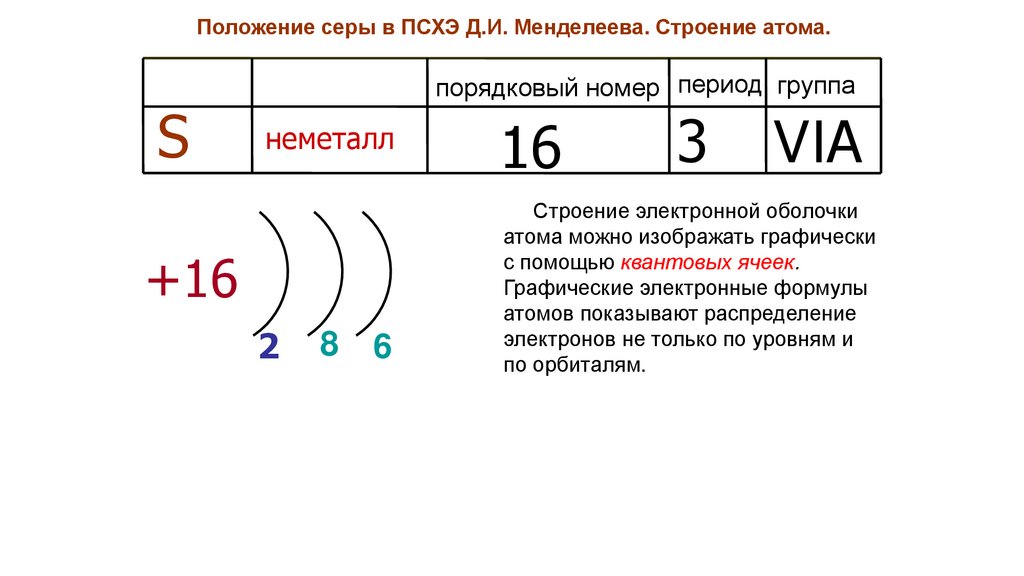
Строение электронной оболочки
атома можно изображать графически
с помощью квантовых ячеек.
Графические электронные формулы
атомов показывают распределение
электронов не только по уровням и
по орбиталям.
19.
Положение серы в ПСХЭ Д.И. Менделеева. Строение атома.S
порядковый номер период группа
неметалл
+16
2
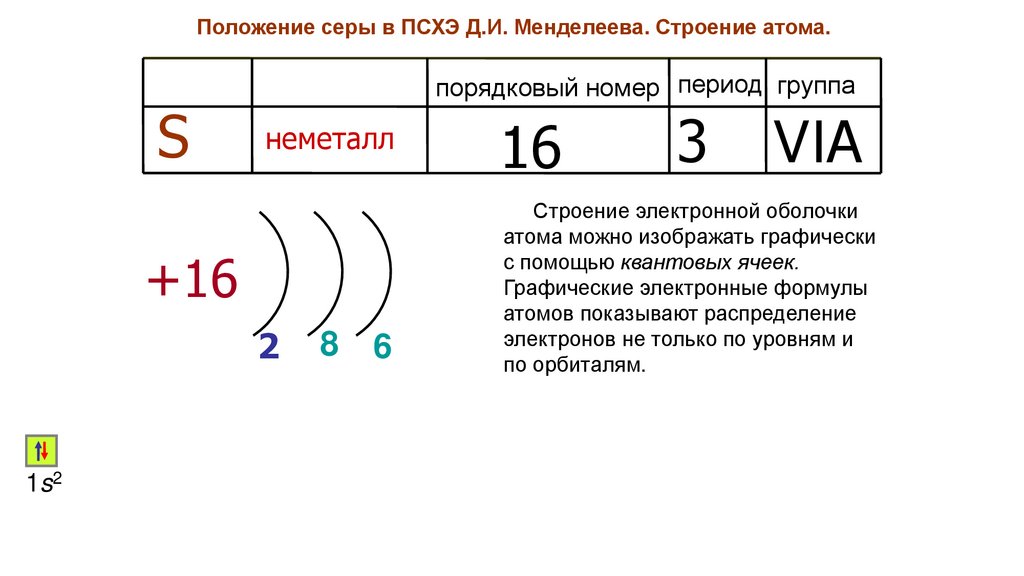
1s2
8
6
16
3
VIA
Строение электронной оболочки
атома можно изображать графически
с помощью квантовых ячеек.
Графические электронные формулы
атомов показывают распределение
электронов не только по уровням и
по орбиталям.
20.
Положение серы в ПСХЭ Д.И. Менделеева. Строение атома.S
порядковый номер период группа
неметалл
+16
2
1s2
2s2
2p6
8
6
16
3
VIA
Строение электронной оболочки
атома можно изображать графически
с помощью квантовых ячеек.
Графические электронные формулы
атомов показывают распределение
электронов не только по уровням и
по орбиталям.
21.
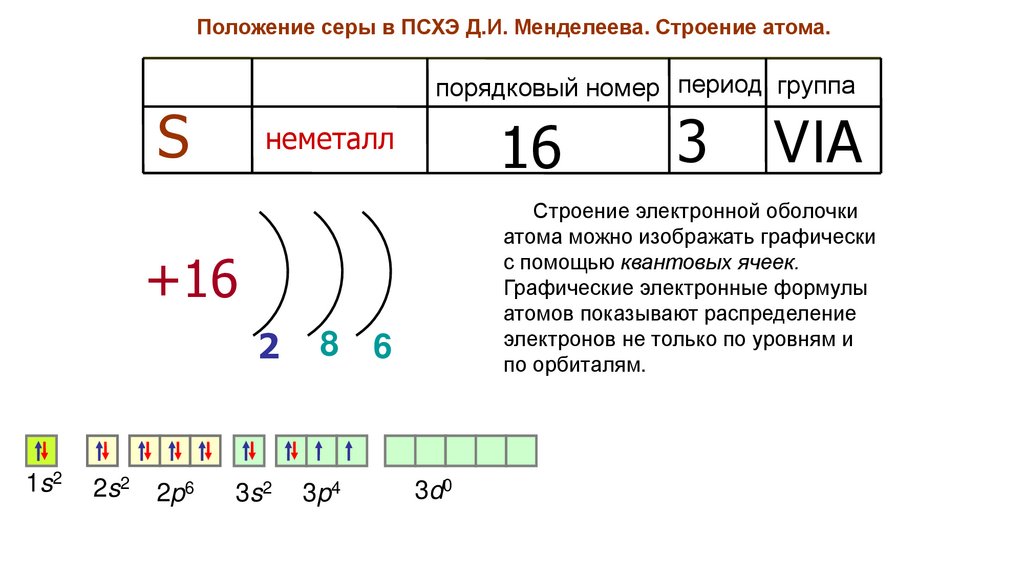
Положение серы в ПСХЭ Д.И. Менделеева. Строение атома.порядковый номер период группа
S
16
неметалл
1s2
2s2
2p6
8
3s2
3p4
VIA
Строение электронной оболочки
атома можно изображать графически
с помощью квантовых ячеек.
Графические электронные формулы
атомов показывают распределение
электронов не только по уровням и
по орбиталям.
+16
2
3
6
3d0
22.
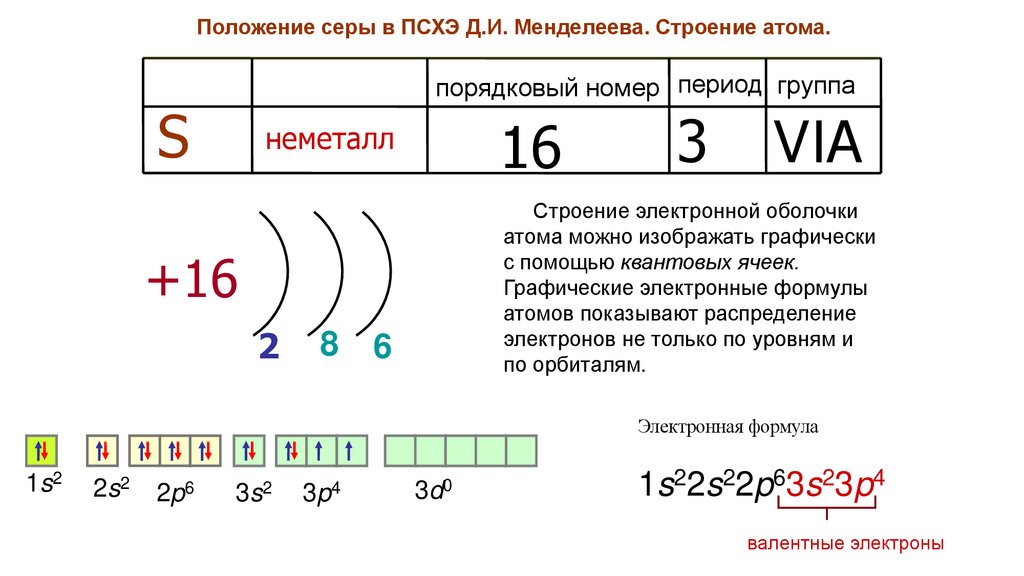
Положение серы в ПСХЭ Д.И. Менделеева. Строение атома.порядковый номер период группа
S
16
неметалл
8
VIA
Строение электронной оболочки
атома можно изображать графически
с помощью квантовых ячеек.
Графические электронные формулы
атомов показывают распределение
электронов не только по уровням и
по орбиталям.
+16
2
3
6
Электронная формула
1s2
2s2
2p6
3s2
3p4
3d0
1s22s22p63s23p4
валентные электроны
23.
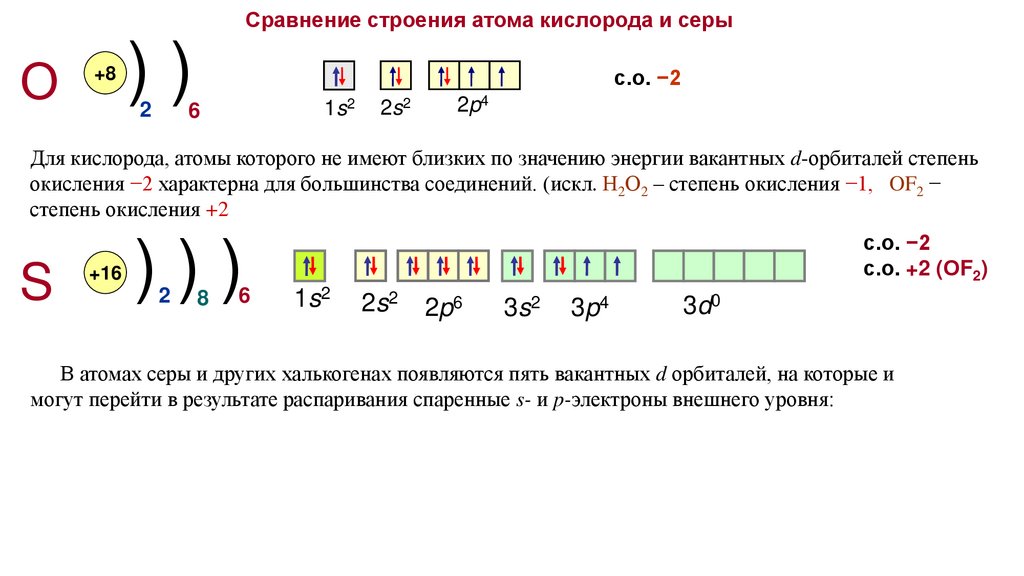
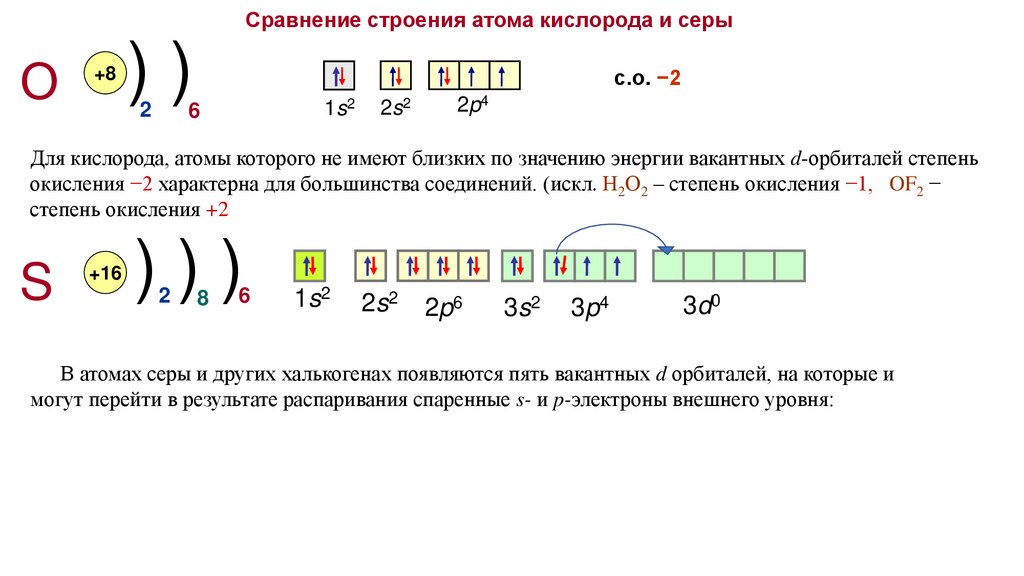
Сравнение строения атома кислорода и серыО
+8
))
2
6
с.о. −2
1s2
2s2
2p4
Для кислорода, атомы которого не имеют близких по значению энергии вакантных d-орбиталей степень
окисления −2 характерна для большинства соединений. (искл. Н2О2 – степень окисления −1, OF2 −
степень окисления +2
24.
Сравнение строения атома кислорода и серыО
+8
))
2
с.о. −2
1s2
6
2s2
2p4
Для кислорода, атомы которого не имеют близких по значению энергии вакантных d-орбиталей степень
окисления −2 характерна для большинства соединений. (искл. Н2О2 – степень окисления −1, OF2 −
степень окисления +2
S
+16
)))
2
8
6
25.
Сравнение строения атома кислорода и серыО
+8
))
2
с.о. −2
1s2
6
2s2
2p4
Для кислорода, атомы которого не имеют близких по значению энергии вакантных d-орбиталей степень
окисления −2 характерна для большинства соединений. (искл. Н2О2 – степень окисления −1, OF2 −
степень окисления +2
S
+16
)))
2
8
6
с.о. −2
с.о. +2 (ОF2)
1s2
2s2
2p6
3s2
3p4
3d0
В атомах серы и других халькогенах появляются пять вакантных d орбиталей, на которые и
могут перейти в результате распаривания спаренные s- и p-электроны внешнего уровня:
26.
Сравнение строения атома кислорода и серыО
+8
))
2
с.о. −2
1s2
6
2s2
2p4
Для кислорода, атомы которого не имеют близких по значению энергии вакантных d-орбиталей степень
окисления −2 характерна для большинства соединений. (искл. Н2О2 – степень окисления −1, OF2 −
степень окисления +2
S
+16
)))
2
8
6
1s2
2s2
2p6
3s2
3p4
3d0
В атомах серы и других халькогенах появляются пять вакантных d орбиталей, на которые и
могут перейти в результате распаривания спаренные s- и p-электроны внешнего уровня:
27.
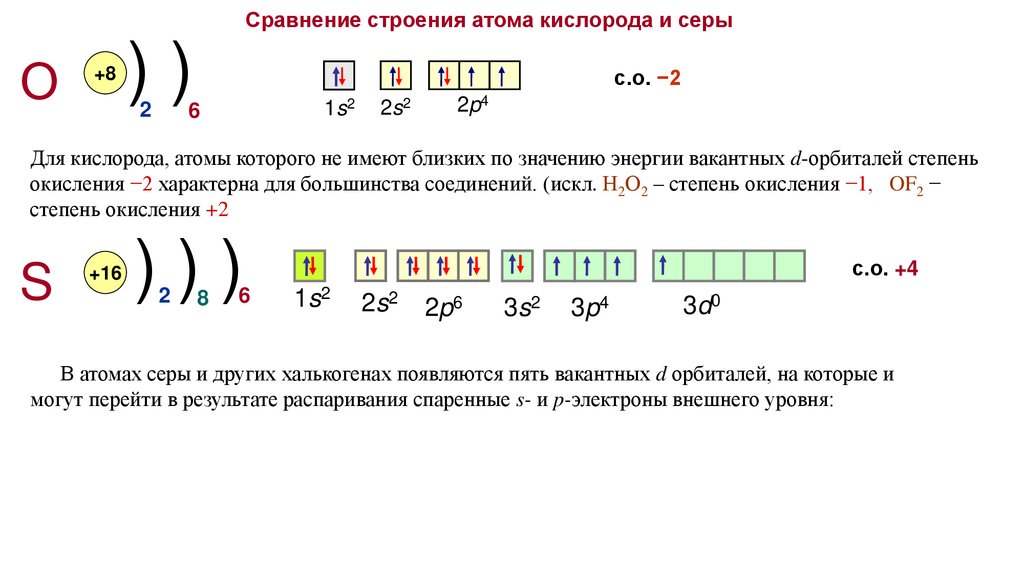
Сравнение строения атома кислорода и серыО
+8
))
2
с.о. −2
1s2
6
2s2
2p4
Для кислорода, атомы которого не имеют близких по значению энергии вакантных d-орбиталей степень
окисления −2 характерна для большинства соединений. (искл. Н2О2 – степень окисления −1, OF2 −
степень окисления +2
S
+16
)))
2
8
6
с.о. +4
1s2
2s2
2p6
3s2
3p4
3d0
В атомах серы и других халькогенах появляются пять вакантных d орбиталей, на которые и
могут перейти в результате распаривания спаренные s- и p-электроны внешнего уровня:
28.
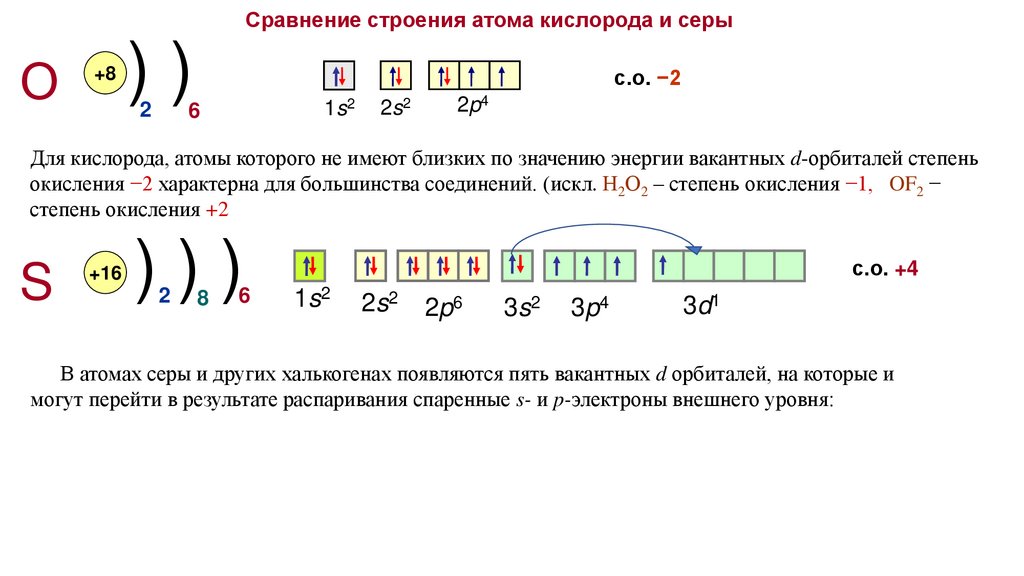
Сравнение строения атома кислорода и серыО
+8
))
2
с.о. −2
1s2
6
2s2
2p4
Для кислорода, атомы которого не имеют близких по значению энергии вакантных d-орбиталей степень
окисления −2 характерна для большинства соединений. (искл. Н2О2 – степень окисления −1, OF2 −
степень окисления +2
S
+16
)))
2
8
6
с.о. +4
1s2
2s2
2p6
3s2
3p4
3d1
В атомах серы и других халькогенах появляются пять вакантных d орбиталей, на которые и
могут перейти в результате распаривания спаренные s- и p-электроны внешнего уровня:
29.
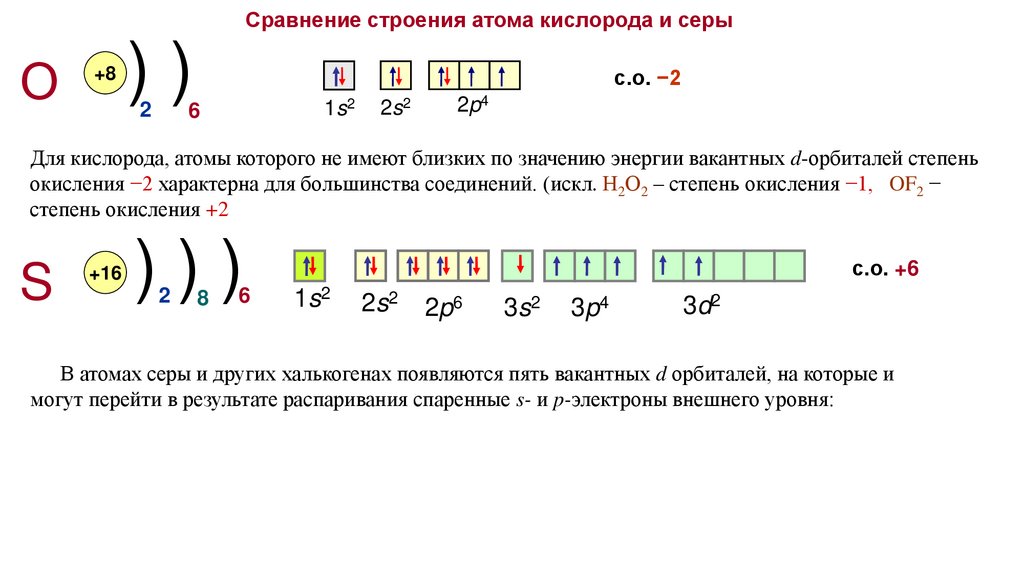
Сравнение строения атома кислорода и серыО
+8
))
2
с.о. −2
1s2
6
2s2
2p4
Для кислорода, атомы которого не имеют близких по значению энергии вакантных d-орбиталей степень
окисления −2 характерна для большинства соединений. (искл. Н2О2 – степень окисления −1, OF2 −
степень окисления +2
S
+16
)))
2
8
6
с.о. +6
1s2
2s2
2p6
3s2
3p4
3d2
В атомах серы и других халькогенах появляются пять вакантных d орбиталей, на которые и
могут перейти в результате распаривания спаренные s- и p-электроны внешнего уровня:
30.
Сера – простое вещество1. Аллотропные модификации серы
2. Характеристика аллотропных модификаций
3. Получение серы
4. Химические свойства серы
5. Применение
31.
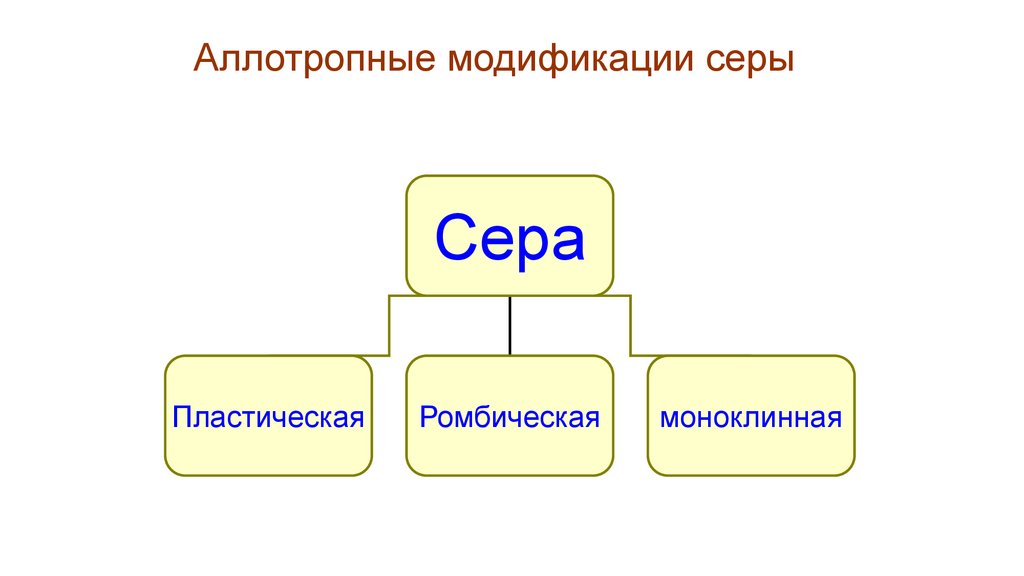
Аллотропные модификации серыСера
Пластическая
Ромбическая
моноклинная
32.
Пластическая сераS∞
Длинные
полимерные
цепи;
пластическая
коричневая масса;
нерастворима в воде;
tпл. = 160ºС
33.
Ромбическая сераS8
Кристаллическое вещество
желтого цвета;
нерастворима в воде;
растворяется
в
органических растворителях;
tпл.= 112ºC
34.
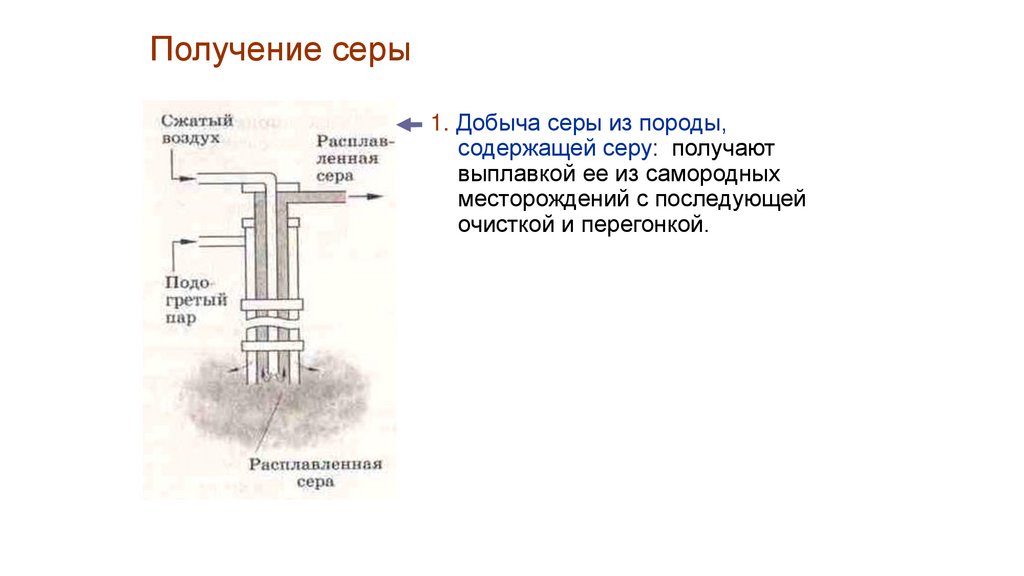
Получение серы35.
Получение серы1. Добыча серы из породы,
содержащей серу: получают
выплавкой ее из самородных
месторождений с последующей
очисткой и перегонкой.
36.
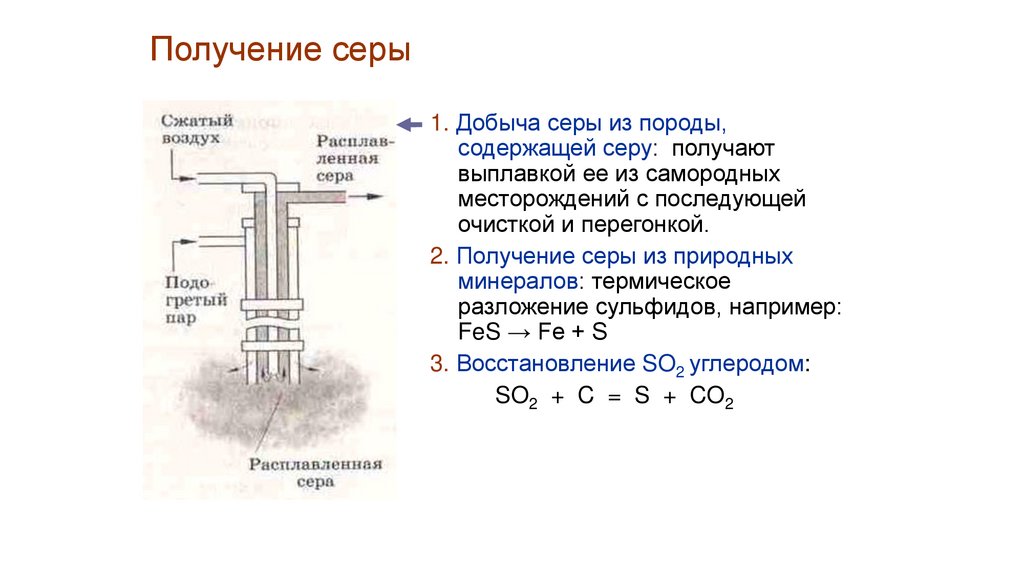
Получение серы1. Добыча серы из породы,
содержащей серу: получают
выплавкой ее из самородных
месторождений с последующей
очисткой и перегонкой.
2. Получение серы из природных
минералов: термическое
разложение сульфидов, например:
FeS → Fe + S
37.
Получение серы1. Добыча серы из породы,
содержащей серу: получают
выплавкой ее из самородных
месторождений с последующей
очисткой и перегонкой.
2. Получение серы из природных
минералов: термическое
разложение сульфидов, например:
FeS → Fe + S
3. Восстановление SO2 углеродом:
SO2 + C = S + CO2
38.
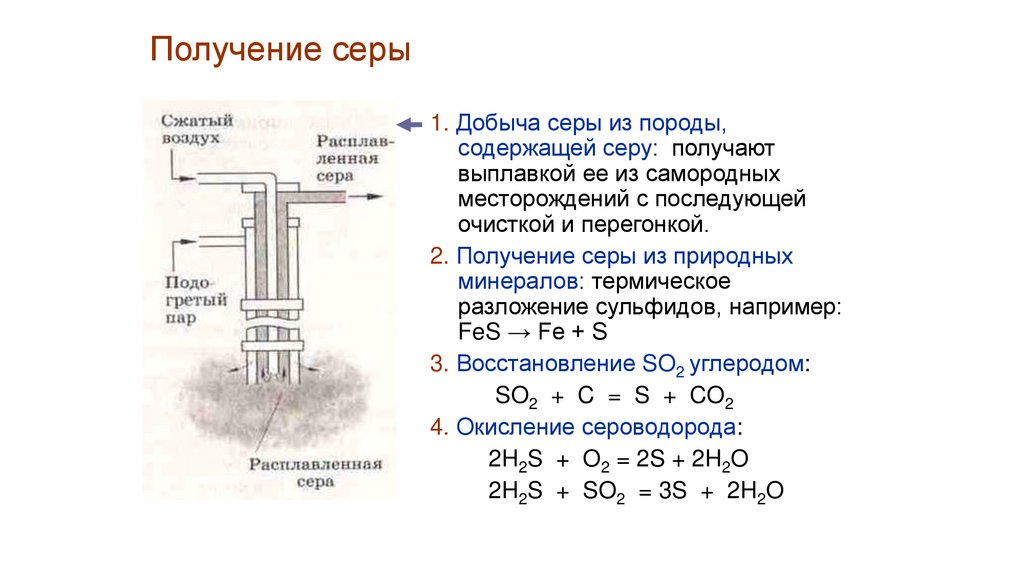
Получение серы1. Добыча серы из породы,
содержащей серу: получают
выплавкой ее из самородных
месторождений с последующей
очисткой и перегонкой.
2. Получение серы из природных
минералов: термическое
разложение сульфидов, например:
FeS → Fe + S
3. Восстановление SO2 углеродом:
SO2 + C = S + CO2
4. Окисление сероводорода:
2H2S + O2 = 2S + 2H2O
2H2S + SO2 = 3S + 2H2O
39.
Химические свойства серы40.
Взаимодействие серы с простыми веществамиметаллами и неметаллами
Взаимодействие серы со сложными веществами
Составить уравнения реакций при помощи
Которых можно осуществить превращения
41.
Взаимодействие серы с простыми веществами1) По приведенным ниже схемам составьте уравнения
химических реакций:
S + Al →
S + Cu →
S + Li →
S + Fe →
S + P →
S + H2 →
S + Cl2 →
S + O2 →
S+C →
Какую роль выполняет сера в этих реакциях? Составьте
электронный баланс к данным реакциям:
42.
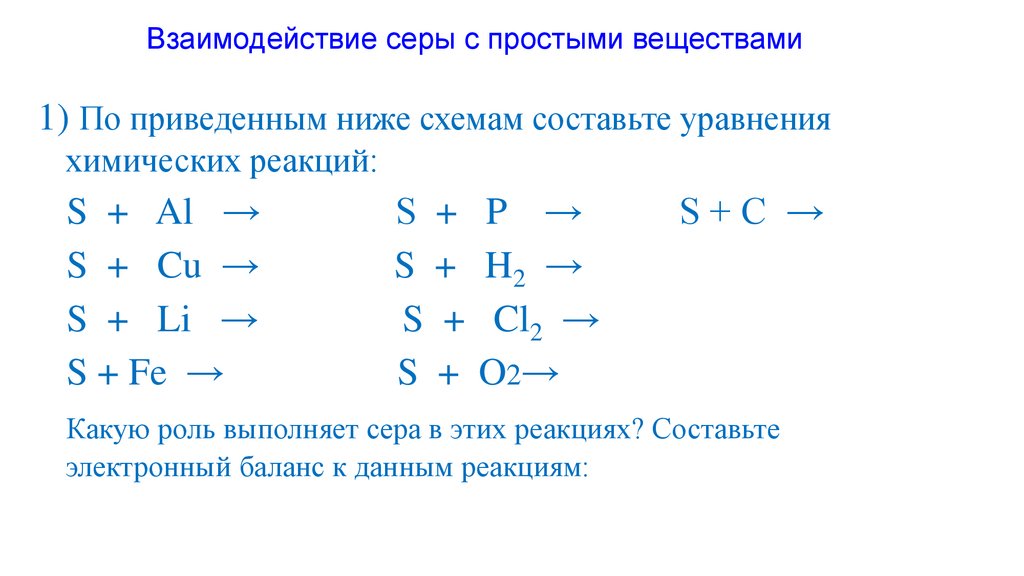
00
S +Al =Al
+3
-2
S
2
3
43.
00
S +Al =Al
+3
-2
S
2
3
44.
00
S +Al =Al
0
S +2ē=S
-2
+3
-2
S
2
3
45.
00
S +Al =Al
0
-2
S +2ē=S
0
+3
Al -3ē=Al
+3
-2
S
2
3
46.
00
S +Al =Al
0
-2
2
S +2ē=S
0
+3
Al -3ē=Al 3
+3
-2
S
2
3
47.
00
S +Al =Al
0
-2
+3
2
S +2ē=S
6
0
+3
Al -3ē=Al 3
-2
S
2
3
48.
00
S +Al =Al
0
-2
+3
3
2
S +2ē=S
6
0
+3
Al -3ē=Al 3 2
-2
S
2
3
49.
00
S +Al =Al
0
-2
+3
-2
S
2
3
S +2ē=S
6
0
+3
пр.окисления
2
3
Al -3ē=Al
2
3
пр.восстановления
50.
00
S +Al =Al
0
-2
+3
-2
S
2
3
S +2ē=S
6
0
+3
пр.окисления
2
3
Al -3ē=Al
0
2
S - окислитель
3
пр.восстановления
51.
00
S +Al =Al
0
-2
+3
-2
S
2
3
S +2ē=S
6
0
+3
пр.окисления
2
3
Al -3ē=Al
0
2
3
S - окислитель
0
Al - восстановитель
пр.восстановления
52.
Расставьте коэффициенты методом электронного баланса в следующихсхемах реакций.
S + H2SO4 (конц.) = SO2 + H2O
S + HNO3 (конц.) =H2SO4 + NO2 + H2O
S + KOH =K2SO3 + K2S + H2O
53.
Расставьте коэффициенты методом электронного баланса в следующихсхемах реакций.
0
+6
3S +2H2S O4 (конц.)
+4
= 3S O2 +
2H2O
54.
Расставьте коэффициенты методом электронного баланса в следующихсхемах реакций.
0
+6
3S +2H2S O4 (конц.)
-4
+2
+4
= 3S O2 +
2H2O
55.
Расставьте коэффициенты методом электронного баланса в следующихсхемах реакций.
0
+6
2S +4H2S O4 (конц.)
-4
+2
+4
= 3S O2 +
2H2O
56.
Расставьте коэффициенты методом электронного баланса в следующихсхемах реакций.
0
+6
2S +4H2S O4 (конц.)
+4
= 6S O2 +
2H2O
57.
Расставьте коэффициенты методом электронного баланса в следующихсхемах реакций.
0
+6
2S +4H2S O4 (конц.)
+4
= 6S O2 +4H2O
58.
Расставьте коэффициенты методом электронного баланса в следующихсхемах реакций.
0
+5
+6
+4
S + 6HN O3 (конц.) =H2S O4 +6N O2 +2H2O
59.
Расставьте коэффициенты методом электронного баланса в следующихсхемах реакций.
0
+5
+6
+4
S + 6HN O3 (конц.) =H2S O4 +6N O2 +2H2O
-6
+1
60.
Расставьте коэффициенты методом электронного баланса в следующихсхемах реакций.
0
+5
+6
+4
S + 6HN O3 (конц.) =H2S O4 +6N O2 +2H2O
61.
Расставьте коэффициенты методом электронного баланса в следующихсхемах реакций.
0
+5
+6
+4
S + 6HN O3 (конц.) =H2S O4 +6N O2 +2H2O
62.
Расставьте коэффициенты методом электронного баланса в следующихсхемах реакций.
0
+5
+6
+4
S + 6HN O3 (конц.) =H2S O4 +6N O2 +2H2O
63.
Расставьте коэффициенты методом электронного баланса в следующихсхемах реакций.
3S +6KOH =3K2SO3 +2K2S +3H2O
64.
Расставьте коэффициенты методом электронного баланса в следующихсхемах реакций.
3S +6KOH =3K2SO3 +2K2S +3H2O
-6;+4
65.
Расставьте коэффициенты методом электронного баланса в следующихсхемах реакций.
3S +6KOH =3K2SO3 +2K2S +3H2O
-6;+4
66.
Расставьте коэффициенты методом электронного баланса в следующихсхемах реакций.
3S +6KOH =3K2SO3 +2K2S +3H2O
67.
Расставьте коэффициенты методом электронного баланса в следующихсхемах реакций.
3S +6KOH =3K2SO3 +2K2S +3H2O
68.
Расставьте коэффициенты методом электронного баланса в следующихсхемах реакций.
3S +6KOH =3K2SO3 +2K2S +3H2O
69.
+6+4
3S + 2H2S O4 = 3S O2 + 2H2O
70.
0+6
+4
3S + 2H2S O4 = 3S O2 + 2H2O
71.
0+6
+4
3S + 2H2S O4 = 3S O2 + 2H2O
72.
0+6
+4
3S + 2H2S O4 = 3S O2 + 2H2O
73.
0+6
+4
2S + 4H2S O4 = 6S O2 + 4H2O
-4
+2
74.
0+6
+4
2S + 2H2S O4 = 3S O2 + 2H2O
75.
0+6
+4
2S + 2H2S O4 = 3S O2 + 2H2O
S0 ─ 4e =S+4
76.
0+6
+4
2S + 2H2S O4 = 3S O2 + 2H2O
S0 ─ 4e =S+4
S+6 + 2e → S+4
77.
0+6
+4
2S + 2H2S O4 = 3S O2 + 2H2O
S0 ─ 4e =S+4
S+6 + 2e → S+4
78.
0+6
+4
2S + 2H2S O4 = 3S O2 + 2H2O
S0 ─ 4e =S+4 4
S+6 + 2e → S+4 2
79.
0+6
+4
2S + 2H2S O4 = 3S O2 + 2H2O
S0 ─ 4e =S+4 4 4
S+6 + 2e → S+4 2
80.
0+6
+4
2S + 2H2S O4 = 3S O2 + 2H2O
S0 ─ 4e =S+4 4 4 1
S+6 + 2e → S+4 2 2
81.
0+6
+4
2S + 2H2S O4 = 3S O2 + 2H2O
S0 ─ 4e =S+4 4 4 1
S+6 + 2e → S+4 2 2
82.
0+6
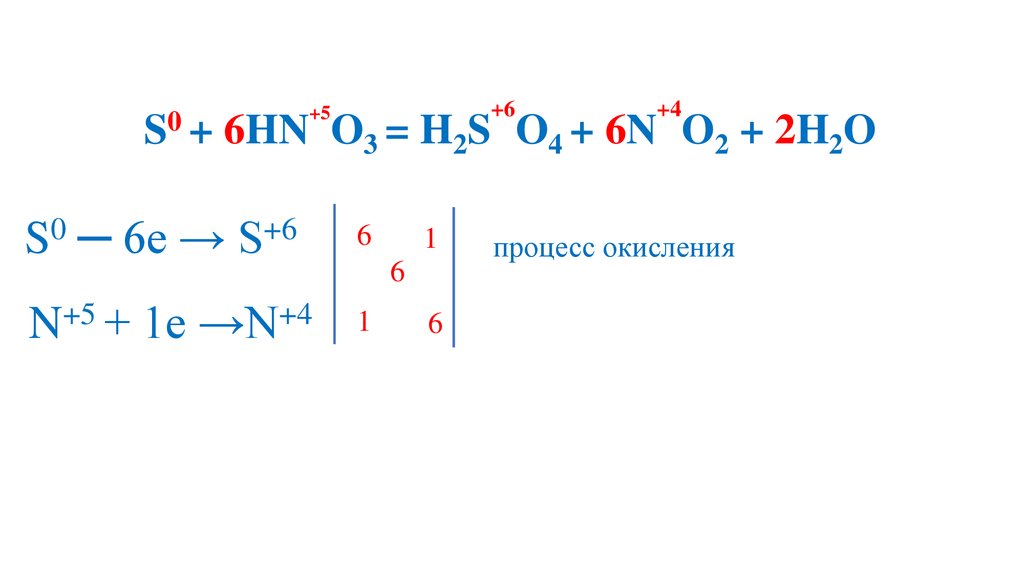
─ 4e =S+4
4
+4
2S + 2H2S O4 = 3S O2 + 2H2O
S0
S+6 + 2e → S+4 2
4
1
2
процесс окисления
83.
0+6
─ 4e =S+4
4
+4
2S + 2H2S O4 = 3S O2 + 2H2O
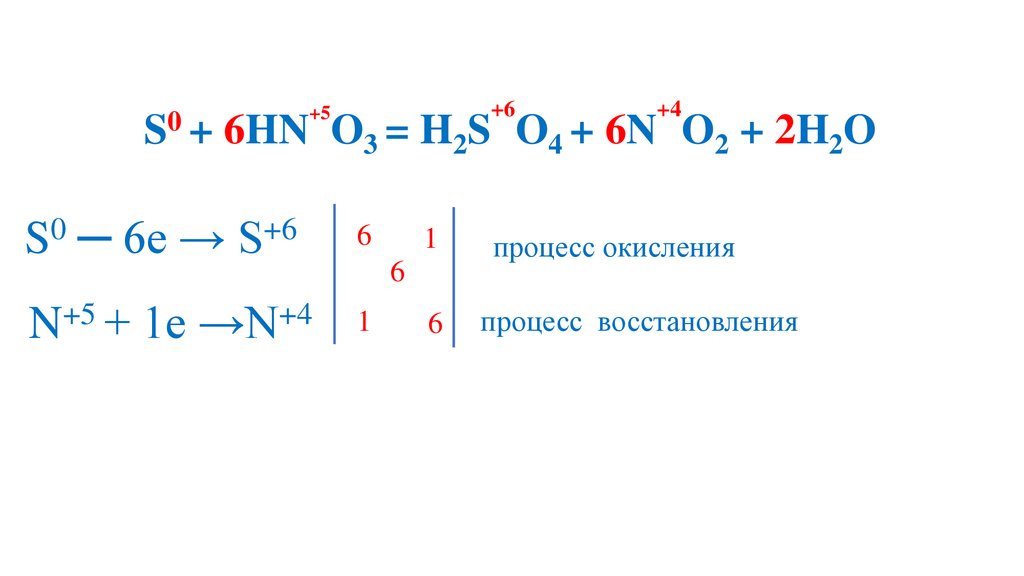
S0
S+6 + 2e → S+4 2
4
1
процесс окисления
2 процесс восстановления
84.
0+6
─ 4e =S+4
4
+4
2S + 2H2S O4 = 3S O2 + 2H2O
S0
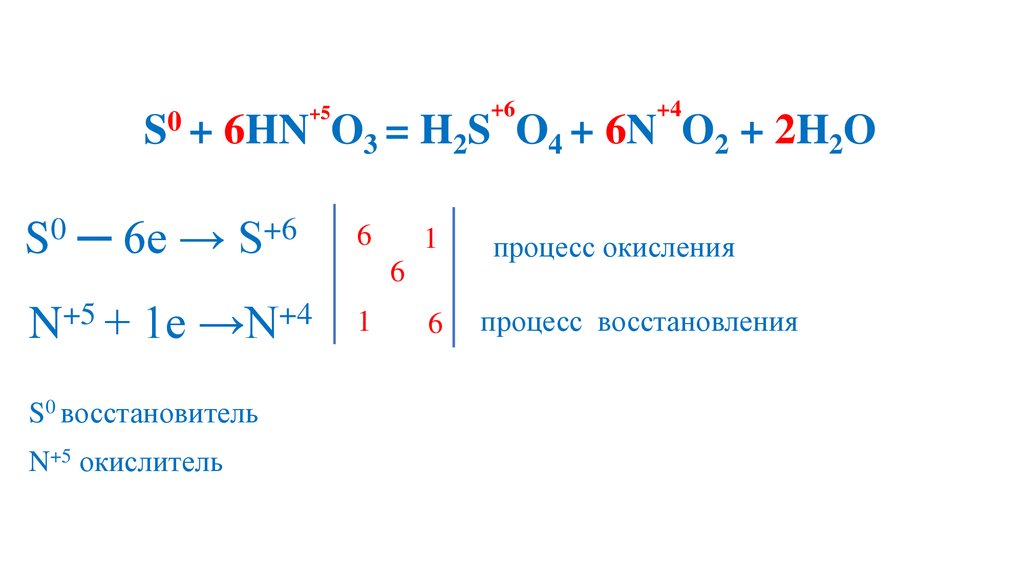
S+6 + 2e → S+4 2
S0 восстановитель
4
1
процесс окисления
2 процесс восстановления
85.
0+6
─ 4e =S+4
4
+4
2S + 2H2S O4 = 3S O2 + 2H2O
S0
S+6 + 2e → S+4 2
S0 восстановитель
S+6 окислитель
4
1
процесс окисления
2 процесс восстановления
86.
+50
S + 6HN O
+6
3 = H2S
+4
O4 + 6N O2 + 2H2O
87.
+6+5
0
S + 6HN O3 = H2S
+4
O4 + 6N O2 + 2H2O
88.
+50
S + 6HN O
-6
+1
+6
3 = H2S
+4
O4 + 6N O2 + 2H2O
89.
+50
S + 6HN O
+6
3 = H2S
+4
O4 + 6N O2 + 2H2O
90.
+50
S + 6HN O
+6
3 = H2S
+4
O4 + 6N O2 + 2H2O
91.
+50
S + 6HN O
+6
3 = H2S
+4
O4 + 6N O2 + 2H2O
92.
+50
S + 6HN O
S0 ─ 6e → S+6
+6
3 = H2S
+4
O4 + 6N O2 + 2H2O
93.
+50
S + 6HN O
S0 ─ 6e → S+6
+5
+4
N + 1e →N
+6
3 = H2S
+4
O4 + 6N O2 + 2H2O
94.
+50
S + 6HN O
+6
3 = H2S
S0 ─ 6e → S+6
6
+5
+4
N + 1e →N
1
+4
O4 + 6N O2 + 2H2O
95.
+50
S + 6HN O
+6
3 = H2S
S0 ─ 6e → S+6
6
+5
+4
N + 1e →N
1
6
+4
O4 + 6N O2 + 2H2O
96.
+50
S + 6HN O
+6
3 = H2S
S0 ─ 6e → S+6
6
+5
+4
N + 1e →N
1
1
6
+4
O4 + 6N O2 + 2H2O
97.
+50
S + 6HN O
+6
3 = H2S
S0 ─ 6e → S+6
6
+5
+4
N + 1e →N
1
1
6
6
+4
O4 + 6N O2 + 2H2O
98.
+50
S + 6HN O
+6
3 = H2S
S0 ─ 6e → S+6
6
+5
+4
N + 1e →N
1
1
6
6
+4
O4 + 6N O2 + 2H2O
процесс окисления
99.
+50
S + 6HN O
+6
3 = H2S
S0 ─ 6e → S+6
6
+5
+4
N + 1e →N
1
+4
O4 + 6N O2 + 2H2O
1
процесс окисления
6
процесс восстановления
6
100.
+50
S + 6HN O
3 = H2S
S0 ─ 6e → S+6
6
+5
+4
N + 1e →N
1
S0 восстановитель
N+5 окислитель
+6
+4
O4 + 6N O2 + 2H2O
1
процесс окисления
6
процесс восстановления
6
101.
3S0 + 6KOH = K2S+4O3 + 2K2S─2 + 3H2OS0 - 4e =S+4
S0 +2e
→S─2
4
1
процесс окисления, S0 восстановитель
2
процесс восстановления, S0
окислитель
4
2
102.
Составить уравнения реакций при помощи которых можно осуществитьпревращение.
Fe
1
2
FeS
3
H 2S
4
S
1) Fe + S = FeS
2) FeS + 2HCl = FeCl2 + H2S
3) 2H2S + SO2 = 3S + 2H2O
4) S + O2 =SO2
SO2
103.
12
3
3
S
7
8
6
8
4
5
104.
IV. Подведение итоговКакими особыми свойствами обладает простое
вещество сера?
Домашнее задание: § 13, выполнить задания № 1—4 после
§ 13
105.
Тест1. Последовательность цифр 2 — 8 — 18 — 6 соответствует распределению электронов
по энергетическим уровням атома:
А) кислород;
В) селен;
Б) сера;
Г) теллур.
2. Какая формула соответствует электронной конфигурации внешнего уровня атома
серы:
А) … 2s22p6; Б) … 3s23p6; В) … 2s22p4; Г) … 3s23p4;
3. В ряду элементов O→S→Se→Te неметаллические свойства:
А) увеличиваются;
В) не изменяются;
Б) уменьшаются;
Г) изменяются периодически.
4. Какое соединение серы называют пиритом:
А) H2S;
Б) ZnS;
В) PbS;
Г) FeS2 .
5. Какую серу можно получить в виде нитей:
А) пластическую;
В) моноклинную;
Б) ромбическую;
Г) циклическую.
6. Какое из перечисленных веществ вступает в реакцию с серой:
А) натрий;
В) вода;
Б) азот;
Г) соляная кислота.
7. Окислительные свойства сера проявляет в реакции:
А) S + O2 = SO2;
В) S + Fe = FeS;
Б) S + 3Cl2 = SCl6;
Г) S + 2H2SO4(конц.) = 3SO2 + 2H2O.
8. Объем воздуха (содержащего 21% кислорода), необходимый для сжигания
2 моль серы (при н.у.), равен:
А) 213,3 л;
Б) 44,8 л;
В) 21,33 л;
Г) 2133 л.
106.
Ответы:1. Б
5. А
2. Г
6. А
3. Б
7. В
4. Г
8. А






















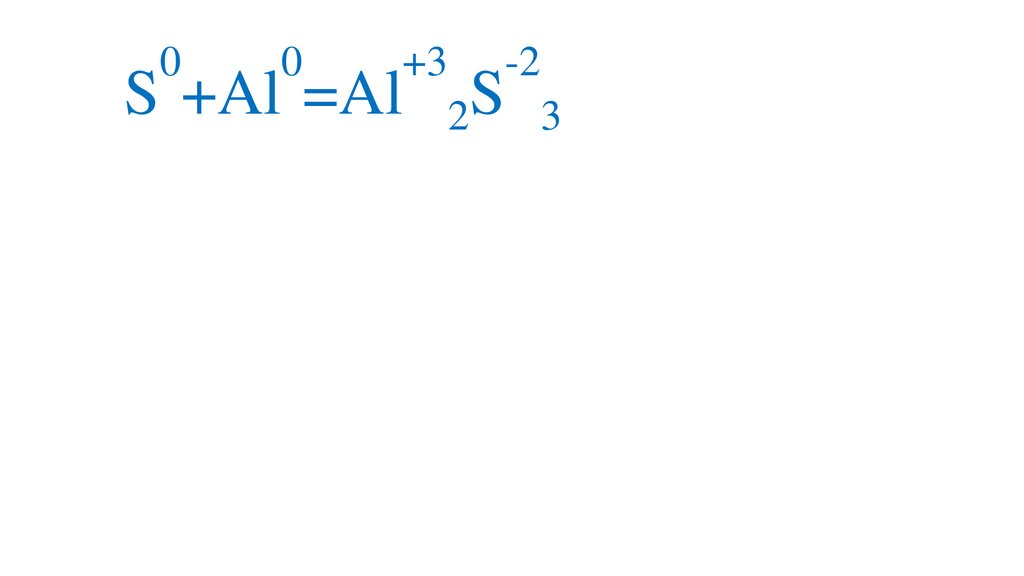
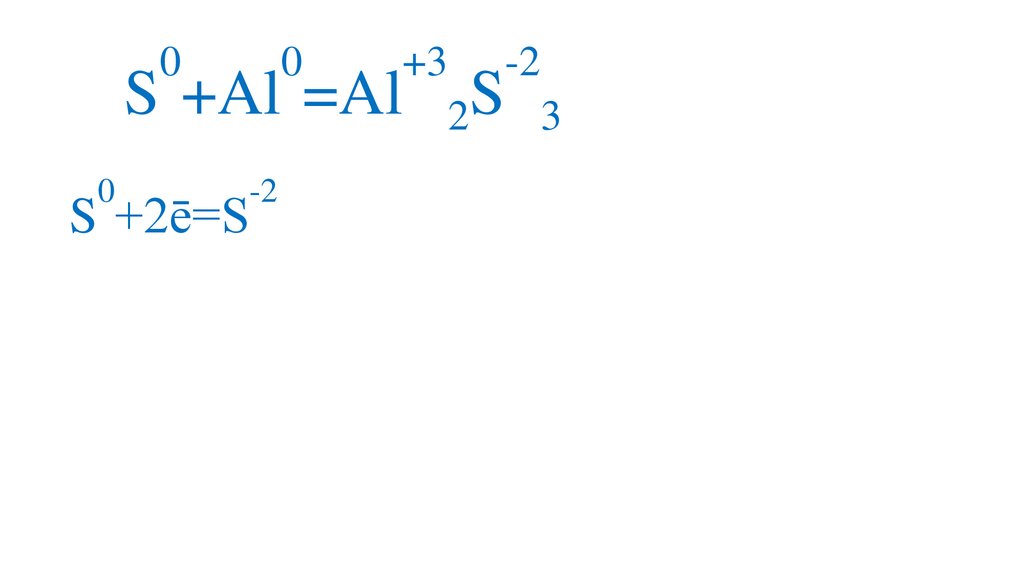
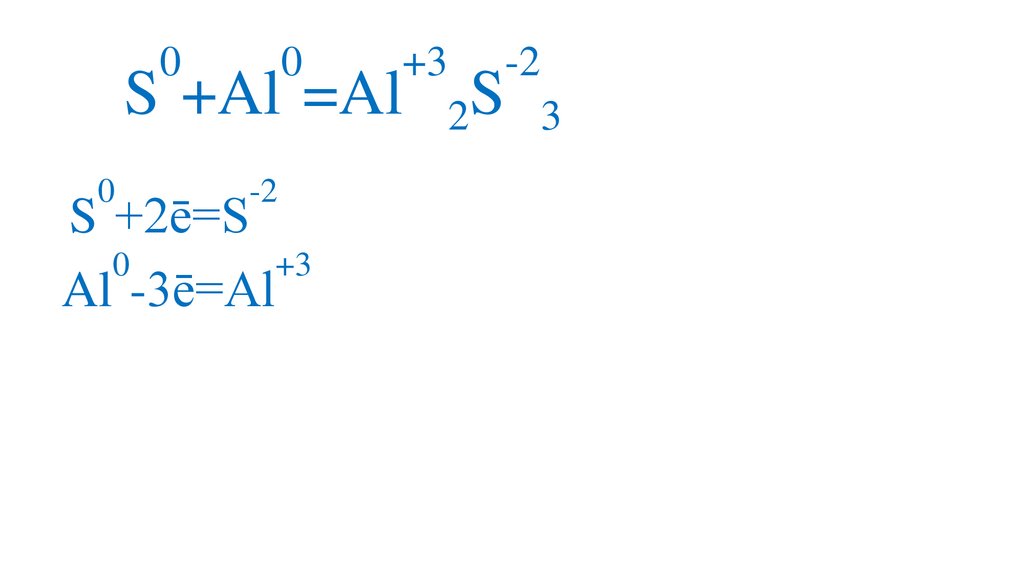
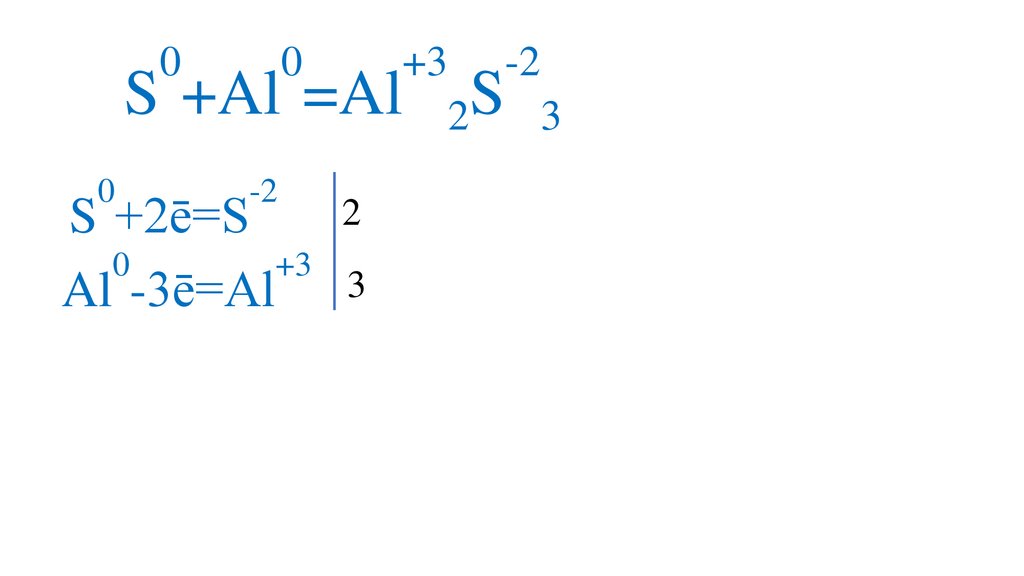
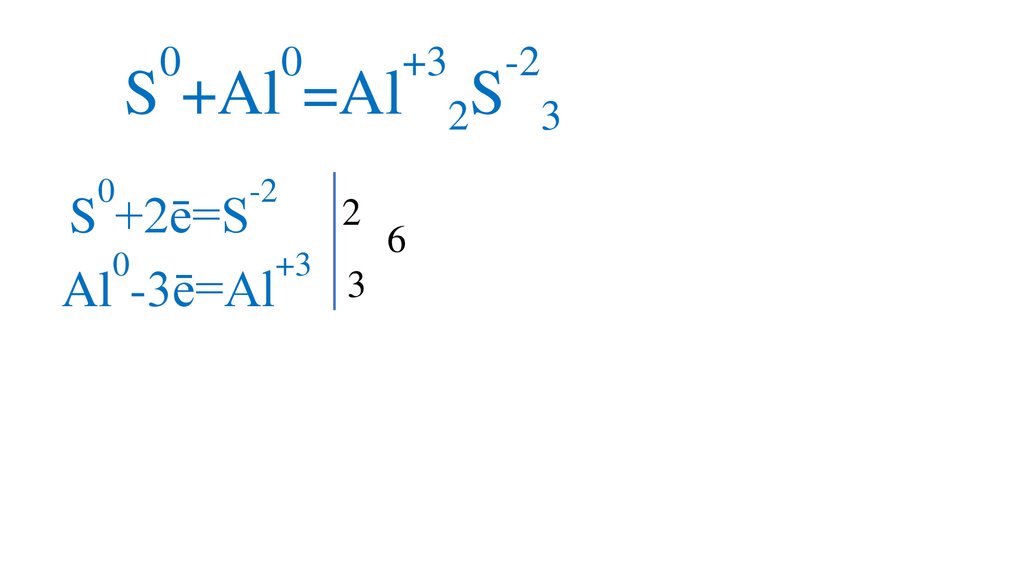
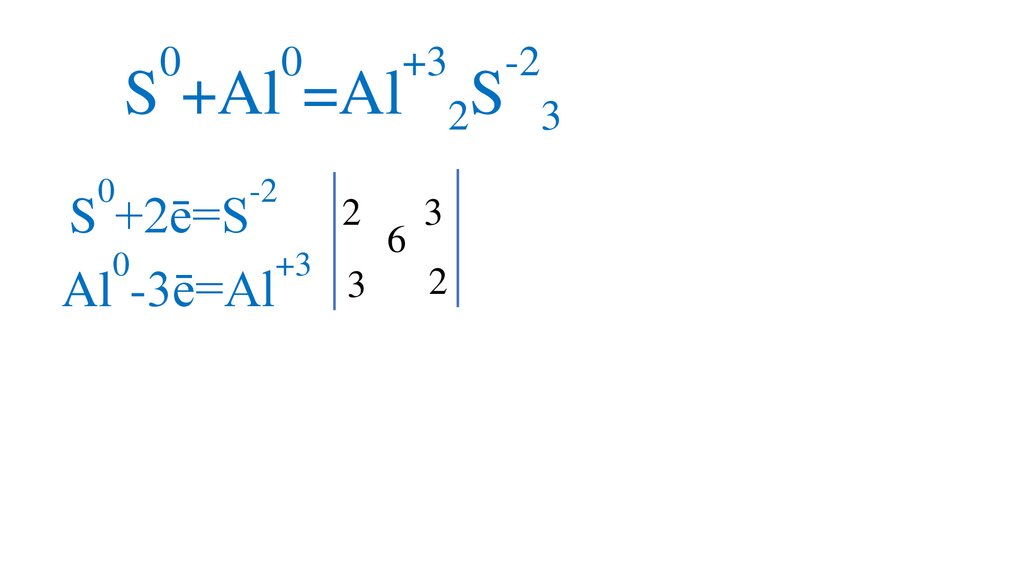




















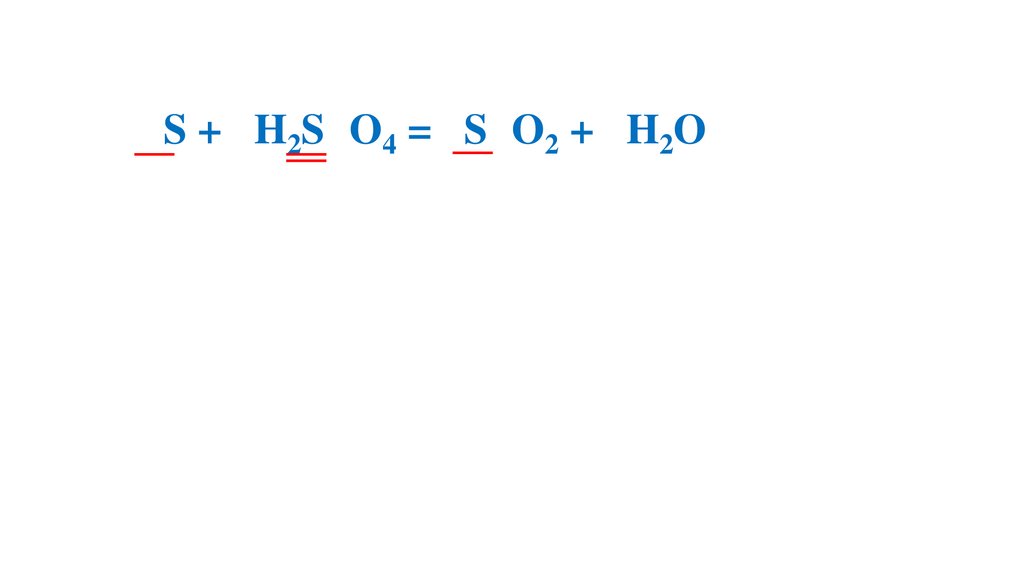

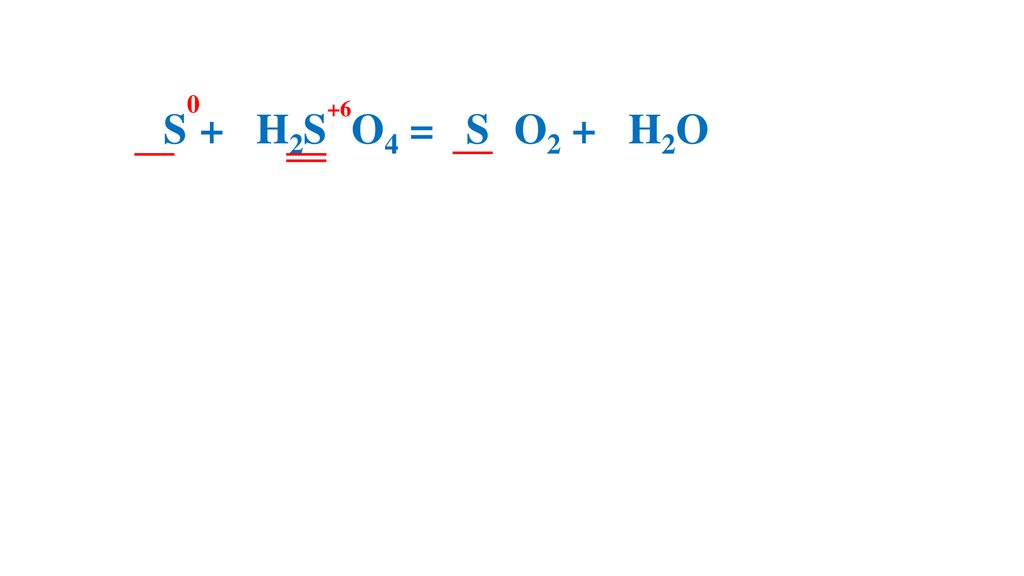
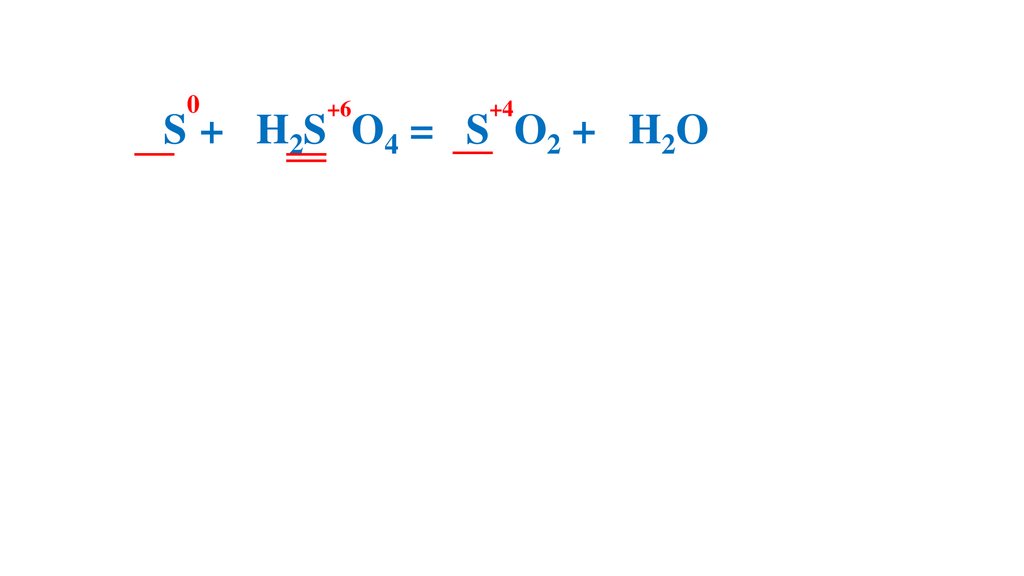
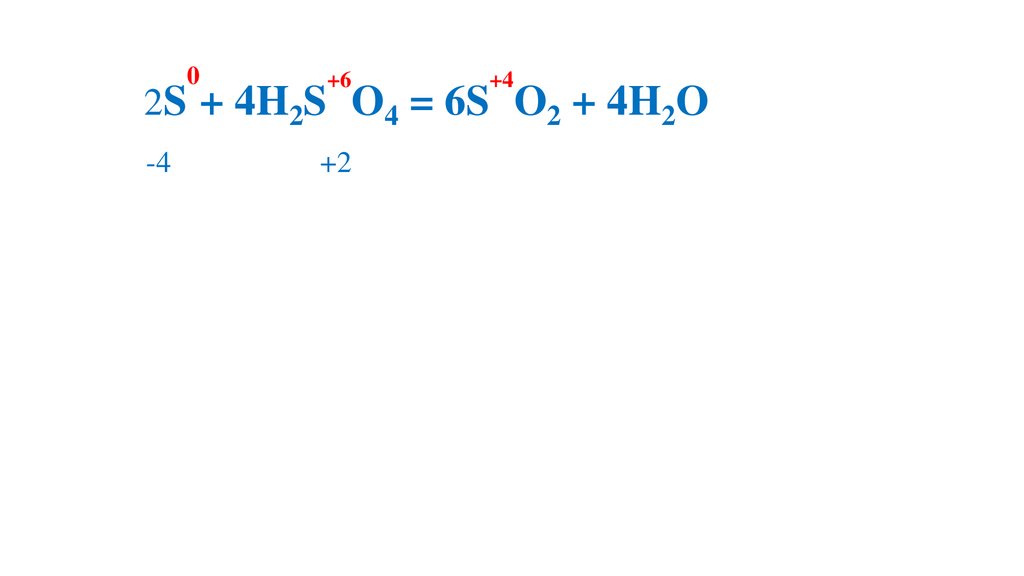
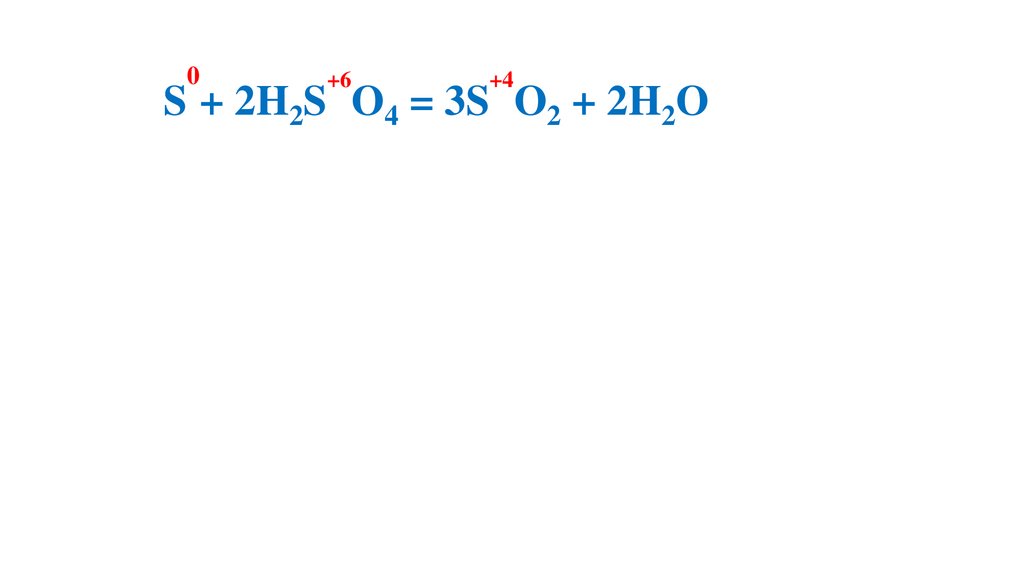
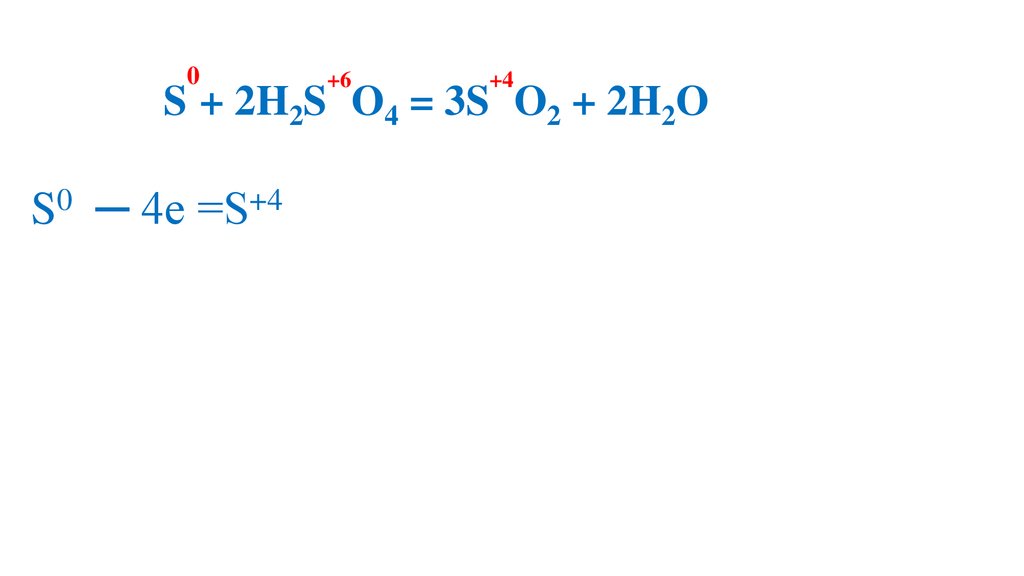


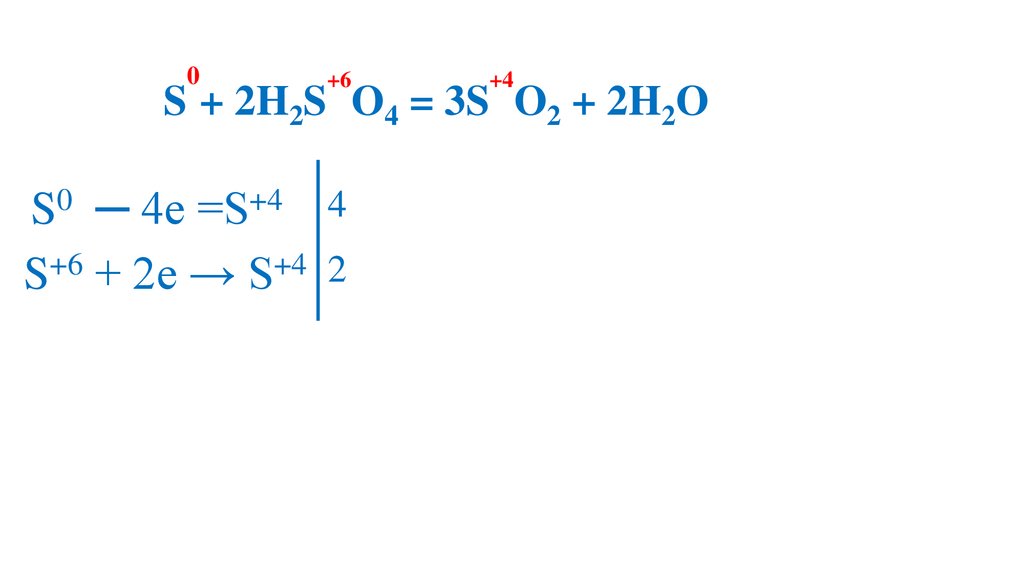
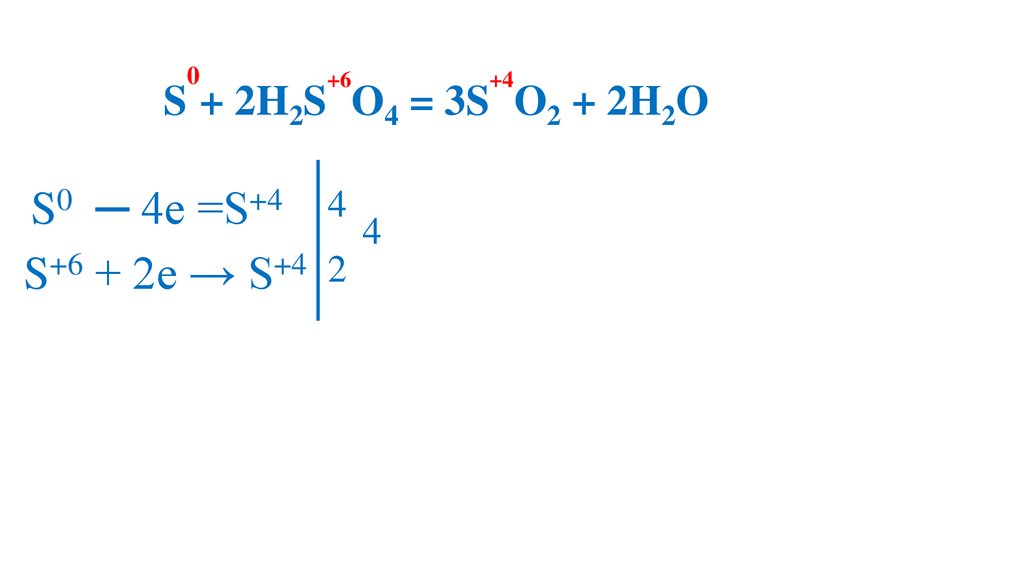
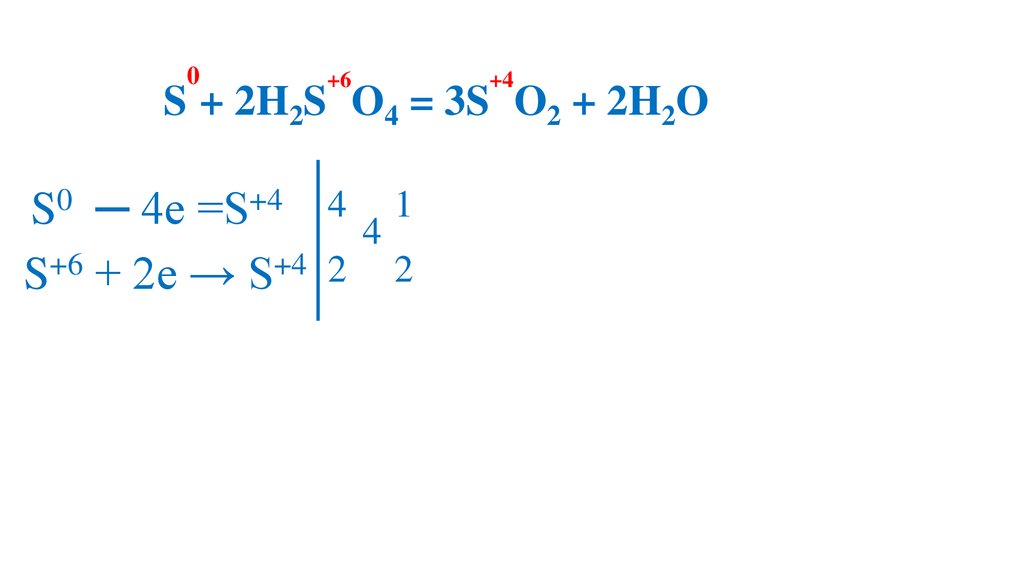
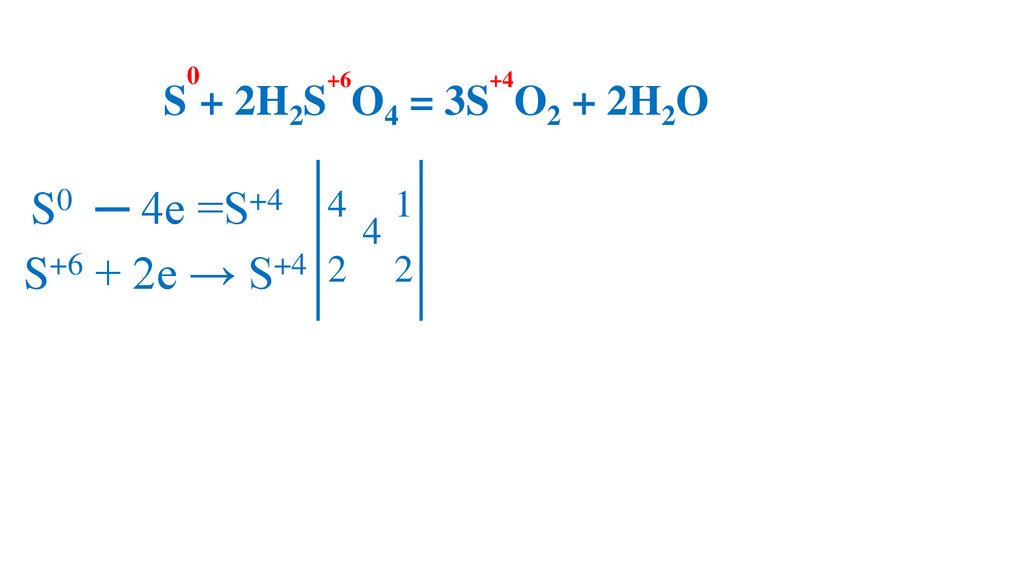




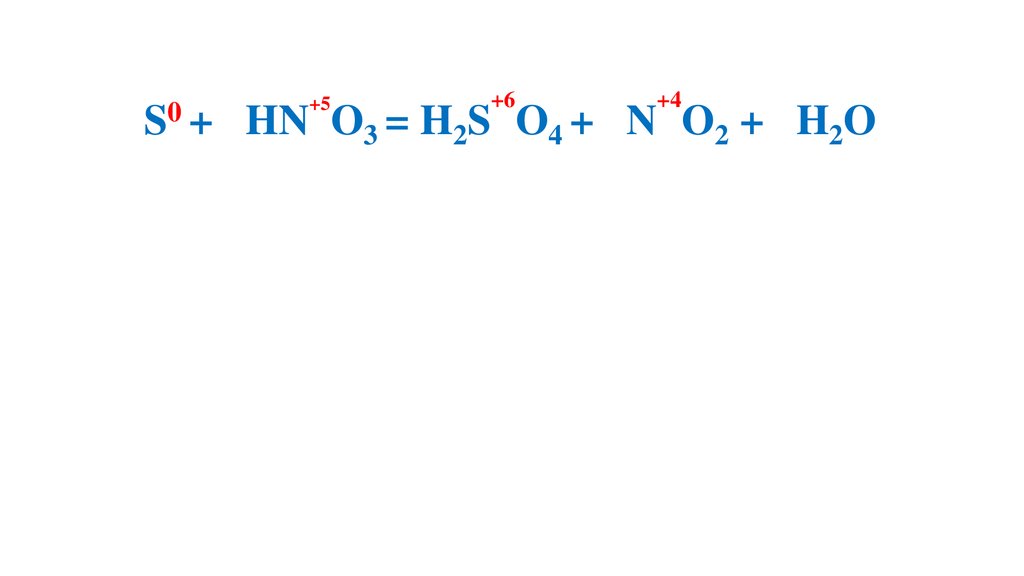
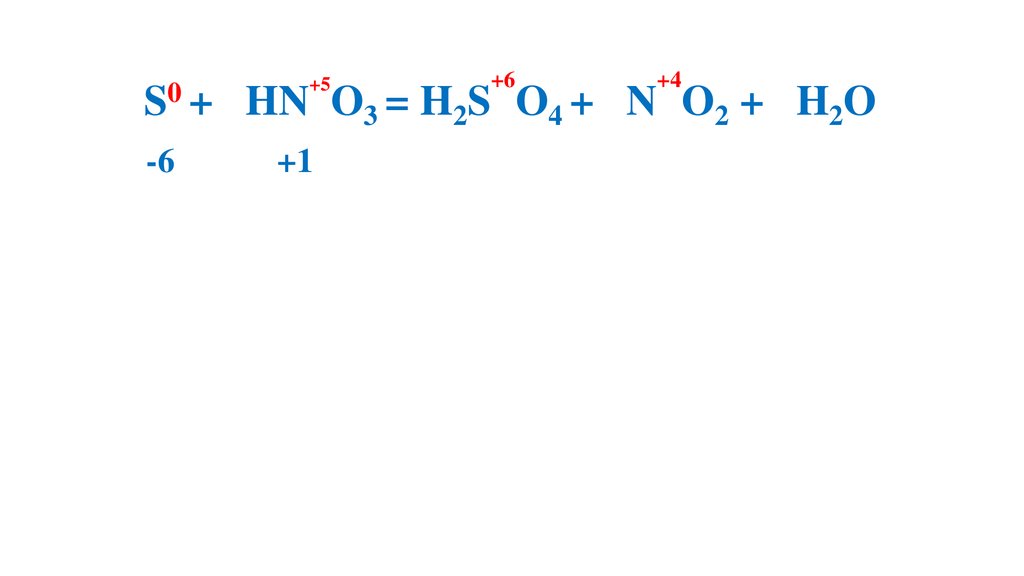
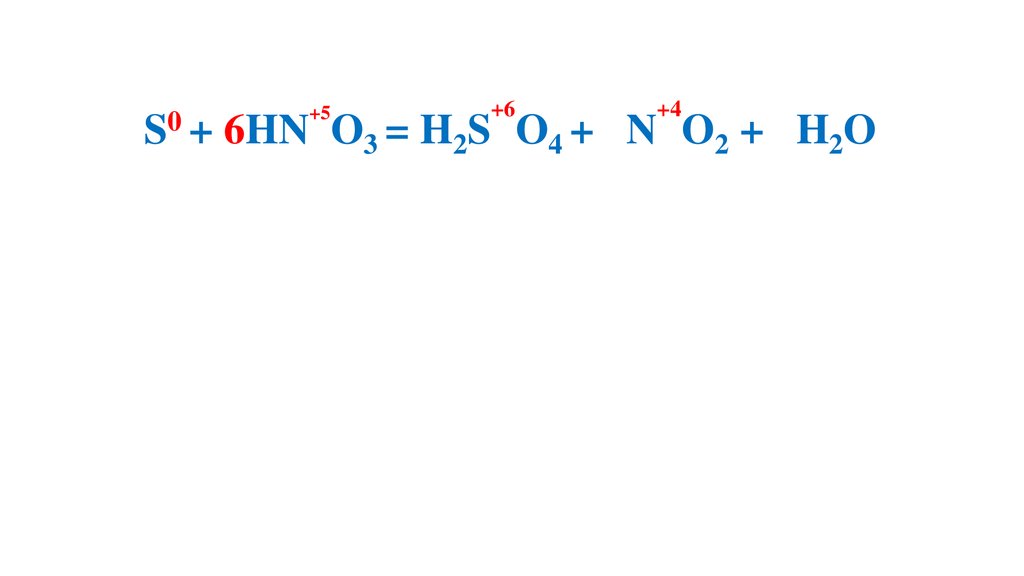
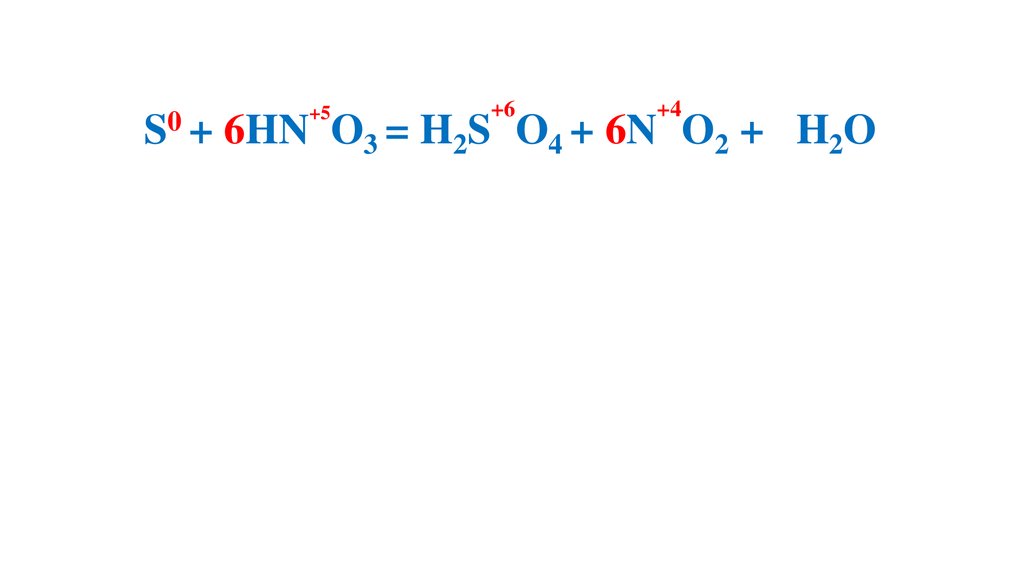
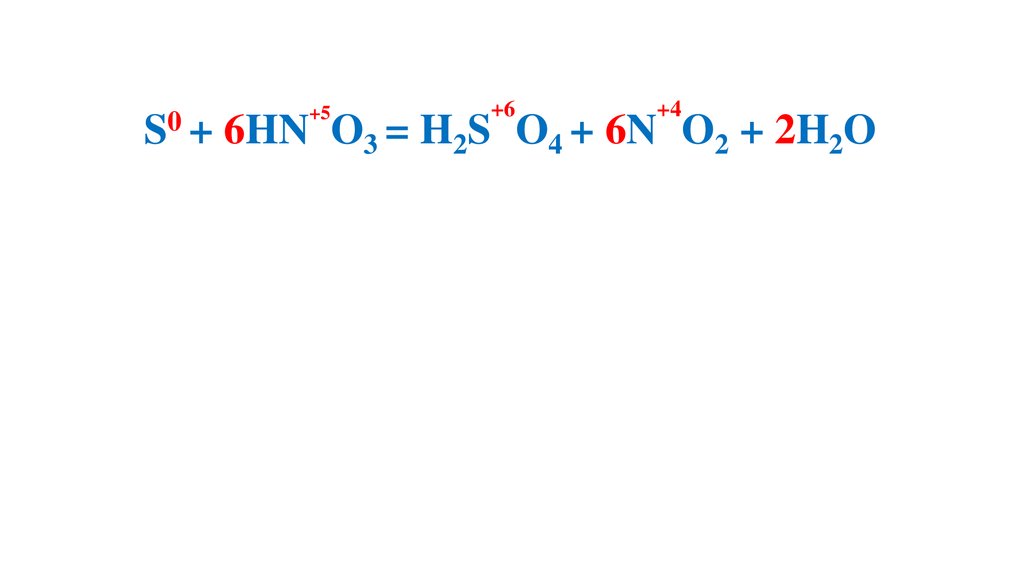
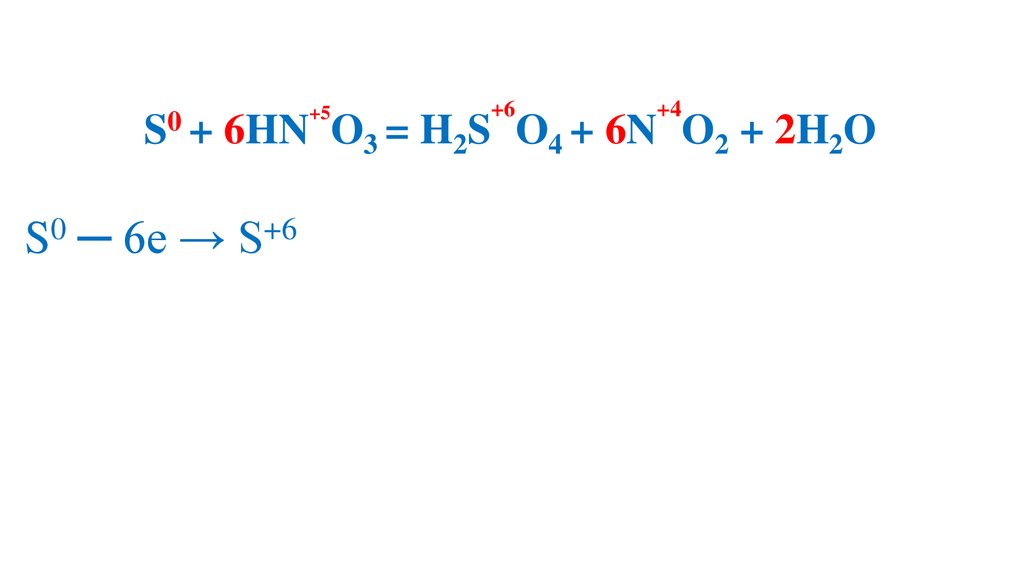
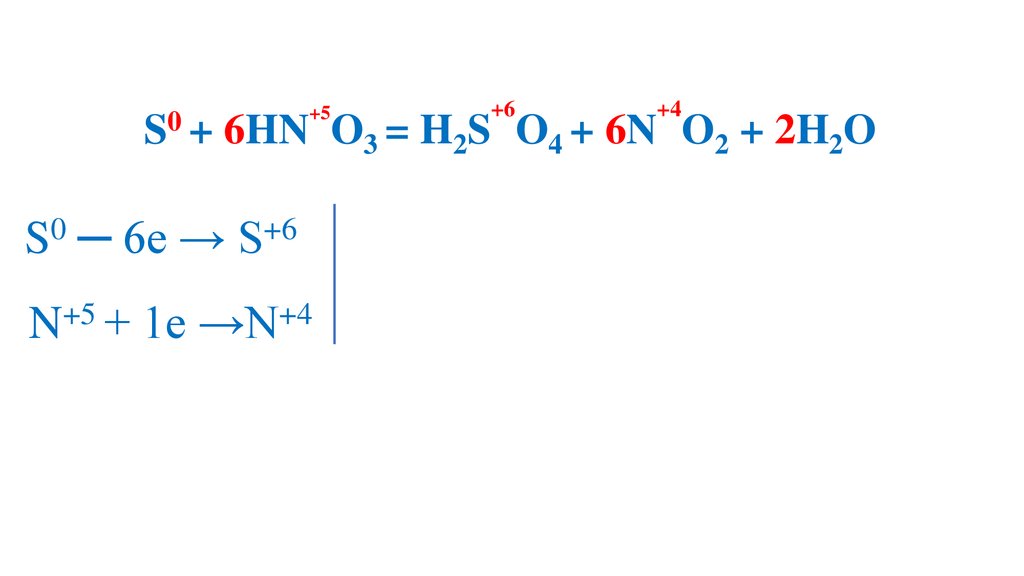
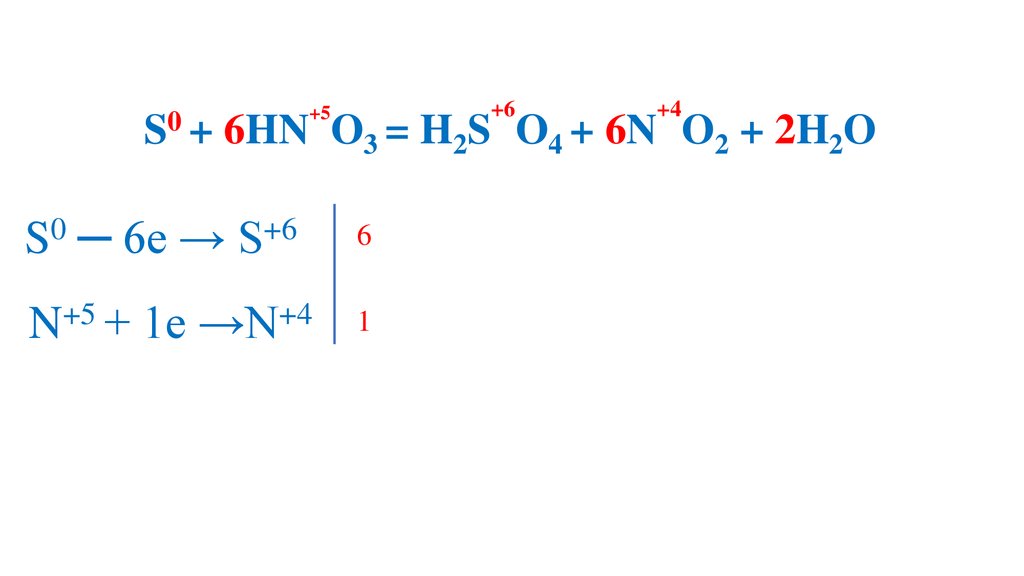
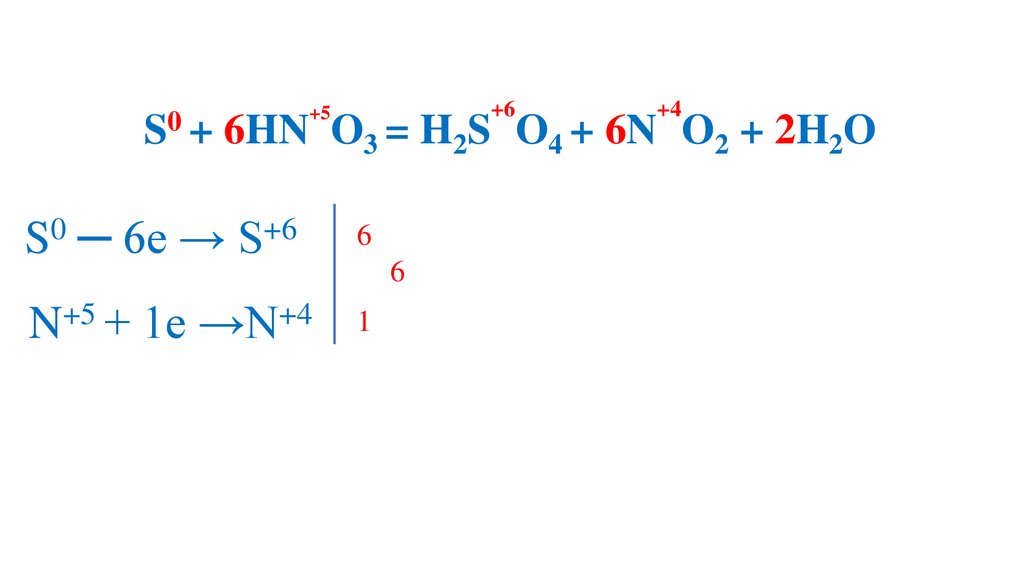
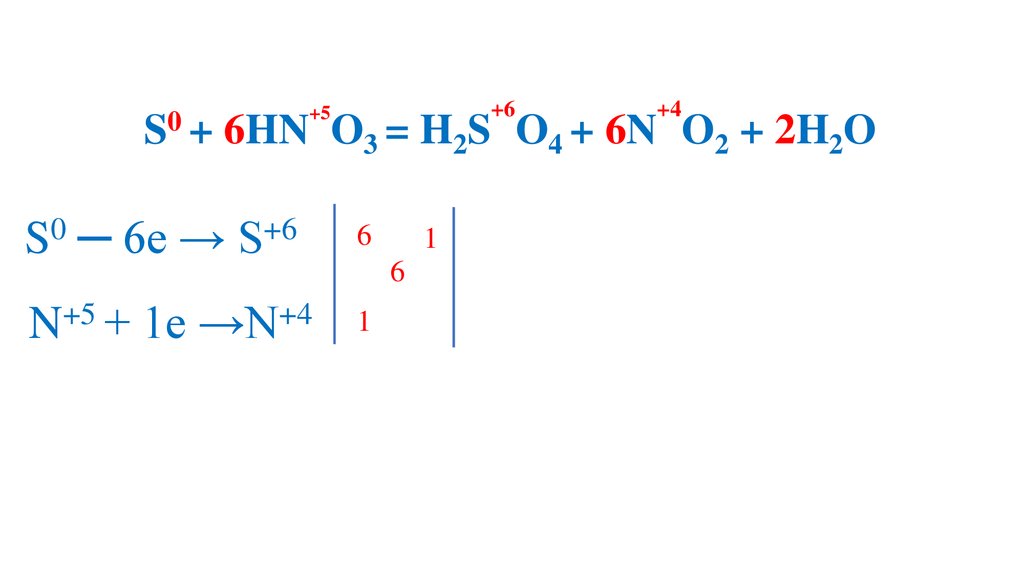
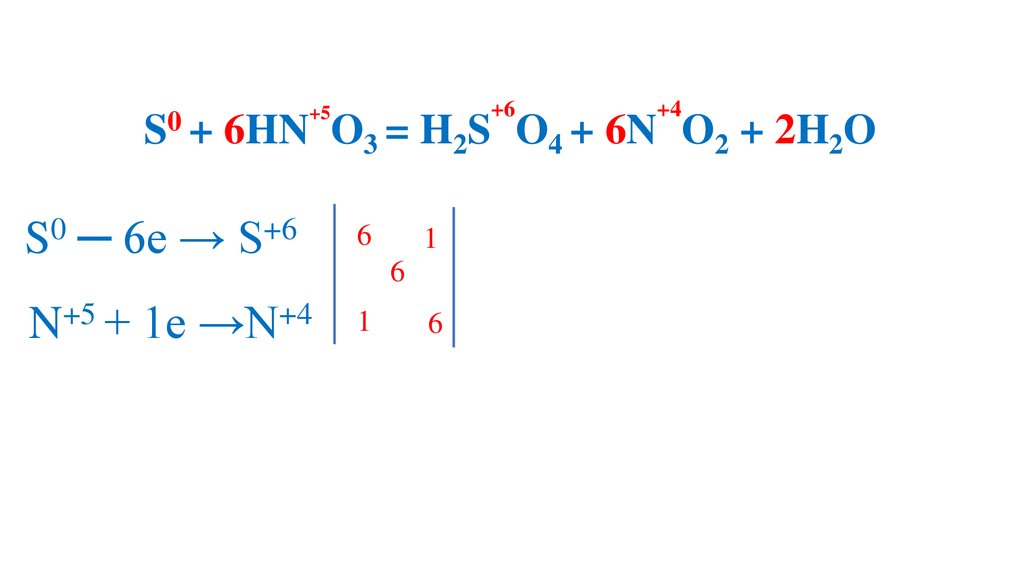






 chemistry
chemistry