Similar presentations:
Презентация_9_класс_Гидролиз_солей
1. Гидролиз солей
2.
Процесс распада электролитов на ионы в водномрастворе или расплаве называется
электролитической диссоциацией.
Положительные ионы называют катионами,
отрицательные ионы – анионами.
К катионам относятся: ион водорода и ионы металлов,
катионы основных солей.
К анионам относятся: гидроксид-ион, ионы кислотных
остатков, анионы кислых солей.
3.
Диссоциация растворимых солей(электролитов):
NaCI → Na+ + CIBaI2 → Ba2+ + 2IK3PO4 → 3K+ + PO43AI2(SO4)3 → 2AI3+ + 3SO42-
4. Существуют 4 типа солей:
соль образованная1. сильной кислотой и слабым основанием
(AlCl3, Ba(NO3)2);
2. сильным основанием и слабой кислотой (Na2S,
Li2SO3);
3. сильным основанием и сильной кислотой (NaCl,
LiNO3);
4. слабым основанием и слабой кислотой (Al2S3,
СН3СООNH4, Cr2(CO3)3).
5.
В чистой воде соотношение ионов водородаи гидроксид-ионов равное:
Н+ = ОН- (среда нейтральная)
При добавлении кислоты равновесие
нарушается:
Н+ > ОН- (среда раствора кислая)
При добавлении щёлочи:
Н+ < ОН- (среда раствора щелочная)
6. Изменение цвета различных индикаторов при действии растворов кислот и щелочей
ИндикаторКислая среда
рН < 7
Нейтральная
среда рН = 7
Щелочная
среда рН > 7
Лакмус
Красный
Фиолетовый
Синий
Фенолфталеин
Бесцветный
Бесцветный
Малиновый
Метиловый
оранжевый
Розовый
Оранжевый
Желтый
7.
«ГИДРОЛИЗ» - от греческого«гидро» - вода и «лизис» разложение.
ГИДРОЛИЗ – это реакция обмена между
некоторыми солями и водой
приводящая к образованию слабого
электролита.
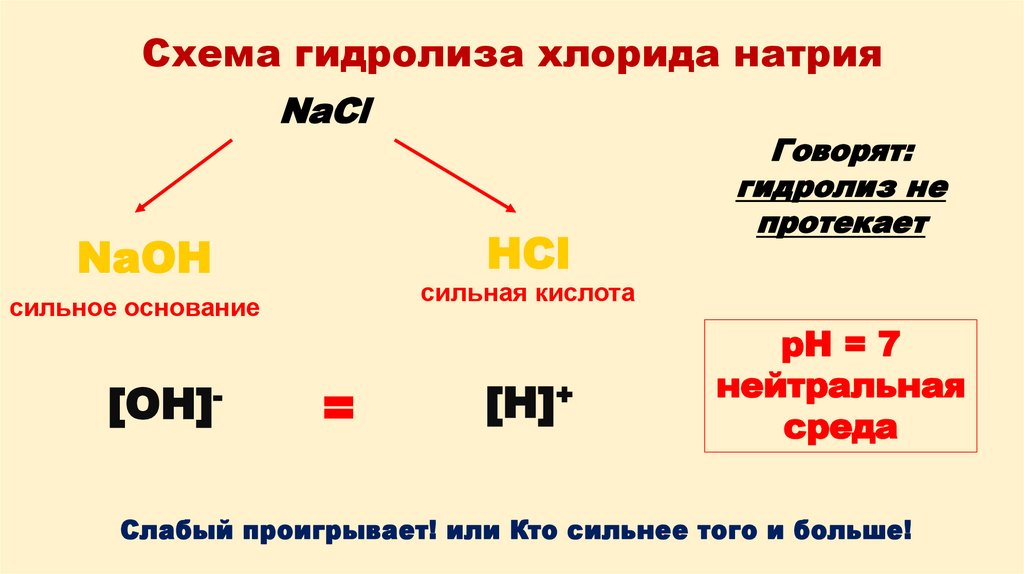
8. Схема гидролиза хлорида натрия
NaClHCl
NaOH
сильная кислота
сильное основание
[OH]-
Говорят:
гидролиз не
протекает
=
[H]+
pH = 7
нейтральная
среда
Слабый проигрывает! или Кто сильнее того и больше!
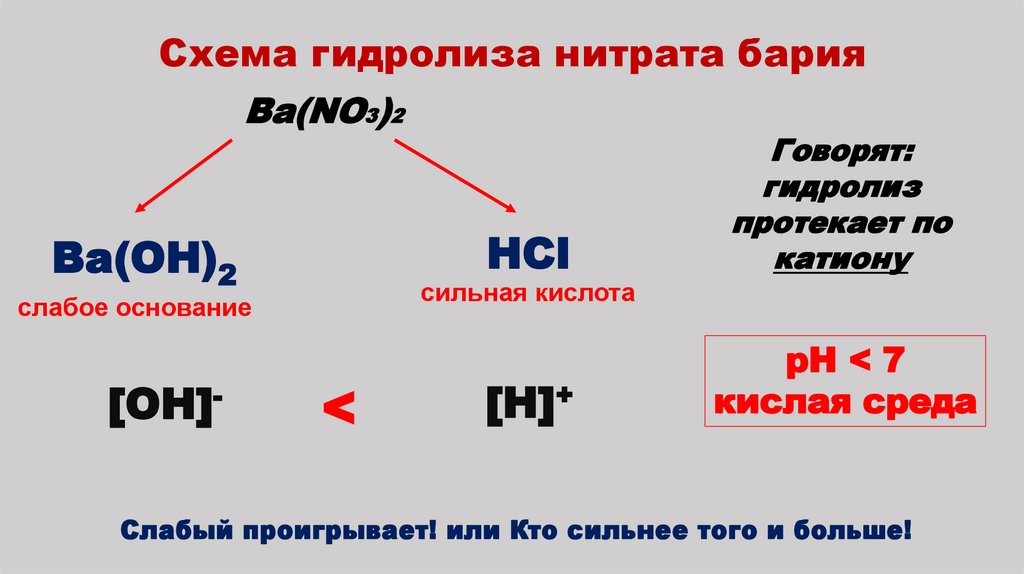
9. Схема гидролиза нитрата бария
Ba(NO3)2HCl
Ba(OH)2
сильная кислота
слабое основание
[OH]-
Говорят:
гидролиз
протекает по
катиону
<
[H]+
pH < 7
кислая среда
Слабый проигрывает! или Кто сильнее того и больше!
10.
Уравнение гидролиза нитрата барияBa2+ + HOH → BaOH+ + H+
Ba(NO3)2 + H2O → Ba(OH)NO3 + HNO3
Одним из продуктов данной обменной
реакции является основная соль.
pH < 7
кислая среда
ВЫВОД: Раствор соли образованной слабым
основанием и сильной кислотой гидролизуется по
катиону. В растворе в свободном виде остался ион
водорода (Н+), следовательно среда раствора кислая.
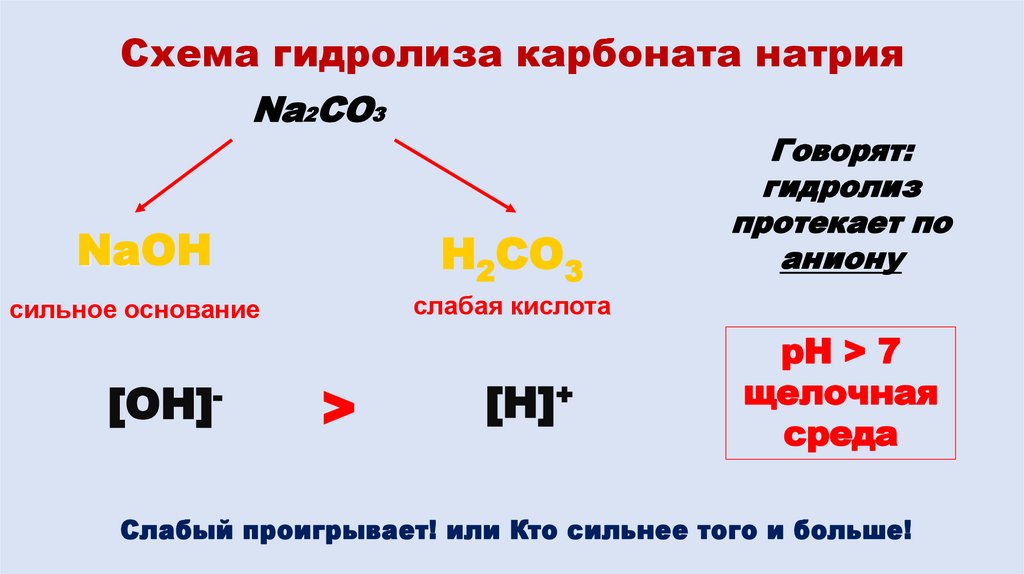
11. Схема гидролиза карбоната натрия
Na2CO3NaOH
H2CO3
сильное основание
слабая кислота
[OH]-
>
[H]+
Говорят:
гидролиз
протекает по
аниону
pH > 7
щелочная
среда
Слабый проигрывает! или Кто сильнее того и больше!
12.
Уравнение гидролиза карбоната натрияCO32- + HOH → HCO3- + OHNa2CO3 + H2O → NaHCO3 + NaOH
Одним из продуктов данной обменной
реакции является кислая соль.
pH > 7
щелочная
среда
ВЫВОД: Раствор соли образованной слабой
кислотой и сильным основанием гидролизуется по
аниону. В растворе в свободном виде осталися ионы
гидроксильных групп (ОН-), следовательно среда
раствора щелочная.
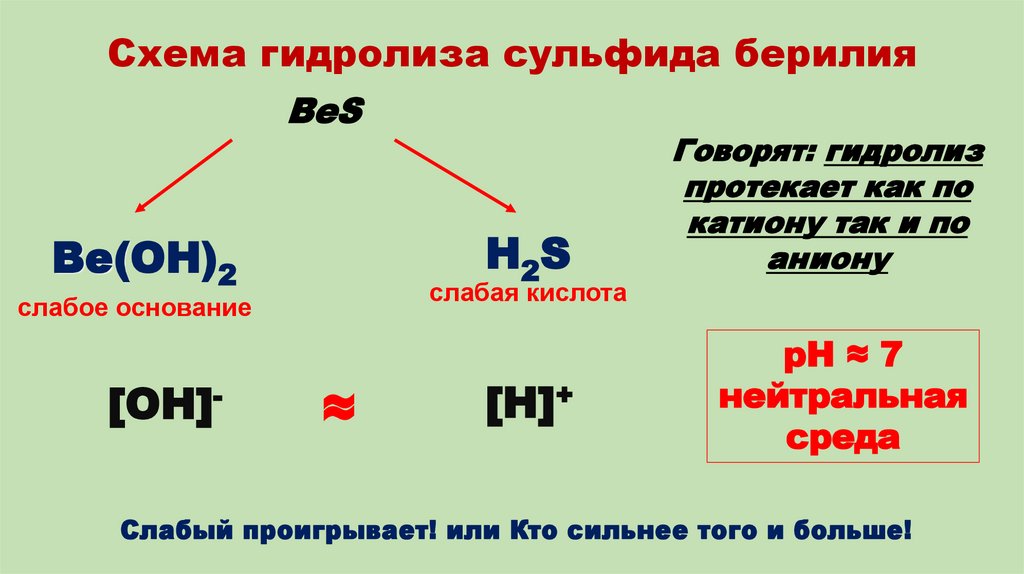
13. Схема гидролиза сульфида берилия
BeSH2S
Be(OH)2
слабая кислота
слабое основание
[OH]-
Говорят: гидролиз
протекает как по
катиону так и по
аниону
≈
[H]+
pH ≈ 7
нейтральная
среда
Слабый проигрывает! или Кто сильнее того и больше!
14.
Уравнение гидролиза сульфидаберилия
BeS + HOH → HCO3- + OH-
BeS + 2H2O → Bе(OH)2↓ + H2S↑
Одним из продуктов данной обменной реакции
является слабая кислота и слабое основание.
pH ≈ 7
нейтральная
среда
ВЫВОД: Раствор соли образованной слабым основанием и слабой
кислотой гидролизуется по катиону и аниону. Среда раствора
оказывается
близкой
к
нейтральной
(слабокислая
или
слабощелочная).
15. Домашнее задание
1.Установите соответствие между названием соли иотношением её к гидролизу.
НАЗВАНИЕ СОЛИ
ОТНОШЕНИЕ К
ГИДРОЛИЗУ
1.Гидролизуется по катиону
А) сульфид цезия
2.Гидролизуется по аниону
Б) сульфат алюминия
3.Гидролизуется по катиону
В) карбонат натрия
и аниону
Г) ацетат аммония
4.Не гидролизуется
А
Б
В
Г
16. Домашнее задание
2. Напишите уравнения гидролиза солей:а. Na3PO4
б. KCl
в. Na2CO3
г. ZnSO4
д. FeCl3
е. K2SO4
ж. Na2CO3
з. BaCl2












 chemistry
chemistry








