Similar presentations:
Ферментативный характер клеточного метаболизма
1. Ферментативный характер реакций клеточного метаболизма
10 класс(углубленный уровень)
2.
ПроблемаМногие биохимические реакции в условиях клетки (37°C,
нейтральный pH) протекали бы чрезвычайно медленно
(например, гидролиз белков в отсутствие ферментов занял бы
сотни лет).
Решение
Метаболизм – это совокупность всех химических реакций в
живом организме.
Ферменты (энзимы) – биологические катализаторы
белковой природы, ускоряющие реакции в миллионы и
миллиарды раз.
3.
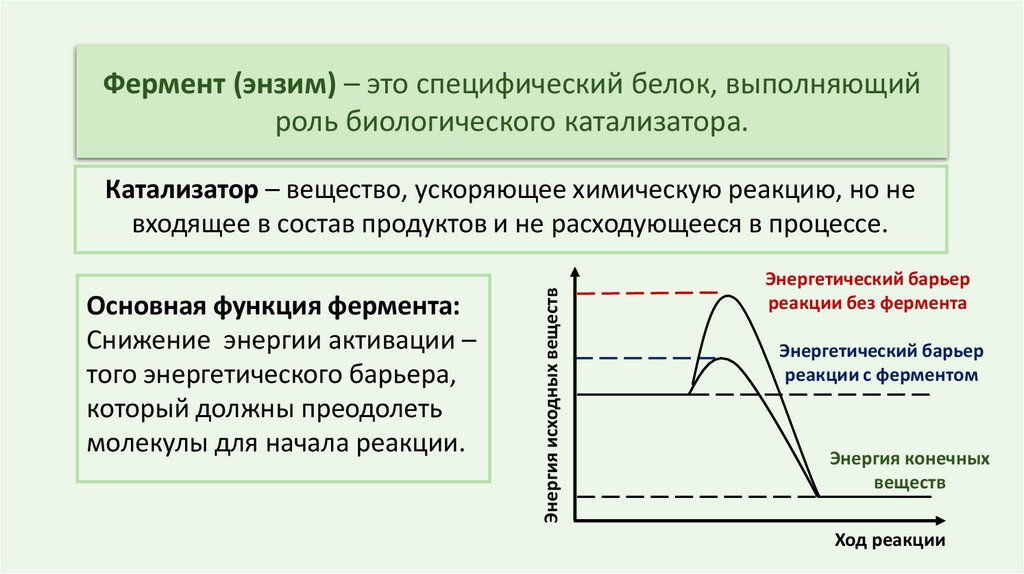
Фермент (энзим) – это специфический белок, выполняющийроль биологического катализатора.
Основная функция фермента:
Снижение энергии активации –
того энергетического барьера,
который должны преодолеть
молекулы для начала реакции.
Энергия исходных веществ
Катализатор – вещество, ускоряющее химическую реакцию, но не
входящее в состав продуктов и не расходующееся в процессе.
Энергетический барьер
реакции без фермента
Энергетический барьер
реакции с ферментом
Энергия конечных
веществ
Ход реакции
4.
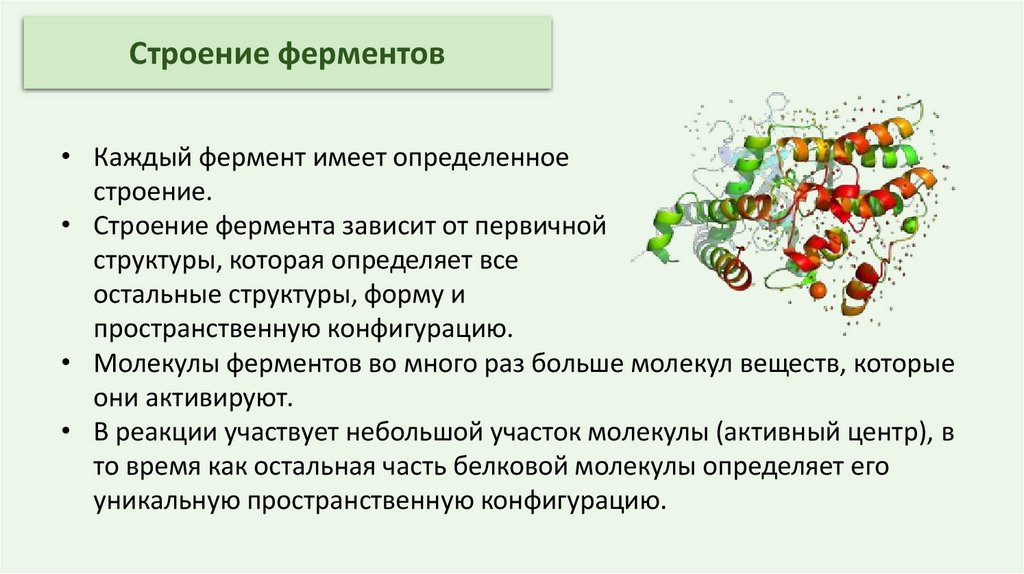
Строение ферментов• Каждый фермент имеет определенное
строение.
• Строение фермента зависит от первичной
структуры, которая определяет все
остальные структуры, форму и
пространственную конфигурацию.
• Молекулы ферментов во много раз больше молекул веществ, которые
они активируют.
• В реакции участвует небольшой участок молекулы (активный центр), в
то время как остальная часть белковой молекулы определяет его
уникальную пространственную конфигурацию.
5.
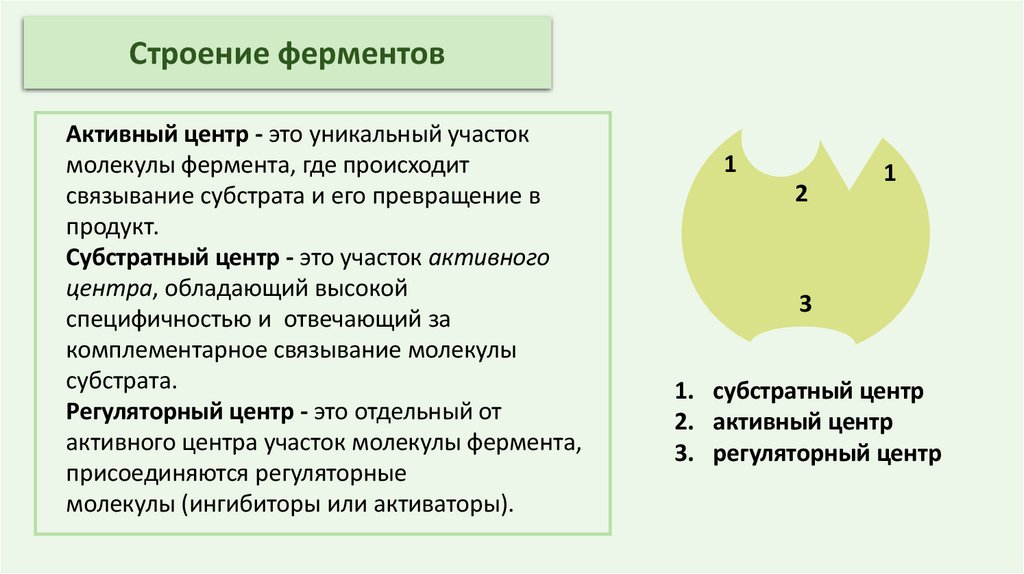
Строение ферментовАктивный центр - это уникальный участок
молекулы фермента, где происходит
связывание субстрата и его превращение в
продукт.
Субстратный центр - это участок активного
центра, обладающий высокой
специфичностью и отвечающий за
комплементарное связывание молекулы
субстрата.
Регуляторный центр - это отдельный от
активного центра участок молекулы фермента,
присоединяются регуляторные
молекулы (ингибиторы или активаторы).
1
2
1
3
1. субстратный центр
2. активный центр
3. регуляторный центр
6.
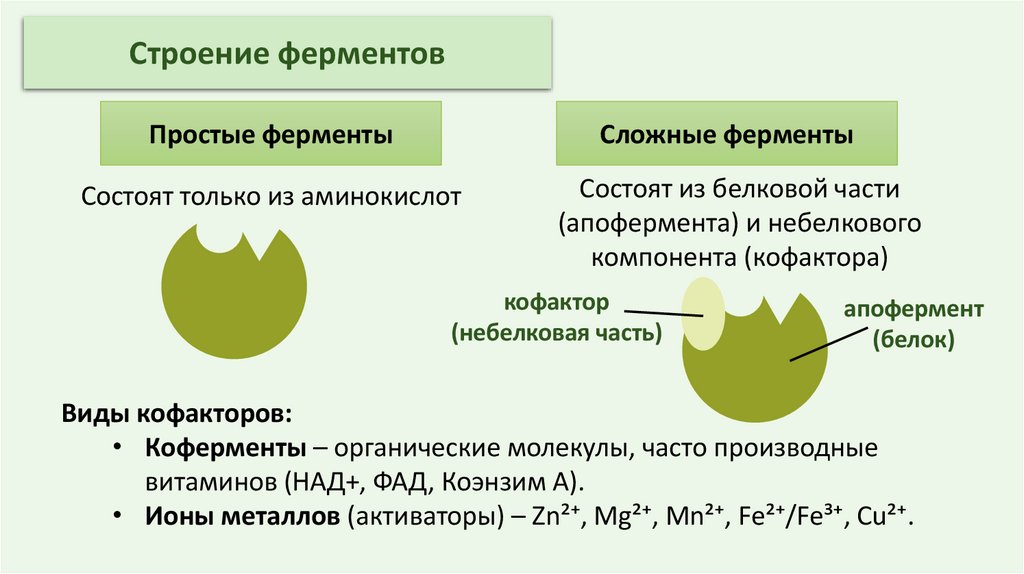
Строение ферментовПростые ферменты
Сложные ферменты
Состоят только из аминокислот
Состоят из белковой части
(апофермента) и небелкового
компонента (кофактора)
кофактор
(небелковая часть)
апофермент
(белок)
Виды кофакторов:
• Коферменты – органические молекулы, часто производные
витаминов (НАД+, ФАД, Коэнзим А).
• Ионы металлов (активаторы) – Zn²⁺, Mg²⁺, Mn²⁺, Fe²⁺/Fe³⁺, Cu²⁺.
7.
КоферментыКофермент – небольшая органическая небелковая молекула,
необходимая для функционирования многих ферментов.
Функция: Перенос химических групп или атомов между разными субстратами.
Пример: НАД+ (никотинамидадениндинуклеотид) переносит ионы
водорода (H⁻) в реакциях окисления-восстановления.
Связь с витаминами: Большинство коферментов – это производные
витаминов.
• НАД+ – из витамина PP (ниацин),
• ФАД – из витамина B₂ (рибофлавин),
• Коэнзим А – из пантотеновой кислоты (B₅).
Важно: Кофермент не остается в составе продукта, а регенерируется и
используется повторно.
8.
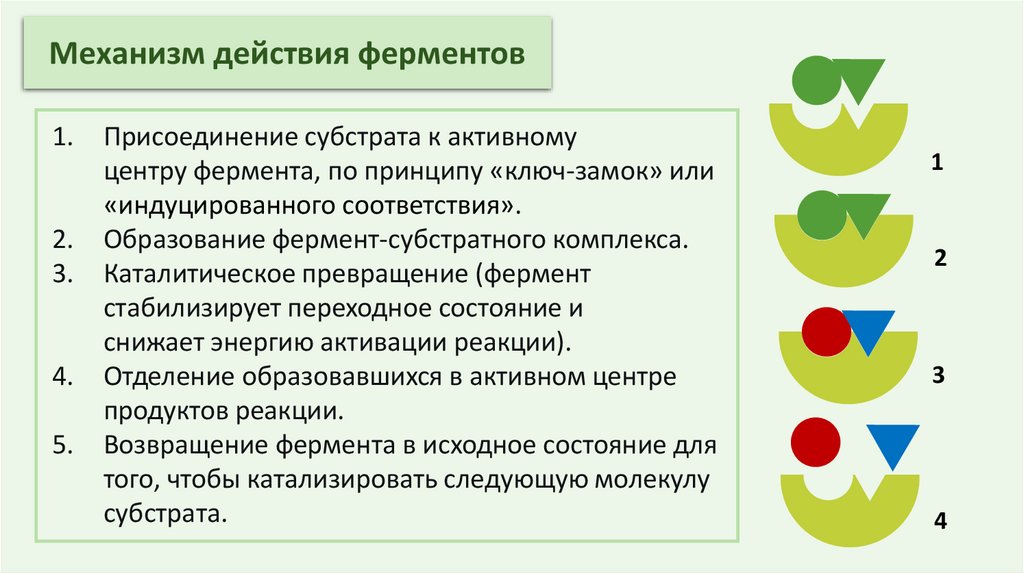
Механизм действия ферментов1.
2.
3.
4.
5.
Присоединение субстрата к активному
центру фермента, по принципу «ключ-замок» или
«индуцированного соответствия».
Образование фермент-субстратного комплекса.
Каталитическое превращение (фермент
стабилизирует переходное состояние и
снижает энергию активации реакции).
Отделение образовавшихся в активном центре
продуктов реакции.
Возвращение фермента в исходное состояние для
того, чтобы катализировать следующую молекулу
субстрата.
1
2
3
4
9.
Свойства ферментовВысокая специфичность
Ферменты обладают абсолютной
специфичностью, действуя только на один
определенный субстрат или небольшую
группу сходных субстратов. Эта
избирательность обеспечивается уникальным
строением активного центра, который
комплементарен субстрату по принципу
«ключ-замок». Благодаря этому в клетке
возможны тысячи параллельных и не
мешающих друг другу химических реакций.
субстрат
фермент
ферментсубстратный
комплекс
10.
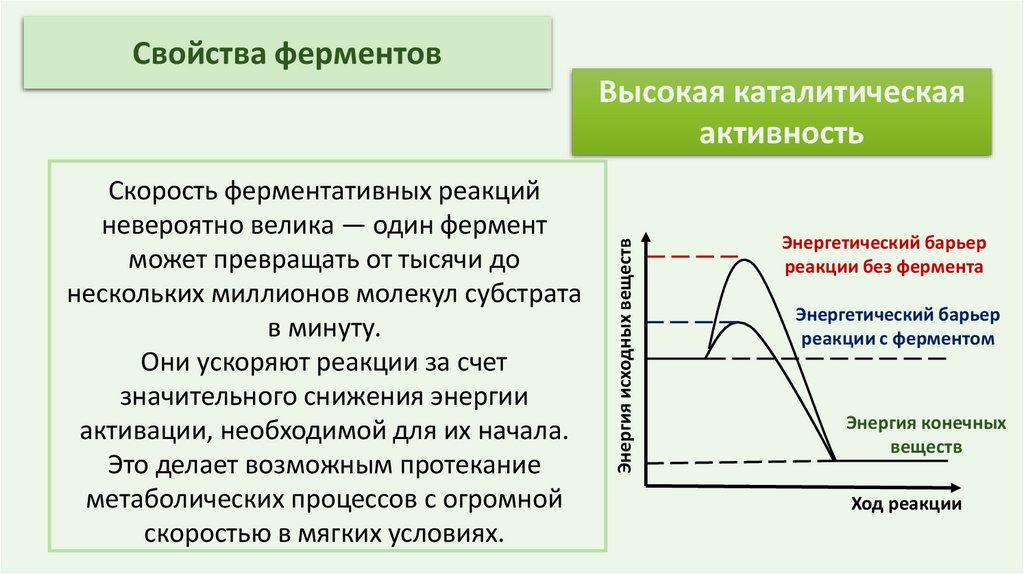
Свойства ферментовСкорость ферментативных реакций
невероятно велика — один фермент
может превращать от тысячи до
нескольких миллионов молекул субстрата
в минуту.
Они ускоряют реакции за счет
значительного снижения энергии
активации, необходимой для их начала.
Это делает возможным протекание
метаболических процессов с огромной
скоростью в мягких условиях.
Энергия исходных веществ
Высокая каталитическая
активность
Энергетический барьер
реакции без фермента
Энергетический барьер
реакции с ферментом
Энергия конечных
веществ
Ход реакции
11.
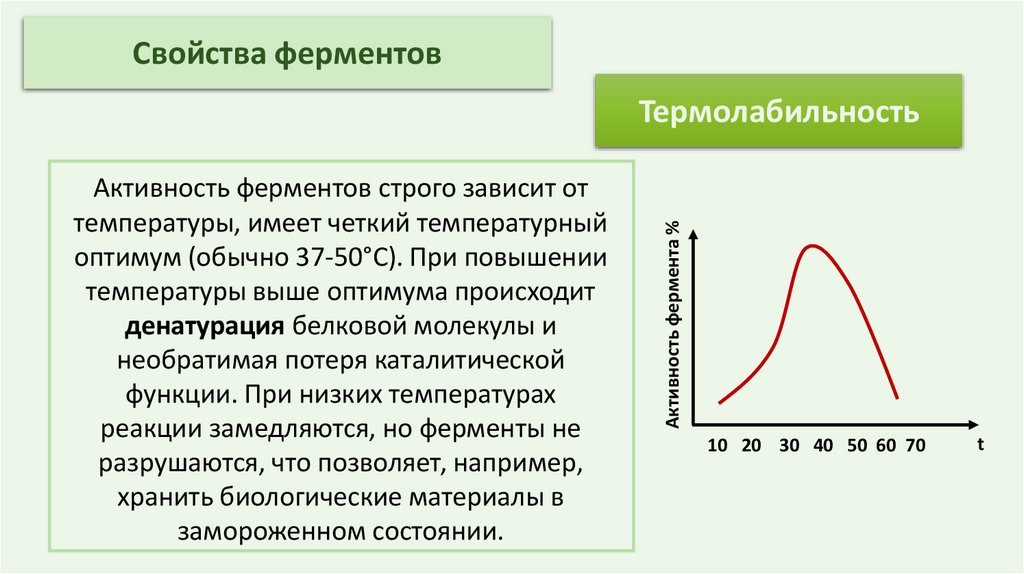
Свойства ферментовАктивность ферментов строго зависит от
температуры, имеет четкий температурный
оптимум (обычно 37-50°C). При повышении
температуры выше оптимума происходит
денатурация белковой молекулы и
необратимая потеря каталитической
функции. При низких температурах
реакции замедляются, но ферменты не
разрушаются, что позволяет, например,
хранить биологические материалы в
замороженном состоянии.
Активность фермента %
Термолабильность
10 20 30 40 50 60 70
t
12.
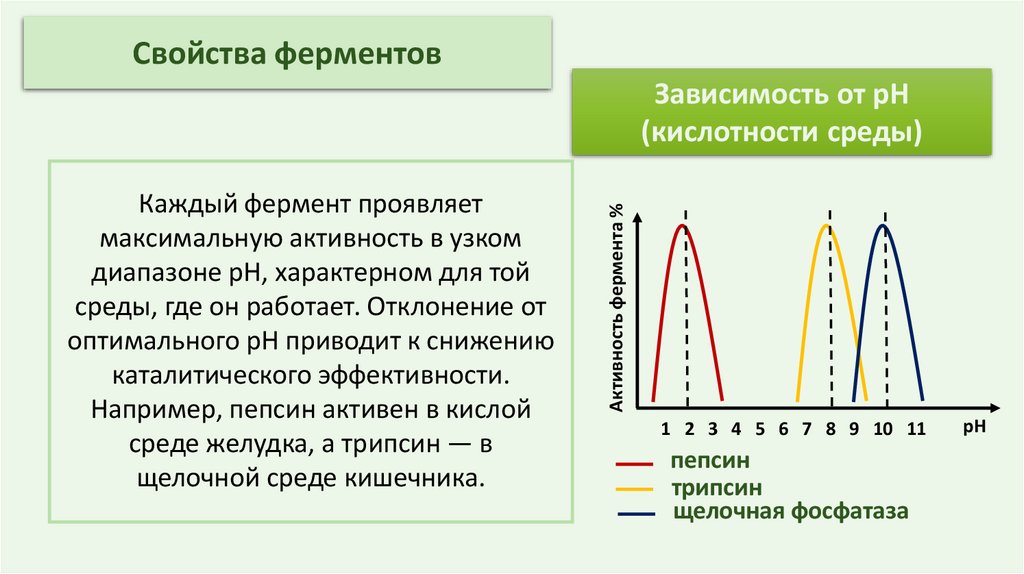
Свойства ферментовКаждый фермент проявляет
максимальную активность в узком
диапазоне pH, характерном для той
среды, где он работает. Отклонение от
оптимального pH приводит к снижению
каталитического эффективности.
Например, пепсин активен в кислой
среде желудка, а трипсин — в
щелочной среде кишечника.
Активность фермента %
Зависимость от pH
(кислотности среды)
1 2 3 4 5 6 7 8 9 10 11
пепсин
трипсин
щелочная фосфатаза
pH
13.
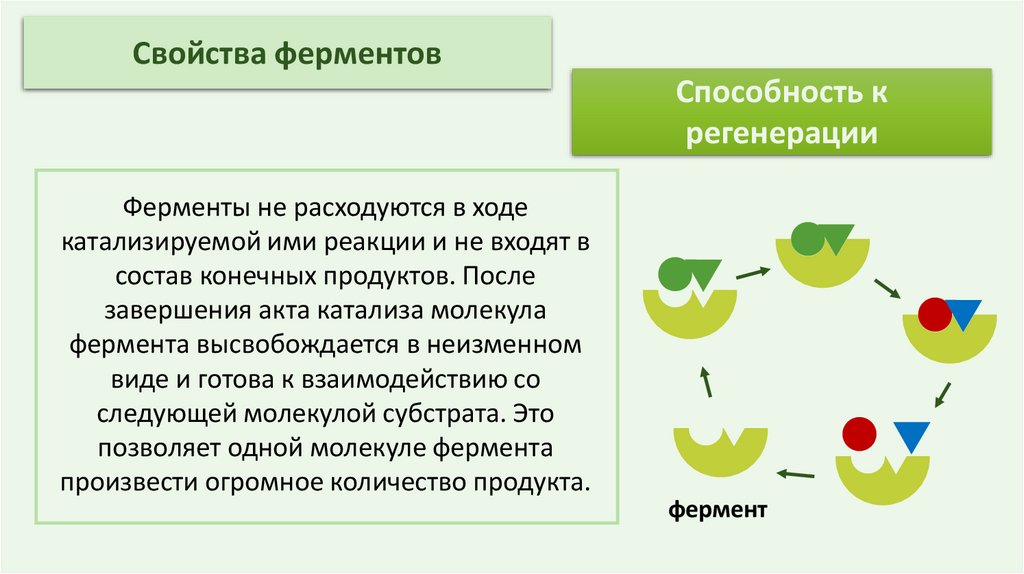
Свойства ферментовСпособность к
регенерации
Ферменты не расходуются в ходе
катализируемой ими реакции и не входят в
состав конечных продуктов. После
завершения акта катализа молекула
фермента высвобождается в неизменном
виде и готова к взаимодействию со
следующей молекулой субстрата. Это
позволяет одной молекуле фермента
произвести огромное количество продукта.
фермент
14.
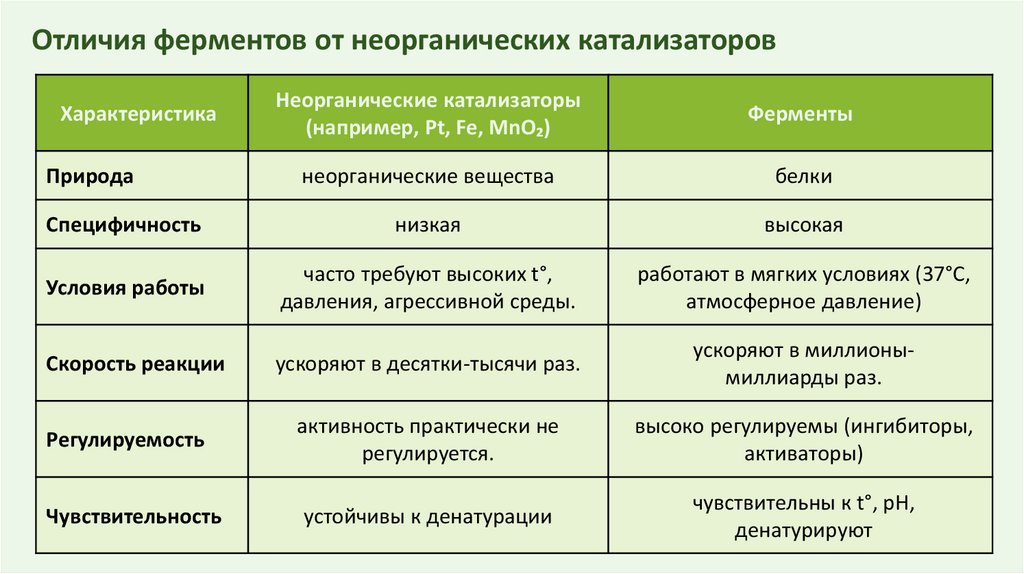
Отличия ферментов от неорганических катализаторовНеорганические катализаторы
(например, Pt, Fe, MnO₂)
Ферменты
неорганические вещества
белки
Специфичность
низкая
высокая
Условия работы
часто требуют высоких t°,
давления, агрессивной среды.
работают в мягких условиях (37°C,
атмосферное давление)
Скорость реакции
ускоряют в десятки-тысячи раз.
ускоряют в миллионымиллиарды раз.
Регулируемость
активность практически не
регулируется.
высоко регулируемы (ингибиторы,
активаторы)
Чувствительность
устойчивы к денатурации
чувствительны к t°, pH,
денатурируют
Характеристика
Природа
15.
Значение ферментовВ клетках живых организмов ферменты обеспечивают все этапы
метаболизма (дыхание, фотосинтез, синтез и распад веществ).
В медицине:
• диагностика (уровень ферментов в крови указывает на патологии:
АЛТ, АСТ при инфаркте, гепатите);
• лечение (ферментные препараты для улучшения процессов
пищеварения);
В промышленности:
• пищевая (сыроварение, производство соков);
• производство моющих средств (ферменты, расщепляющие белки
и жиры);
• генная инженерия (рестрикционные эндонуклеазы, ДНК-лигазы).
16.
ВыводыФерменты – это высокоспецифичные белковые катализаторы,
жизненно необходимые для метаболизма.
Их строение может быть простым или сложным.
Действие основано на снижении энергии активации путем
образования фермент-субстратного комплекса по механизму
индуцированного соответствия.
Ферменты превосходят неорганические катализаторы по
специфичности, скорости и способности к регуляции.
Активность ферментов зависит от условий и может регулироваться
ингибиторами.






 biology
biology








