Similar presentations:
Ферменты. Строение, свойства ферментов. Лекция №3
1.
Лекция №3.Ферменты. Строение, свойства ферментов.
Вопросы:
1.Общие и специфические свойства ферментов.
2.Общие принципы строения ферментов.
3.Коферменты: строение, представители, функции.
4.Активный центр фермента: строение, свойства.
5.Специфичность действия ферментов.
6. Механизм действия ферментов.
7. Кинетика ферментативных реакций.
8.Классификация ферментов.
9.Области применения ферментов.
2.
Свойства ферментов:Общие с химическими катализаторами:
• не входят в состав конечных продуктов реакции;
• не катализируют реакции, противоречащие законам термодинамики;
• не смещают положения равновесия реакции ( ускоряют его);
Специфические свойства ферментов:
• белки по хим.строению, размеры их молекул больше молекул
субстратов;
• скорость реакции на несколько порядков выше, чем при участии хим.
катализаторов;
• специфичность действия ферментов;
• регуляция ферментов;
• в ферментативных реакциях почти 100% выход продуктов;
3.
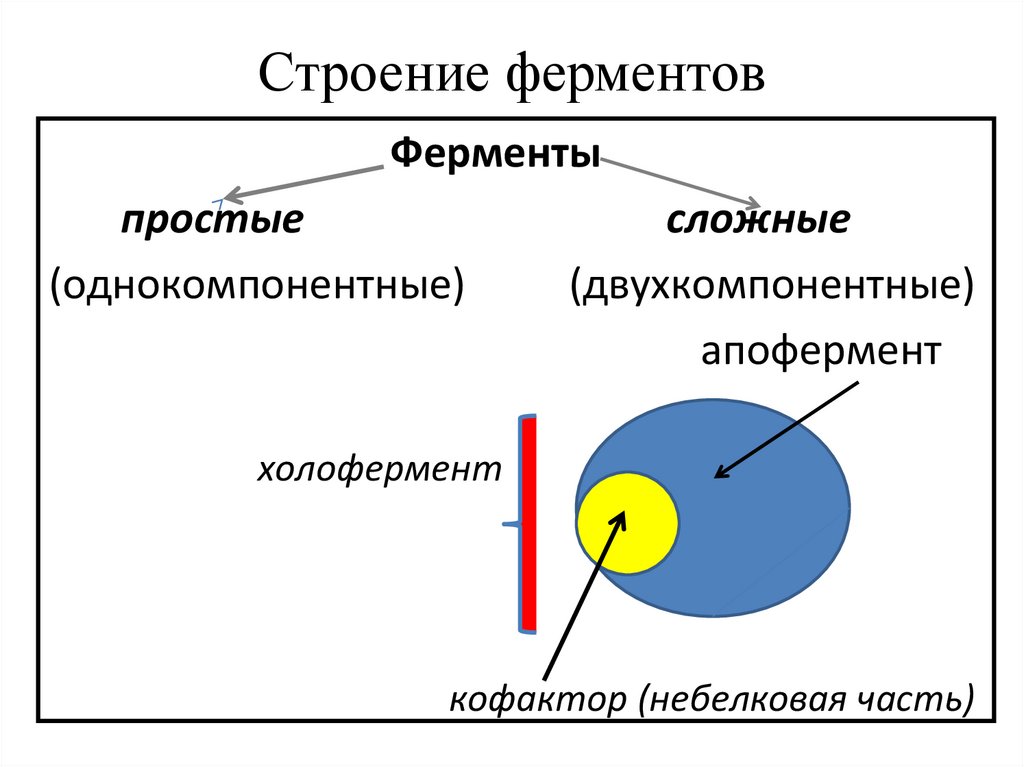
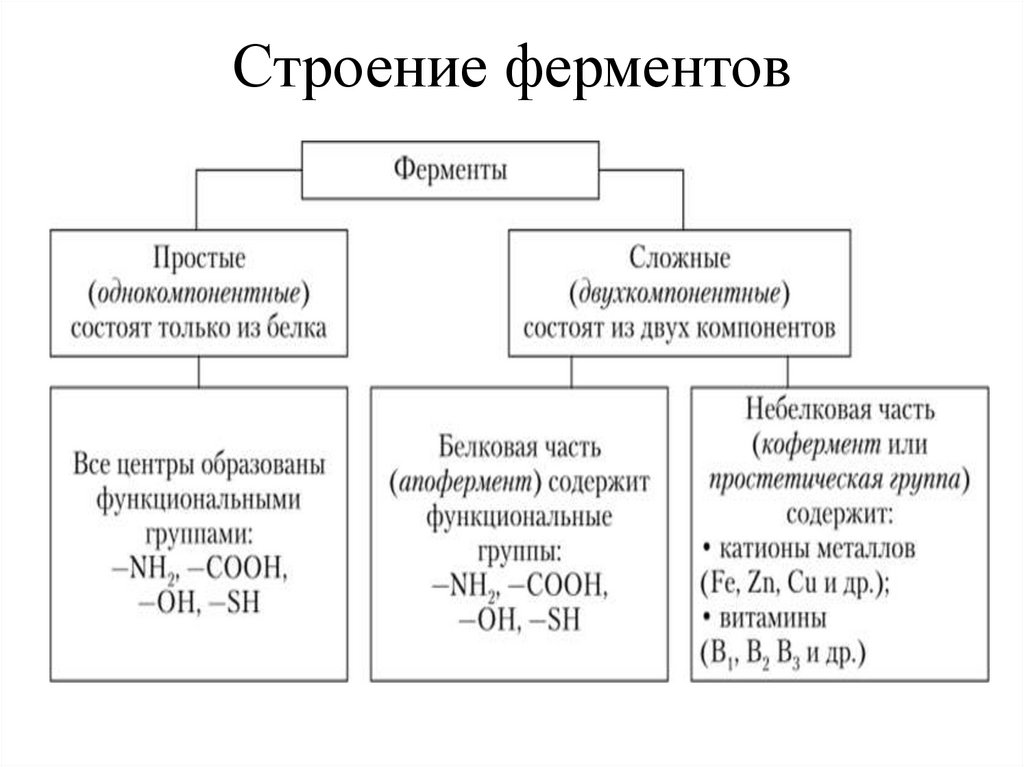
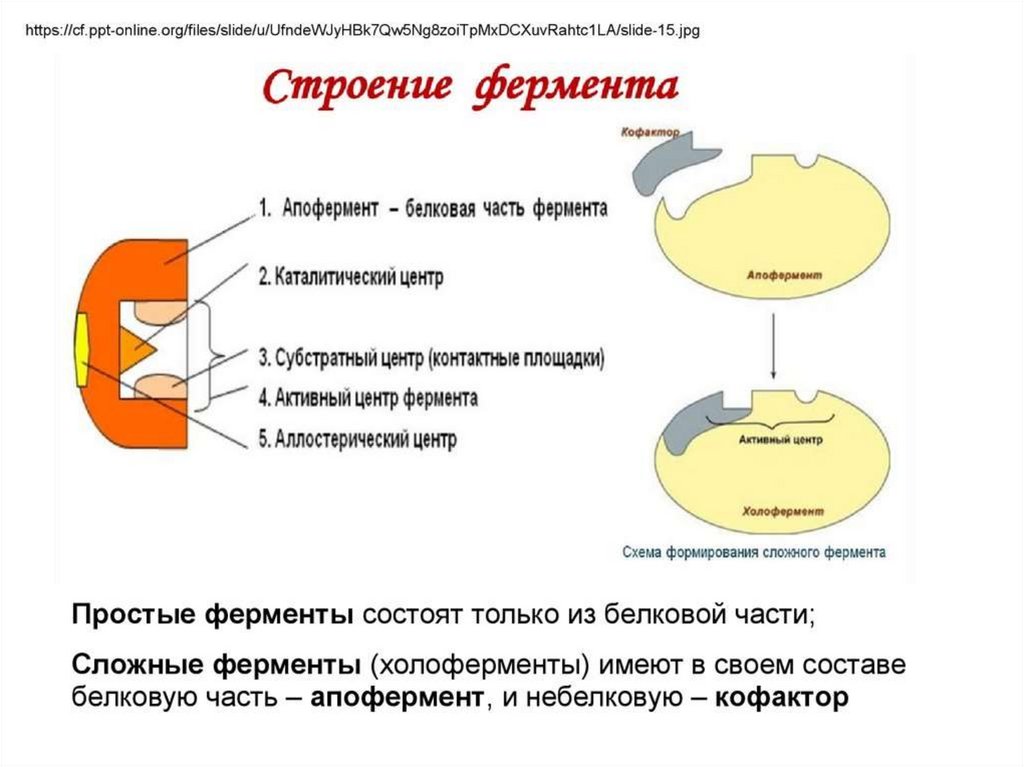
Строение ферментовФерменты
простые
(однокомпонентные)
сложные
(двухкомпонентные)
апофермент
холофермент
кофактор (небелковая часть)
4.
Строение ферментов5.
Кофакторы• простетическая группа ( прочно связана с
апоферментом и в ходе реакции не
отсоединяется от него)
• коферменты ( легко диссоциируют от
комплекса с апоферментом в ходе
ферментативной реакции)-действуют как
акцепторы или доноры атомов или
функциональных групп
6.
Строение ферментов7.
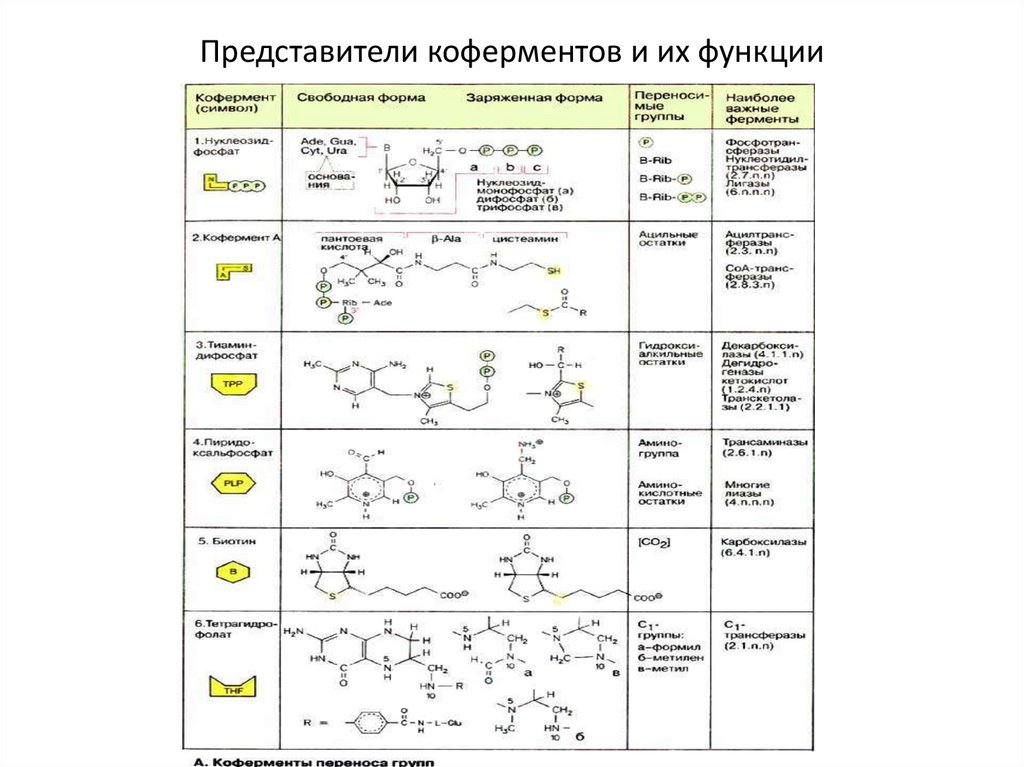
Представители коферментов и их функции8.
Коферменты и витаминыВитамин
Коферментная форма
Тип катализируемой реакции
Водорастворимые витамины
Тиамин (В1)
Тиаминпирофосфат
Декарбоксилирование a-кетокислот
Рибофлавин (В2)
Флавинмононуклеотид,
флавинадениндинуклеотид
Окислительно-восстановительные
реакции
Никотиновая
кислота
Никотинамидадениндинуклеотид, никотинамидадениндинуклеотидфосфат
Окислительно-восстановительные
реакции
Пантотеновая
кислота
Кофермент (коэнзим) А
Перенос ацильных групп
Пиридоксин (В6)
Пиридоксальфосфат
Перенос аминогрупп
Биотин (H)
Биотицин
Перенос СО2
Фолиевая
кислота
Тетрагидрофолат
Перенос одноуглеродных групп
Витамин В12
Дезоксиаденозилкобаламин
Перенос связанного с углеродом атома
водорода на соседний атом углерода
Аскорбиновая
кислота (С)
Не известна
Реакции гидроксилирования
9.
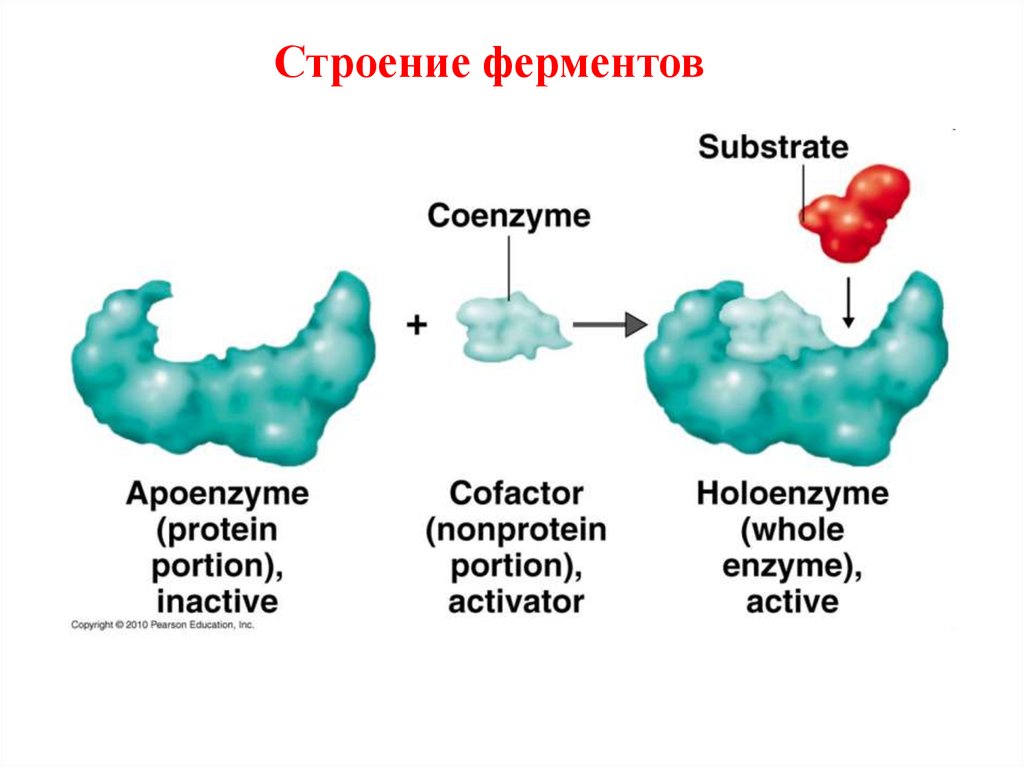
Функции апофермента и кофактора:Апофермент:
1. усиливает каталитическую активность
небелковой части;
2. определяет специфичность действия фермента;
Кофактор:
1. участие в акте катализа ( перенос атомов,
функ.групп с одного соединения на другое);
2. осуществление контакта между ферментом и
субстратом;
3. стабилизация апофермента;
10.
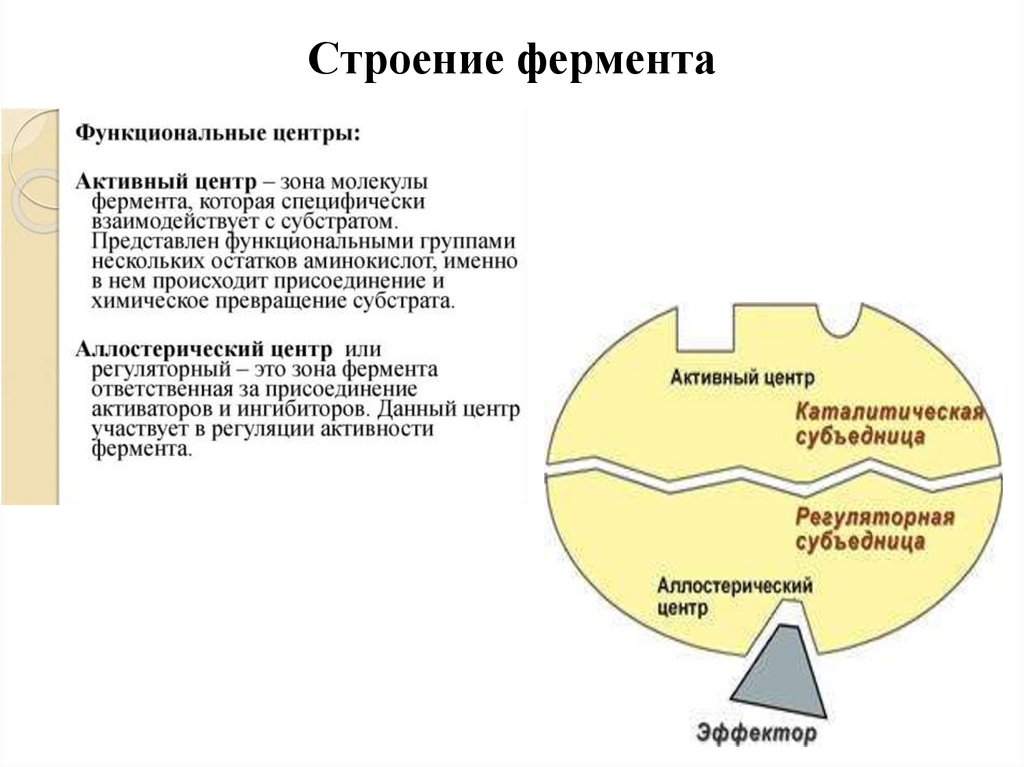
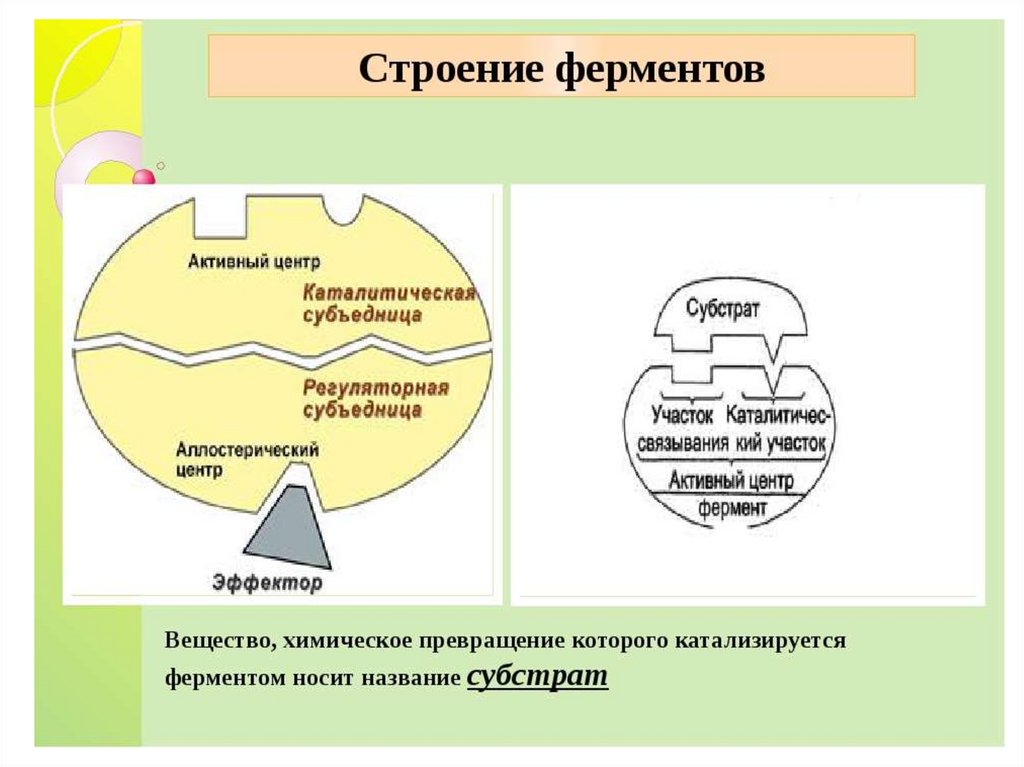
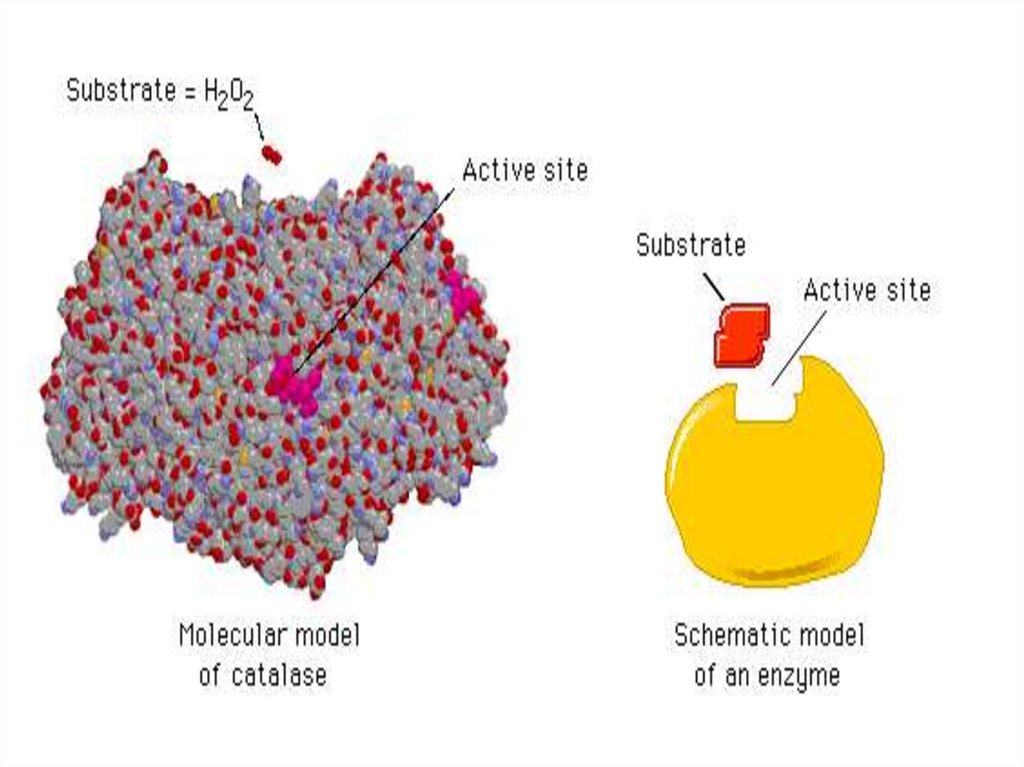
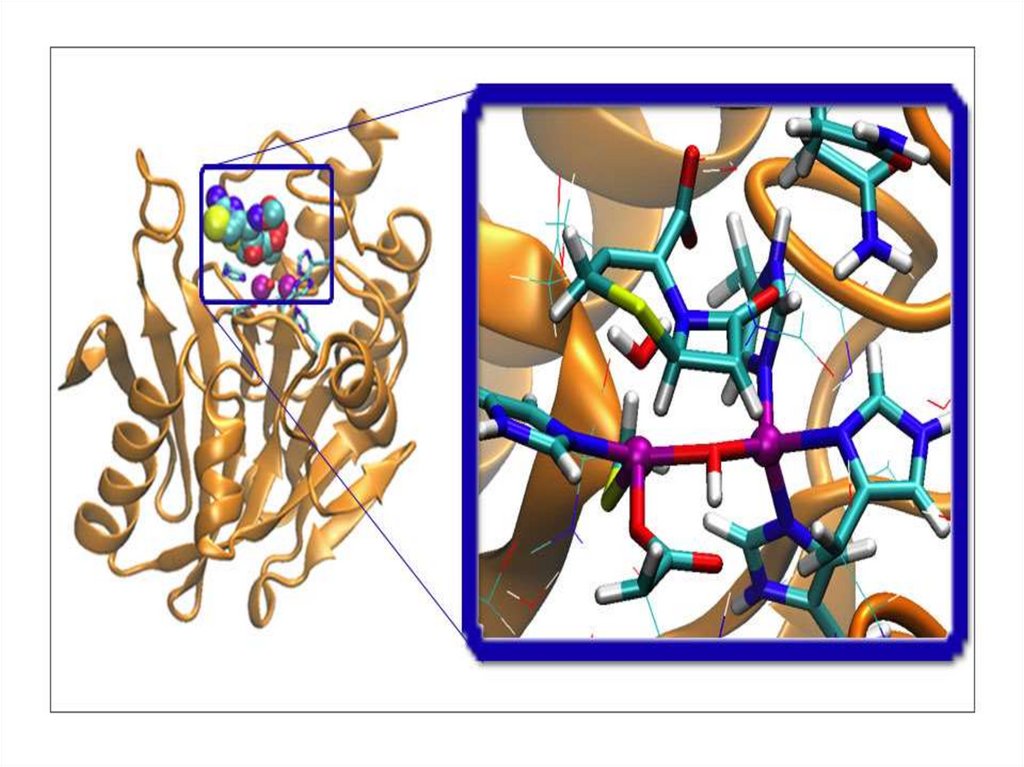
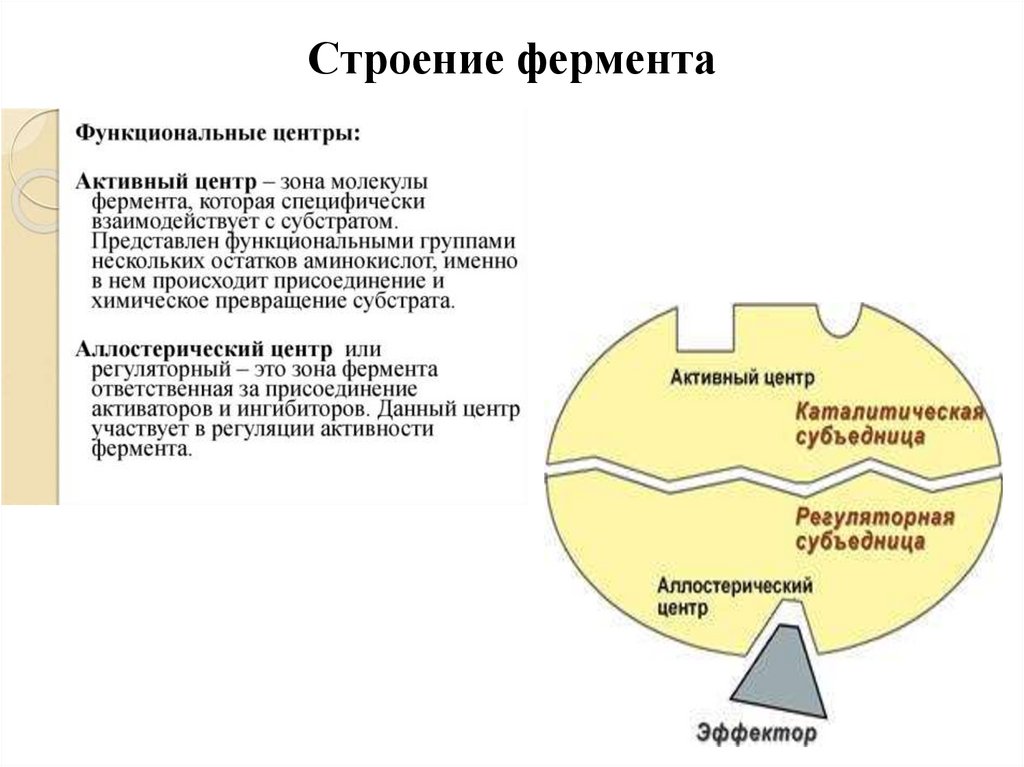
Строение фермента11.
Активный центр ферментаАктивный центр фермента – участок молекулы
фермента, в котором происходит связывание и
превращение субстрата.
Пространственная структура активного
центра определяет:
1. Строение соединения, которое стереохимически
комплементарно этому центру;
2. Природу превращений субстрата, приводящих к
образованию соответствующего продукта;
12.
13.
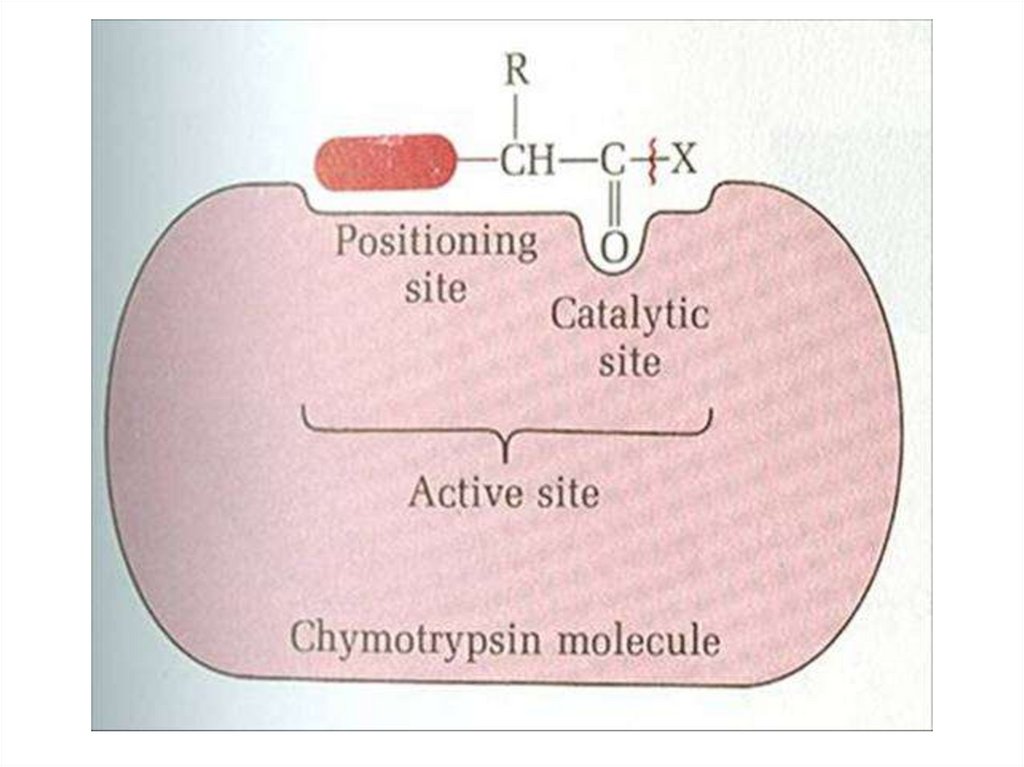
Активный центркаталитическая зона
те функциональные группы
активного центра, которые
контактируют с подвергающимися
превращению фрагментами
молекул субстрата ( принимают
непосредственное участие в
синтезе и расщеплении связи
субстрата)
зона связывания
группы, контактирующие с
непревращаемыми фрагментами
субстрата, и укрепляющие его в
активном центре
В составе активных центров наиболее часто
встречаются следующие аминокислоты:
Ser, His, Tre, Cys, Gln, Asn, Arg, Lys
14.
15.
Свойства активного центра:• 1. Активный центр- небольшая часть общего
объема молекулы фермента
• 2. Активный центр- трехмерное образование
• 3. Субстраты относительно слабо связаны с
ферментом
• 4. Имеет форму узкого углубления или щели
• 5. Специфичность связывания субстрата зависит
от строго определенного расположения атомов в
активном центре
16.
17.
18.
19.
20.
Специфичность действияАбсолютная
специфичность
–
фермент
катализирует превращение только одного
вещества ( уреаза, сукцинатдегидрогеназа);
Относительная
специфичностьферменты
катализируют превращение небольшой группы
близких по свойствам веществ (эстеразы,
фосфатазы, пептидазы);
Стереоспецифичность – ферменты различают
изомеры и катализируют превращение только
одного из них (α- и β- гликозидазы, фумаратгидратаза (только транс-изомер)).
21.
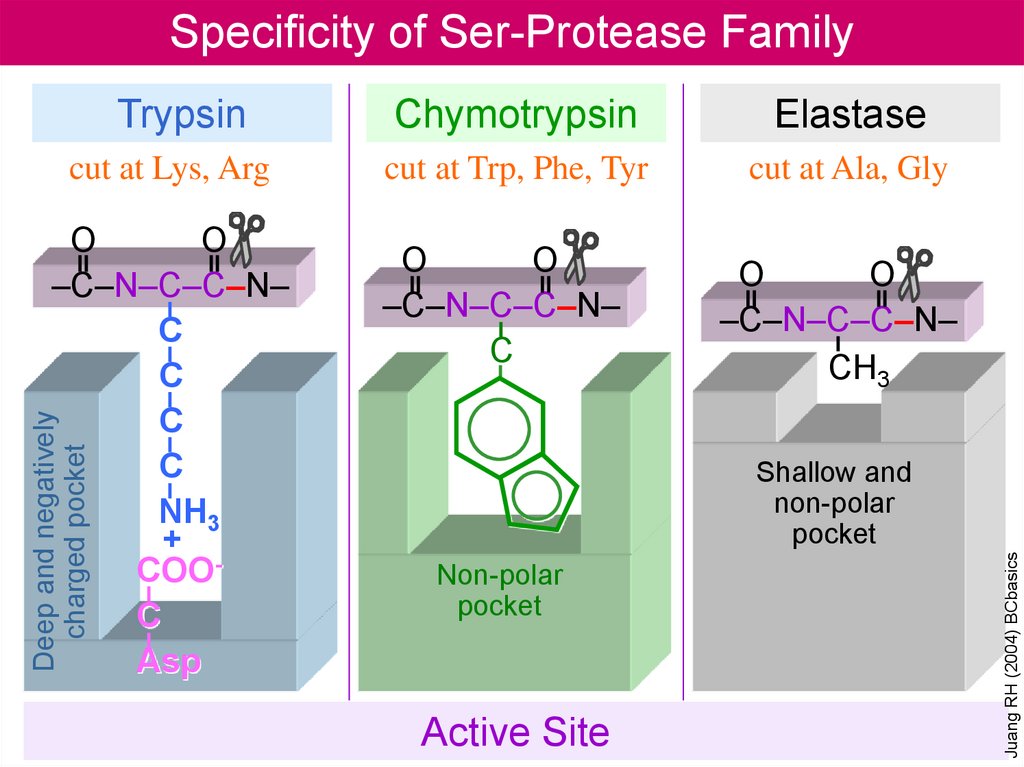
Specificity of Ser-Protease FamilyTrypsin
Chymotrypsin
Elastase
cut at Lys, Arg
cut at Trp, Phe, Tyr
cut at Ala, Gly
O
O
–C–N–C–C–N–
C
O
O
–C–N–C–C–N–
CH3
Shallow and
non-polar
Non-polar
Active Site
Juang RH (2004) BCbasics
Deep and negatively
charged pocket
O
O
–C–N–C–C–N–
C
C
C
C
NH3
+
COOC
Asp
22.
23.
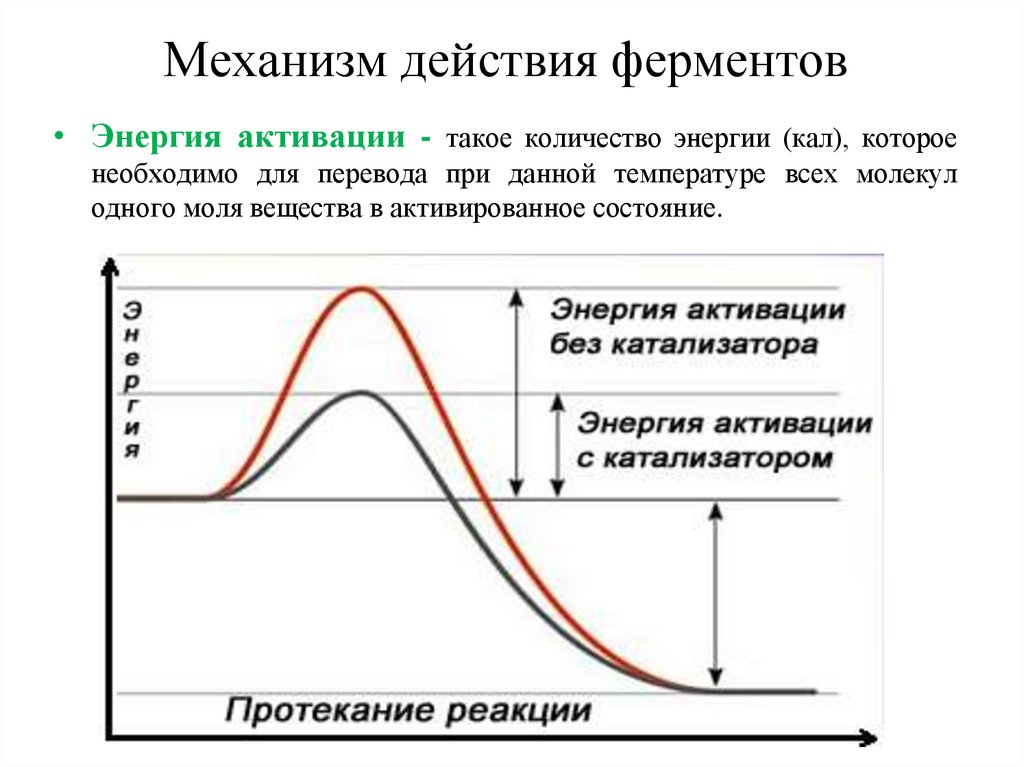
Механизм действия ферментов• Энергия активации - такое количество энергии (кал), которое
необходимо для перевода при данной температуре всех молекул
одного моля вещества в активированное состояние.
24.
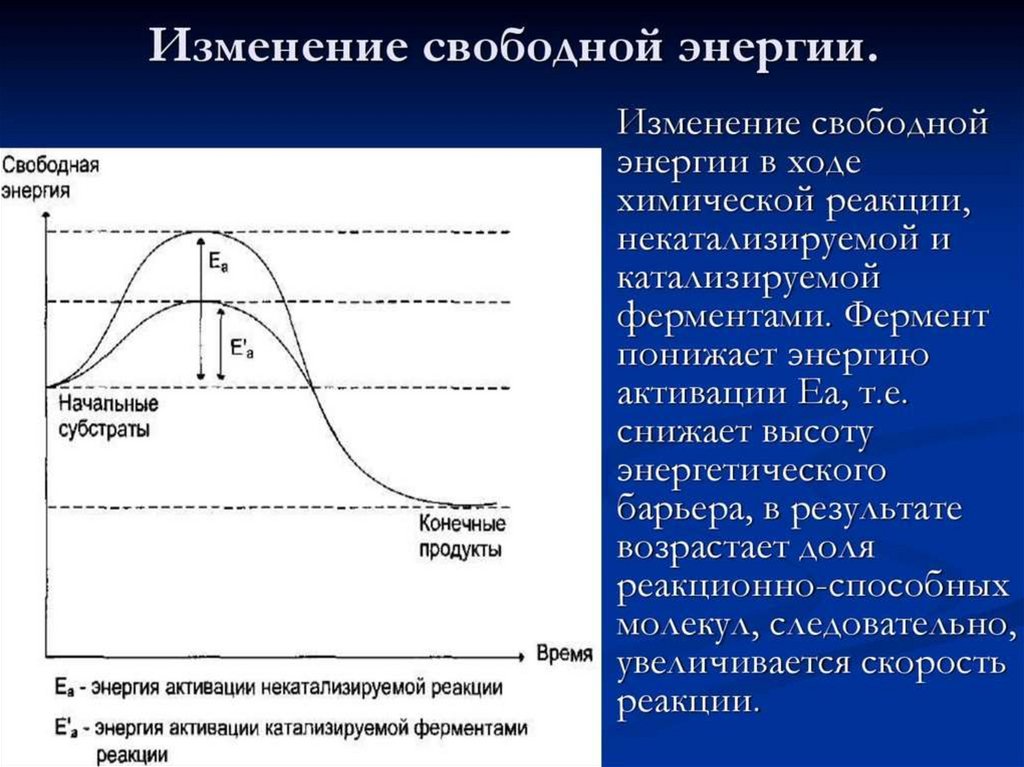
Энергия активации катализируемыхреакций
В ходе любой химической реакции реагирующие вещества должны
преодолеть энергетический барьер. Например, для осуществления
реакции типа АВ — А + В, вещество АВ переходит в активное
состояние.
Энергия активации — это определенное количество энергии, которым
должен обладать 1 моль вещества для преодоления им
энергетического барьера.
Роль ферментов, как и любых катализаторов, в химических реакциях
заключается в том, что ферменты способствуют преодолению
веществами энергетического барьера на более низком энергетическом
уровне. Иными словами, ферменты снижают энергию активации.
Образование промежуточного фермент-субстратного комплекса, как
правило,
сопровождается
определенной
деформацией
(видоизменением) молекулы субстрата, что приводит к ослаблению
внутримолекулярных взаимодействий в молекуле субстрата и
повышению ее реакционной способности. Таким образом, снижение
энергии активации происходит именно в момент образования
фермент-субстратного комплекса. По величине снижения энергии
активации можно судить об эффективности действия фермента.
25.
26.
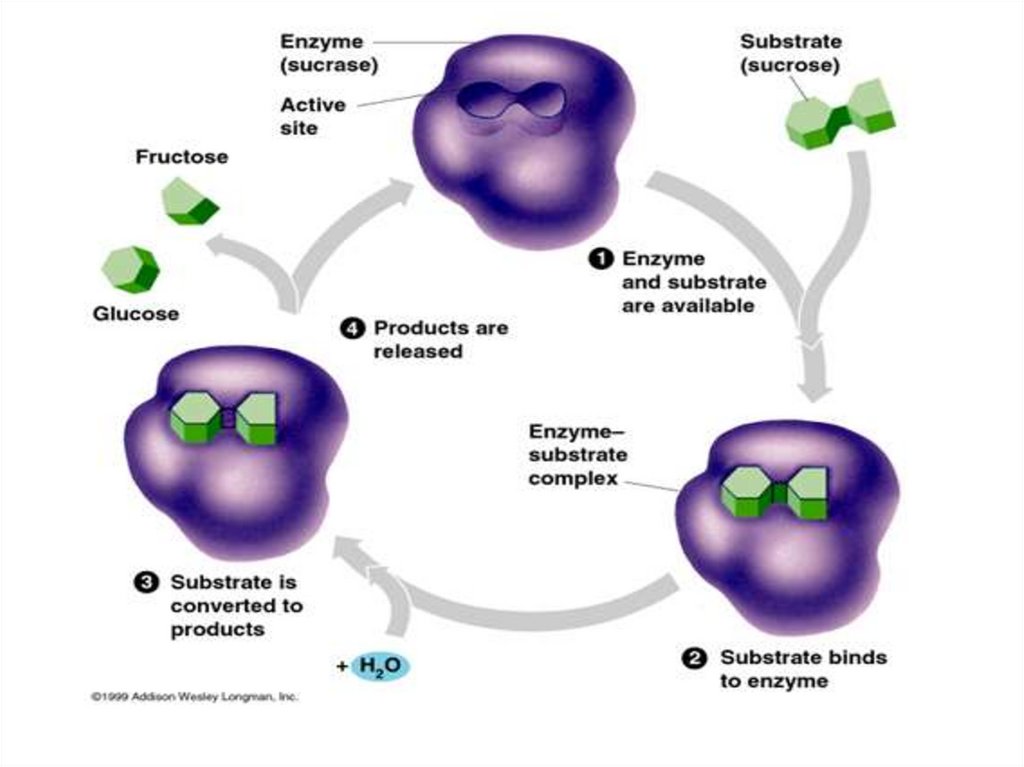
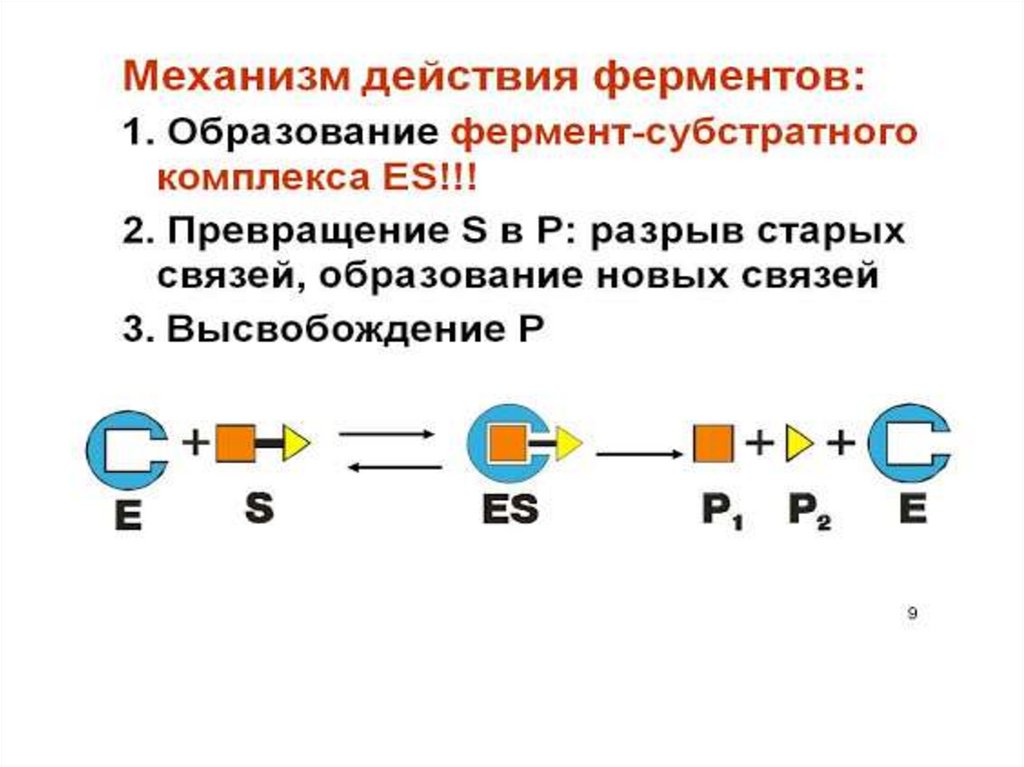
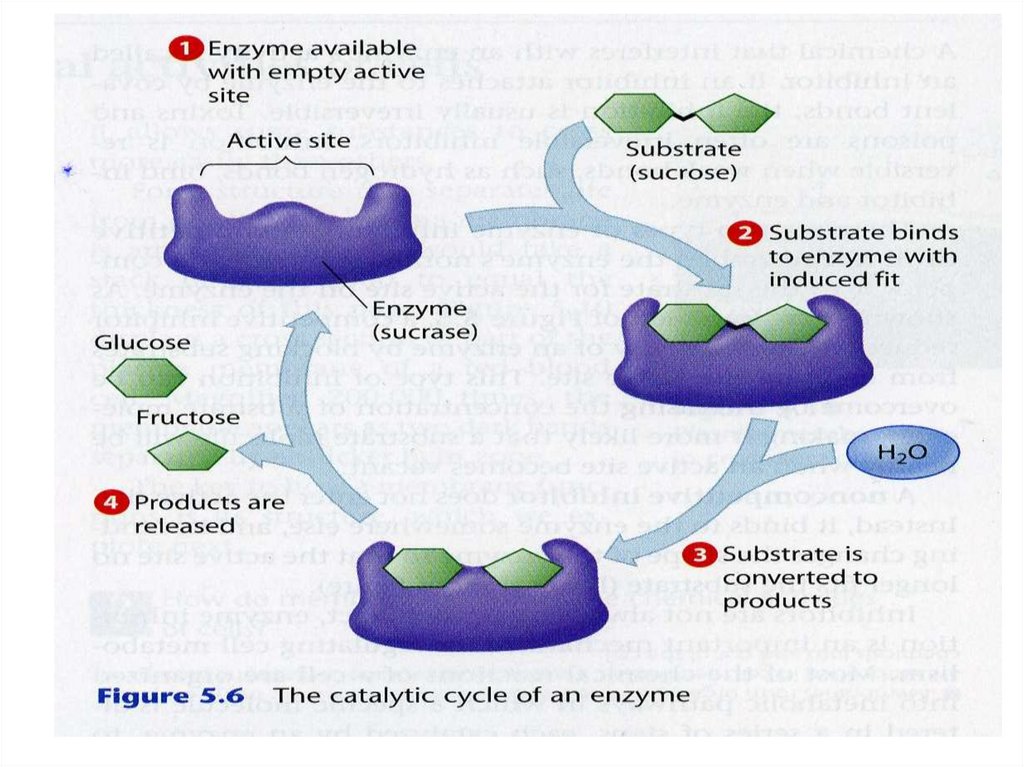
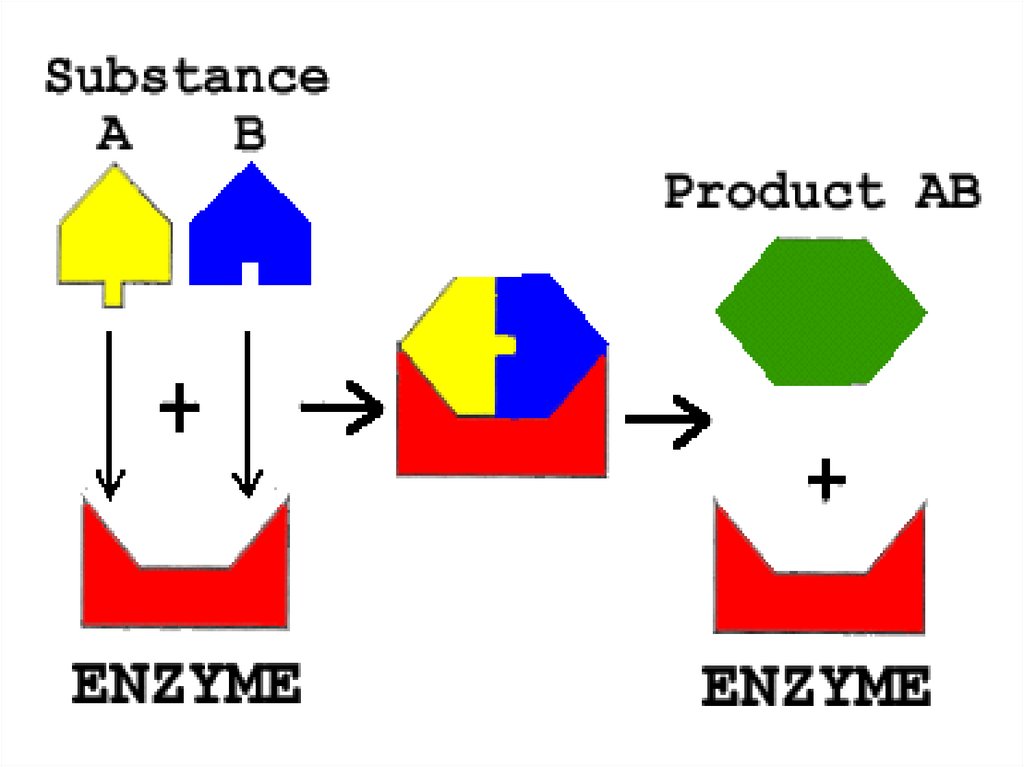
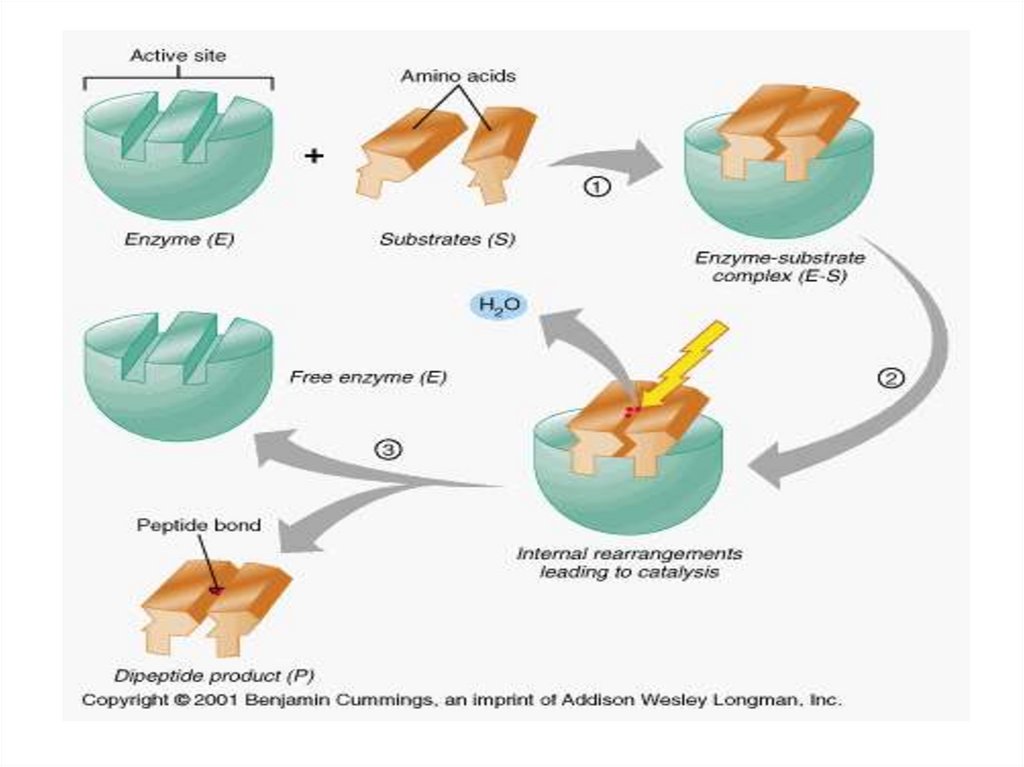
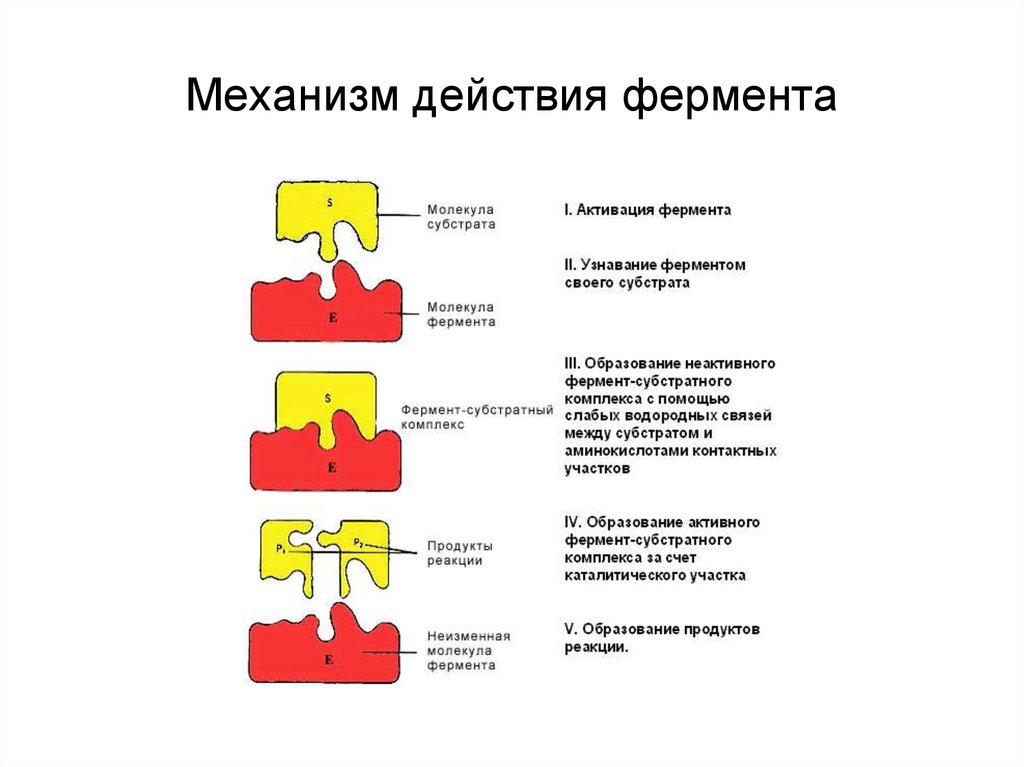
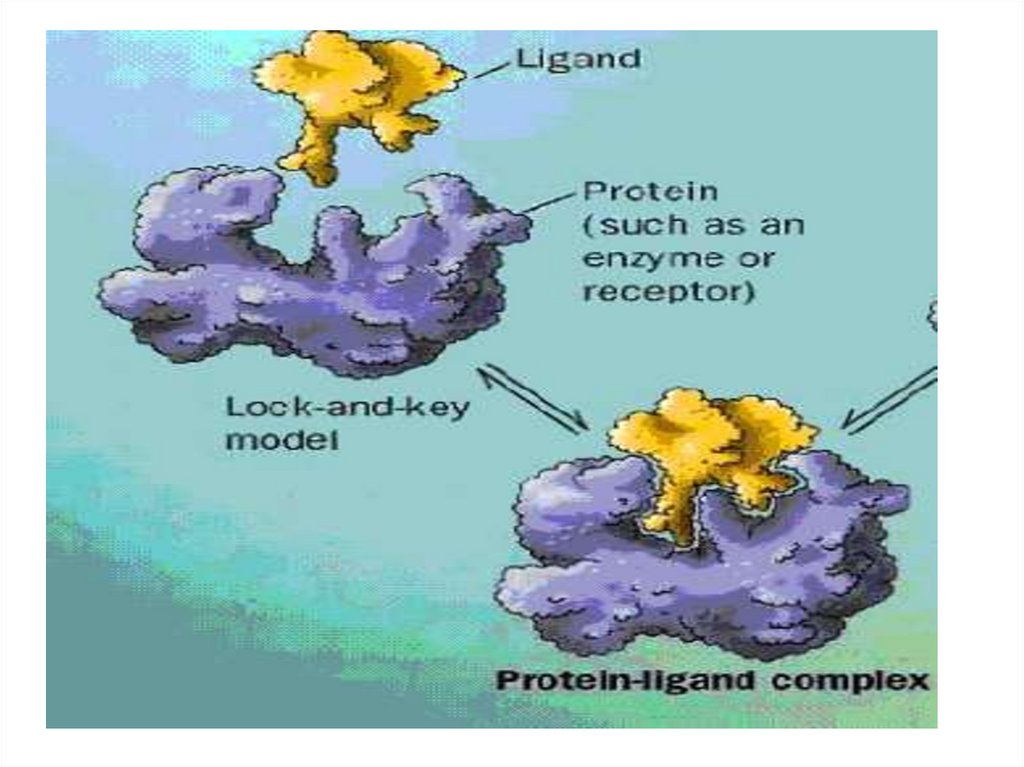
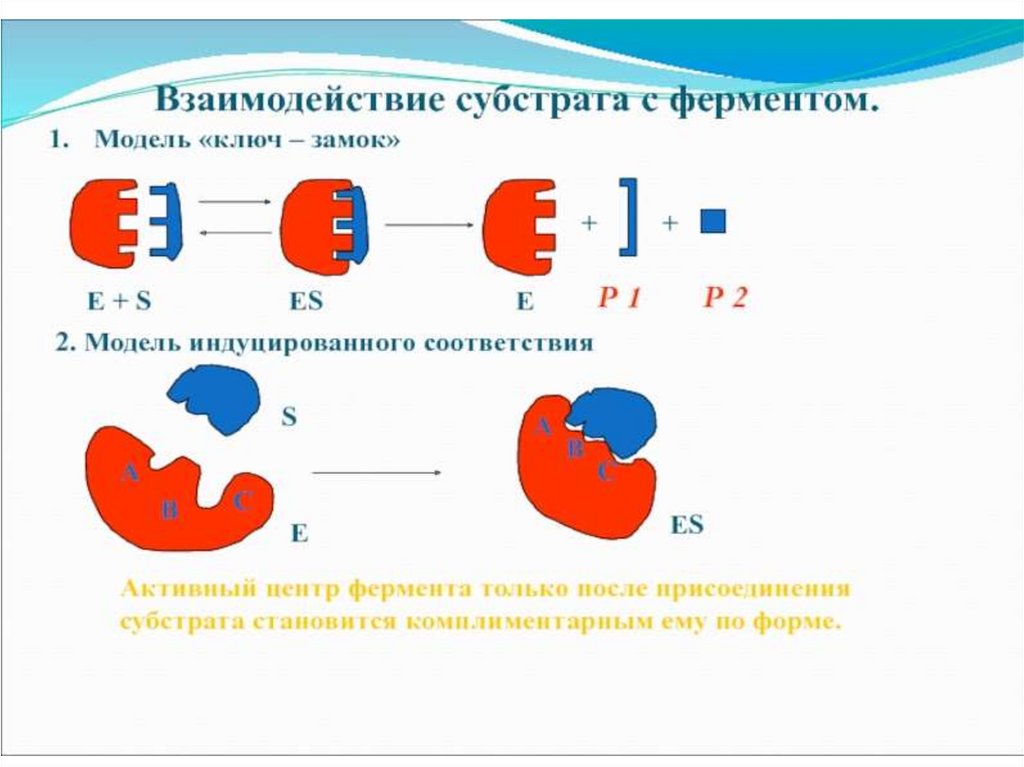
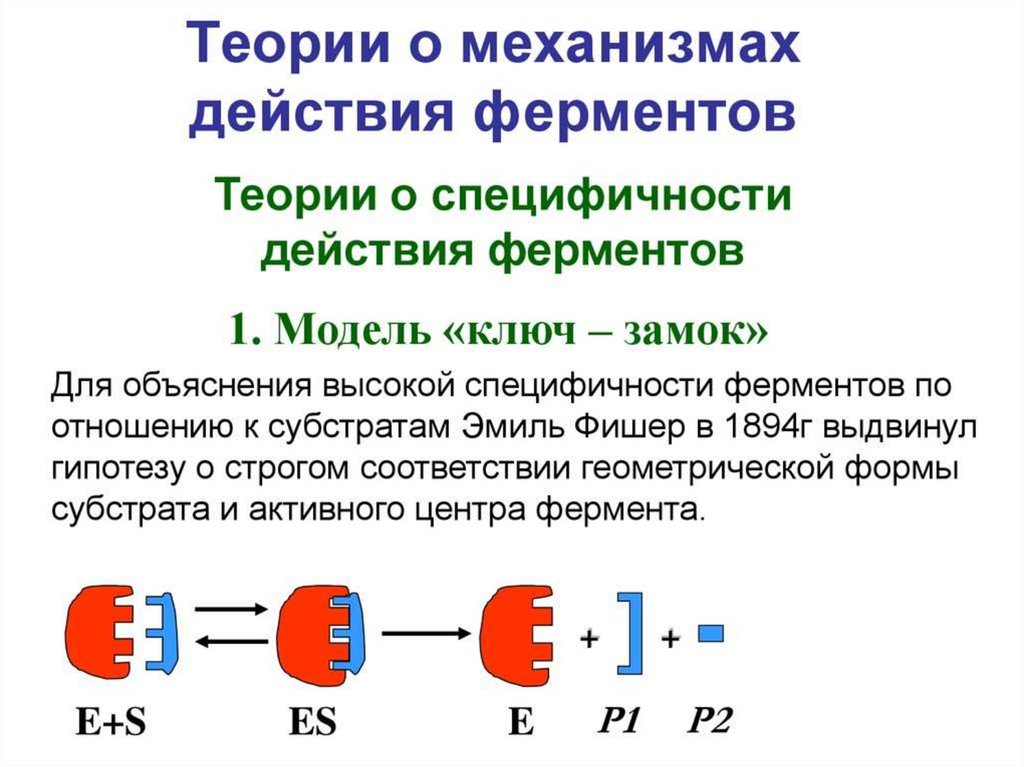
Механизм действия ферментаE + S ↔ ES → E + P
Стадии каталитического действия фермента:
1. присоединение молекулы субстрата (S) к
ферменту Е (образование ES )
2. превращение субстрата
3. отделение конечных продуктов реакции
(Р) от фермента
27.
28.
29.
30.
31.
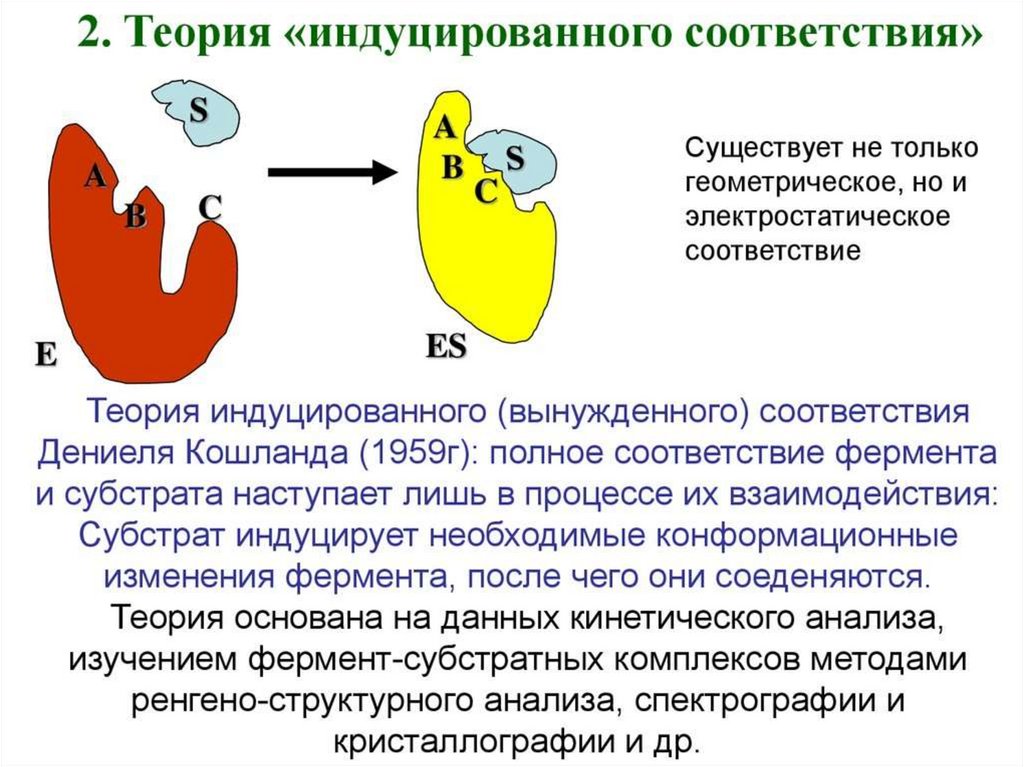
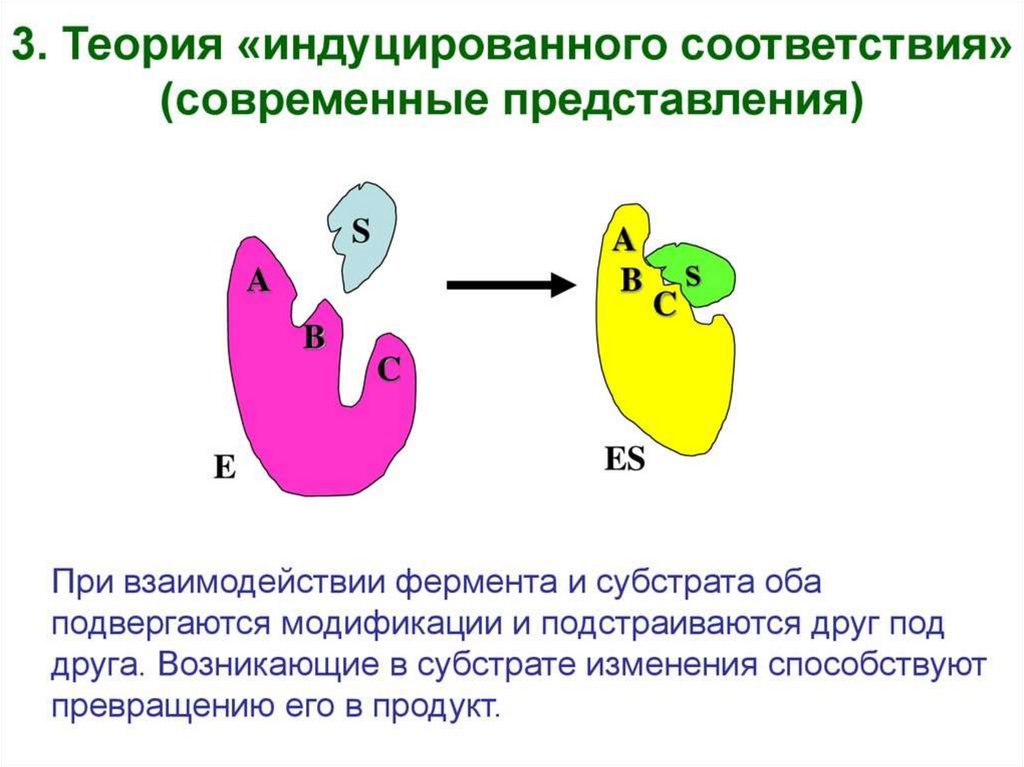
Механизм действия фермента32.
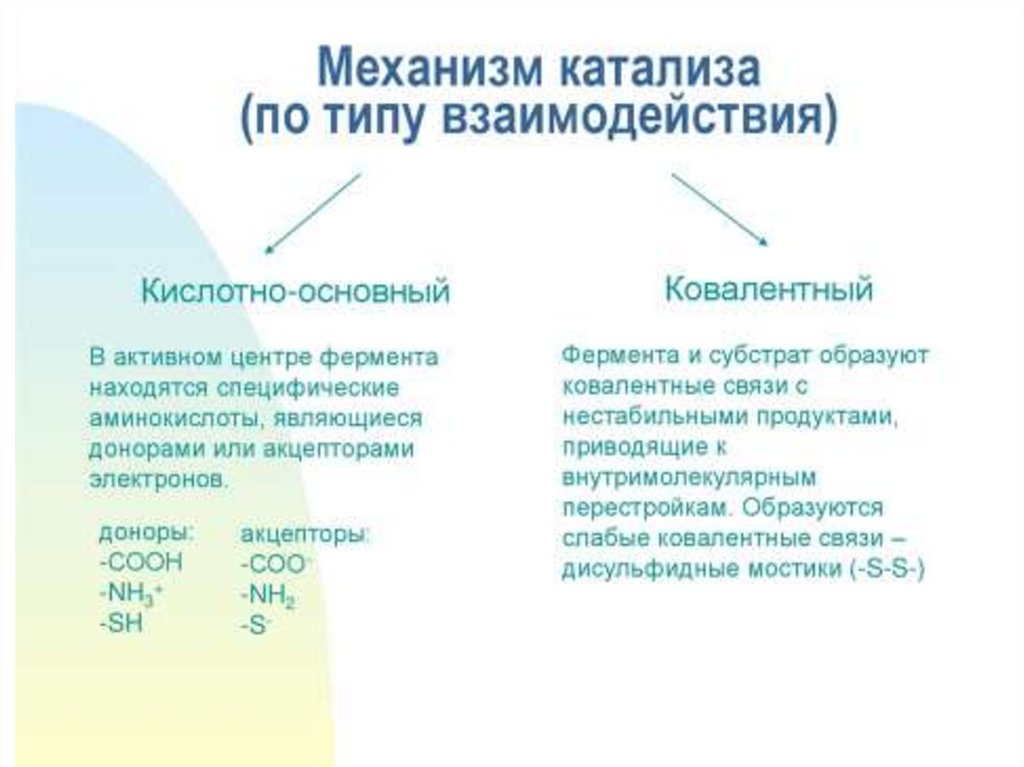
Факторы, определяющиекаталитическую активность
ферментов
• 1. сближение и ориентация
• 2. напряжение и деформация
(индуцированное соответствие)
• 3. общий кислотно-основный катализ
• 4. ковалентный катализ
33.
34.
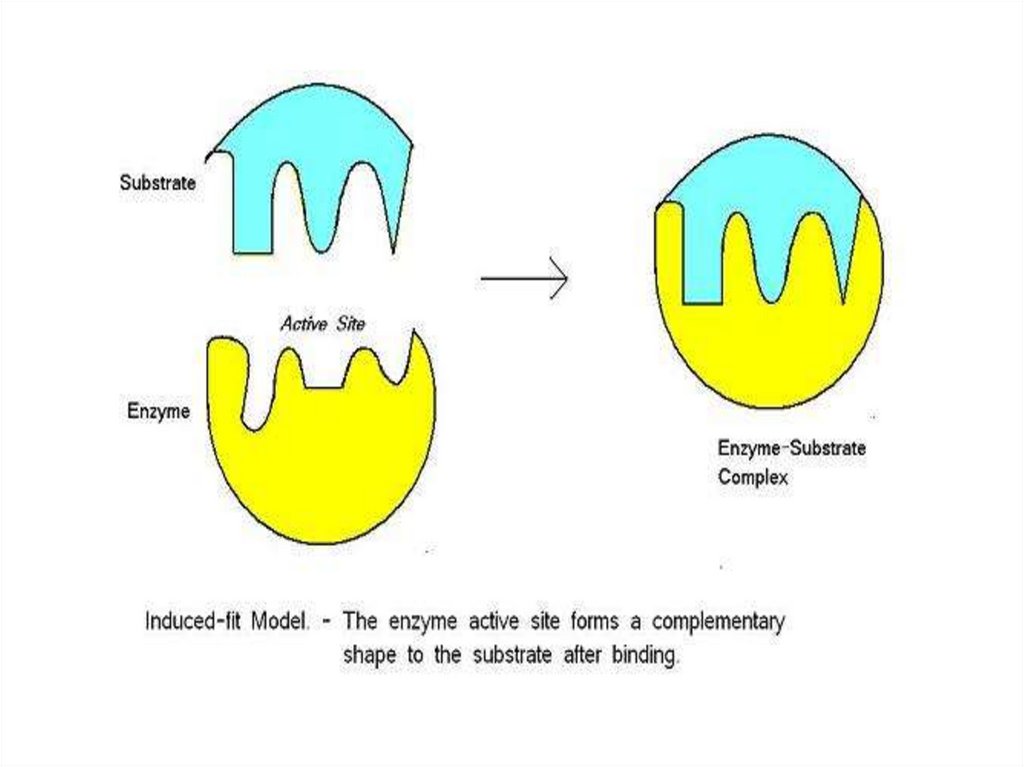
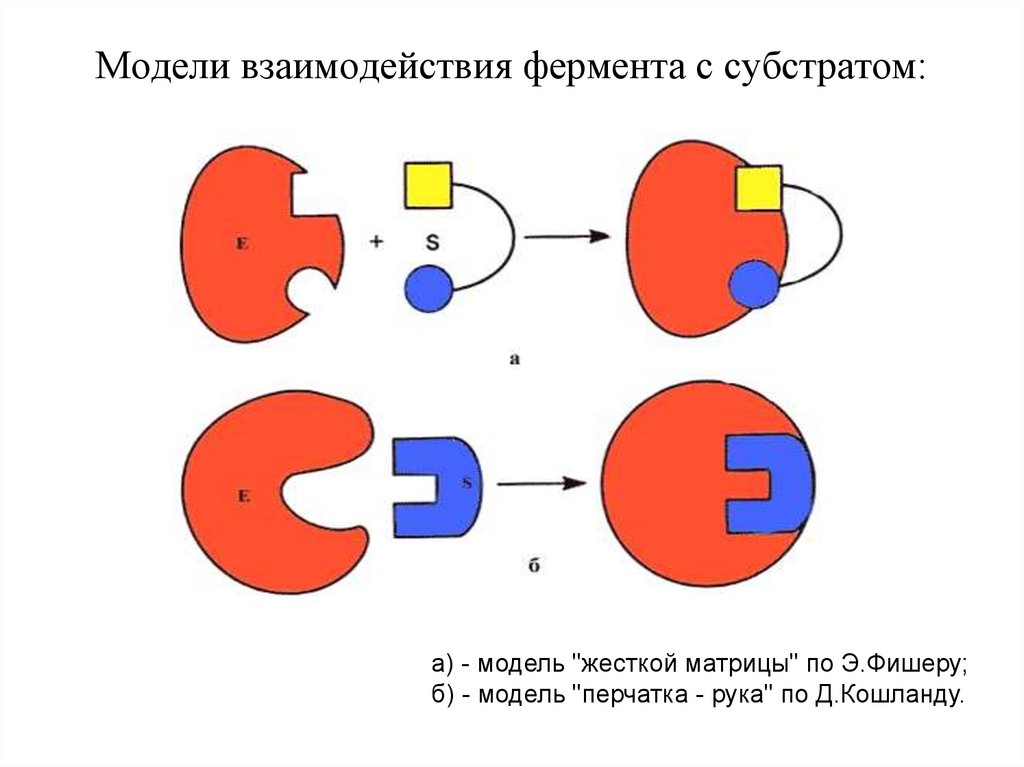
Модели взаимодействия фермента с субстратом:а) - модель "жесткой матрицы" по Э.Фишеру;
б) - модель "перчатка - рука" по Д.Кошланду.
35.
36.
37.
38.
39.
40.
41.
Типы ферментативных реакций:• Односубстратные ( изомеризацияодносубстратная однопродуктная реакция).
Мономолекулярные реакции (А→Р)
• Двухсубстратные (60% реакций являются
двухсубстратными двухпродуктными,
например, реакции переноса групп)
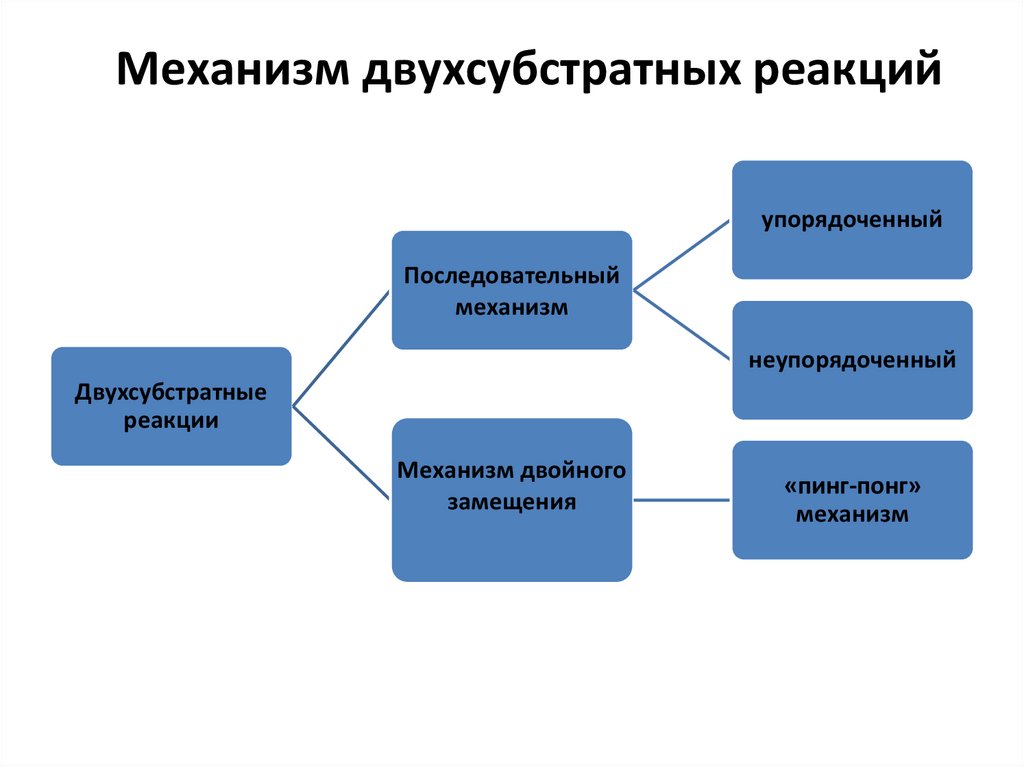
42.
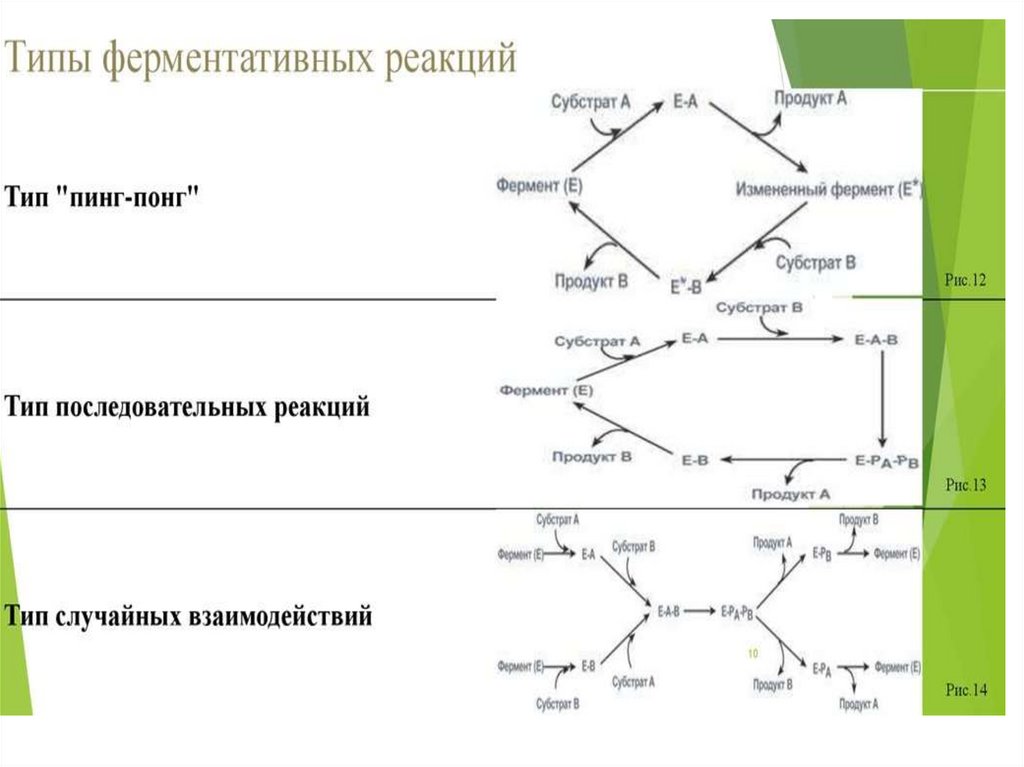
Механизм двухсубстратных реакцийупорядоченный
Последовательный
механизм
неупорядоченный
Двухсубстратные
реакции
Механизм двойного
замещения
«пинг-понг»
механизм
43.
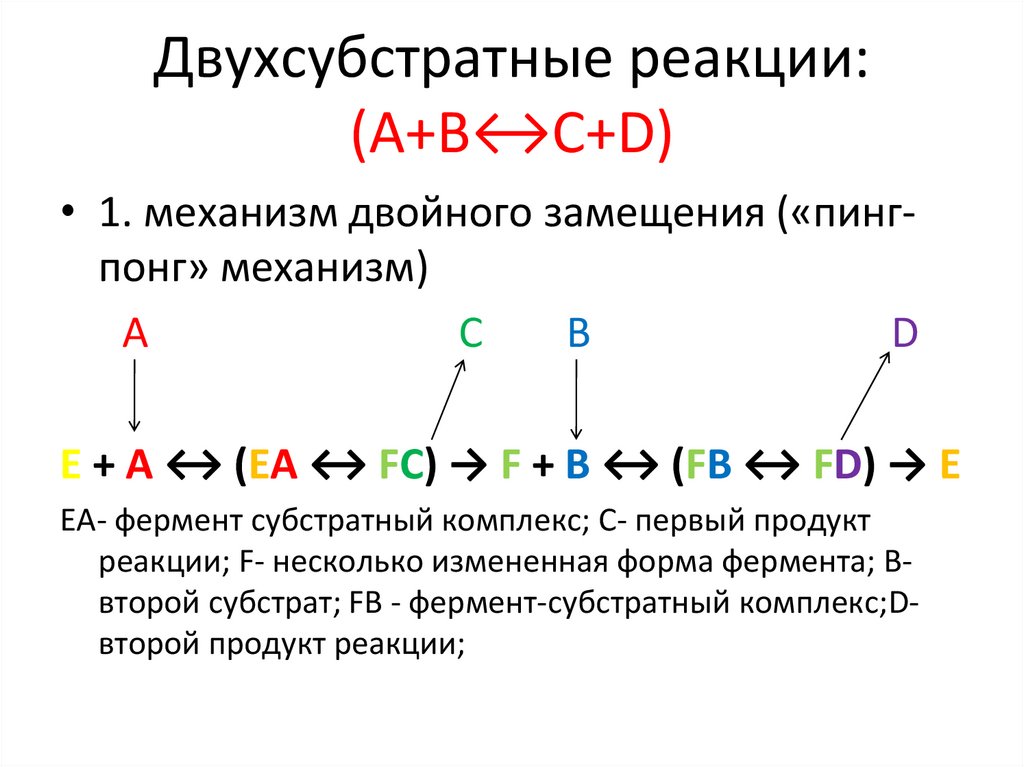
Двухсубстратные реакции:(А+В↔C+D)
• 1. механизм двойного замещения («пингпонг» механизм)
А
C
B
D
Е + А ↔ (ЕА ↔ FC) → F + B ↔ (FB ↔ FD) → E
EA- фермент субстратный комплекс; С- первый продукт
реакции; F- несколько измененная форма фермента; Ввторой субстрат; FВ - фермент-субстратный комплекс;Dвторой продукт реакции;
44.
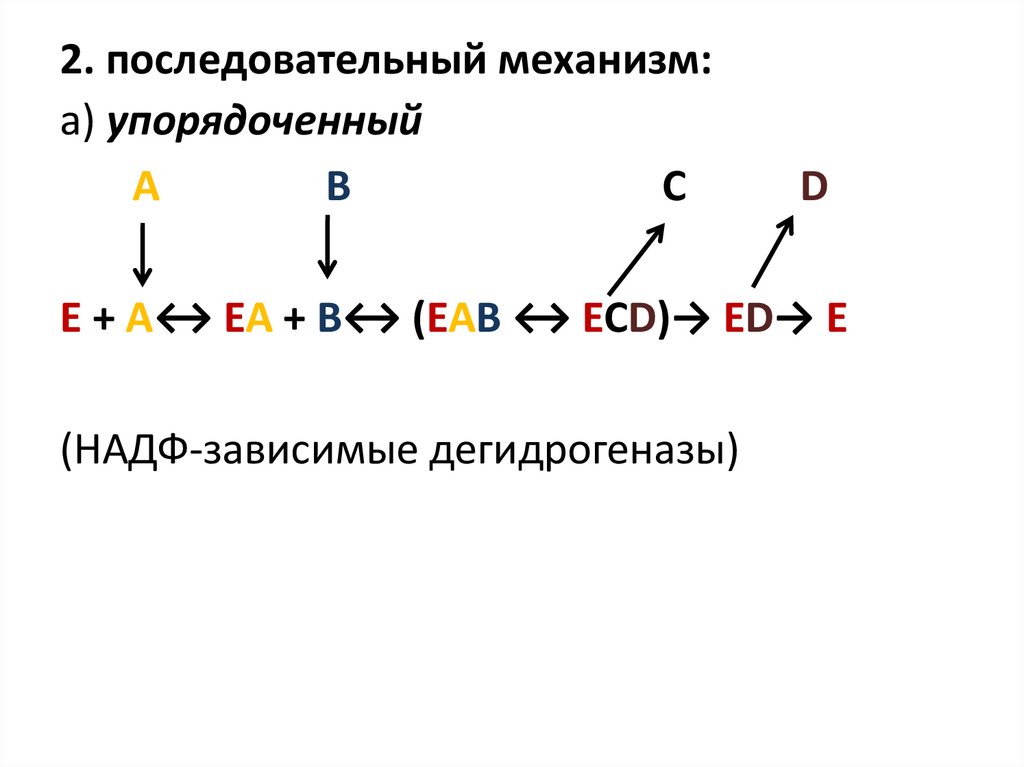
2. последовательный механизм:а) упорядоченный
A
B
C
D
E + A↔ EA + B↔ (EAB ↔ ECD)→ ED→ E
(НАДФ-зависимые дегидрогеназы)
45.
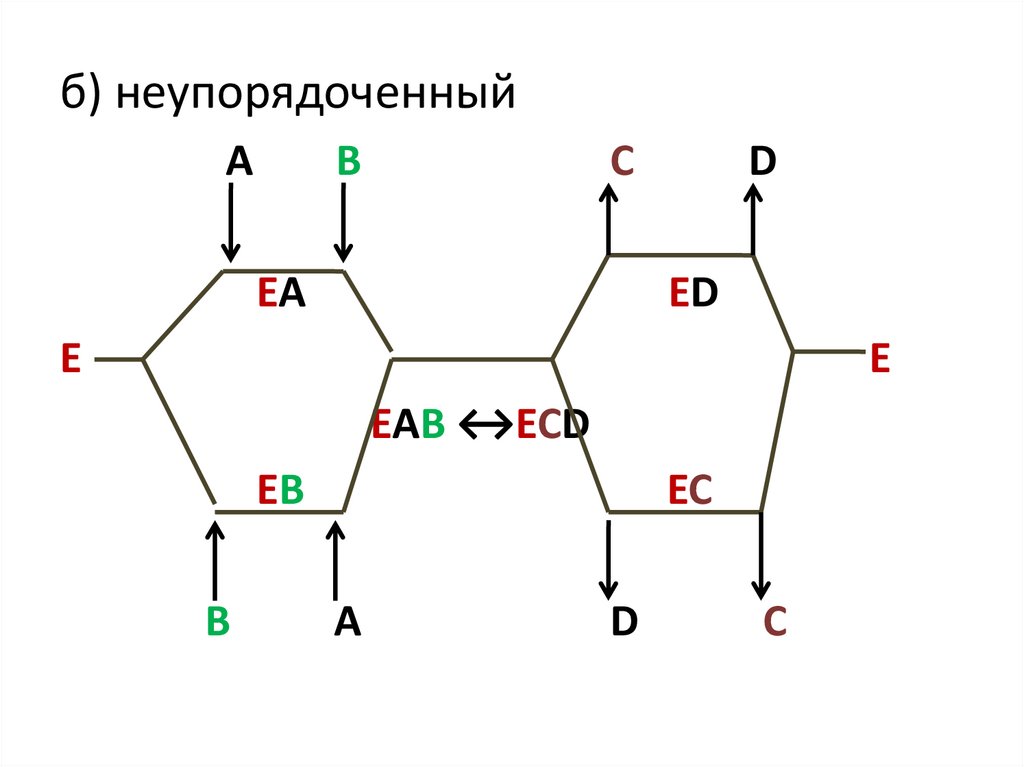
б) неупорядоченныйA
B
C
EA
D
ED
E
E
EAB ↔ECD
EB
B
EC
A
D
C
46.
47.
Кинетика ферментативных реакций:Активность ферментов – способность в разной степени
ускорять скорость реакции. Активность выражают в:
• 1) Международных единицах активности – (МЕ)
количество фермента, катализирующего превращение 1
мкМ субстрата за 1 мин.
• 2) Каталах (кат) – количество катализатора (фермента),
способное превращать 1 моль субстрата за 1 с.
• 3) Удельной активности – число единиц активности
(любых из вышеперечисленных) в исследуемом образце к
общей массе белка в этом образце.
• 4) Реже используют молярную активность – количество
молекул субстрата превращенных одной молекулой
фермента за минуту.
48.
49.
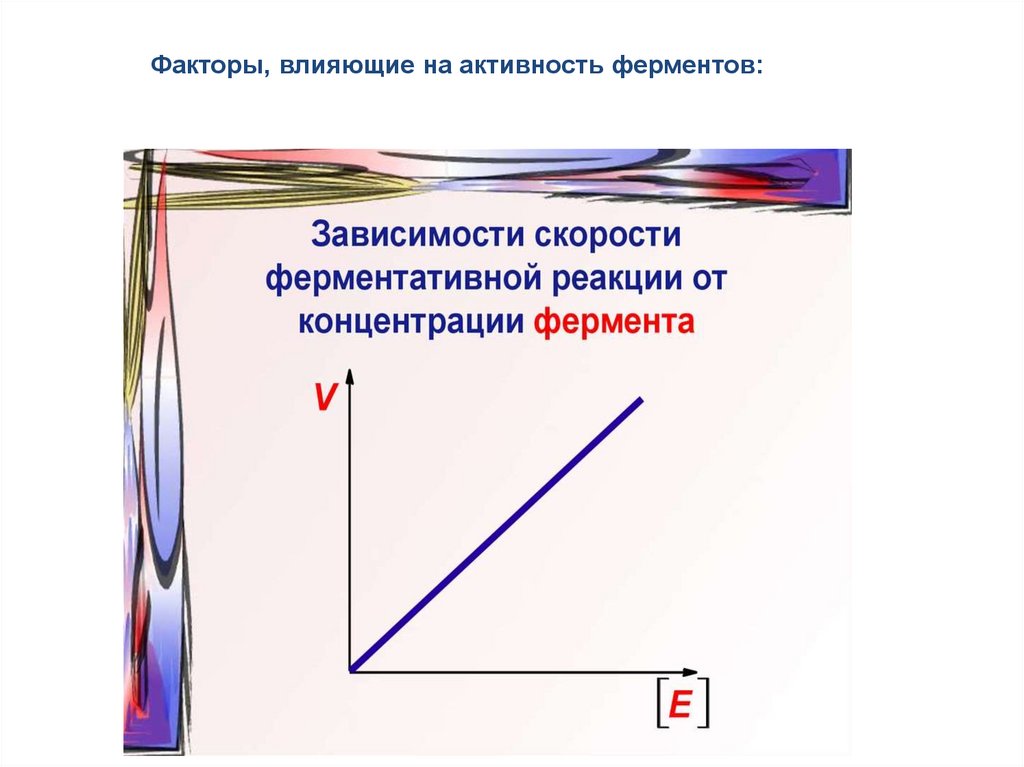
Факторы, влияющие на активность ферментов:50.
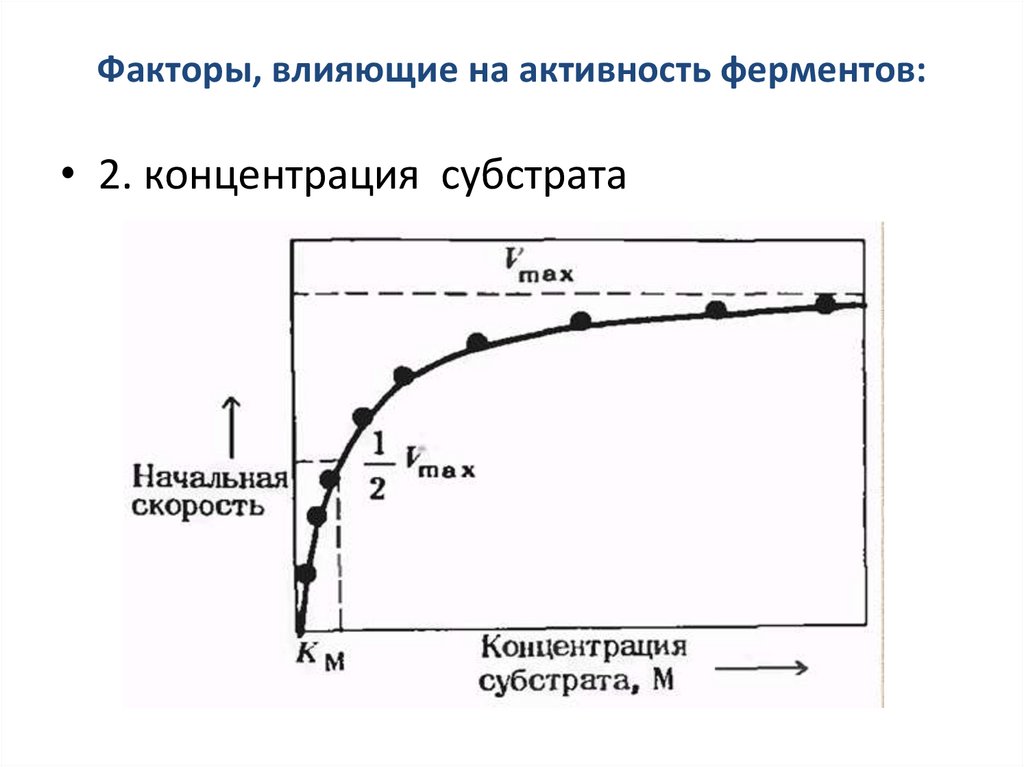
Факторы, влияющие на активность ферментов:• 2. концентрация субстрата
51.
52.
53.
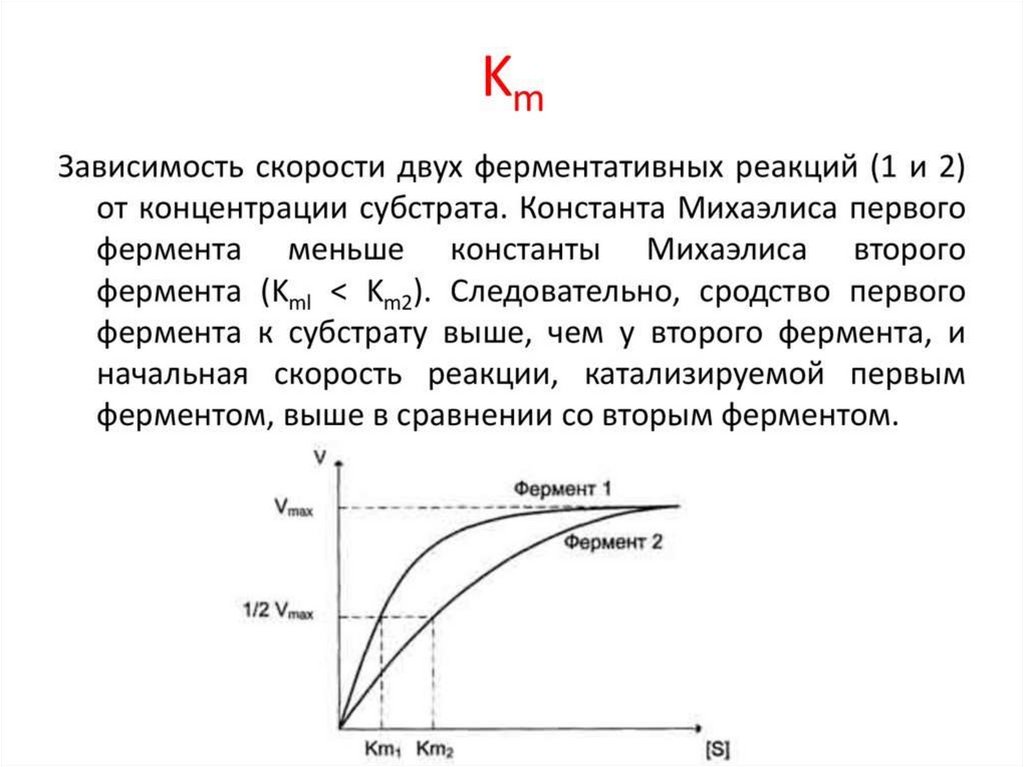
Модель Михаэлиса-МентонУравнение Михаэлиса-Ментен
Vmax [ S ]
v0
K М [S ]
где v0- начальная скорость при концентрации субстрата [S],
Vmax – максимальная скорость;
Км – константа Михаэлиса-Ментен для данного фермента,
соответствующая определенному субстрату
Км- концентрация специфического субстрата, при которой
данный фермент обеспечивает скорость реакции, равную
половине ее максимальной скорости.
54.
55.
56.
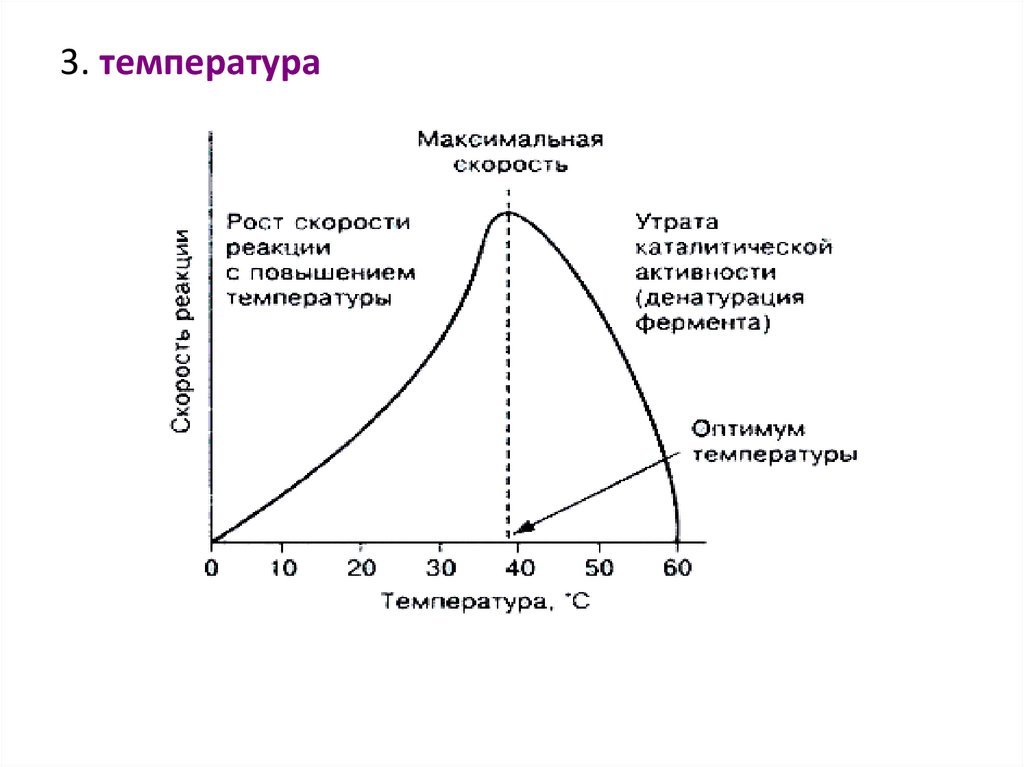
3. температура57.
58.
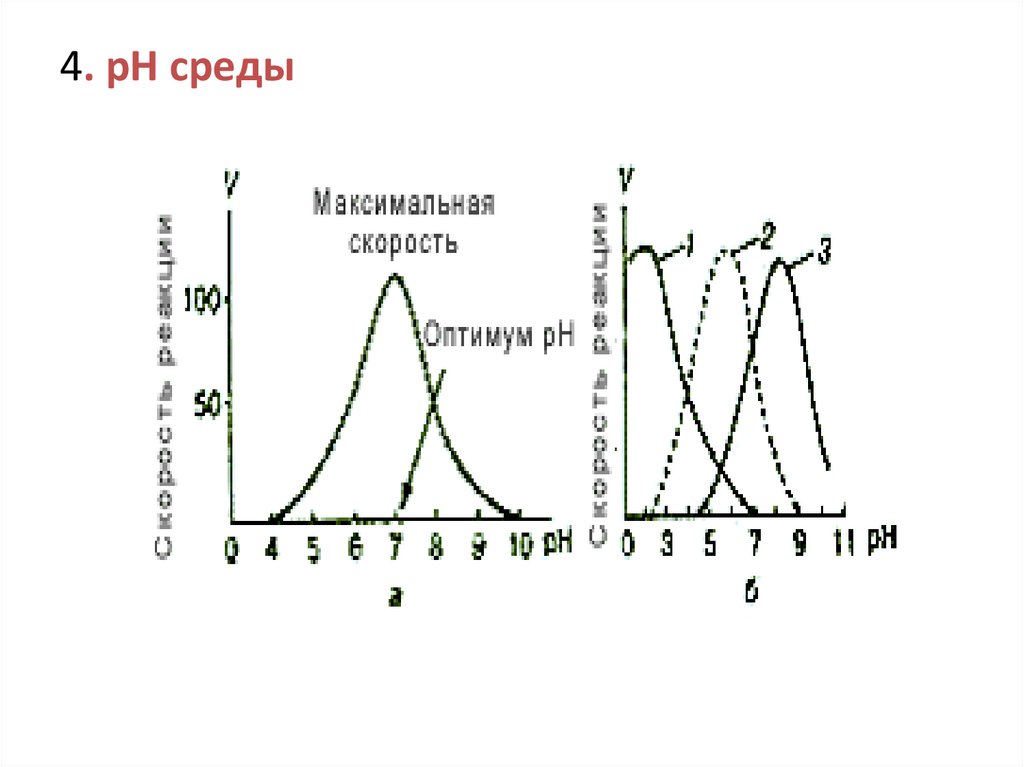
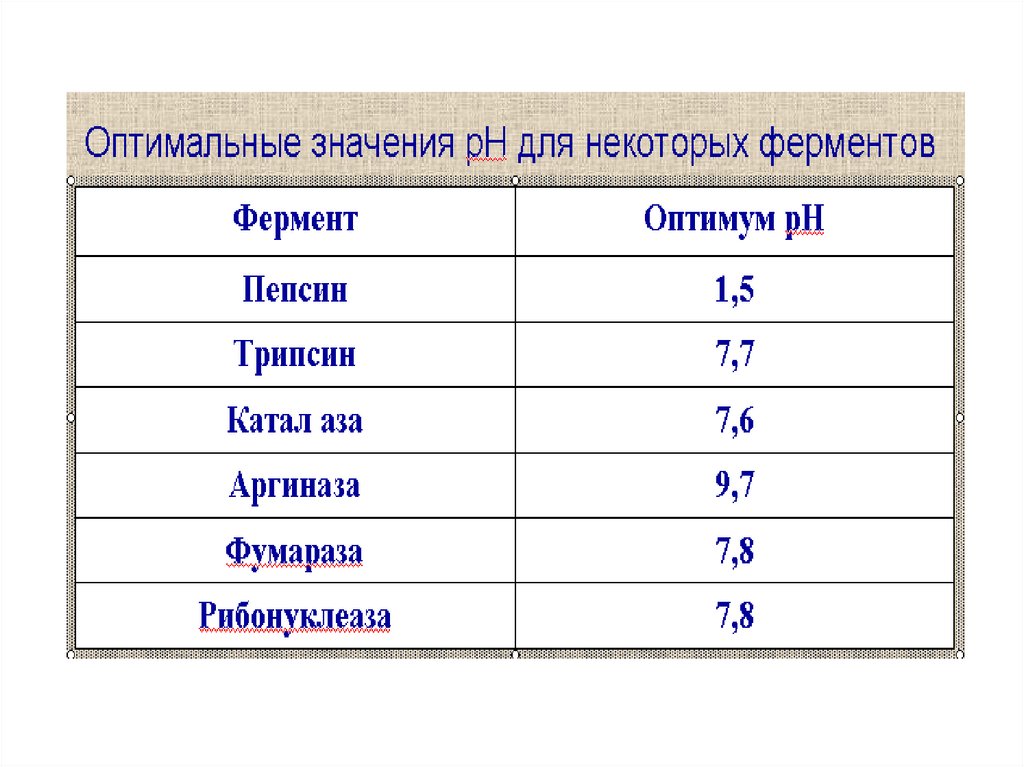
4. рН среды59.
60.
61.
Строение фермента62.
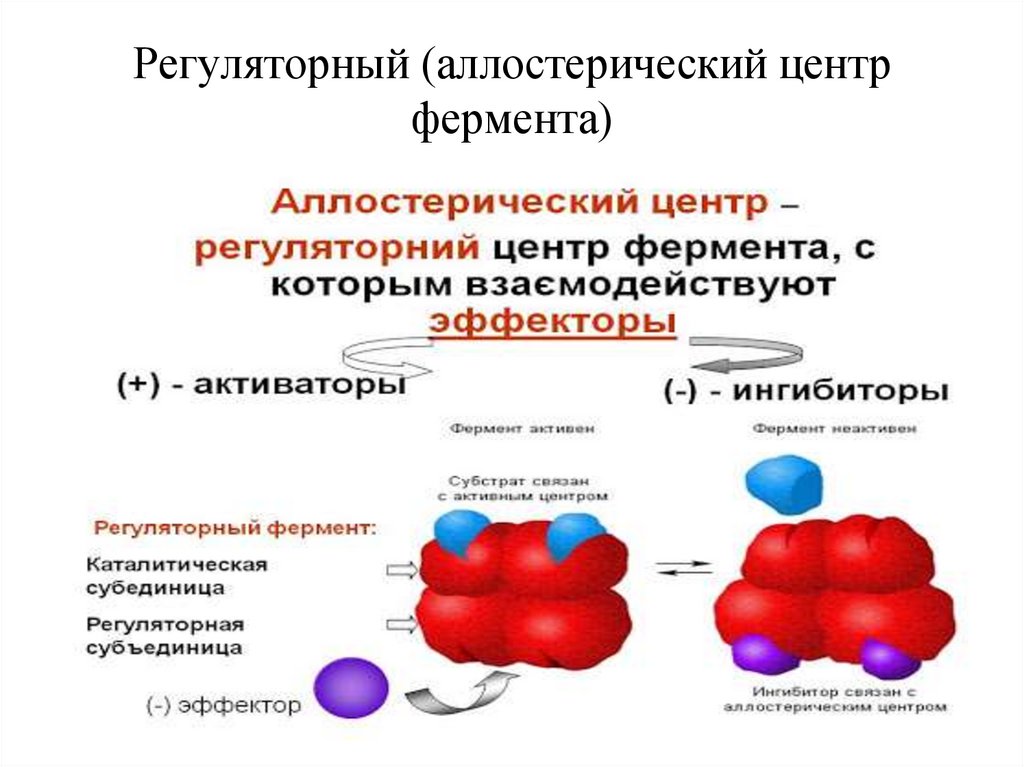
Регуляторный (аллостерический центрфермента)
63.
64.
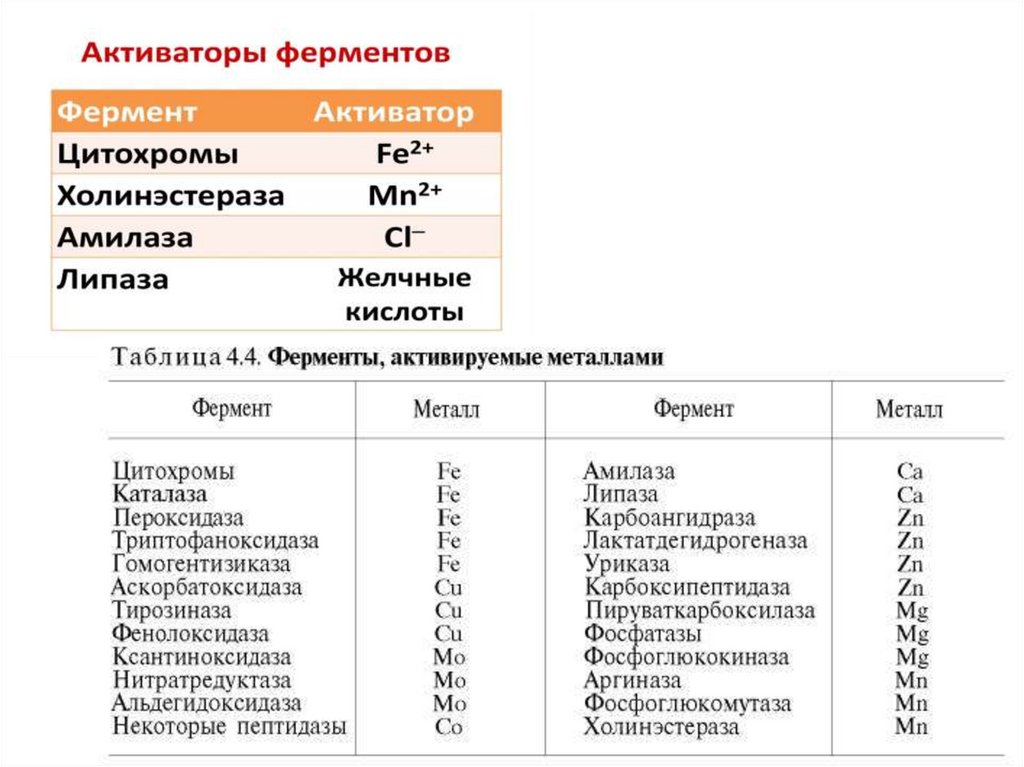
Активаторы ферментов65.
66.
67.
68.
69.
70.
71.
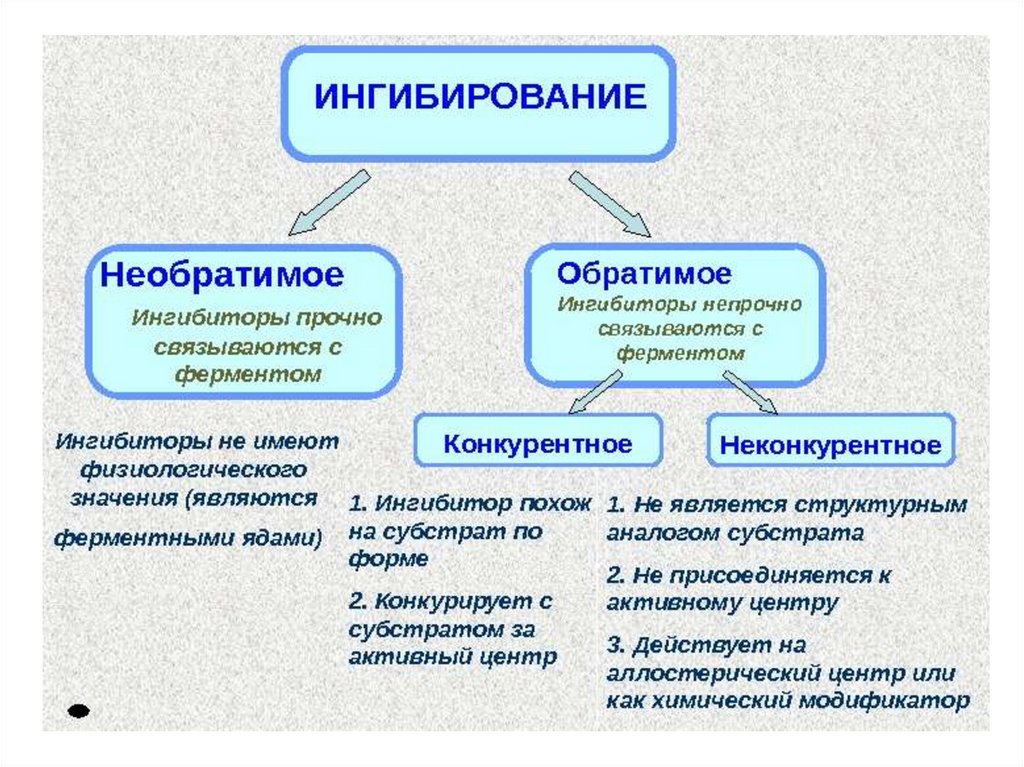
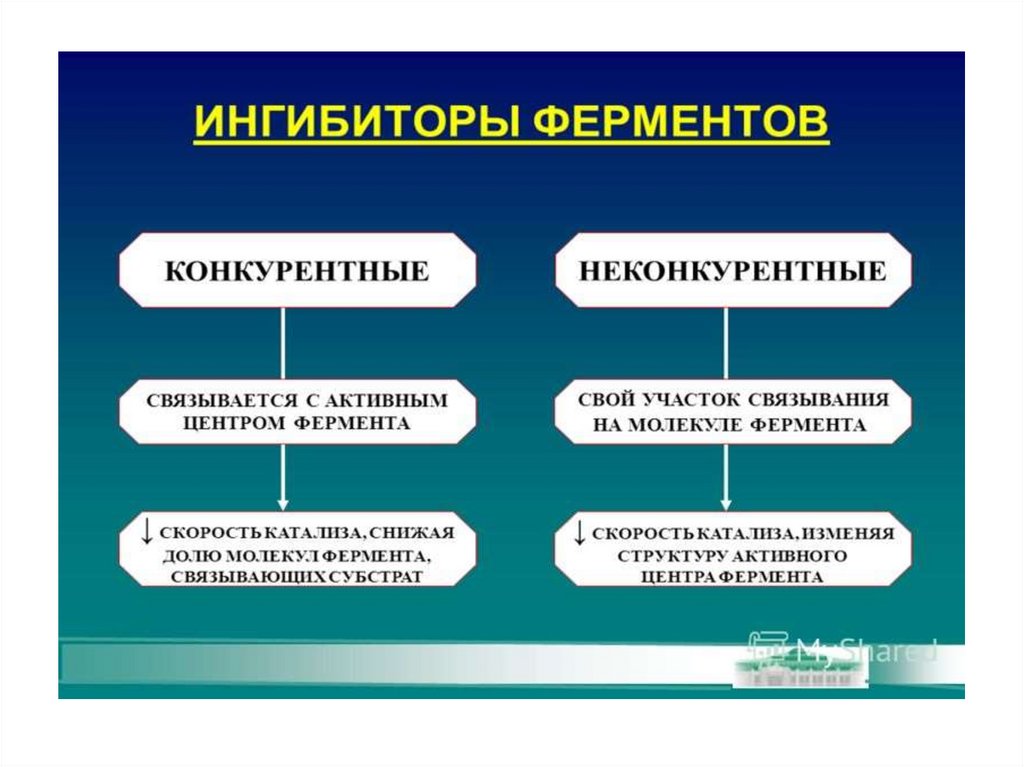
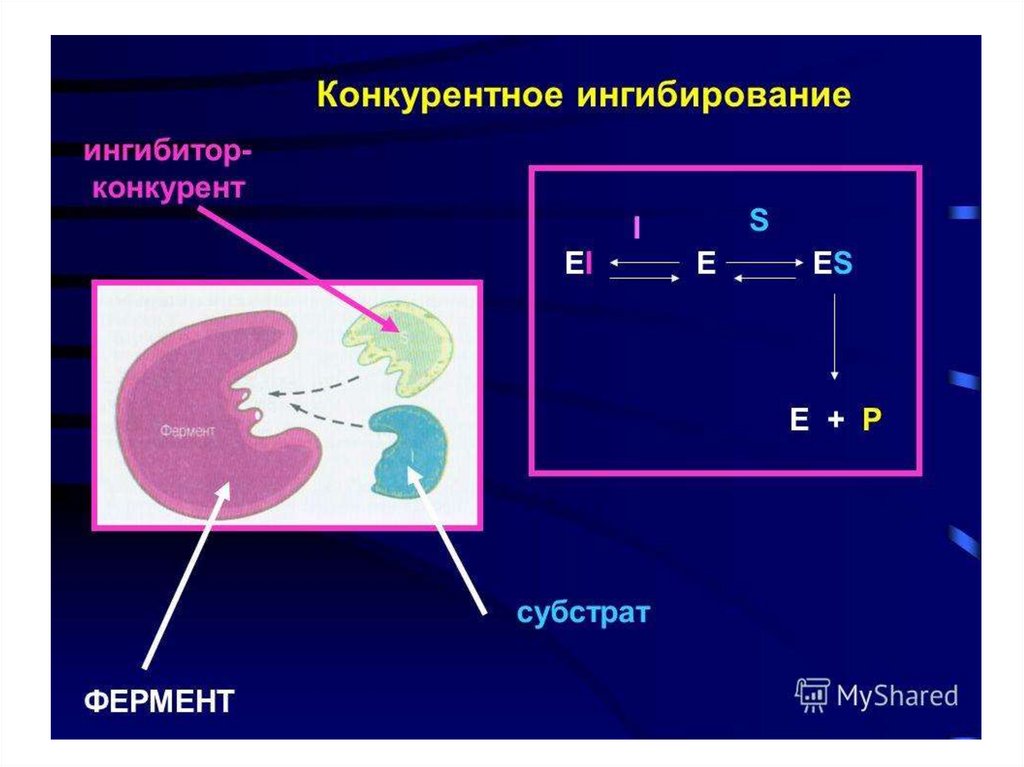
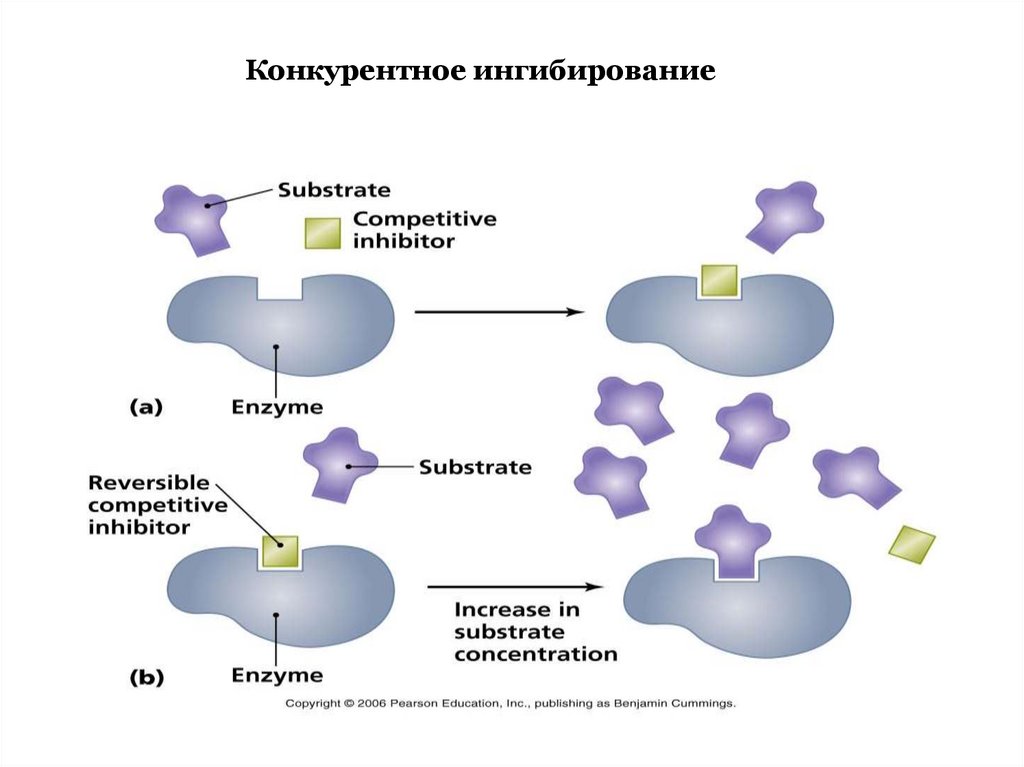
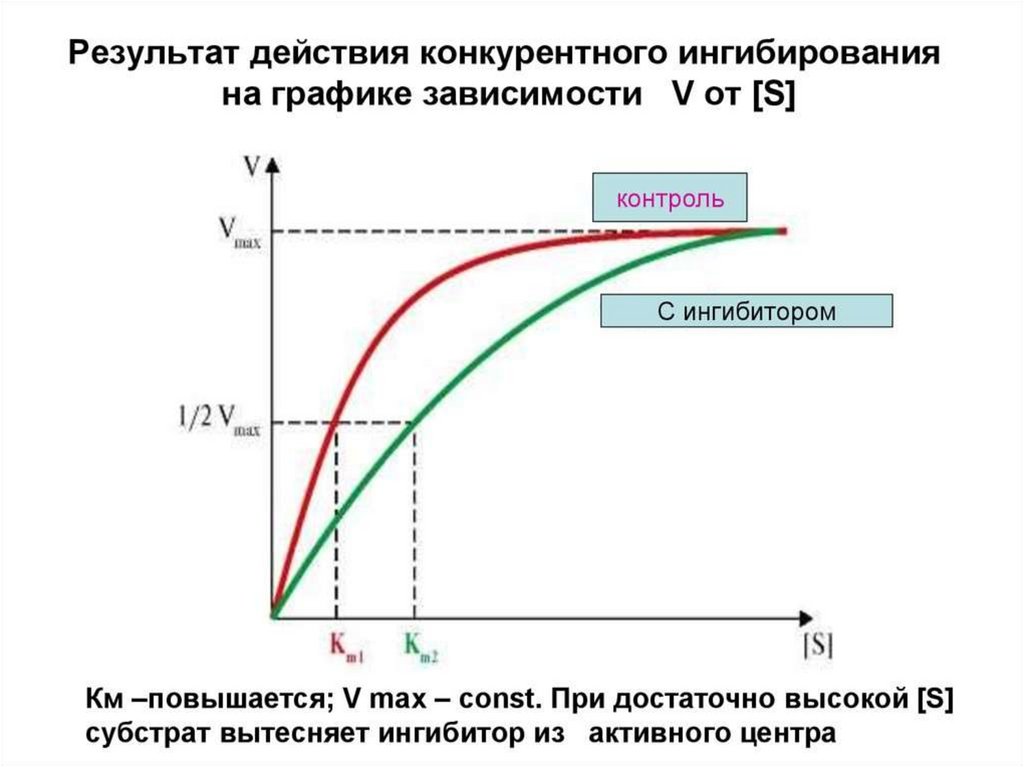
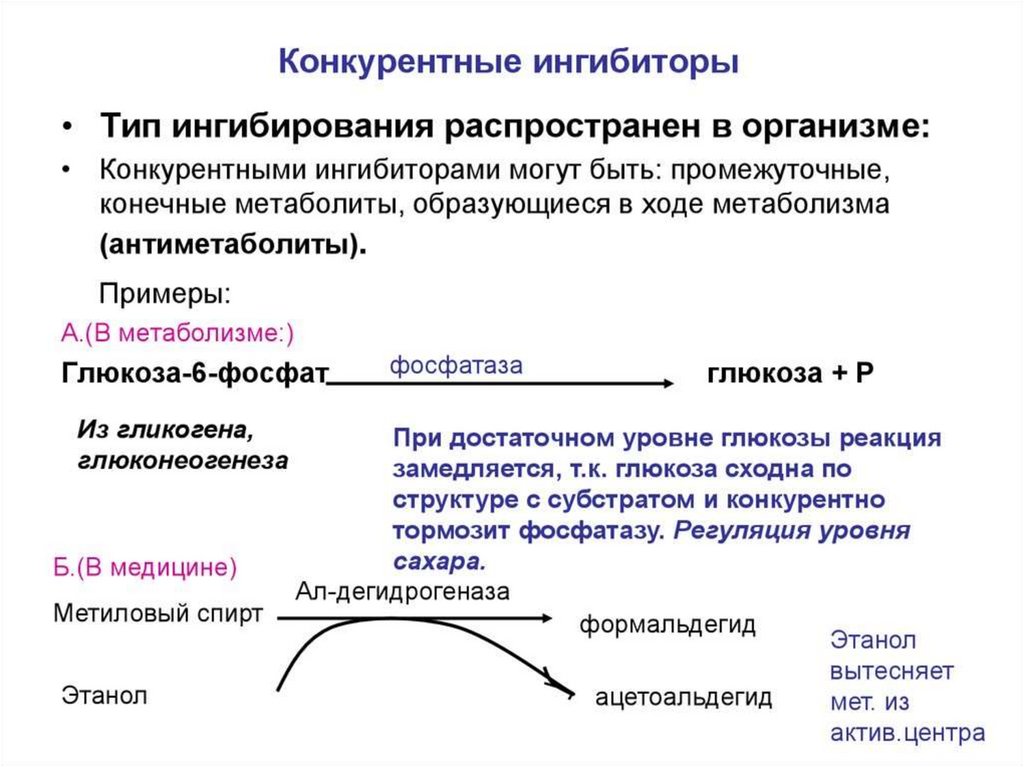
Конкурентное ингибирование72.
73.
74.
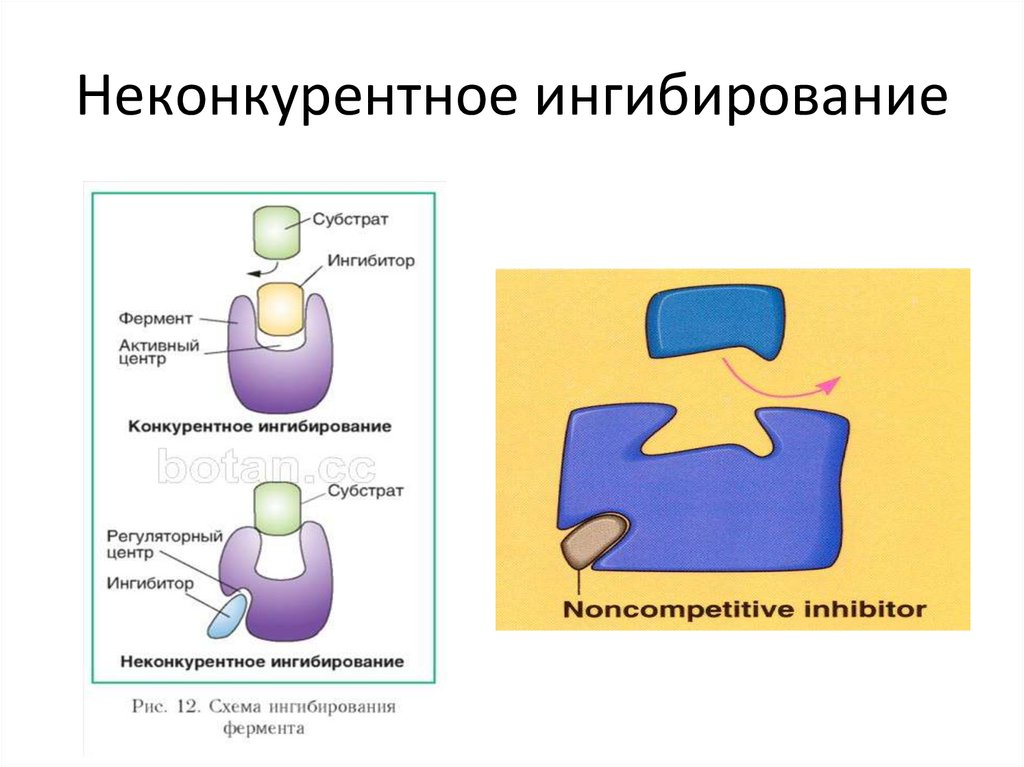
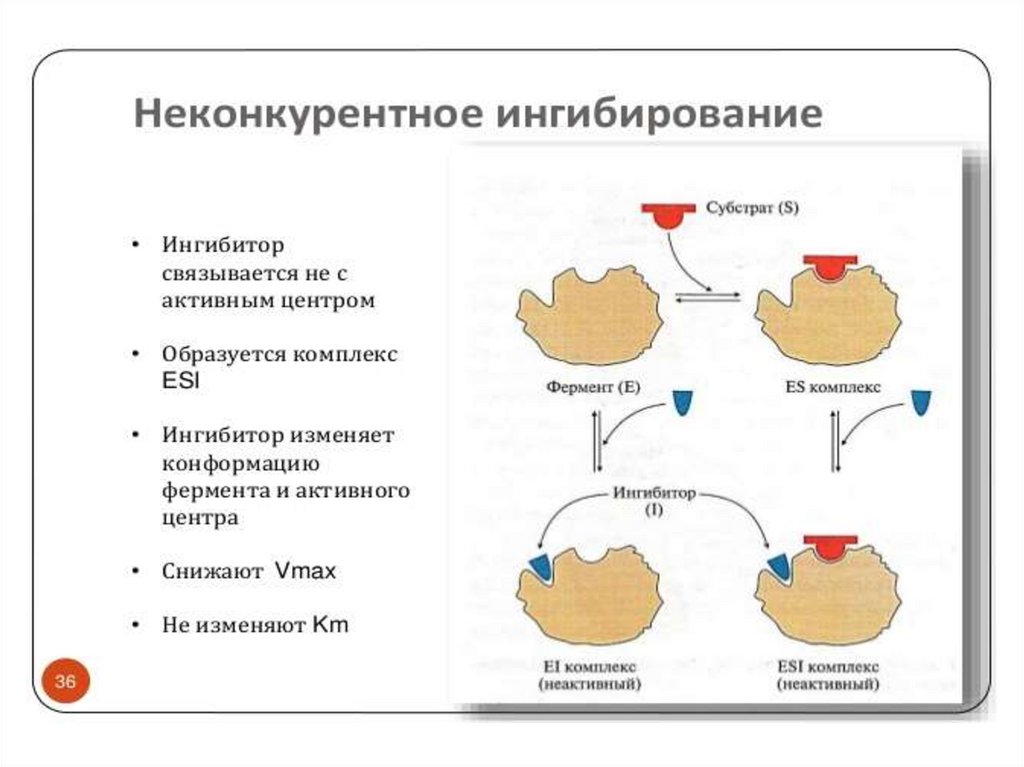
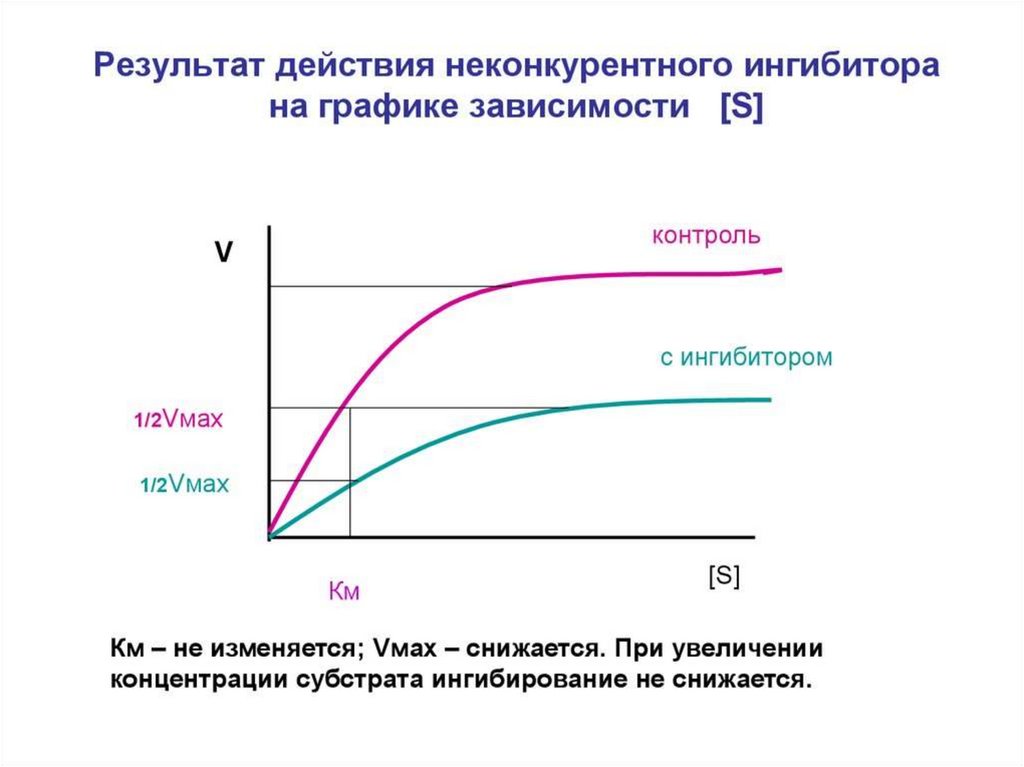
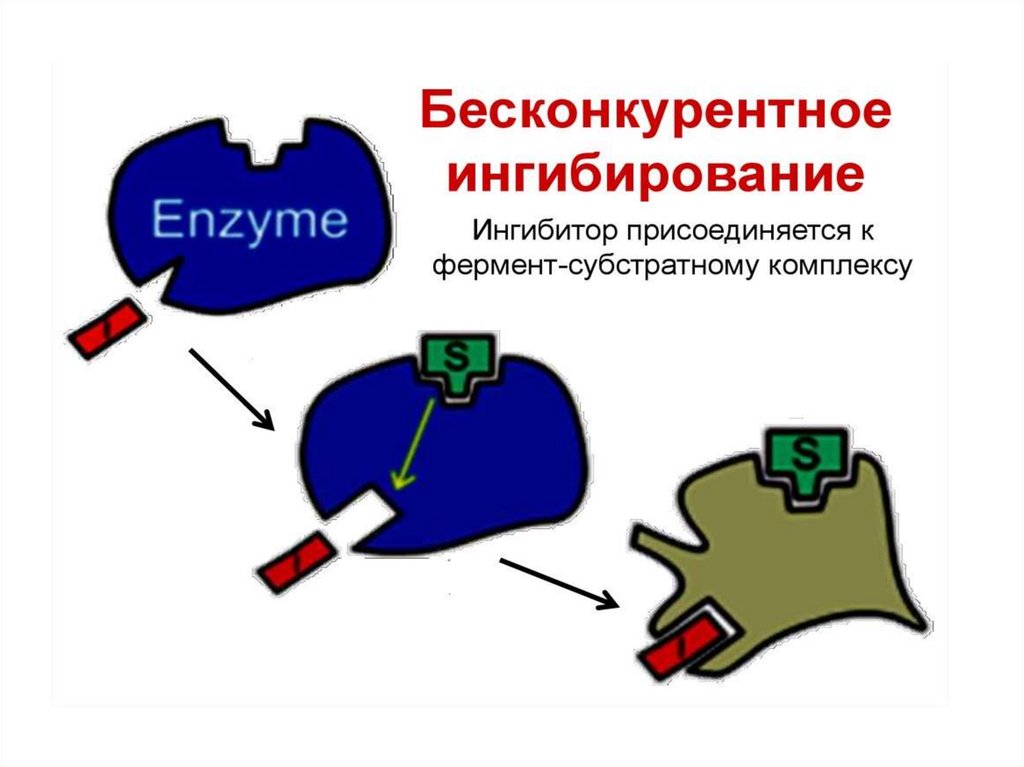
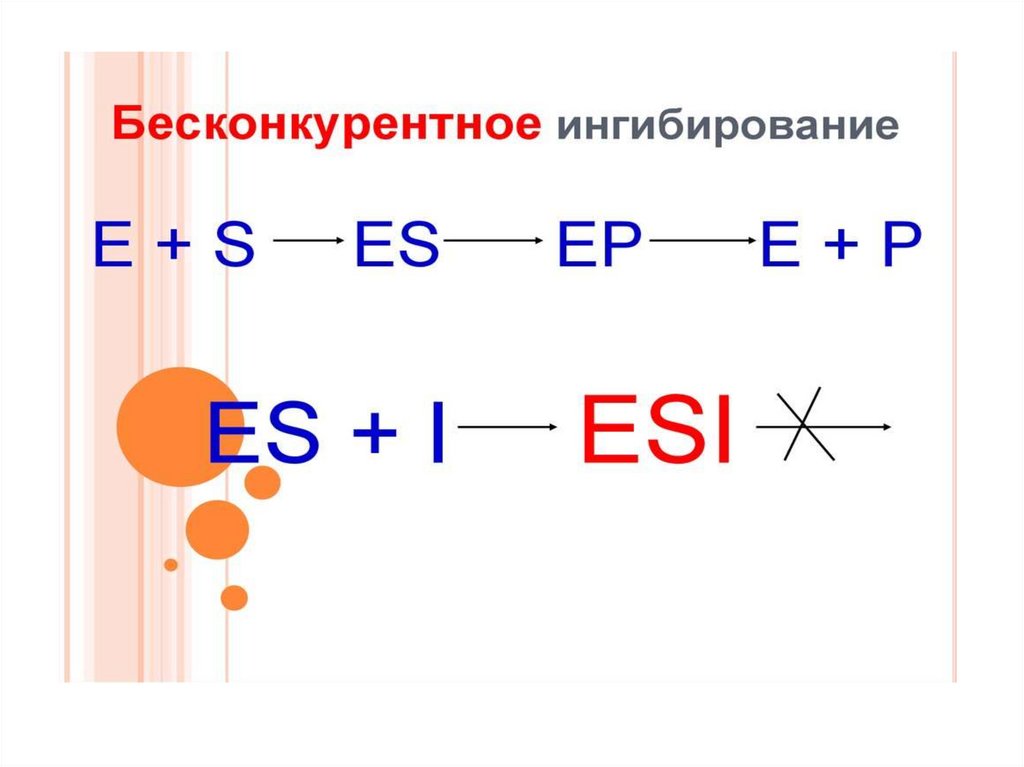
Неконкурентное ингибирование75.
76.
77.
78.
79.
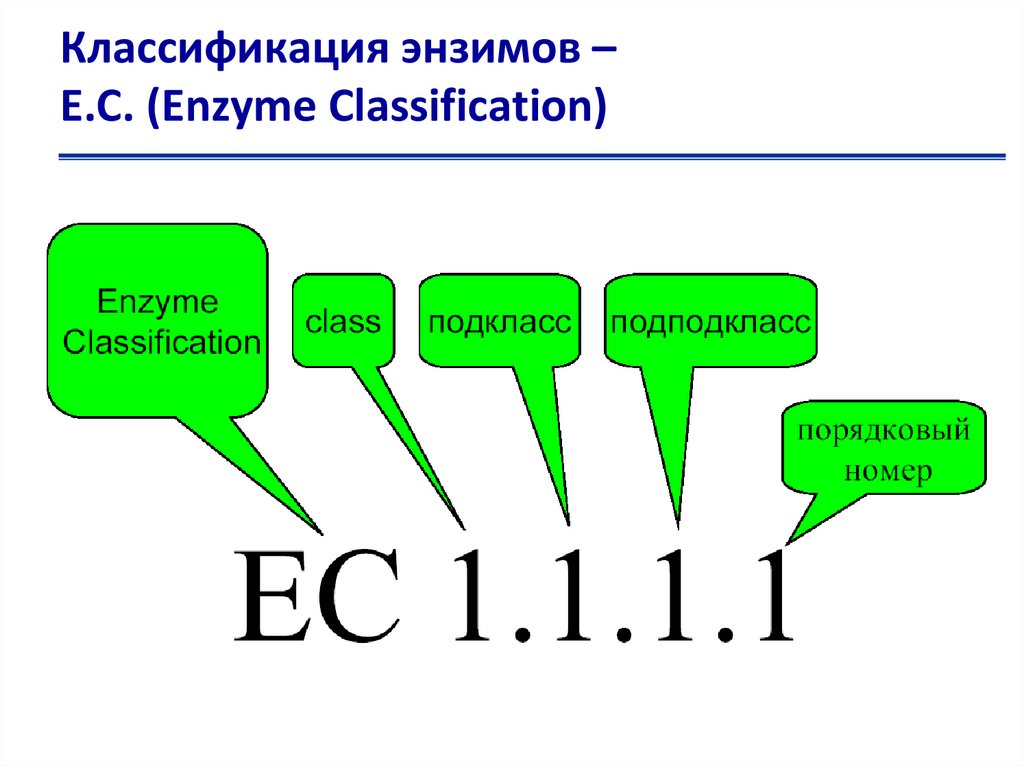
Классификация энзимов –Е.С. (Enzyme Classification)
80.
Номенклатура ферментов1. Класс : указывает номер одного из шести главных классов
ферментов
2. Подкласс: означает подкласс, характеризующий основные
виды субстратов , участвующих в данном типе химических
реакций (Например, у трансфераз вторая цифра указывает
на природу той группы, которая подвергается переносу,
у гидролаз — на тип гидролизуемой связи и т. д.)
3. Под-подкласс: определяет более частные подгруппы (подподклассы),
отличающиеся
природой
химических
соединений доноров или акцепторов, участвующих в
данной подгруппе реакций (у лиаз — тип отщепляемой
группы)
4. Все ферменты, относящиеся к данному под-подклассу,
получают свой порядковый номер (четвёртое число в
шифре).
81.
82.
Пример 4-х значного кода.Например, глюкозоксидаза имеет шифр КФ 1.1.3.4,
что означает:
КФ 1 — Оксидоредуктазы
КФ 1.1 — Алкогольоксидоредуктазы
КФ 1.1.3 — Оксидоредуктазы, окисляющие группу
CH-OH и восстанавливающие кислород.
КФ 1.1.3.4 — Оксидоредуктазы,
окисляющие глюкозу в присутствии кислорода.
Всего известно 3 глюкозоксидазы из разных
организмов.
83.
Классификация энзимов –Е.С. (Enzyme Classification)
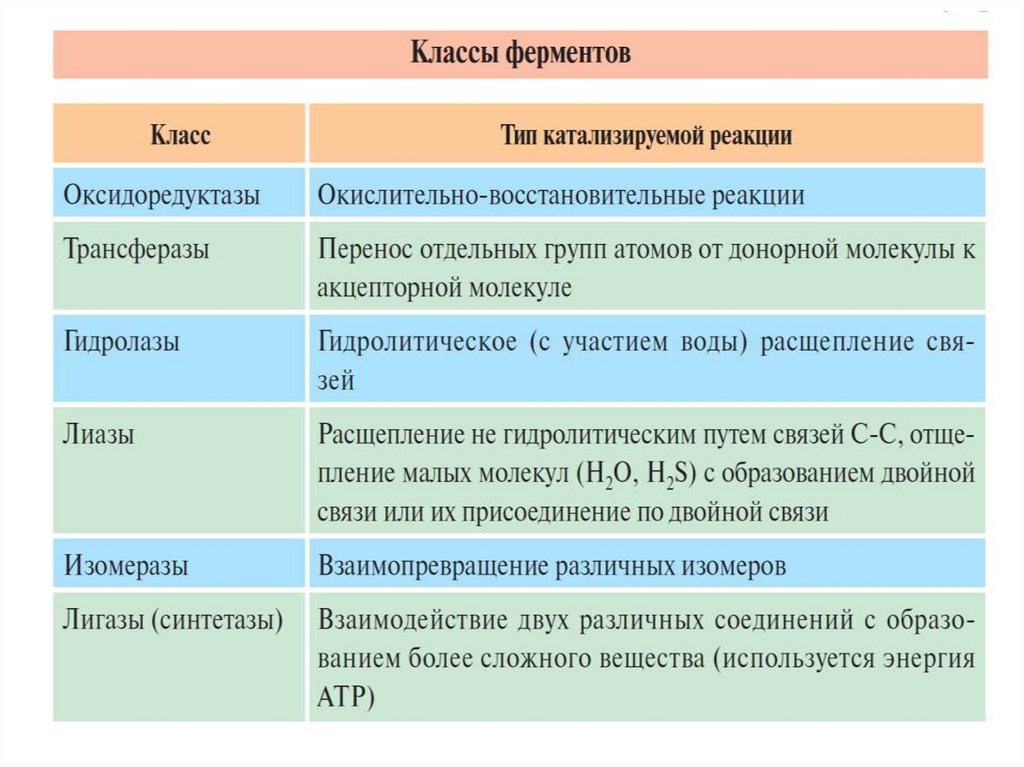
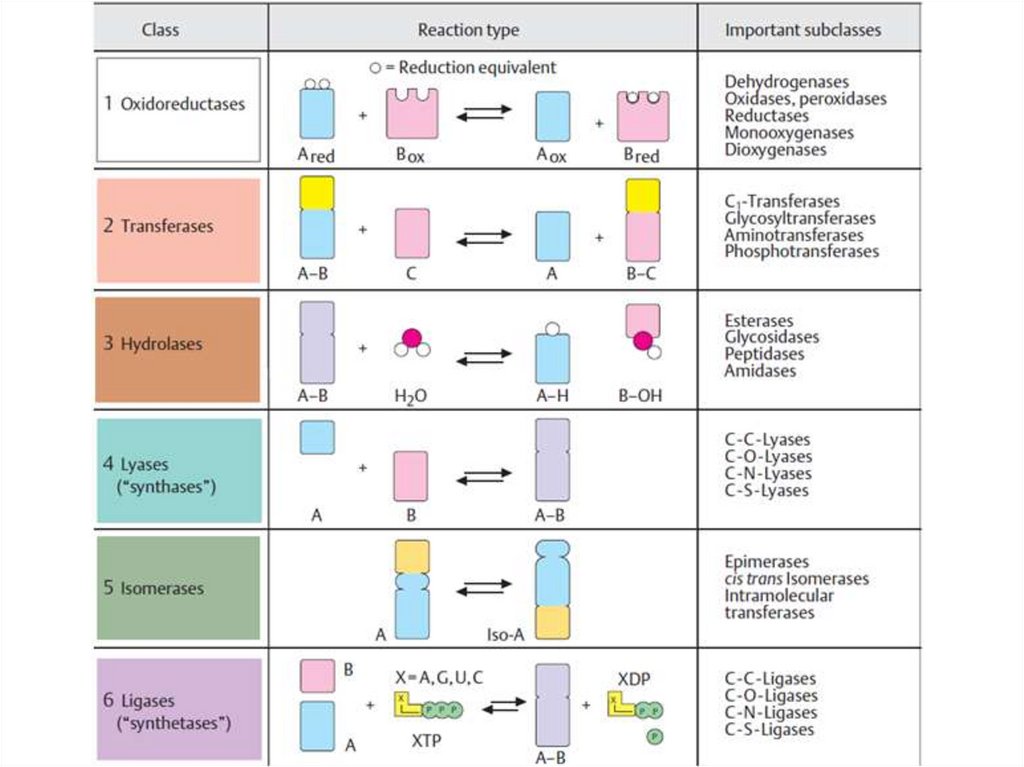
•Е.С.1. – оксидоредуктазы (oxidoreductases).
•Е.С.2. – трансферазы (transferases).
•Е.С.3. – гидролазы (hydrolases).
•Е.С.4. – лиазы (lyases(=)).
•Е.С.5. – изомеразы (isomerases)
•Е.С.6. – лигазы (ligases-synthetase).


































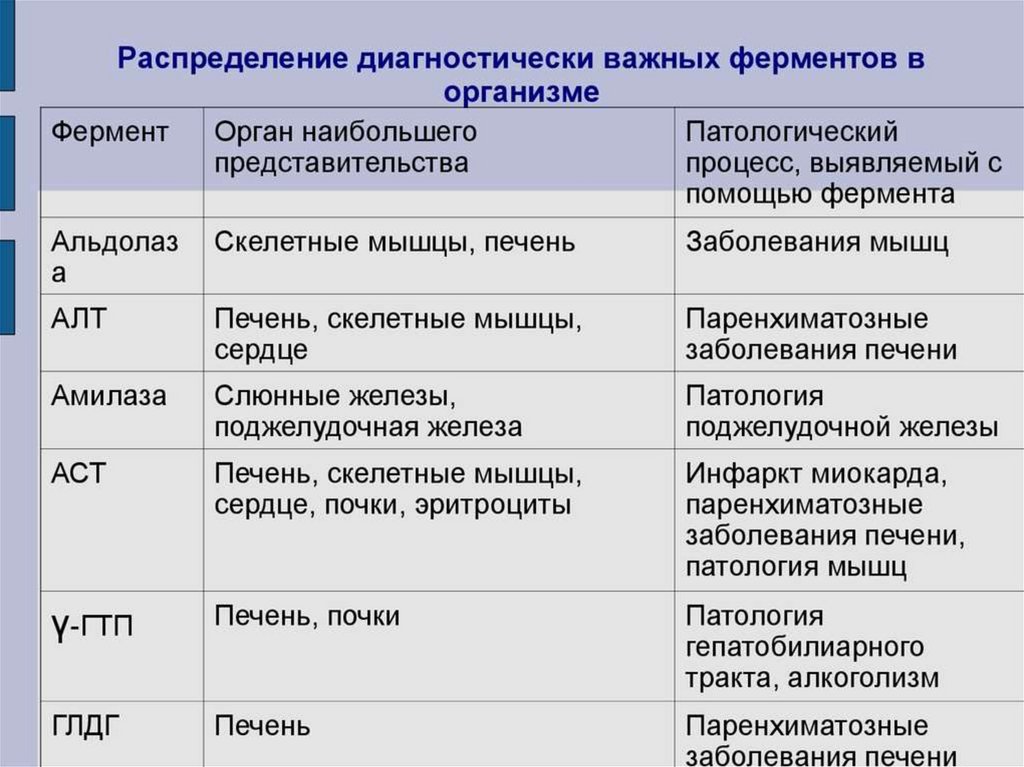

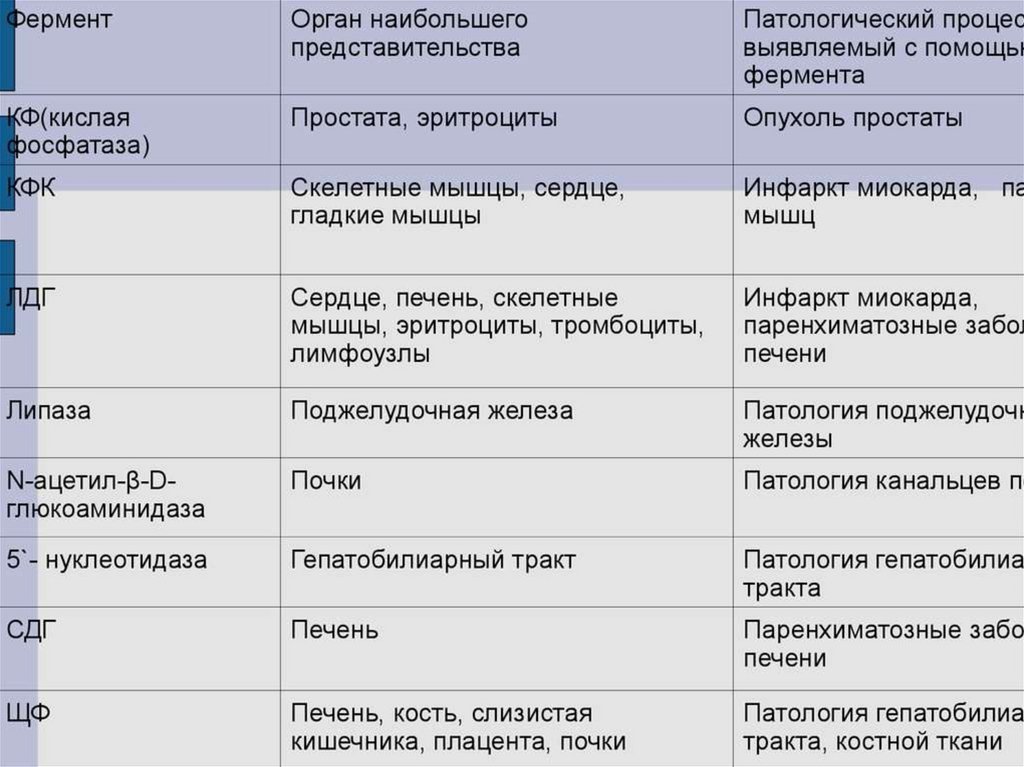

 biology
biology








