Similar presentations:
Ферменты простые и сложные (лекция 1)
1.
Красноярский государственный медицинскийуниверситет им. проф. В.Ф.Войно-Ясенецкого
Кафедра биохимии с курсами медицинской,
фармацевтической и токсикологической химии
Тема лекции:
«Ферменты»
Старший преподаватель,
Семенчуков Алексей Алексеевич
2017
2.
Ферменты – биологические катализаторыбелковой природы.
Активный центр фермента – участок
фермента, в котором происходит
специфическое связывание субстрата и его
превращение в продукт.
Активный центр состоит из двух сайтов
(участков):
- Связывающий участок (связывает
субстрат в активном центре)
- Каталитический участок (катализирует
превращение субстрата в продукт)
Связывающий участок и
каталитический участок активного
центра фермента лизоцим.
Пептидогликан – субстрат лизоцима.
3.
В отличие от неорганических катализаторов,ферменты:
1) действуют в мягких условиях (37ºС; 7,4 рН)
2) специфичны (действуют на один субстрат или на
группу близкородственных субстратов);
3) высокоэффективны (одна молекула фермента
катализирует превращения миллионов молекул
субстрата в минуту);
4) регулируются (т.е. при определенных условиях
работают с соответсвующими данной ситуации
скоростями).
пепсин
4.
ФерментыПростые
(состоят только
из аминокислот)
Сложные
(Апофермент + Кофактор)
Органические кофакторы (коферменты):
Никотинамидадениндинуклеотид (НАД+);
Флавинадениндинуклеотид (ФАД)
Тиаминдифосфат (ТДФ)
Пиридоксальфосфат (ПФ)
Тетрагидробиоптерин (Н4БП)
S-аденозилметионин (SAM) и т.д.
Ионы металлов:
Mg2+, Mn2+, Zn2+, Fe2+,
Cu2+
5.
КофакторыКофакторы участвуют в:
1) стабилизации субстрата в активном
центре фермента;
2) стабилизации самого активного
центра фермента;
3) каталитизируемой реакции
Участие ионов Zn2+ в стабилизации четвертичной
структуры алкогольдегидрогеназы
Ионы Mg2+ участвуют в размещении глюкозы
и АТР в активном центре гексокиназы
6.
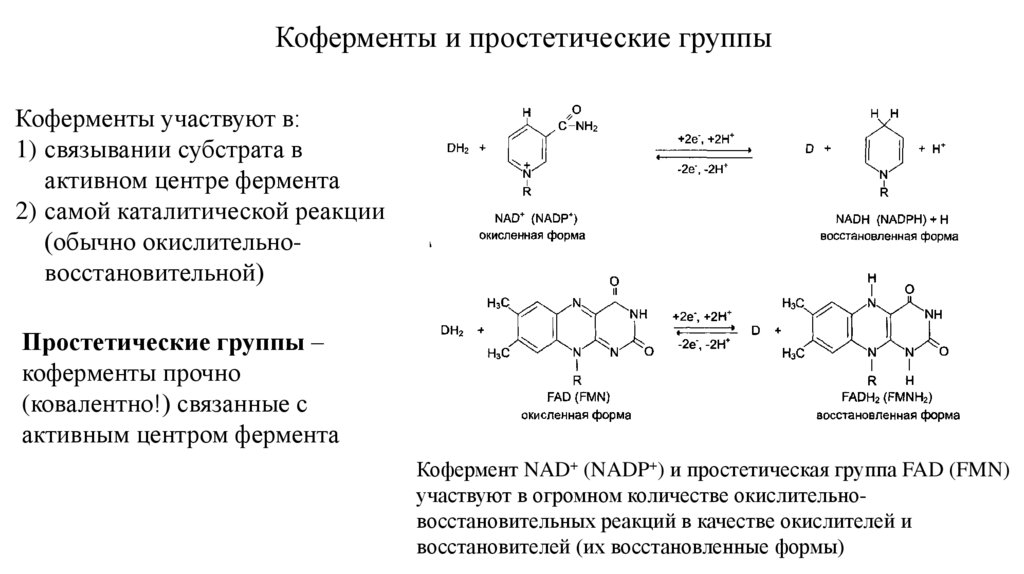
Коферменты и простетические группыКоферменты участвуют в:
1) связывании субстрата в
активном центре фермента
2) самой каталитической реакции
(обычно окислительновосстановительной)
Простетические группы –
коферменты прочно
(ковалентно!) связанные с
активным центром фермента
Кофермент NAD+ (NADP+) и простетическая группа FAD (FMN)
участвуют в огромном количестве окислительновосстановительных реакций в качестве окислителей и
восстановителей (их восстановленные формы)
7.
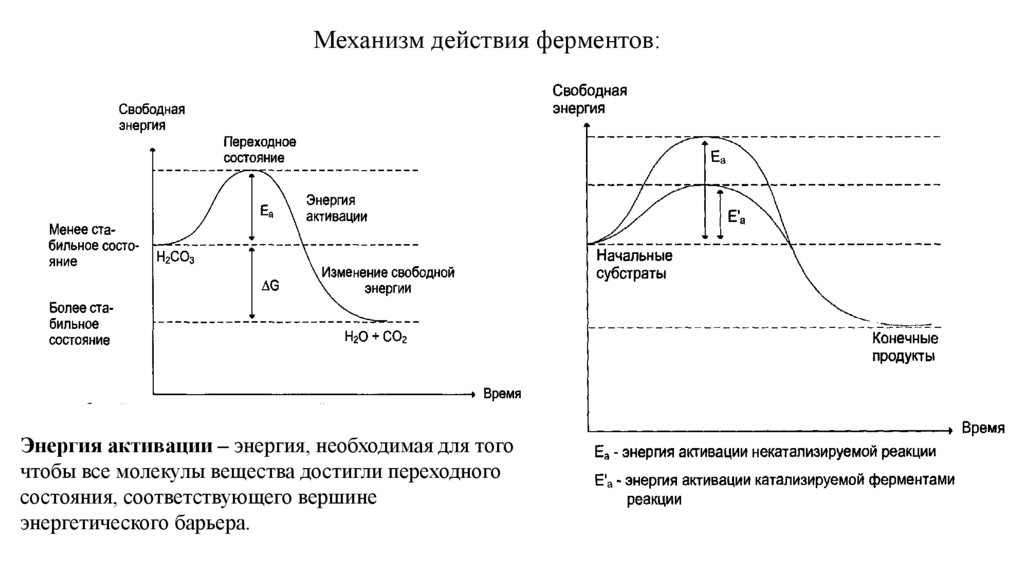
Механизм действия ферментов:Энергия активации – энергия, необходимая для того
чтобы все молекулы вещества достигли переходного
состояния, соответствующего вершине
энергетического барьера.
8.
Общее уравнение ферментативной реакции:Е – фермент;
S – субстрат;
ES – фермент-субстратный комплекс;
Р – продукт реакции.
9.
Скорость ферментативной реакции (активность фермента) –изменение концентрации субстрата (убыль) и/или продукта (прирост)
за единицу времени.
А= - Δ[S] = Δ[P]
t
t
моль = катал
л∙с
мкмоль = МЕ (междунарожные единицы)
Чаще – А = мин∙л
Удельная активность =
мкмоль
мин • мг белка
10.
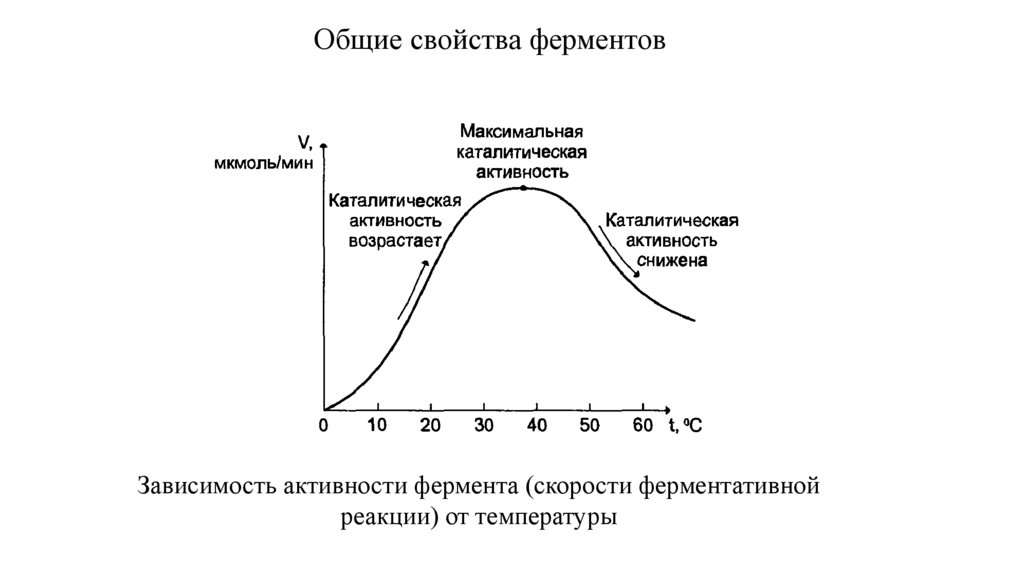
Общие свойства ферментовЗависимость активности фермента (скорости ферментативной
реакции) от температуры
11.
Общие свойства ферментовЗависимость активности фермента (скорости ферментативной
реакции) от рН среды
12.
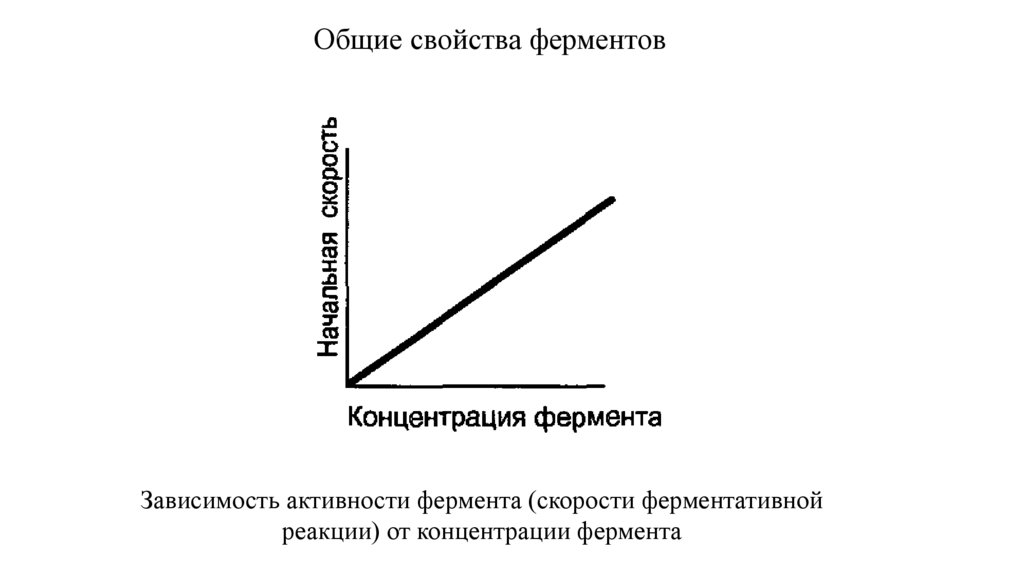
Общие свойства ферментовЗависимость активности фермента (скорости ферментативной
реакции) от концентрации фермента
13.
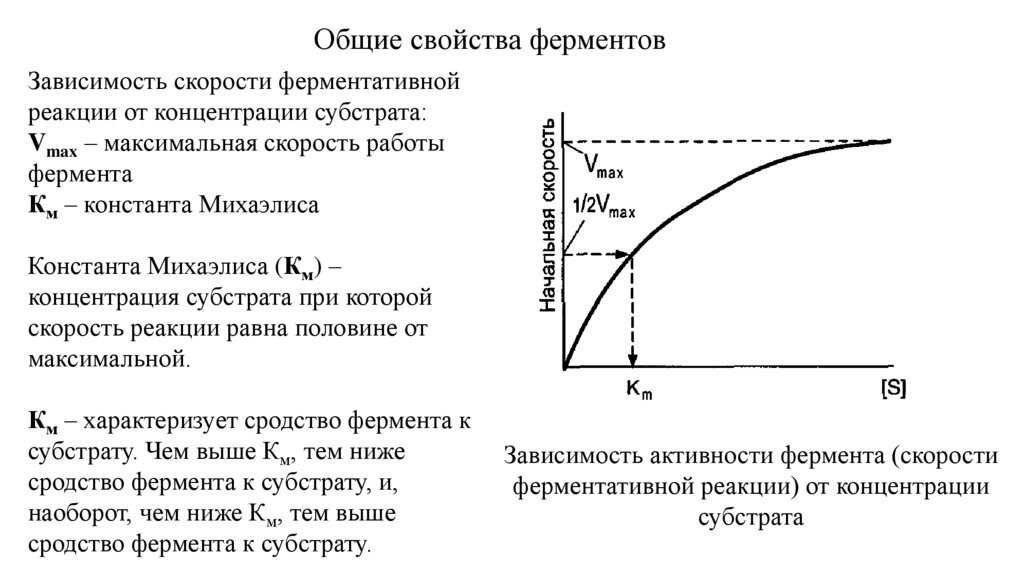
Общие свойства ферментовЗависимость скорости ферментативной
реакции от концентрации субстрата:
Vmax – максимальная скорость работы
фермента
Км – константа Михаэлиса
Константа Михаэлиса (Км) –
концентрация субстрата при которой
скорость реакции равна половине от
максимальной.
Км – характеризует сродство фермента к
субстрату. Чем выше Км, тем ниже
сродство фермента к субстрату, и,
наоборот, чем ниже Км, тем выше
сродство фермента к субстрату.
Зависимость активности фермента (скорости
ферментативной реакции) от концентрации
субстрата
14.
Ферментативная цепь (метаболический путь) – последовательное превращенияодних веществ в другие.
Е1
Е2
Е3
Е4
Е5
Е6
А→Б→В→Г→Д→Е→Ж
Линейный метаболический путь
Ключевые ферменты – ферменты способные изменять свою активность
(«включаться» или «выключаться») под действием определенных специфичных
стимулов. Катализируют необратимые реакции, стоящие в начале ферментативной
цепи, на ее развилке и имеющие наименьшую скорость.
Биологическая роль ключевых ферментов – регуляция протекания метаболического
пути.
15.
Пример ферментативной цепи: гликолиз – процесс окисления глюкозыдо пировиноградной кислоты (пирувата)
Е1
Е2
Е3
Е4
Е5
Е6
А→Б→В→Г→Д→Е→Ж
Глюкоза
Пировиноградная
кислота
Ключевые ферменты гликолиза – гексокиназа, фосфофруктокиназа,
пируваткиназа.
Функция гликолиза: Образование энергии в клетке (образование АТФ)
16.
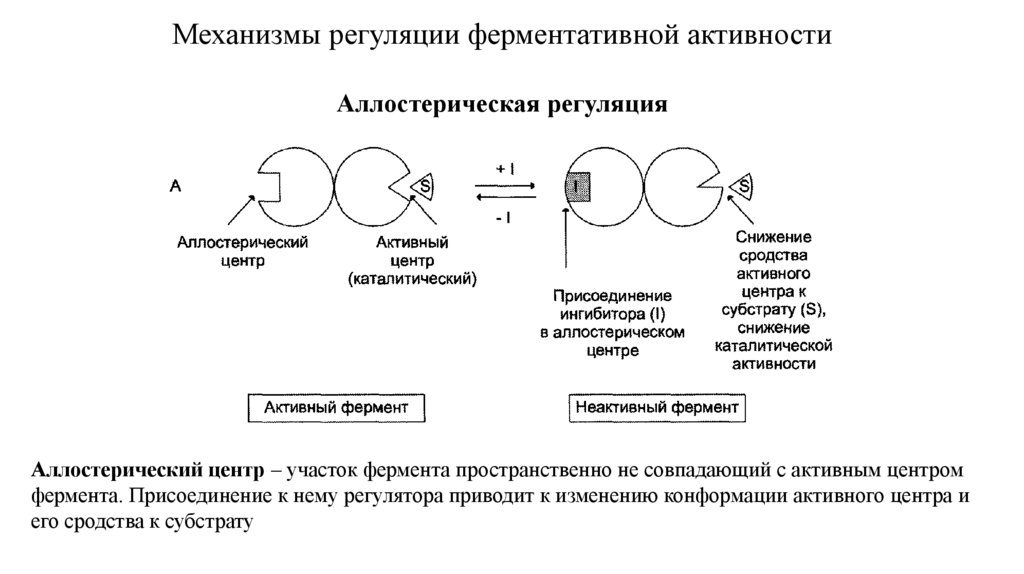
Механизмы регуляции ферментативной активностиАллостерическая регуляция
Аллостерический центр – участок фермента пространственно не совпадающий с активным центром
фермента. Присоединение к нему регулятора приводит к изменению конформации активного центра и
его сродства к субстрату
17.
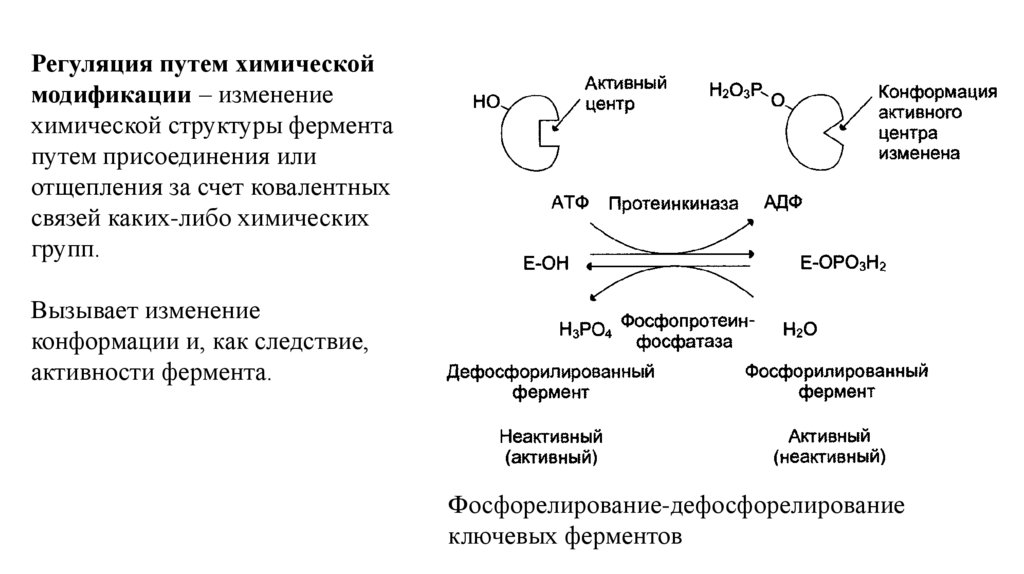
Регуляция путем химическоймодификации – изменение
химической структуры фермента
путем присоединения или
отщепления за счет ковалентных
связей каких-либо химических
групп.
Вызывает изменение
конформации и, как следствие,
активности фермента.
Фосфорелирование-дефосфорелирование
ключевых ферментов
18.
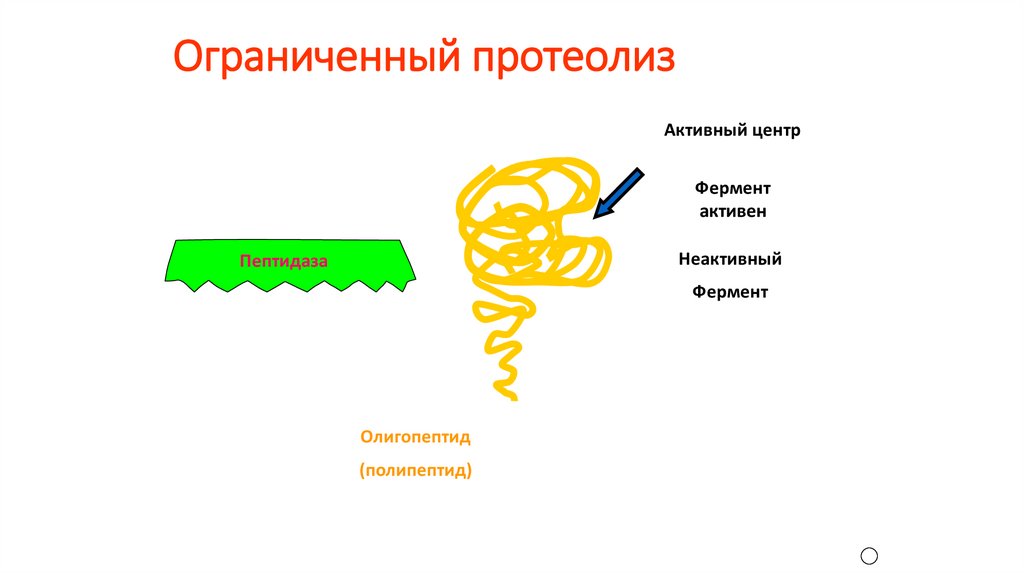
Ограниченный протеолизАктивный центр
Фермент
активен
Неактивный
Пептидаза
Фермент
Олигопептид
(полипептид)
19.
Регуляция путем взаимодействия«белок-белок» – характерна для
белков имеющих четвертичную
структуру, т.е. состоящих из
субъединиц.
Диссоциация и ассоциация этих
субъединиц приводит к изменению
конформации активного центра
фермента.
Пример: Активация Протеинкиназы А
путем диссоциации ее каталитических (С) и
регуляторных (R) субъединиц.
20.
Типы ингибирования ферментативной активностиИнгибирование:
I. необратимое (ингибитор прочно связан с активным центром);
II. обратимое (ингибитор не прочно связан с активным центром).
Типы обратимого ингибирования:
1) конкурентное - ингибитор похож на субстрат и конкурирует с
ним за активный центр – (а);
2) бесконкурентное - ингибитор связывается только с ферментсубстратным комплексом – (b);
3) неконкурентное (смешанное) – ингибитор связывается как с
ферментом, так и с фермент-субстратным комплексом – (с);
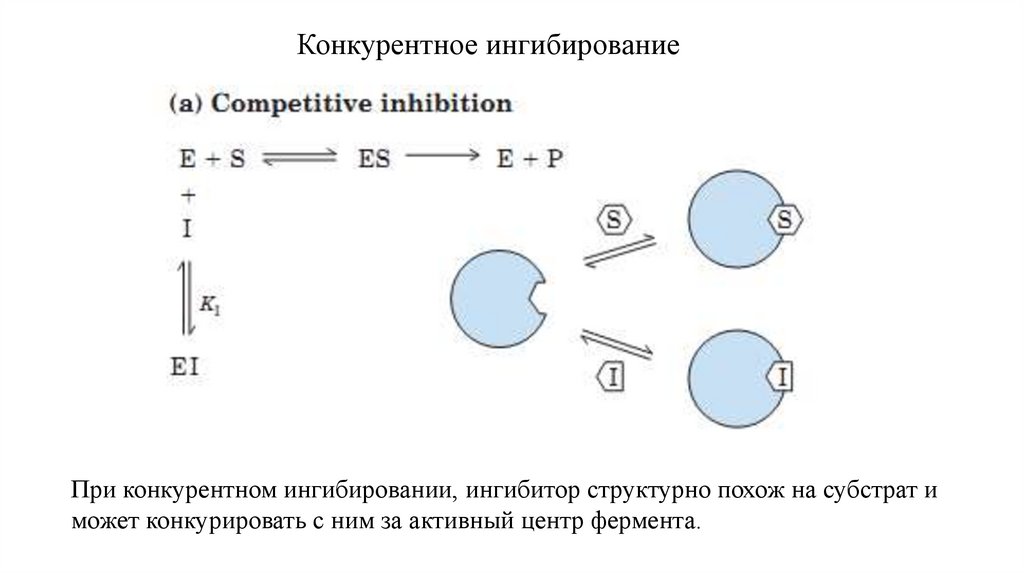
21.
Конкурентное ингибированиеПри конкурентном ингибировании, ингибитор структурно похож на субстрат и
может конкурировать с ним за активный центр фермента.
22.
Бесконкурентное ингибированиеПри бесконкурентном ингибировании, ингибитор способен связываться только с
фермент-субстратным комплексом и ингибировать превращение субстрата в
продукт
23.
Неконкурентное (смешанное) ингибированиеПри неконкурентном ингибировании, ингибитор способен связываться как с
ферментом, так и с фермент-субстратным комплексом в участке отличном от
активного центра
24.
Классификация ферментовI. Оксидоредуктазы –
катализируют окислительновосстановительные реакции.
Делятся на:
1) Дегидрогеназы (используют
NAD+, FAD);
2) Оксидазы (окислитель –
кислород, восстанавливается до
воды);
3) Оксигеназы (окислитель –
кислород, встраивается в
молекулу субстрата в виде -ОН)
4) Редуктазы (используют NADРН)
SH2 + NAD+ = S+ + NADH + H+
25.
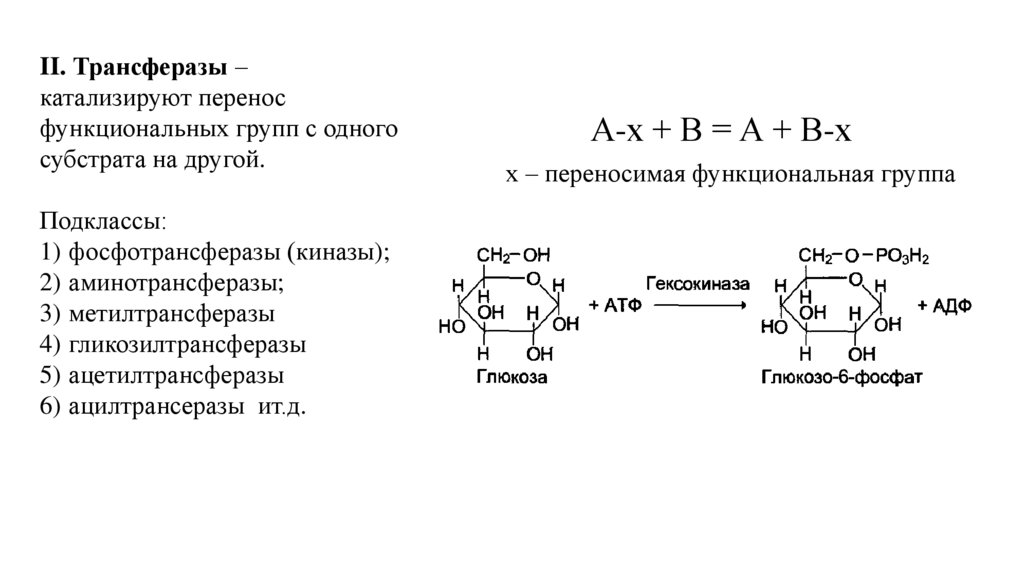
II. Трансферазы –катализируют перенос
функциональных групп с одного
субстрата на другой.
Подклассы:
1) фосфотрансферазы (киназы);
2) аминотрансферазы;
3) метилтрансферазы
4) гликозилтрансферазы
5) ацетилтрансферазы
6) ацилтрансеразы ит.д.
А-х + В = А + В-х
х – переносимая функциональная группа
26.
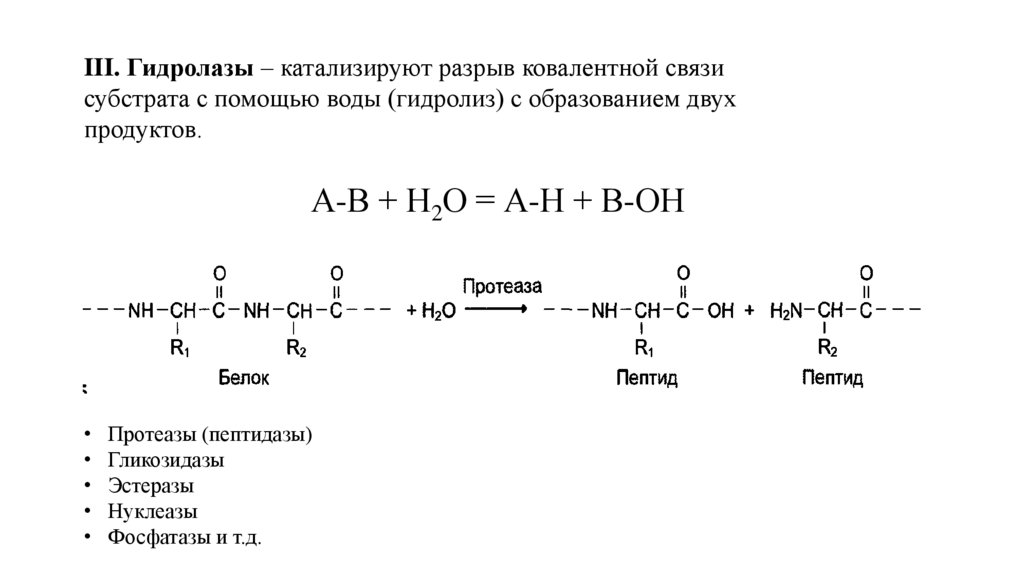
III. Гидролазы – катализируют разрыв ковалентной связисубстрата с помощью воды (гидролиз) с образованием двух
продуктов.
А-В + Н2О = А-Н + В-ОН
Протеазы (пептидазы)
Гликозидазы
Эстеразы
Нуклеазы
Фосфатазы и т.д.
27.
IV. Лиазы – катализируютрасщепление ковалентных
связей без участия воды, либо,
расщепление двойных связей с
участием воды (при этом вода
присоединяется по месту
разрыва двойной связи).
А-В = А + В
А=В + Н2О = Н-А-В-ОН
28.
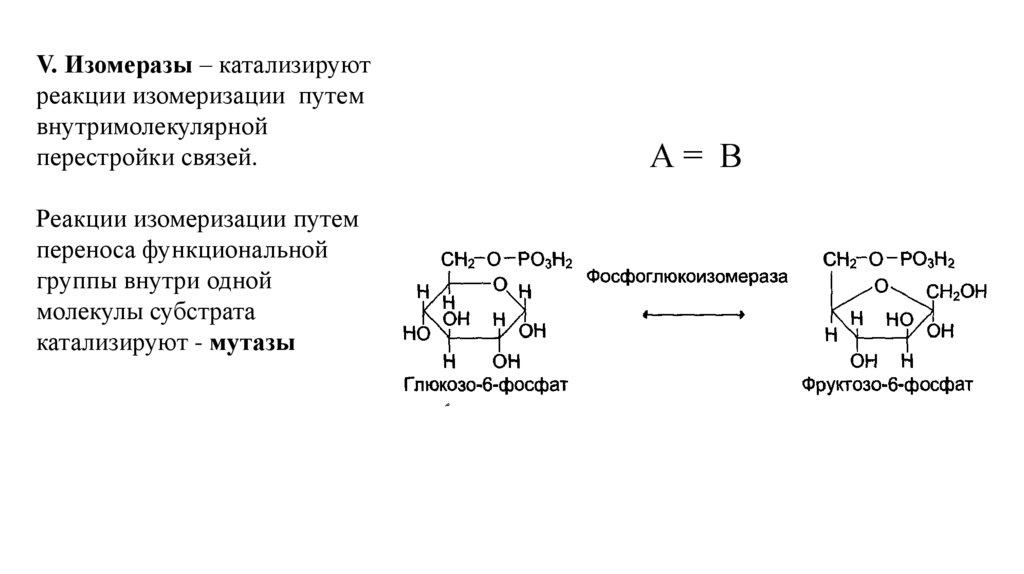
V. Изомеразы – катализируютреакции изомеризации путем
внутримолекулярной
перестройки связей.
Реакции изомеризации путем
переноса функциональной
группы внутри одной
молекулы субстрата
катализируют - мутазы
А= В
29.
VI. Лигазы (синтетазы) –катализируют реакции
синтеза - образование
ковалентных связей между
несколькими молекулами
субстрата с образованием
одного продукта за счет
энергии АТР.
А + В + АТФ = А-В + АДФ + Н3РО4
30.
Литература:1. Северин, Е. С. Биохимия / Е. С. Северин. - М. :
ГЭОТАР-Медиа, 2005. - 784 с.
2. Нельсон, Д. Основы биохимии Ленинджера:
учебник. В 3 т. Т.1. Основы биохимии.
Строение и катализ / Д. Нельсон, М. Кокс ; ред.
А. А. Богданов, С. Н. Кочетков ; пер. с англ. Т.
П. Мосолова, Е. М. Молочкина, В. В. Белов. М. : БИНОМ. Лаборатория знаний, 2012. - 694
с. : ил. - (Лучший зарубежный учебник)


















 biology
biology








