Similar presentations:
2025 Оксиды серы 1
1. Оксиды серы
ОКСИДЫ СЕРЫ2.
Физические свойства оксидов серыСернистый газ - бесцветен, с
резким запахом, ядовит.
Тяжелее воздуха более чем в 2
раза. Хорошо растворяется в
воде.
Серный ангидрид - бесцветная жидкость,
которая при температуре ниже 17оС
превращается в белую кристаллическую
массу. Растворяется в воде с выделением
большого количества тепла.
3.
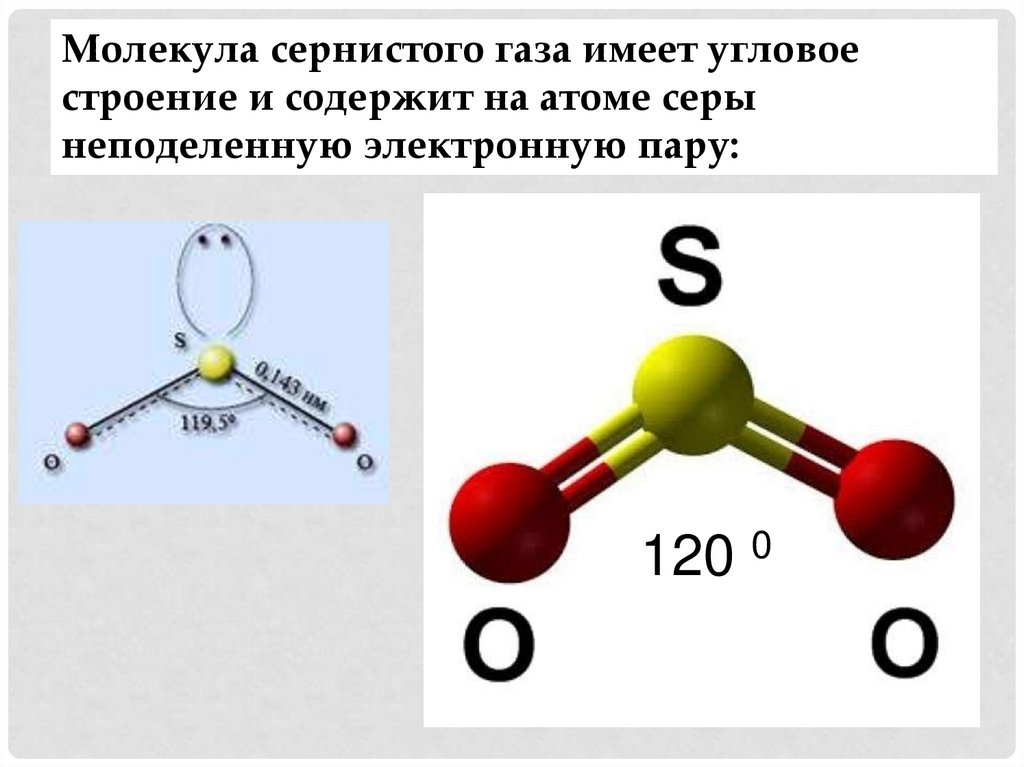
Молекула сернистого газа имеет угловоестроение и содержит на атоме серы
неподеленную электронную пару:
120 0
4.
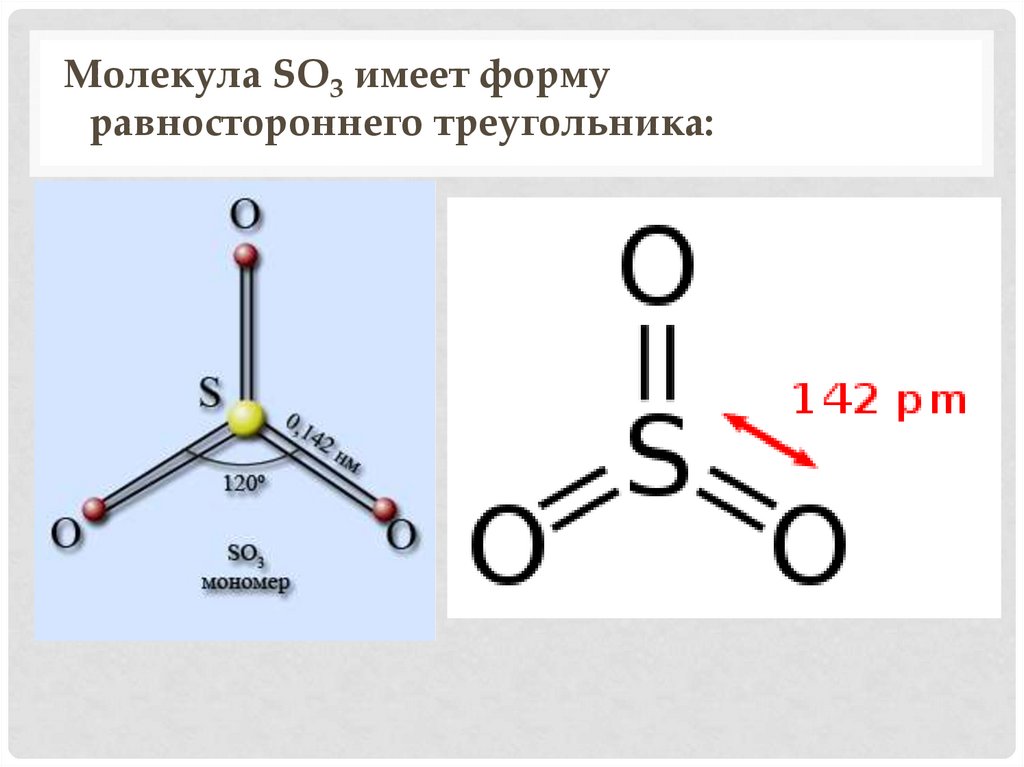
Молекула SO3 имеет формуравностороннего треугольника:
5.
6.
7. Получение оксида серы (VI)
ПОЛУЧЕНИЕ ОКСИДА СЕРЫ (VI)Серный ангидрид получают каталитическим
окислением оксида серы (IV)
2·сернистый газ + кислород → оксид серы(VI)
8. Химические свойства оксидов серы
ХИМИЧЕСКИЕ СВОЙСТВАОКСИДОВ СЕРЫ
SO2 и SO3 – кислотные оксиды
SO2 + H2O = H2SO3
SO2 + Na2O = Na2SO3
SO2 + 2 NaOH = Na2SO3 + H2O
SO2 + NaOH = NaHSO3
9. Химические свойства оксида серы (VI)
ХИМИЧЕСКИЕ СВОЙСТВАОКСИДА СЕРЫ (VI)
10.
Окислительно-восстановительныесвойства оксидов серы
В молекулах SO2 атомы серы
В молекулах SO3 атомы серы
имеют промежуточную степень
находятся в высшей степени
окисления (+4), и поэтому сернистый окисления, и поэтому этот оксид
ангидрид проявляет и
проявляет только сильные
окислительные, и
окислительные свойства. При этом он
восстановительные свойства.
обычно восстанавливается до SO2
11.
12.
Окислительные свойстваоксида серы (IV) SO2
SO2 + 2H2S = 3S + 2H2O
13. SO2 как отбеливатель
SO2 КАК ОТБЕЛИВАТЕЛЬОксид серы
(IV) SO2 разрушает
органические
красители,
обесцвечивая их.
Например, зеленые
чернила "Радуга" под
действием оксида
серы (IV) изменяют
свой цвет. Поэтому
сернистый газ
применяется в
промышленности
как отбеливатель.
14. Применение
ПРИМЕНЕНИЕСернистый газ применяется в производстве
серной кислоты, оксида серы (VI), сульфитов,
гидросульфитов, для отбеливания шерсти,
шелка, соломы, консервирования фруктов и
овощей, дезинфекции и как антиоксидант.
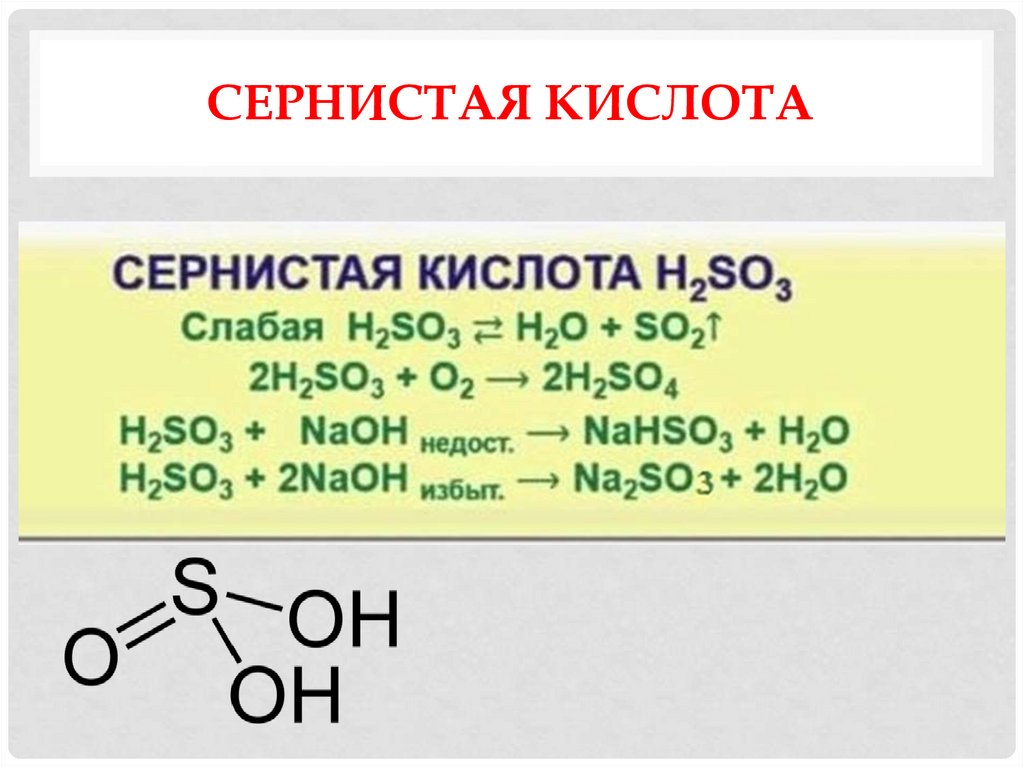
15. Сернистая кислота
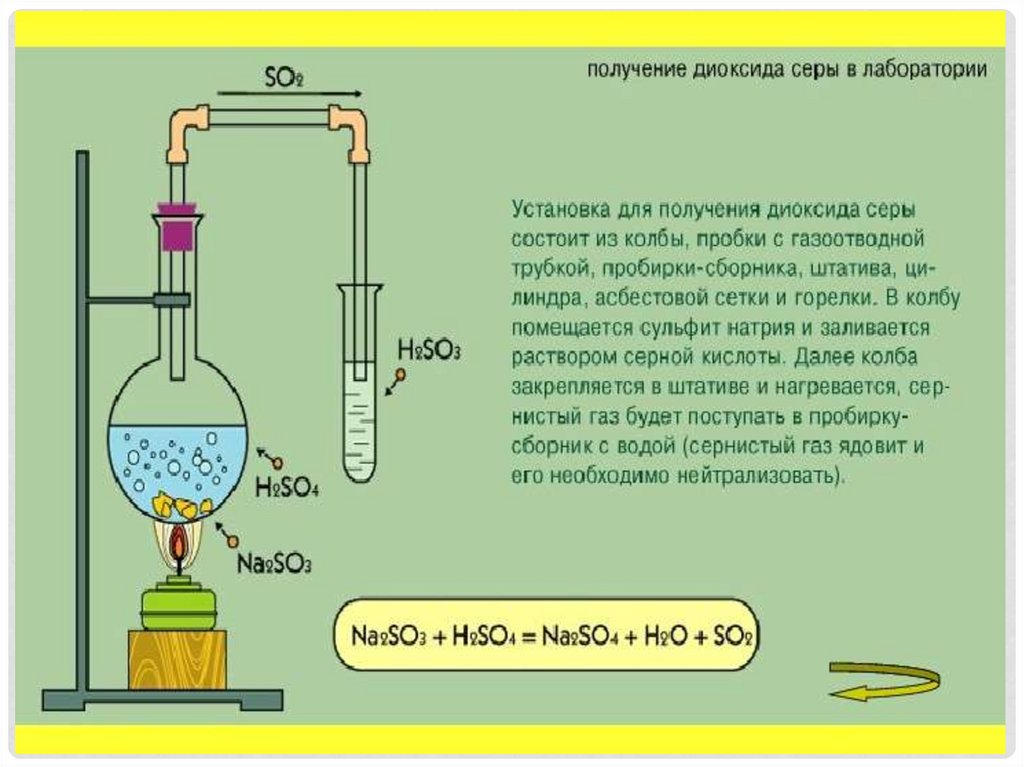
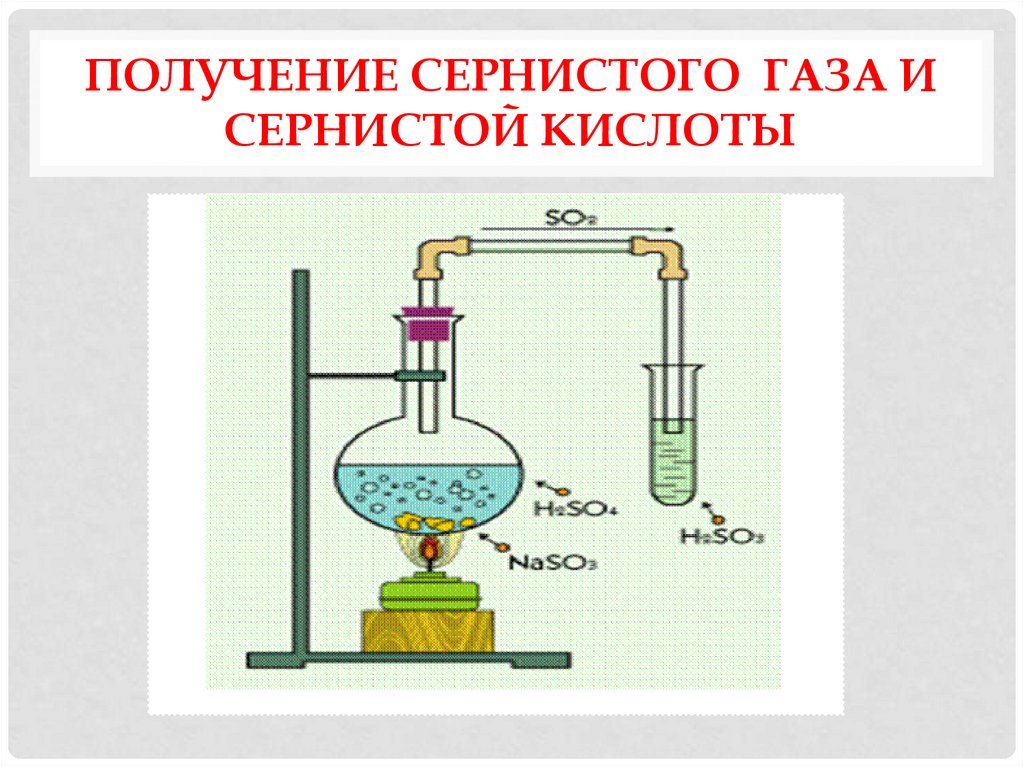
СЕРНИСТАЯ КИСЛОТА16. Получение сернистого газа и сернистой кислоты
ПОЛУЧЕНИЕ СЕРНИСТОГО ГАЗА ИСЕРНИСТОЙ КИСЛОТЫ
17. Качественная реакция на сульфит-ион
КАЧЕСТВЕННАЯ РЕАКЦИЯ НАСУЛЬФИТ-ИОН
Na2SO3 + 2HCl = 2NaCl + SO2 + H2O
2H+ + SO32- = SO2 + H2O
18.
Серный ангидрид – очень сильный окислитель,т.к. сера в нем имеет максимальную степень окисления
(+6).
Поэтому он энергично взаимодействует с такими
восстановителями, как, например, иодид калия,
сероводород или фосфор:
19. Составить уравнения реакций
СОСТАВИТЬ УРАВНЕНИЯ РЕАКЦИЙS SO2 Na2SO3 BaSO3
















 chemistry
chemistry








