Similar presentations:
1481847
1.
Практическая работа №1.Влияние различных факторов на
скорость химической реакции.
Цель: изучить влияние различных
факторов на скорость химической
реакции.
2.
Влияние площадисоприкосновения реагирующих
веществ.
3.
В одну пробиркунасыпьте немного порошка
железа, в другую – положите
железную гранулу и в обе
пробирки прилить по 2 мл
разбавленной соляной кислоты
(1:2).
4.
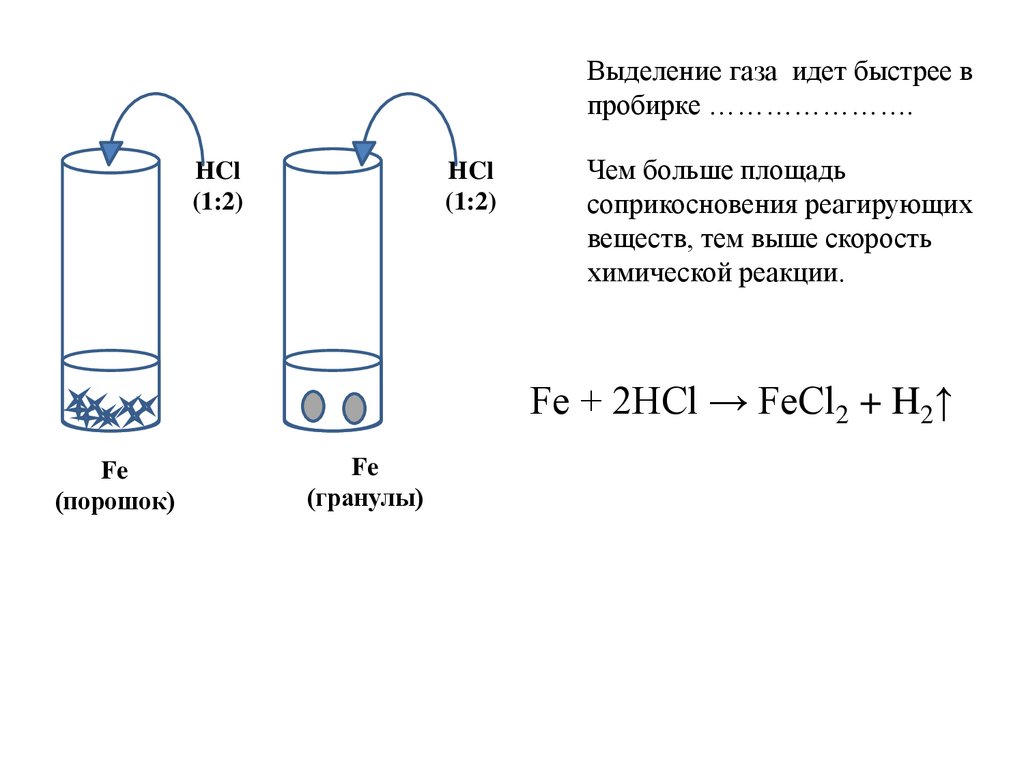
Выделение газа идет быстрее впробирке ………………….
HCl
(1:2)
HCl
(1:2)
Чем больше площадь
соприкосновения реагирующих
веществ, тем выше скорость
химической реакции.
Fe + 2HCl → FeCl2 + H2↑
Fe
(порошок)
Fe
(гранулы)
5.
Влияние температуры6.
В две пробирки поместите по 1грануле алюминия, прилейте в
обе пробирки раствор соляной
кислоты. Одну из пробирок
нагрейте.
7.
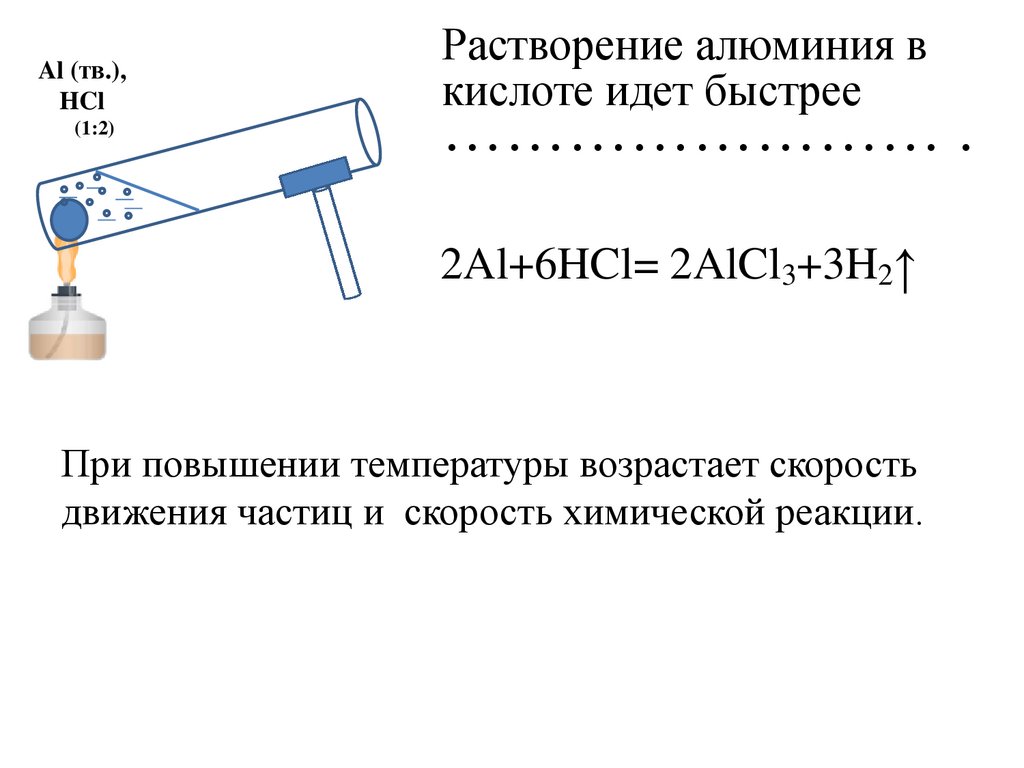
Al (тв.),HCl
(1:2)
Растворение алюминия в
кислоте идет быстрее
…………………… .
2Al+6HCl= 2AlCl3+3H2↑
При повышении температуры возрастает скорость
движения частиц и скорость химической реакции.
8.
Влияние катализатора.9.
В две пробирки налейте по 1 млпероксида водорода Н2О2, в одну
из пробирок добавьте несколько
кристалликов оксида марганца
(IV) MnO2.
10.
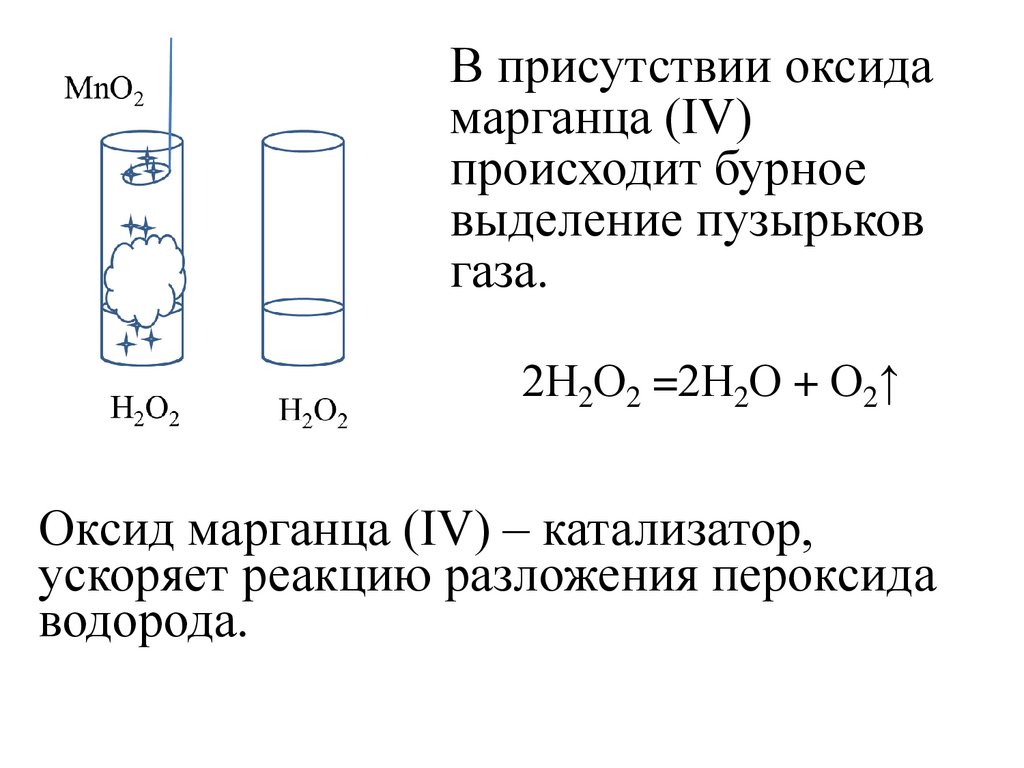
В присутствии оксидамарганца (IV)
происходит бурное
выделение пузырьков
газа.
2Н2О2 =2Н2О + О2↑
Оксид марганца (IV) – катализатор,
ускоряет реакцию разложения пероксида
водорода.
11.
Влияние природыреагирующих веществ.
12.
Поместим в первую пробиркукусочек магния, во вторуюпробирку - гранулу алюминия.
Нальём в две пробирки по 30 капель
раствора соляной кислоты.
Наблюдаем скорость двух реакций.
13.
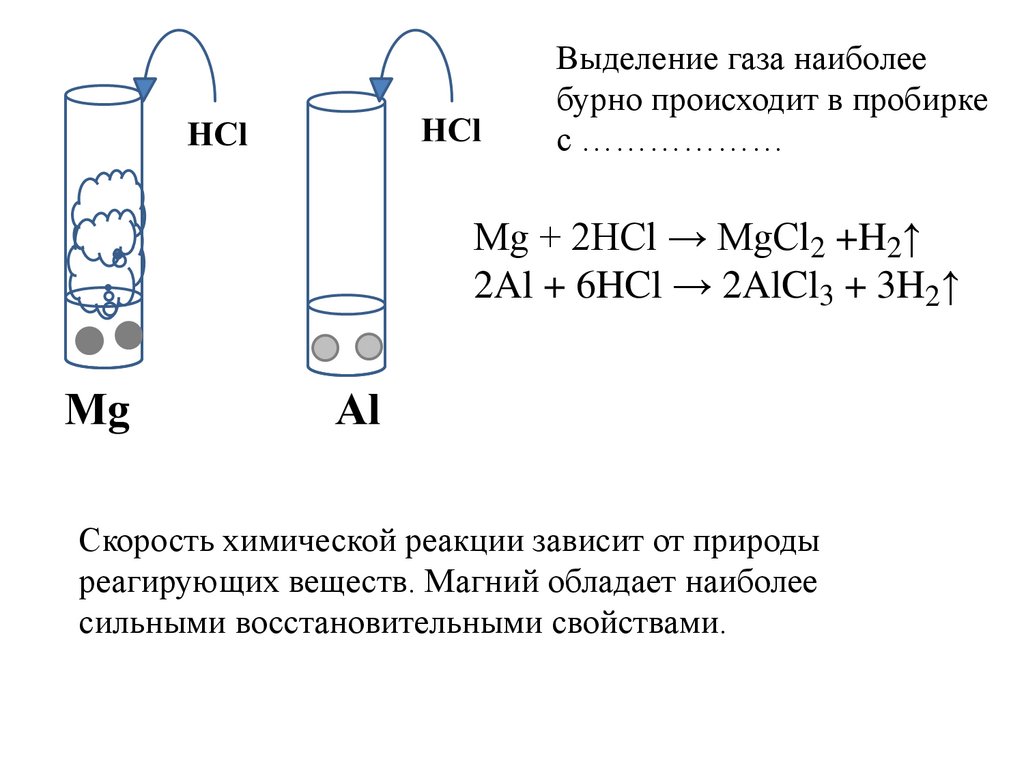
Выделение газа наиболеебурно происходит в пробирке
с ………………
Мg + 2HCl → MgCl2 +H2↑
2Al + 6HCl → 2AlCl3 + 3H2↑
Скорость химической реакции зависит от природы
реагирующих веществ. Магний обладает наиболее
сильными восстановительными свойствами.
14.
Влияние концентрацииреагирующих веществ.
15.
В две пробиркиопустите по грануле цинка, осторожно
прилейте растворы соляной кислоты: в
первую пробирку раствор кислоты 1:5, во
вторую – 1:10.
16.
В первой пробирке газ выделяется болееинтенсивно.
Zn + 2HCl→ ZnCl2 + H2↑
Чем выше концентрация реагирующих
веществ, тем чаще столкновения их
частиц и тем выше скорость химической
реакции.
17.
Вывод: скорость химической реакциизависит от условий: от природы
реагирующих веществ, от площади
соприкосновения, от концентрации, от
температуры, от присутствия
катализаторов.













 chemistry
chemistry








