Similar presentations:
6 лекция
1. Лекция 6. ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
Ермоленко Анастасия Алексеевна, к.х.н.,старший преподаватель кафедры аналитической химии
2.
ПЛАН ЛЕКЦИИ• I. Химическая кинетика.
• II. Факторы, влияющие на скорость
химических реакций.
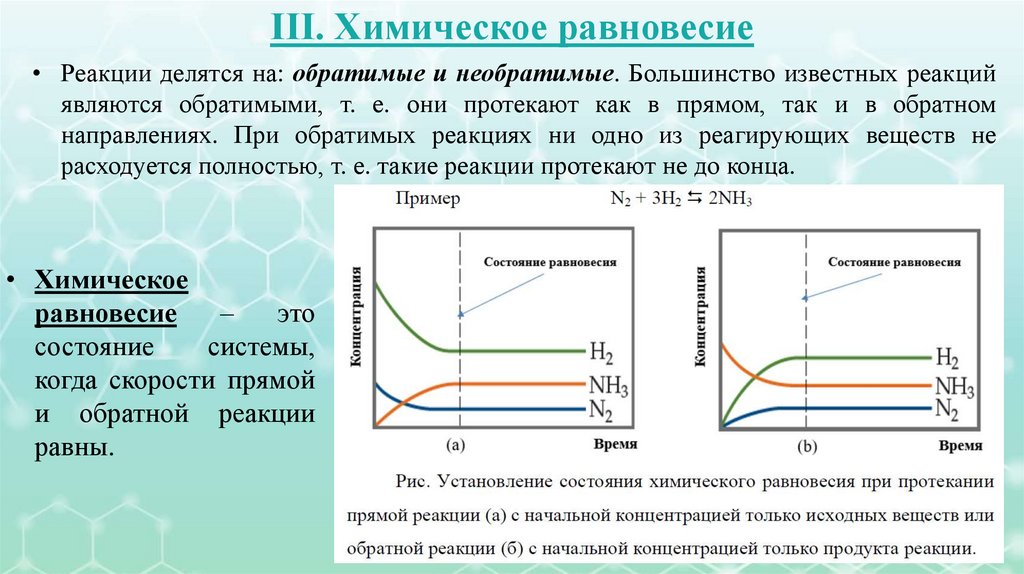
• III. Химическое равновесие.
• IV. Принцип Ле Шателье.
3.
I. Химическая кинетика• Химической кинетикой называется раздел химии, изучающий вопрос
о скоростях и механизмах химических процессов.
• Принципиальная возможность протекания конкретного химического
процесса определяется знаком и величиной изменения энергии Гиббса
ΔG. Однако реальная возможность этого процесса определяется его
скоростью.
• Скорости химических процессов могут существенно отличаться: от
медленной коррозии до взрыва.
• Реакции могут быть гомогенными (протекают в объеме одной фазы) и
гетерогенными (протекают на границе раздела двух фаз).
• Скоростью химического процесса называют изменение концентрации
какого-либо из реагирующих веществ в единицу времени при
неизменном объеме системы [моль/л сек].
4.
• Предположим, что за промежуток времени Δt = t2 – t1 концентрация одного изисходных веществ, участвующих в гомогенной реакции, уменьшается на -ΔС =
С2 – С1. Отсюда, средняя скорость реакции за взятый промежуток времени, в
случае линейного изменения концентрации, будет равна:
• Если же мы определяем изменение концентрации одного из продуктов реакции,
Δ














 chemistry
chemistry








