Similar presentations:
Кинетика химических реакций и катализ. Химическое равновесие
1.
Кинетика химическихреакций и катализ.
Химическое равновесие
Ключевые вопросы:
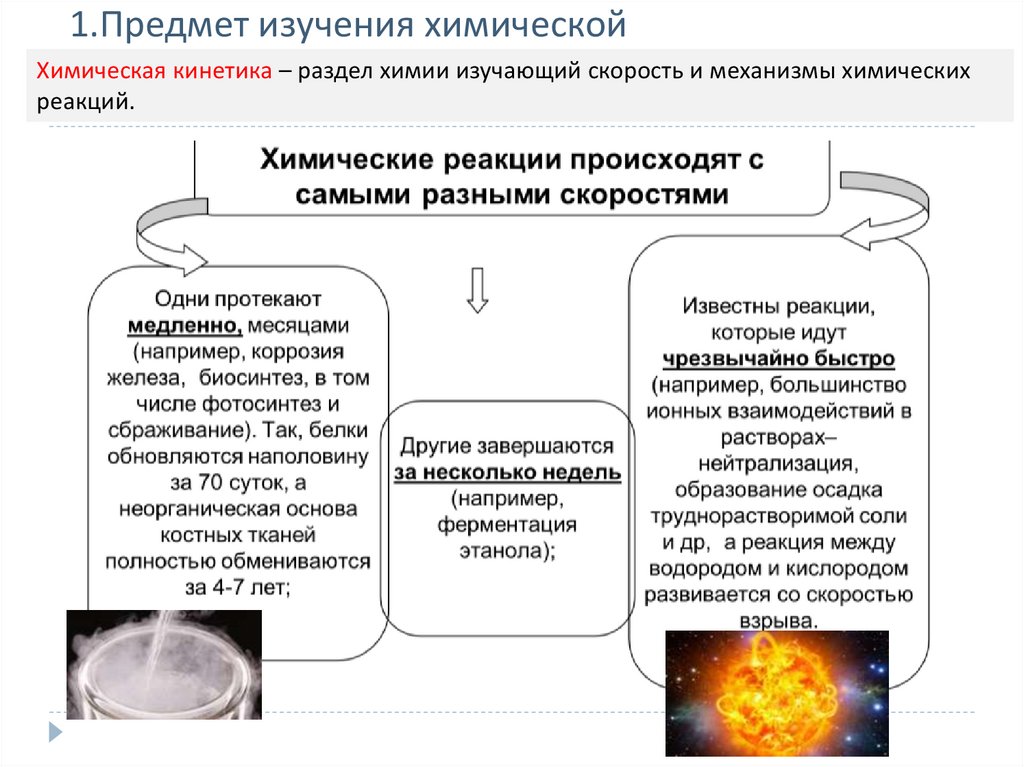
1. Предмет изучения химической кинетики. Химерическая реакция и ее
классификация (простые и сложные, гомогенные и гетерогенные; молекулярность и
порядок реакции).
2. Скорость химической реакции
- Средняя скорость и истинная (мгновенная) скорость реакции.
- Факторы, влияющие на скорость химических реакций. Закон действия масс.
- Кинетическое уравнение. Константа скорости..
3. Зависимость скорости реакции от температуры.
-Правило Вант-Гоффа.
-Уравнение Аррениуса. Энергии активации реакции.
4. Ферментативная кинетика
-Катализ/ и ферментативный катализ.
-Уравнение Михаэлиса-Ментен, смысл его параметров
5. Химическое равновесие. Константа химического равновесия. Смещение
химического равновесия
2.
1.Предмет изучения химическойХимическая
кинетика – раздел химии изучающий скорость и механизмы химических
кинетики
реакций.
3. Химическая реакция
Химическая реакция – это процесс, в результате которого происходит разрывсуществующих химических связей и образование новых.
Для реакции необходимо
1.Столкновение частиц (атомов,
молекул, ионов)
2. Наличие у сталкивающихся частиц
достаточного для осуществления
реакции запаса энергии
3. Оптимальное расположение частиц относительно друг друга в пространстве
Столкновение 2-х или более частиц, обладающих достаточно большой энергией,
позволяет преодолеть взаимное отталкивание их электронных оболочек –
происходит элементарный акт химической реакции
Элементарный акт хим. реакции – единичное взаимодействие молекул,
приводящее к образованию новых молекул.
4.
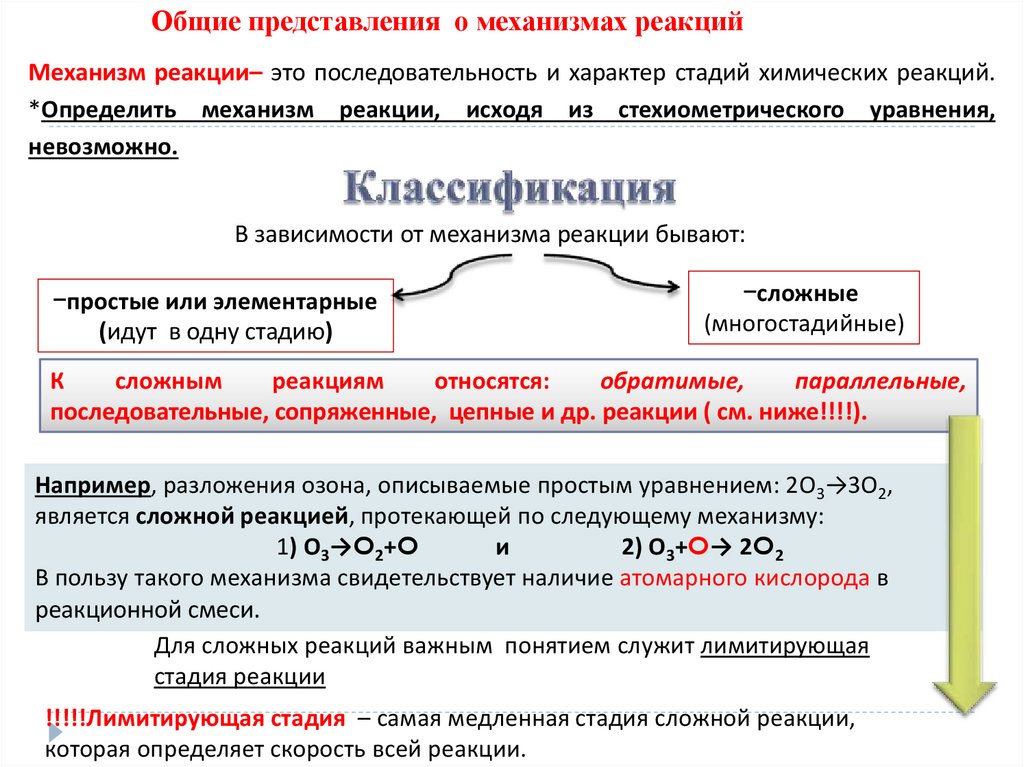
Общие представления о механизмах реакцийМеханизм реакции– это последовательность и характер стадий химических реакций.
*Определить механизм реакции, исходя из стехиометрического уравнения,
невозможно.
В зависимости от механизма реакции бывают:
-простые или элементарные
(идут в одну стадию)
-сложные
(многостадийные)
К
сложным
реакциям
относятся:
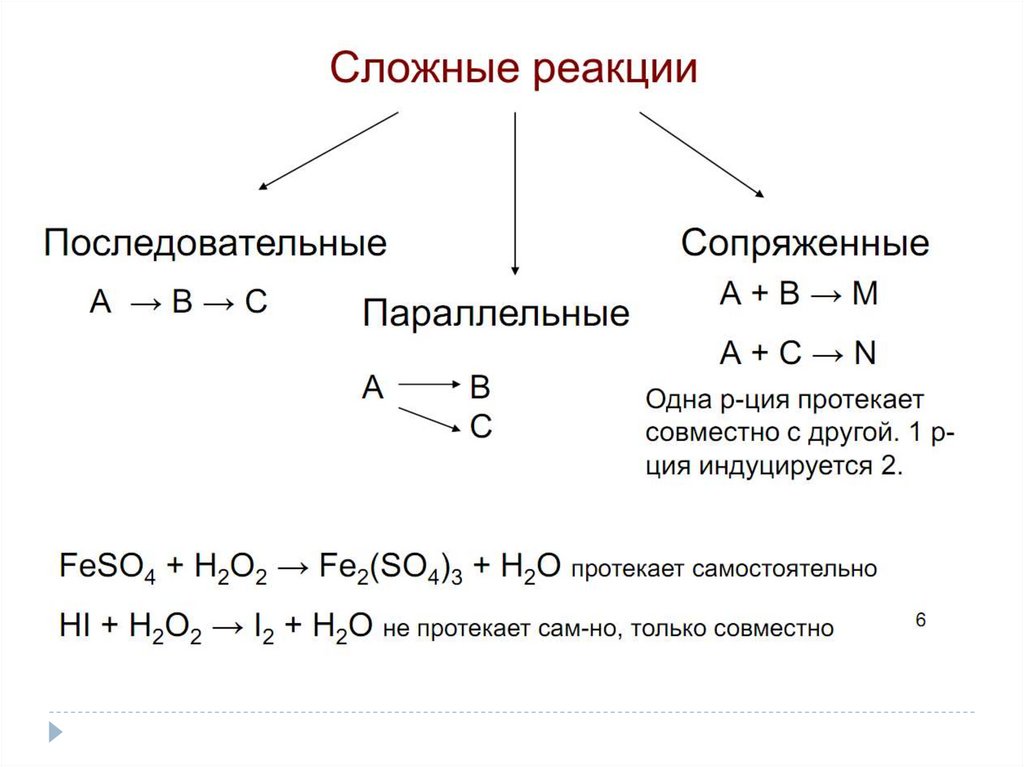
обратимые,
параллельные,
последовательные, сопряженные, цепные и др. реакции ( см. ниже!!!!).
Например, разложения озона, описываемые простым уравнением: 2О3→3О2,
является сложной реакцией, протекающей по следующему механизму:
1) О3→O2+O
и
2) О3+O→ 2O2
В пользу такого механизма свидетельствует наличие атомарного кислорода в
реакционной смеси.
Для сложных реакций важным понятием служит лимитирующая
стадия реакции
!!!!!Лимитирующая стадия – самая медленная стадия сложной реакции,
которая определяет скорость всей реакции.
5.
6.
7.
2.Реакции могут быть:гомогенными
и гетерогенными
1) Гомогенные реакции
протекают в однородной среде
и во всем объеме
системы(например, в газовой
фазе или жидком растворе).
2) Гетерогенные реакции протекают в
неоднородной среде и только на поверхности
раздела фаз, где реагирующие вещества могут
соприкасаться друг с другом (твердой и
жидкой, газовой и жидкой и т.д.), .
Например: NH4C1(водн) +
NaOH(водн)→ NH3(г) + Н2О(ж) +
NaCI(водн)
Например: СО2(г) + NaOH(водн) →
NaHCO3(водн)
FeS(т) + 2НС1(водн) →H2S(г) + FeCl2(водн) и т.д.
3.Все химические реакции классифицируют
(кинетическая классификация) nо:
и порядку реакции
молекулярности
Молекулярностю химической реакции называется число молекул,
непосредственно принимающих участие в элементарной реакции.
Столкновение частиц исходных веществ является необходимым (хотя и
недостаточным) условием столкновения или взаимодействия. Так как число
столкновений зависит от концентрации, т.е. с ее ростом должна возрастать и
скорость химической реакции.
8.
По признаку молекулярности реакции делят на: моно-, би- итримолекулярные реакции
Примеры
Признаки
1.I2→I+I
2.СНзСОСН3→С2Н4 + Н2 + СО
3.N2O4→ 2NO2, а также радиоактивный
распад
элементов,
диффузия
и
изомеризация.
К одномолекулярным реакциям типа А →
В или А→В + С относятся процессы
распада молекул на более простые
составные части.
1.H2 + I2 →2HI
2.СH3COOC2H5+NaOH→СH3COONa+
C2H5OH
3.CO+CI2→COCI
1. 2NO + O2 → 2NO2
2. 2NO+H2→ 2N2O
Двухмолекулярными называются реакции
типа А+В-→ С или 2А →В.
Значительно
реже
встречаются
трехмолекулярные реакции А + 2В
→С или ЗА →В.
9.
Скорость гомогенных и гетерогенных реакциимоль/л·с)
▪Скорость химической реакции определяется
числом элементарных актов реакции,
приводящих к химическому превращению, в
единицу времени в единице объема.
Изменение концентрации
реагирующих в-в во
времени
Где dC-бесконечно малое
изменение концентрации; dtбесконечно малый промежуток
времени
Знак определяется направлением изменения концентрация вещества: «+» –
означает ее увеличение, а «-» – уменьшение.
10.
Пример:Скорость гетерогенных реакций измеряется количеством вещества системы,
вступающего в реакцию или образующегося в результате реакции за единицу времени
на единицу поверхности раздела фаз:
11.
Факторы, влияющие на скорость химических реакций. Закондействующих масс.
Скорость реакции зависит от:
1) Природы реагирующих веществ;
2) условий, при которых протекает реакция: концентраций реагирующих
веществ, температуры, давления (для газов), облучения квантами света
и др.;
3) присутствия катализаторов.
4) величины удельной поверхности (для гетерог. реакций)
Закон действующих масс
Зависимость скорости реакции от концентраций дается законом
действия масс ( 1867 г. Гульдберг и Вааге )
«Скорость химической реакции прямо пропорциональна
произведению молярных концентраций реагирующих
веществ, взятых в степени, равной стехиометрическому
коэффициенту данного вещества в уравнении реакции».
!!!!!Закон действующих масс справедлив только для простых реакций с
небольшим порядком и молекулярностью
12.
Например, для реакции общего вида:Закон действия масс математически записывается:
кинетическое уравнение:
где СА, СВ, СС — концентрации веществ А, В, С в данный момент времени,
моль/л (кмоль/м3); k — константа скорости реакции; n1, n2….–порядок реакции по
соответствующим реагентам.
!!!!!Она зависит от природы реагирующих веществ, температуры, наличия
катализатора, но не зависит от концентрации.
13.
Кинетическое уравнение для моно-, би- и тримолекулярных реакцийСкорость
1-молекулярной
реакции
пропорциональна концентрации взятого
вещества С.
(1)
n=1
(2)
При условии, если C1 = C2=C, то
(3)
(4)
Если C1 = C2 — C3 = C, то
(5)
Скорость 2-молекулярных реакций в
общем случае прямо пропорциональна
произведению концентраций двух
веществ С1 и С 2 .
n=2
Скорость 3-молекулярных реакций в общем
случае прямо пропорциональна
произведению концентраций трех
реагирующих веществ:
n=3
14.
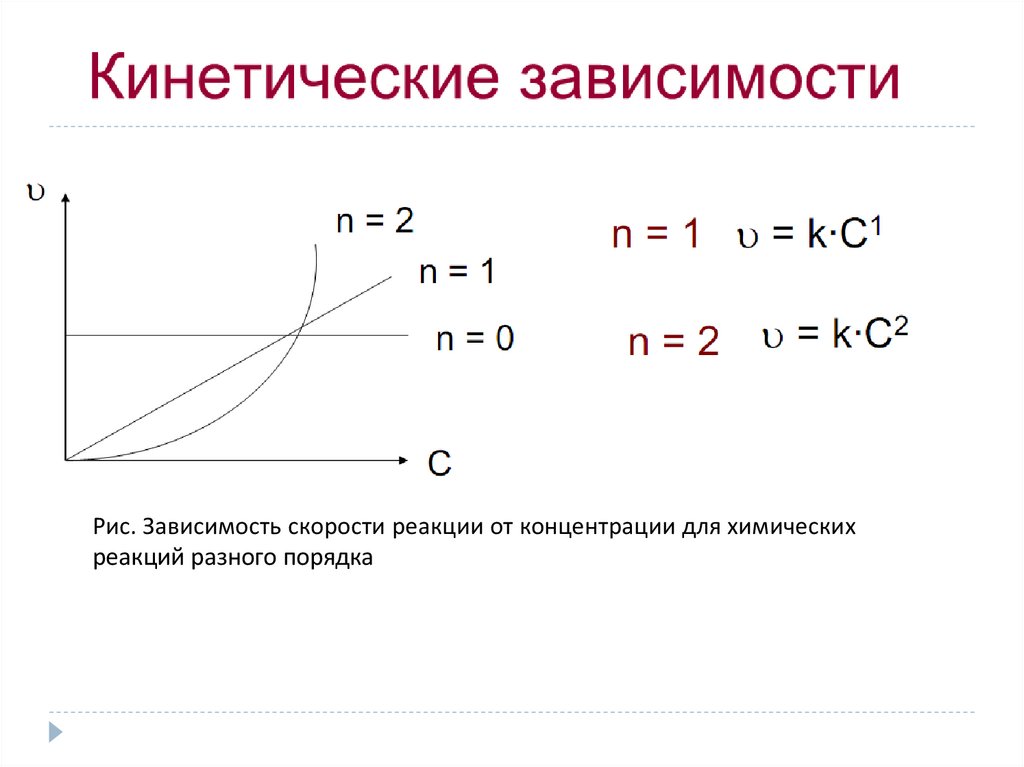
Рис. Зависимость скорости реакции от концентрации для химическихреакций разного порядка
15.
Порядок реакцииПод порядком реакции понимают сумму показателей степеней
(n1+n2+n3+……) при концентрациях в выражении закона действующих масс.
2) Реакции могут быть первого (v = kc), второго (v = kc 2), третьего (v
= kc3), а также нулевого и дробного порядка.
Дробный порядок характерен для сложных реакций,
протекающих через промежуточные стадии.
Нулевой порядок наблюдается в таких гетерогенных реакциях, в
которых скорость подвода вещества больше скорости его
расходования. В реакциях нулевого порядка скорость —
постоянная величина (v = k, т.е. скорость процесса не зависит
от концентраций реагирующих веществ ).
Порядок и молекулярность совпадают лишь
для простых одностадийных реакций.
16.
Для вычисления констант скоростей реакций 1–го,2-го,3-го порядковдифференциальные уравнения (1-5) интегрируют:
Где а и b — начальная концентрация 1го и 2-го вещества соответственно; х —
количество вещества, вступившее в
реакцию к моменту времени t от начала
опыта.
(6)
Для реакций первого порядка
(7)
Для реакций второго порядка
Если начальные концентрации веществ
одинаковы,
т. е. С1= С2, то при
интегрировании (3) получают более
простое выражение для k``
(8)
(9)
При равенстве концентраций всех трех
веществ в результате интегрирования (5)
получают выражение для подсчета
константы скорости 3-молекулярной
реакции k```.
17.
Причины несовпадения порядка и молекулярности реакцийМожно назвать две причины несовпадения порядка и
молекулярности:
1) Постоянство концентрации одного или нескольких участников реакции.
Например, в реакции омыления эфира: С2Н5СООСН3 + Н2О →
С2Н5ОН+СНзСООН. Концентрация воды практически постоянна, поэтому
выражение для скорости реакции v = kСэфира Своды = k'Сэфира. Реакция
бимолекулярна, но первого порядка;
2) ступенчатый характер реакции. Например, тримолекулярная реакция
хлорирования оксида азота 2NO + Cl2 = 2NOCl состоит из двух стадий:
a) NO + СI2→NOC12,
б) NOCI2 + NO → 2NOC1. Первая стадия
протекает быстро, образуется нестойкий продукт NOCI2. Вторая стадия медленная
и лимитирующая. Суммарная скорость реакции выражается равенством v =kC
NOCI2 C NO. Реакция тримолекулярна, но второго порядка.
Таким образом, если скорости отдельных стадий сильно различаются, то скорость в
целом и ее порядок определяются скоростью и порядком самой медленной
стадии, называемой скоростьопределяющей или лимитирующей стадией
Задание:
1. РЕАКЦИЯ, ПРОТЕКАЮЩАЯ ПО УРАВНЕНИЮ: СuO(Т ) H 2 ( Г ) Cu (Т ) H 2O
ИМЕЕТ _____ ПОРЯДОК РЕАКЦИИ.
1) 0
2) 1
3) 2
4) 3
18.
Зависимость скорости реакции от температуры. Правило Вант-Гоффа.Уравнение Аррениуса. Энергии активации реакции
1884 г. Вант-Гофф
Эмпирическое правило: При увеличении температуры на каждые 10 градусов
скорость большинства реакций возрастает в 2 – 4 раза.
19.
***Увеличение скорости реакции при повышении температуры связано свозрастанием константы скорости реакции; концентрации реагирующих
веществ при этом практически не изменяются.
Для ферментативных реакций температурный коэффициент может
достигать значений γ=7-9, поэтому колебания температуры тела
человека в пределах даже 1o сильно сказывается на его самочувствии.
20.
Уравнение АррениусаПреодоление этого энергетического барьера частицами исходных веществ
связано с образованием активного комплекса, который затем превращается в
продукты реакции за счет разрыва старых связей и образования новых. Например,
Даже небольшое уменьшение энергии активации приводит к значительному
возрастанию скорости реакции.
21.
22.
23.
24.
КАТАЛИЗПОЛОЖИТЕЛЬНЫЙ
ОТРИЦАТЕЛЬНЫЙ
25.
+ катализ-ускорение р-ции, -катализ-замедление р-ии.Ингибирование широко используется для
регулирования скорости радикальной
полимеризации. Ингибиторы окисления
используют для стабилизации полиолефинов и
каучуков, смазочных материалов и
углеводородных топлив, сохранения пищ. жиров и
лек. препаратов.
26.
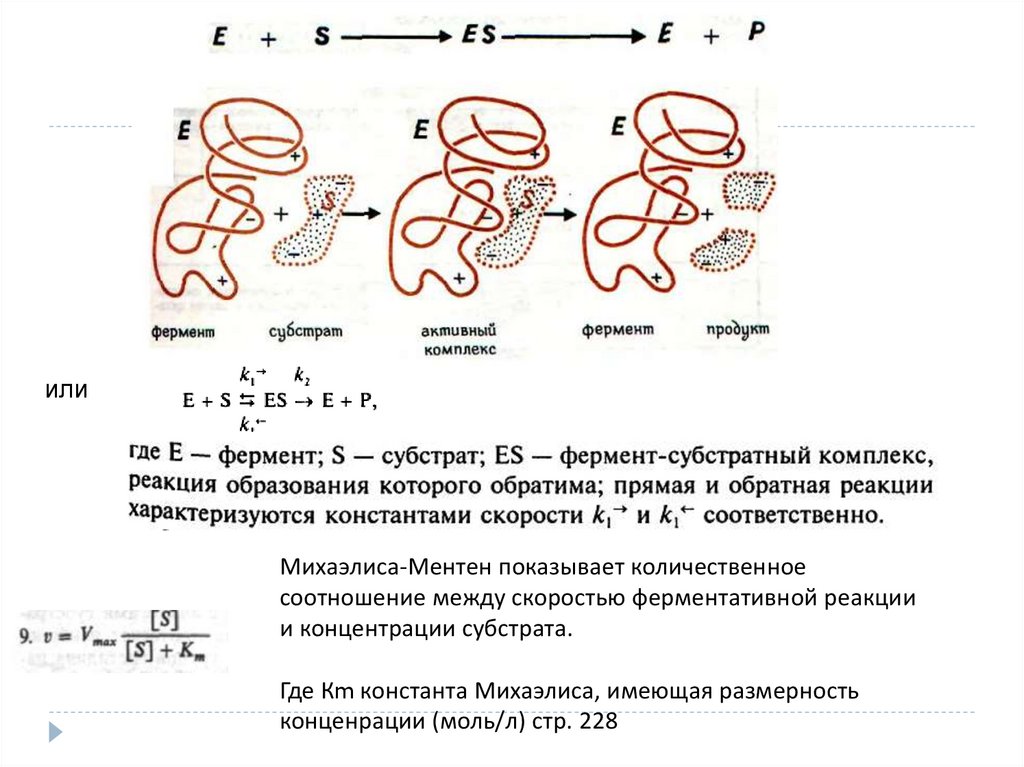
Ферментативная кинетика. Катализ/ и ферментативный катализ.Уравнение Михаэлиса-Ментен, смысл его параметров
Катализом называют изменение скорости химических реакций в присутствии
веществ, которые сами после реакции остаются химически неизмененными.
Обычно катализаторами называют только ускорители реакций, а ингибиторами —
замедлители.
Если катализатор и реагирующие вещества находятся в
одной фазе, то катализ называют гомогенным, если в
разных фазах — гетерогенным.
Действие катализаторов:
1) не изменяет теплового эффекта реакции;
2) снижает энергию активации как прямой, так и обратной реакции на одну
и ту же величину ∆Е, поэтому не смещает равновесия;
3) увеличивая в одинаковой степени скорость прямой и обратной реакции,
сокращает время достижения равновесия;
4) является избирательным, что определяется природой катализатора и
условиями его применения.
27.
Механизм гомогенного катализа состоит в том, что конечный продуктреакции АВ в присутствии катализатора К образуется не за счет
непосредственного взаимодействия исходных веществ А и В, согласно
уравнению А+В→АВ (Еа), а в результате реакции, протекающей в две
стадии:
Таким образом, катализатор остается неизменным, а скорость реакции
увеличивается за счет снижения энергии активации на величину ∆Еа, равную разности
Еа—Е'а, если Е'а,>Е а" или Еа— Е а", если Е а">Е'а.
28.
В случае гетерогенного катализа основную роль играет адсорбциямолекул реагирующих веществ на поверхности катализатора, что
приводит к повышению их энергии и снижению энергии активации
катализируемой реакции.
Примеры гомогенного катализа
Кислотно-основной катализ (гидролиз сложного эфира с образованием
карбоновой кислоты и спирта или фенола).
Ферментативный катализ (энзимы – это специфические катализаторы
белковой природы).
Примеры гетерогенного катализа
Многие переходные металлы (Fe, Ni) работают как гетрогенные
катализаторы.
Аутокатализ– встречаются реакции, в которых один из продуктов является
катализатором (например, Mn2+ катализирует реакцию окисление H2O2
перманганатом (V) ) в кислой среде.
!!!!!!!!Необходимо понимать их и знать об обратимых и необратимых
ингибиторах. Большинство ядов и многие лекарства являются ингибиторами
ферментов
29.
илиМихаэлиса-Ментен показывает количественное
соотношение между скоростью ферментативной реакции
и концентрации субстрата.
Где Кm константа Михаэлиса, имеющая размерность
конценрации (моль/л) стр. 228
30.
Понятие о фармокинетикеФармакокинетика — это исследование кинетики всасывания,
распределения, метаболизма и экскреции лекарств в сопоставлении с
соответствующими фармакологическим, терапевтическим или токсическим
эффектами у животных и человека».
Фармакокинетика — комплексная дисциплина, стоящая на стыке ряда наук
— физической и аналитической химии, биохимии, биофизики,
фармакологии, фармации, медицины, математики, генетики и др.
Основным инструментом современной фармакокинетики считается
математическое
моделирование
процессов,
происходящих
с
лекарственным средством в организме.
Для исследования фармакокинстики нового препарата подбирают
больных, которым этот препарат показан. В некоторых странах такие
исследования проводят на здоровых добровольцах, однако это не
оправдано с этической и правовой сторон.
Подбор больных проводят так, чтобы в исследуемую группу попали люди
примерно одного возраста, со средней массой тела, без повреждений
функции печени, почек, желудочно-кишечного тракта, сердечнососудистой системы. Исключение составляют случаи, когда препарат
предназначен специально для лечения какого-либо из этих органов или
систем.





























 chemistry
chemistry








