Similar presentations:
Тема 10 Соли
1.
ВажнейшиеВажнейшие классы
классы
неорганических
неорганических соединений.
соединений.
СОЛИ
КИСЛОТЫ
Составители: к.х.н. Махмутова Г.Ф.,
к.х.н. Ефимова И.Г.
2.
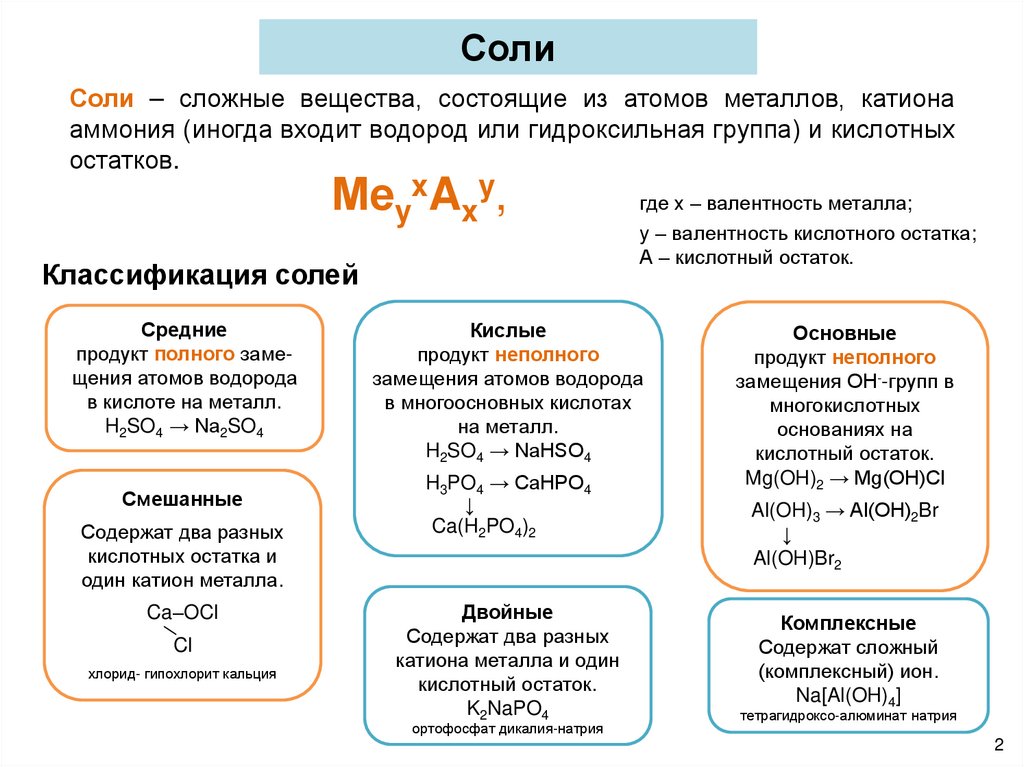
СолиСоли – сложные вещества, состоящие из атомов металлов, катиона
аммония (иногда входит водород или гидроксильная группа) и кислотных
остатков.
МеyxAxy,
Классификация солей
Средние
продукт полного замещения атомов водорода
в кислоте на металл.
H2SO4 → Na2SO4
Смешанные
Содержат два разных
кислотных остатка и
один катион металла.
Ca–OCl
Cl
хлорид- гипохлорит кальция
где х – валентность металла;
y – валентность кислотного остатка;
А – кислотный остаток.
Кислые
продукт неполного
замещения атомов водорода
в многоосновных кислотах
на металл.
H2SO4 → NaHSO4
H3PO4 → CaHPO4
↓
Ca(H2PO4)2
Двойные
Содержат два разных
катиона металла и один
кислотный остаток.
K2NaPO4
ортофосфат дикалия-натрия
Основные
продукт неполного
замещения ОН--групп в
многокислотных
основаниях на
кислотный остаток.
Mg(OH)2 → Mg(OH)Cl
Al(OH)3 → Al(OH)2Br
↓
Al(OH)Br2
Комплексные
Содержат сложный
(комплексный) ион.
Na[Al(OH)4]
тетрагидроксо-алюминат натрия
2
3.
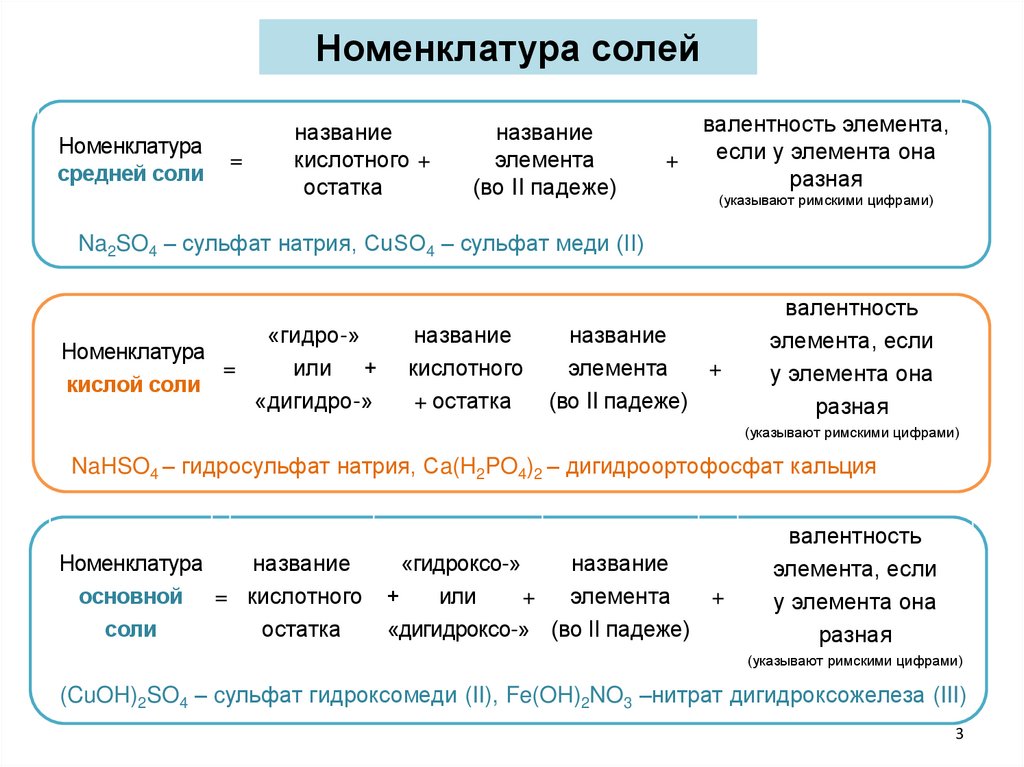
Номенклатура солейНоменклатура
средней соли
=
название
кислотного +
остатка
название
элемента
(во II падеже)
+
валентность элемента,
если у элемента она
разная
(указывают римскими цифрами)
Na2SO4 – сульфат натрия, CuSO4 – сульфат меди (II)
Номенклатура
=
кислой соли
«гидро-»
или +
«дигидро-»
название
кислотного
+ остатка
название
элемента
+
(во II падеже)
валентность
элемента, если
у элемента она
разная
(указывают римскими цифрами)
NaHSO4 – гидросульфат натрия, Сa(H2PO4)2 – дигидроортофосфат кальция
Номенклатура
название
основной = кислотного
соли
остатка
«гидроксо-»
название
+
или
+
элемента
+
«дигидроксо-» (во II падеже)
валентность
элемента, если
у элемента она
разная
(указывают римскими цифрами)
(CuOH)2SO4 – cульфат гидроксомеди (II), Fe(OH)2NO3 –нитрат дигидроксожелеза (III)
3
4.
Физические свойства солейСоли – кристаллические вещества с высокими температурами кипения и
плавления.
Соли имеют разную растворимость в воде. Растворимость соли можно определить
по таблице «Растворимость солей, кислот, оснований в воде».
Большинство солей имеют белый цвет. Примеры солей, которые имеют окраску:
K2CrO4 –
K2Cr2O7 –
KMnO4 –
CuS
–
СoCl2 –
NiCl2
–
жёлтый цвет,
оранжевый цвет,
фиолетовый цвет,
чёрный цвет,
розовый цвет,
зелёный цвет
4
5.
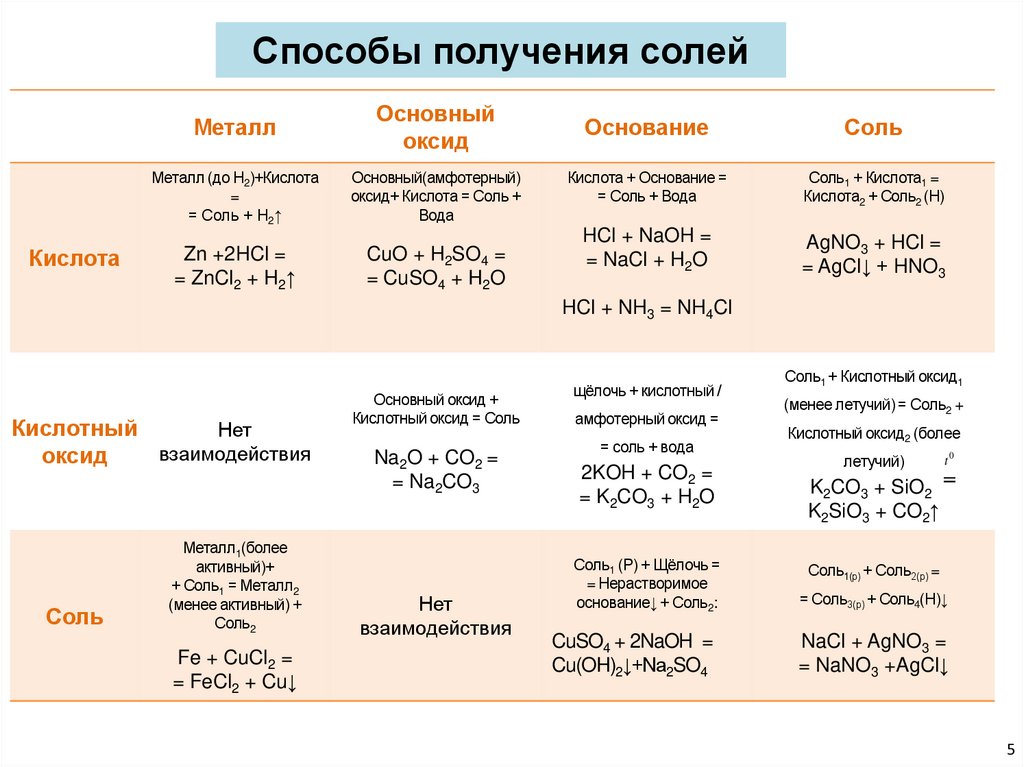
Способы получения солейКислота
Металл
Основный
оксид
Металл (до Н2)+Кислота
=
= Соль + Н2↑
Основный(амфотерный)
оксид+ Кислота = Соль +
Вода
Zn +2HCl =
= ZnCl2 + H2↑
CuO + H2SO4 =
= CuSO4 + H2O
Основание
Соль
Кислота + Основание =
= Соль + Вода
Соль1 + Кислота1 =
Кислота2 + Соль2 (Н)
HCl + NaOH =
= NaCl + H2O
AgNO3 + HCl =
= AgCl↓ + HNO3
HCl + NH3 = NH4Cl
Кислотный
Нет
взаимодействия
оксид
Соль
Металл1(более
активный)+
+ Соль1 = Металл2
(менее активный) +
Соль2
Fe + CuCl2 =
= FeCl2 + Cu↓
Основный оксид +
Кислотный оксид = Соль
Na2O + CO2 =
= Na2CO3
Нет
взаимодействия
щёлочь + кислотный /
амфотерный оксид =
= соль + вода
Соль1 + Кислотный оксид1
(менее летучий) = Соль2 +
Кислотный оксид2 (более
летучий)
t0
2KOH + CO2 =
= K2CO3 + H2O
K2CO3 + SiO2
K2SiO3 + CO2↑
Соль1 (Р) + Щёлочь =
= Нерастворимое
основание↓ + Соль2:
Соль1(р) + Соль2(р) =
= Соль3(р) + Соль4(Н)↓
CuSO4 + 2NaOH =
Cu(OH)2↓+Na2SO4
NaCl + AgNO3 =
= NaNO3 +AgCl↓
5
6.
Химические свойства солей1. Термическое разложение некоторых солей
1.1. Все нерастворимые карбонаты, карбонат лития и аммония разлагаются с
образованием оксида металла и оксида углерода (IV):
t0
СаСO3 СаO + СО2↑
t0
Li2СO3 Li2O + СО2↑
Гидрокарбонаты разлагаются с образованием средней соли, углекислого газа и воды:
t0
2NaHСO3 Na2СO3 + СО2↑ + H2O
1.2.
Разложение
сульфита
восстановительная реакция):
натрия
(щелочных
металлов)
(окислительно-
t0
4Na2SO3 3Na2SO4 + Na2S.
1.3. Разложение сульфатов происходит по следующей схеме:
t0
2Fe2(SO4)3 2Fe2O3 + 6SO2↑ + 3O2↑
t0
Ag2SO4 2Ag↓ + SO2↑ + O2↑
6
7.
Химические свойства солей1. Термическое разложение
1.4. Галогениды металлов разлагаются на простые вещества (исключение: AgF):
0
t
2AgCl
2Ag + Cl2
Галогениды металлов IA, IIA групп, Zn, Al, Cr при нагревании не разлагаются.
1.6. Хлорат и перманганат
восстановительная реакция):
разлагаются
150 -200оС
MnO2
2KClO3
4KClO3
400оС
следующим
образом
(окислительно-
2KCl + 3O2↑
3KClО4 + KCl
t0
2KMnO4 K2MnO4 + MnO2↓ + O2↑
7
8.
Химические свойства солей1. Термическое разложение
1.7. Разложение некоторых солей аммония:
t0
NH4Cl NH3 + HCl
t0
(NH4)2СO3 2NH3↑ + СО2↑ + H2O
t0
(NH4)3PO4 2NH3↑ + NH4H2PO4
t
0
t0
NH4NO2 N2↑ + 2H2O
t0
NH4NO3 N2O↑ + 2H2O
t0
(NH4)2Cr2O7 N2↑ + Cr2O3+ 4H2O
(NH4)2SO4 NH3↑ + NH4HSO4
1.8. Все нитраты металлов разлагаются с выделением O2 по следующей схеме:
РЯД АКТИВНОСТИ МЕТАЛЛОВ / ЭЛЕКТРОХИМИЧЕСКИЙ РЯД НАПРЯЖЕНИЙ
Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb (H) Sb Bi Cu Hg Ag Pt Au
Rb-Na
Li, Mg-Cu
Hg-Au
t0
2KNO3 2KNO2 + O2↑
t0
2Mg(NO3)2 2MgО + 4NO2↑ + O2↑
t0
2AgNO3 2Ag +2NO2↑ + O2↑
8
9.
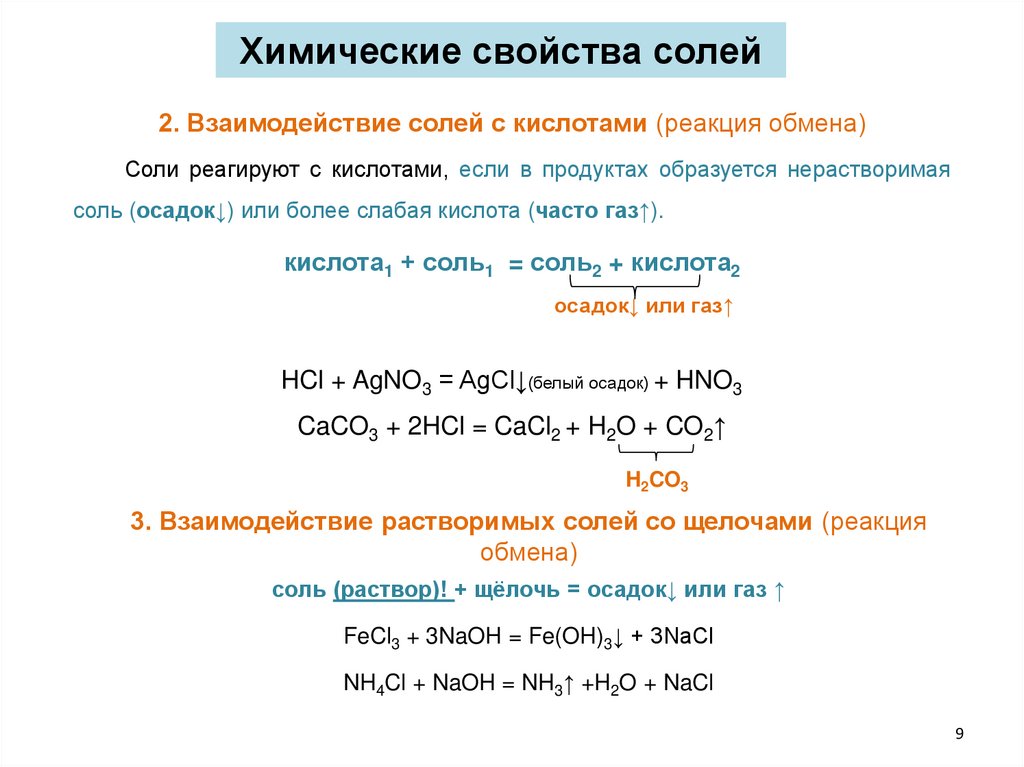
Химические свойства солей2. Взаимодействие солей с кислотами (реакция обмена)
Соли реагируют с кислотами, если в продуктах образуется нерастворимая
соль (осадок↓) или более слабая кислота (часто газ↑).
кислота1 + соль1 = соль2 + кислота2
осадок↓ или газ↑
HCl + AgNO3 = AgCl↓(белый осадок) + HNO3
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
H2CO3
3. Взаимодействие растворимых солей со щелочами (реакция
обмена)
соль (раствор)! + щёлочь = осадок↓ или газ ↑
FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl
NH4Cl + NaOH = NH3↑ +H2O + NaCl
9
10.
Химические свойства солей4. Взаимодействие солей с солями (реакция обмена)
Реакция происходит, если взаимодействуют растворимые соли, и при этом
образуется осадок:
cоль1 (раствор) + соль2 (раствор) = осадок↓
Соль1 (осадок) + Соль2 (раствор) ≠
Соль1 (раствор) + Соль2 (раствор) ≠ Соль3 (раствор) + Соль4 (раствор)
AgNO3 + NaCl → AgCl↓ + NaNO3
5. Взаимодействие солей с металлами
Каждый предыдущий металл в ряду напряжений вытесняет последующий за
ним из раствора его соли:
Fe + CuSO4(раствор) → Cu + FeSO4
Hg + CuSO4 (раствора) → ×
Для реакций в растворе важно, чтобы металл не взаимодействовал с водой:
Na + CuSO4(раствор) →×
2Na + 2H2O = 2NaOH + H2↑
Реальная реакция: 2NaOH + CuSO4(раствор) = Cu(OH)2↓ + Na2SO4
10
11.
Химические свойства солей6. Взаимодействие солей с кислотными оксидами
При этом менее летучие оксиды вытесняют более летучие при сплавлении.
t0
K2CO3 + SiO2 K2SiO3 + CO2↑
t0
3K2CO3 + P2O5 2K3PO4 + 3CO2↑
7. Взаимодействие галогенидов металлов с другими галогенами
При этом более активный галоген вытесняет менее активный галоген из
соли. Активность галогенов падает в ряду: Cl2 > Br2 > I2
2KBr + Cl2 = 2KCl + Br2
KBr + I2 ≠
Фтор с водными растворами галогенидов металлов не взаимодействует, так
как фтор реагирует с водой:
4F2 + 2H2O = 4HF + O2
11
12.
Потренируемся1. Составьте химические формулы солей по их названиям:
хлорид железа (II), гидросульфид калия, нитрит бария, сульфит калия,
сульфат калия, ортофосфат железа (III), нитрат магния, карбонат натрия,
перманганат калия, дихромат натрия.
2. При помощи каких реакций можно осуществить следующие переходы
от одного вещества к другому:
1) С → CО2 → H2CO3 → BaCO3 → BaCl2
2) MgO → MgCl2 → Mg(OH)2 → Mg(NO3)2
3) Zn → ZnS → ZnCl2 → Zn(OН)2 → ZnO
4) Cu(OH)2 → CuCl2 → ZnCl2 → Zn(NO3)2
5) CO2 → MgCO3 → Mg(HCO3)2 → MgCO3 → MgO
12
13.
Домашнее задание1. Установите соответствие между формулой вещества и реагентами, с каждым
из которых это вещество может взаимодействовать:
Формула вещества
а) Ba
б) Ba(OH)2
в) SO2
г) FeI3
Реагенты
1) AgNO3, Na3PO4, Cl2
2) P2O5, CrO3, Li2SO4
3) H2O, O2, NaOH
4) CO, K3PO4, H2
5) O2, HCl, HNO3
+X
+Y
2. Задана следующая схема превращений веществ: CO2 → BaCO3 → BaSO4
Какие из указанных веществ являются веществами X и Y.
1) Ba
2) Ba(OH)2
3) H2O
4) HCl
5) H2SO4
+X
+Y
3. Задана следующая схема превращений веществ: Сu → CuSO4 → FeSO4
Какие из указанных веществ являются веществами X и Y.
1) SO2 2) H2SO4(конц.)
3) FeO
4) Fe(NO3)2
5) Fe
13










 chemistry
chemistry








